Лекция 12.Трансляция.pptx
- Количество слайдов: 108
 Процесс трансляции 1. Составляющие элементы процесса трансляции. 2. Механизм трансляции. 3. Факторы, влияющие на процесс трансляции.
Процесс трансляции 1. Составляющие элементы процесса трансляции. 2. Механизм трансляции. 3. Факторы, влияющие на процесс трансляции.
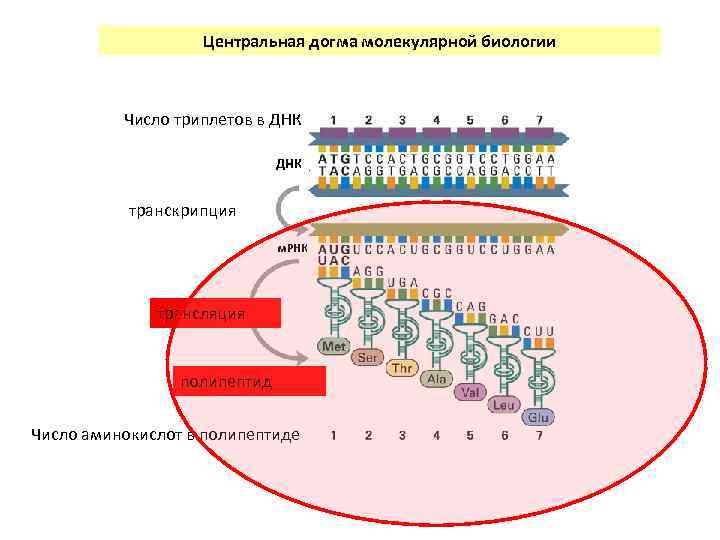 Центральная догма молекулярной биологии Число триплетов в ДНК транскрипция м. РНК трансляция полипептид Число аминокислот в полипептиде
Центральная догма молекулярной биологии Число триплетов в ДНК транскрипция м. РНК трансляция полипептид Число аминокислот в полипептиде
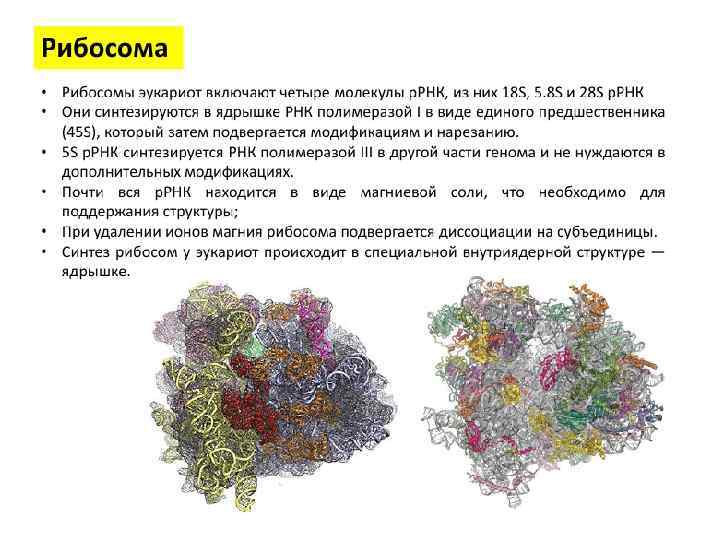
 Трансляция – это осуществляемый рибосомами синтез белка из аминокислот на матрице м. РНК. Cоставляющие элементы процесса трансляции: аминокислоты, т. РНК, рибосомы, м. РНК, ферменты для аминоацилирования т. РНК, белковые факторы трансляции (белковые факторы инициации, элонгации, терминации специфические внерибосомные белки, необходимые для процессов трансляции), источники энергии АТФ и ГТФ, ионы магния (стабилизируют структуру рибосом).
Трансляция – это осуществляемый рибосомами синтез белка из аминокислот на матрице м. РНК. Cоставляющие элементы процесса трансляции: аминокислоты, т. РНК, рибосомы, м. РНК, ферменты для аминоацилирования т. РНК, белковые факторы трансляции (белковые факторы инициации, элонгации, терминации специфические внерибосомные белки, необходимые для процессов трансляции), источники энергии АТФ и ГТФ, ионы магния (стабилизируют структуру рибосом).
 Составляющие элементы процесса трансляции: 1. Аминокислоты. 2. т. РНК. 3. Аминоацил-т-РНК-синтетазы. 4. Беловые факторы трансляции. 5. м. РНК. 5. Источники энергии ГТФ и АТФ.
Составляющие элементы процесса трансляции: 1. Аминокислоты. 2. т. РНК. 3. Аминоацил-т-РНК-синтетазы. 4. Беловые факторы трансляции. 5. м. РНК. 5. Источники энергии ГТФ и АТФ.
 Аминокислоты В синтезе белка участвует 20 аминокислот.
Аминокислоты В синтезе белка участвует 20 аминокислот.
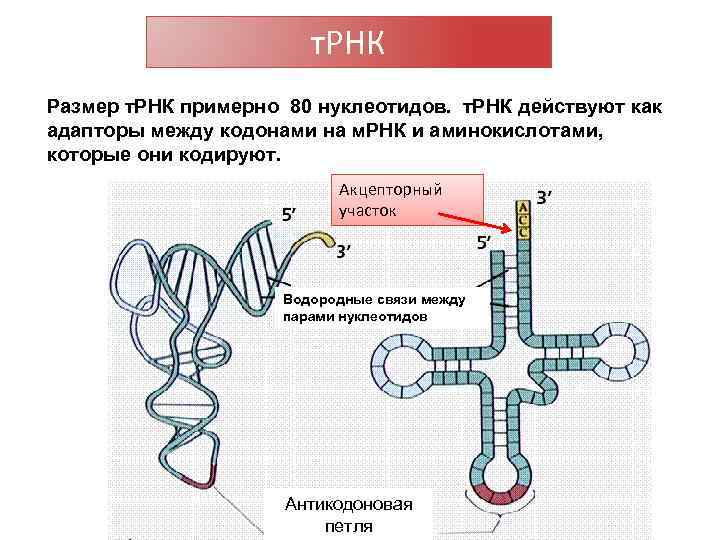 т. РНК Размер т. РНК примерно 80 нуклеотидов. т. РНК действуют как адапторы между кодонами на м. РНК и аминокислотами, которые они кодируют. Акцепторный участок Водородные связи между парами нуклеотидов Антикодоновая петля
т. РНК Размер т. РНК примерно 80 нуклеотидов. т. РНК действуют как адапторы между кодонами на м. РНК и аминокислотами, которые они кодируют. Акцепторный участок Водородные связи между парами нуклеотидов Антикодоновая петля
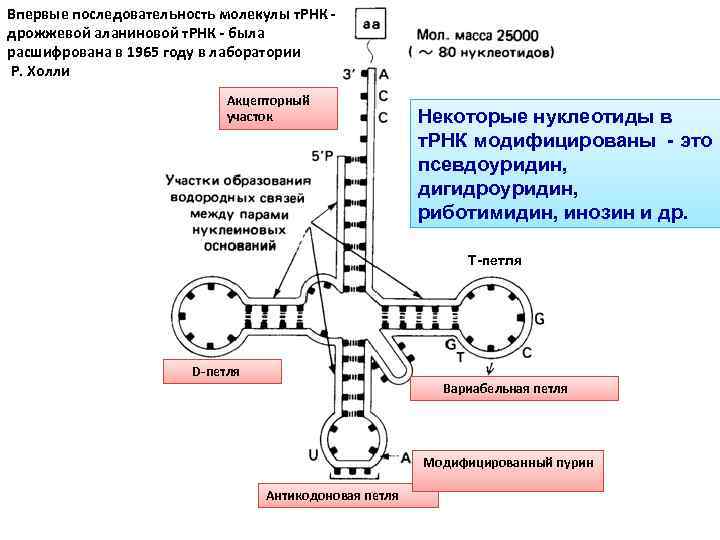 Впервые последовательность молекулы т. РНК - дрожжевой аланиновой т. РНК - была расшифрована в 1965 году в лаборатории Р. Холли Акцепторный участок Некоторые нуклеотиды в т. РНК модифицированы - это псевдоуридин, дигидроуридин, риботимидин, инозин и др. Т-петля D-петля Вариабельная петля Модифицированный пурин Антикодоновая петля
Впервые последовательность молекулы т. РНК - дрожжевой аланиновой т. РНК - была расшифрована в 1965 году в лаборатории Р. Холли Акцепторный участок Некоторые нуклеотиды в т. РНК модифицированы - это псевдоуридин, дигидроуридин, риботимидин, инозин и др. Т-петля D-петля Вариабельная петля Модифицированный пурин Антикодоновая петля
 т. РНК: пространственная структура
т. РНК: пространственная структура
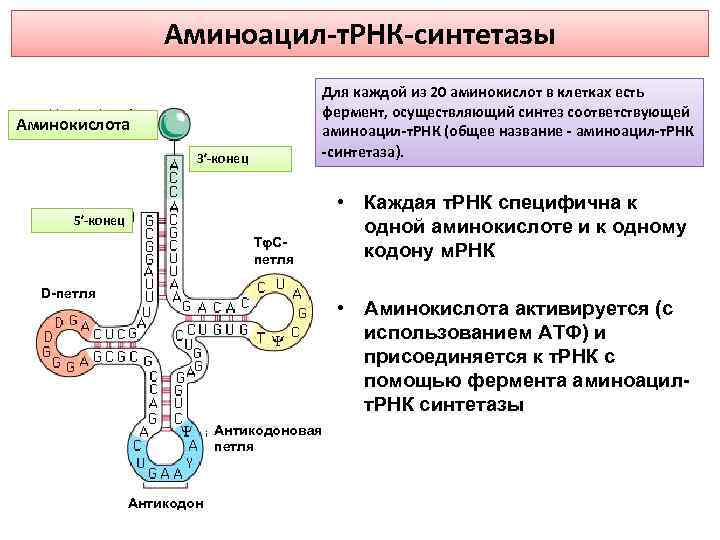 Аминоацил-т. РНК-синтетазы Для каждой из 20 аминокислот в клетках есть фермент, осуществляющий синтез соответствующей аминоацил-т. РНК (общее название - аминоацил-т. РНК -синтетаза). Аминокислота 3′-конец 5′-конец ТφСпетля D-петля • Каждая т. РНК специфична к одной аминокислоте и к одному кодону м. РНК • Аминокислота активируется (с использованием АТФ) и присоединяется к т. РНК с помощью фермента аминоацилт. РНК синтетазы Антикодоновая петля Антикодон
Аминоацил-т. РНК-синтетазы Для каждой из 20 аминокислот в клетках есть фермент, осуществляющий синтез соответствующей аминоацил-т. РНК (общее название - аминоацил-т. РНК -синтетаза). Аминокислота 3′-конец 5′-конец ТφСпетля D-петля • Каждая т. РНК специфична к одной аминокислоте и к одному кодону м. РНК • Аминокислота активируется (с использованием АТФ) и присоединяется к т. РНК с помощью фермента аминоацилт. РНК синтетазы Антикодоновая петля Антикодон
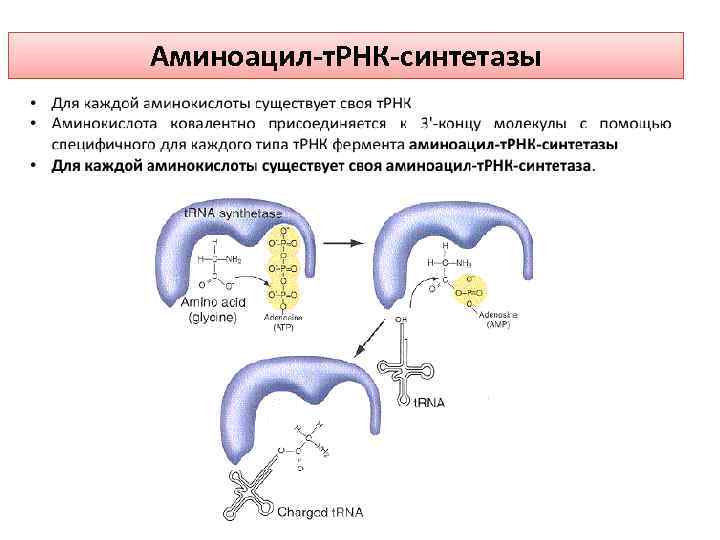
 Чтобы аминокислота «узнала» свое место в будущей полипепетидной цепи, она должна связаться с транспортной РНК (т. РНК), выполняющей адапторную функцию. Затем т. РНК, связавшаяся с аминокислотой «узнает» соответствующий кодон на м. РНК. АК + т. РНК + АТФ = АК-т. РНК + АМФ + ФФн включающую две стадии: Фермент + АК + АТФ = Комплекс [фермент(АК-АМФ) ]+ ФФн (1) Комплекс [фермент(АК-АМФ) ]+ т. РНК = фермент + АМФ + АК-т. РНК (2)
Чтобы аминокислота «узнала» свое место в будущей полипепетидной цепи, она должна связаться с транспортной РНК (т. РНК), выполняющей адапторную функцию. Затем т. РНК, связавшаяся с аминокислотой «узнает» соответствующий кодон на м. РНК. АК + т. РНК + АТФ = АК-т. РНК + АМФ + ФФн включающую две стадии: Фермент + АК + АТФ = Комплекс [фермент(АК-АМФ) ]+ ФФн (1) Комплекс [фермент(АК-АМФ) ]+ т. РНК = фермент + АМФ + АК-т. РНК (2)
 Аминоацил-т. РНК-синтетазы
Аминоацил-т. РНК-синтетазы
 Аминоацил-т. РНК-синтетазы должны отличить «свои» т. РНК от всех других, несмотря на удивительное сходство их вторичной и третичной структур. Поэтому необходимо, чтобы ферменты обладали очень высокой специфичностью, позволяющей им сделать правильный выбор из столь родственных структур и избежать ошибок при синтезе белка. Удивительно, но аминоацил-т. РНК-синтетазы ошибок практически не делают. Они всегда «садят» на т. РНК ту аминокислоту, которая ей соответствует, т. е. аланин на т. РНКAla, триптофан – на т. РНКTrp и т. д.
Аминоацил-т. РНК-синтетазы должны отличить «свои» т. РНК от всех других, несмотря на удивительное сходство их вторичной и третичной структур. Поэтому необходимо, чтобы ферменты обладали очень высокой специфичностью, позволяющей им сделать правильный выбор из столь родственных структур и избежать ошибок при синтезе белка. Удивительно, но аминоацил-т. РНК-синтетазы ошибок практически не делают. Они всегда «садят» на т. РНК ту аминокислоту, которая ей соответствует, т. е. аланин на т. РНКAla, триптофан – на т. РНКTrp и т. д.
 Исключительно низкая частота ошибок при аминоацилировании т. РНК (<10 -4) является непременным условием. Если произошла ошибка и к т. РНК присоединилась аминокислота, не соответствующая специфичности антикодона, то эта ошибка уже не может быть исправлена на последующих этапах белкового синтеза. И неудивительно, что в ходе эволюции выработались специфические механизмы отбора "правильных" субстратов для аминоацил-т. РНК-синтетаз, обеспечивающие безошибочное аминоацилирование т. РНК. В связи с особым значением этих механизмов для реализации генетической информации их называют иногда «вторым генетическим кодом» .
Исключительно низкая частота ошибок при аминоацилировании т. РНК (<10 -4) является непременным условием. Если произошла ошибка и к т. РНК присоединилась аминокислота, не соответствующая специфичности антикодона, то эта ошибка уже не может быть исправлена на последующих этапах белкового синтеза. И неудивительно, что в ходе эволюции выработались специфические механизмы отбора "правильных" субстратов для аминоацил-т. РНК-синтетаз, обеспечивающие безошибочное аминоацилирование т. РНК. В связи с особым значением этих механизмов для реализации генетической информации их называют иногда «вторым генетическим кодом» .
 Сразу же обозначим главное – отбор "правильных" т. РНК в этих реакциях зависит от узнавания ферментом отдельных элементов Lобразной структуры молекул т. РНК, о которых говорилось чуть выше. Итак, каждая т. РНК, сохраняя универсальную L-образную форму, должна иметь какие-то отличительные признаки, безошибочно распознаваемые "своим" ферментом как "притягательные", а остальными 19 ферментами – как "отталкивающие". Очевидно, что такие признаки должны быть общими у изоакцепторных т. РНК, специфичных для одной и той же аминокислоты.
Сразу же обозначим главное – отбор "правильных" т. РНК в этих реакциях зависит от узнавания ферментом отдельных элементов Lобразной структуры молекул т. РНК, о которых говорилось чуть выше. Итак, каждая т. РНК, сохраняя универсальную L-образную форму, должна иметь какие-то отличительные признаки, безошибочно распознаваемые "своим" ферментом как "притягательные", а остальными 19 ферментами – как "отталкивающие". Очевидно, что такие признаки должны быть общими у изоакцепторных т. РНК, специфичных для одной и той же аминокислоты.
 На сегодняшний день ученые знают, хотя бы в первом приближении, набор нуклеотидов, существенных для аминоацилирования "своих" т. РНК почти для каждой аминоацилт. РНК-синтетазы. Этот набор выглядит следующим образом: 1. Антикодоновый участок (нуклеотиды 34– 36). 2. Нуклеотид 73, предшествующий ССA-концу. Присутствие в этом положении того или другого пуринового нуклеотида (A или G) коррелирует с типом аминокислот, присоединяемых к т. РНК. Если в этом положении находится A, то т. РНК акцептирует гидрофобные аминокислоты, а если G – то полярные. 3. Первые три пары нуклеотидов акцепторного участка. В разных случаях в узнавании аминоацил-т. РНК-синтетазой может вовлекаться от одной до трех пар нуклеотидов акцепторного участка. 4. В случае некоторых т. РНК к элементам узнавания относят также отдельные модифицированные нуклеотиды D- и T-петель (в первую очередь, 20 -й нуклеотид D-петли).
На сегодняшний день ученые знают, хотя бы в первом приближении, набор нуклеотидов, существенных для аминоацилирования "своих" т. РНК почти для каждой аминоацилт. РНК-синтетазы. Этот набор выглядит следующим образом: 1. Антикодоновый участок (нуклеотиды 34– 36). 2. Нуклеотид 73, предшествующий ССA-концу. Присутствие в этом положении того или другого пуринового нуклеотида (A или G) коррелирует с типом аминокислот, присоединяемых к т. РНК. Если в этом положении находится A, то т. РНК акцептирует гидрофобные аминокислоты, а если G – то полярные. 3. Первые три пары нуклеотидов акцепторного участка. В разных случаях в узнавании аминоацил-т. РНК-синтетазой может вовлекаться от одной до трех пар нуклеотидов акцепторного участка. 4. В случае некоторых т. РНК к элементам узнавания относят также отдельные модифицированные нуклеотиды D- и T-петель (в первую очередь, 20 -й нуклеотид D-петли).
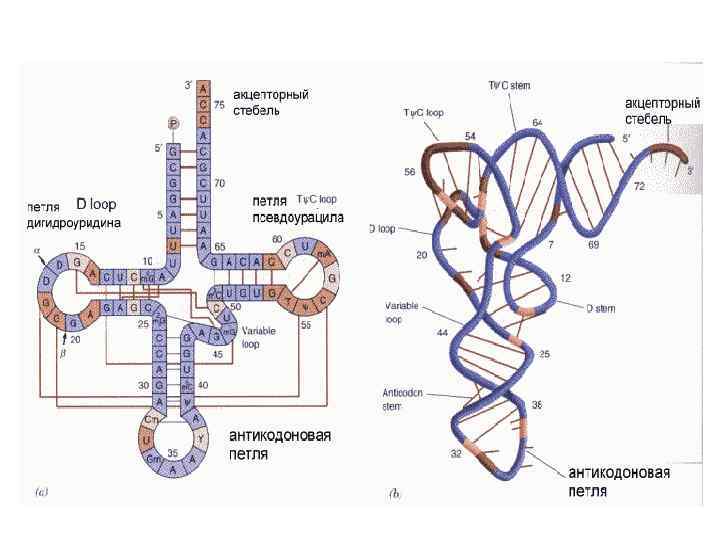
 Адапторная функция т. РНК заключаентся в том, что она выполняет роль посредника при переводе смысла, записанного в виде последовательности нуклеотидов в м. РНК на «язык» белков (последовательность аминокислот в белке). Адапторная функция возможна благодаря наличию в структуре т. РНК акцепторного участка для аминокислоты на 3'конце и антикодона для спаривания (образования водородных связей между комплементарными парами) с кодоном на м. РНК. Такое взаимодействие позволяет каждой аминокислоте включиться в растущую белковую цепь в том порядке, который диктуется нуклеотидной последовательностью м. РНК и обеспечивает образование пептидной связи между последней аминокислотой образованного пептида и аминокислотой, присоединённой к т. РНК в ходе трансляции.
Адапторная функция т. РНК заключаентся в том, что она выполняет роль посредника при переводе смысла, записанного в виде последовательности нуклеотидов в м. РНК на «язык» белков (последовательность аминокислот в белке). Адапторная функция возможна благодаря наличию в структуре т. РНК акцепторного участка для аминокислоты на 3'конце и антикодона для спаривания (образования водородных связей между комплементарными парами) с кодоном на м. РНК. Такое взаимодействие позволяет каждой аминокислоте включиться в растущую белковую цепь в том порядке, который диктуется нуклеотидной последовательностью м. РНК и обеспечивает образование пептидной связи между последней аминокислотой образованного пептида и аминокислотой, присоединённой к т. РНК в ходе трансляции.
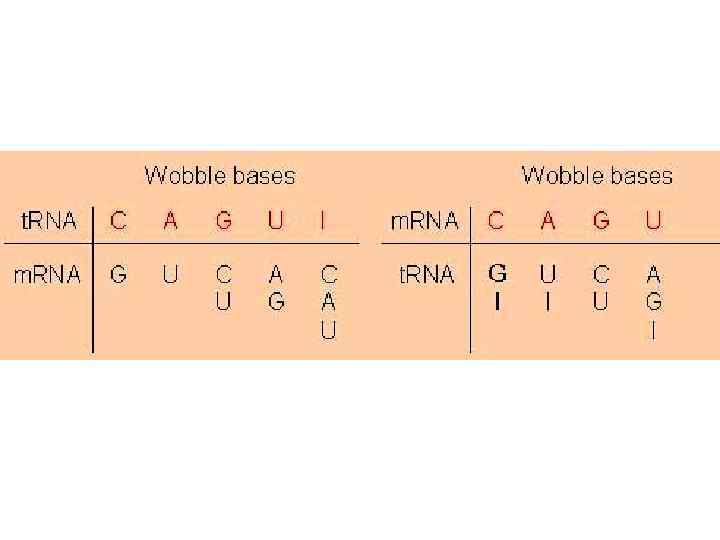
 Узнавание кодона на м. РНК • Взаимодействие кодон - антикодон основано на принципах комплементарности и антипараллельности: • 3’----Ц - Г- А*------5’ Антикодон т. РНК • 5’-----Г- Ц- У*------3’ Кодон м. РНК • Гипотеза качания (wobble) была предложена Ф. Криком: • 3′- основание кодона м. РНК имеет нестрогое спаривание с 5′- основанием антикодона т. РНК: например, У (м. РНК) может взаимодействовать с А и Г (т. РНК) • Некоторые т. РНК могут спариваться с более, чем одним кодоном.
Узнавание кодона на м. РНК • Взаимодействие кодон - антикодон основано на принципах комплементарности и антипараллельности: • 3’----Ц - Г- А*------5’ Антикодон т. РНК • 5’-----Г- Ц- У*------3’ Кодон м. РНК • Гипотеза качания (wobble) была предложена Ф. Криком: • 3′- основание кодона м. РНК имеет нестрогое спаривание с 5′- основанием антикодона т. РНК: например, У (м. РНК) может взаимодействовать с А и Г (т. РНК) • Некоторые т. РНК могут спариваться с более, чем одним кодоном.
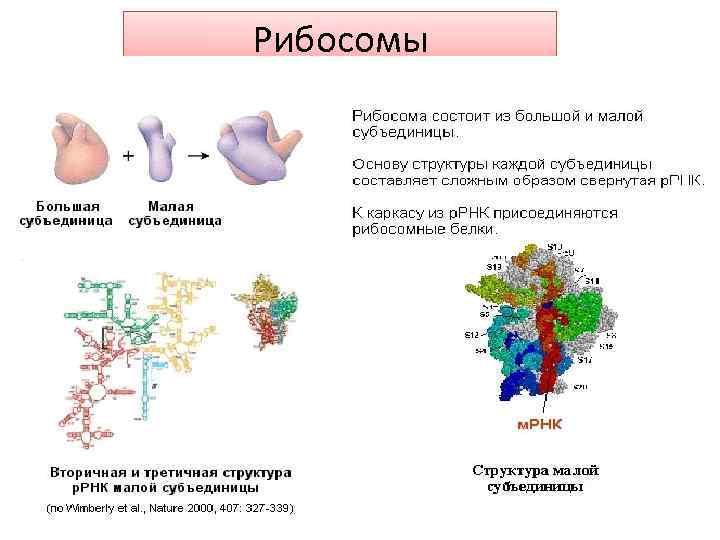 Рибосомы
Рибосомы
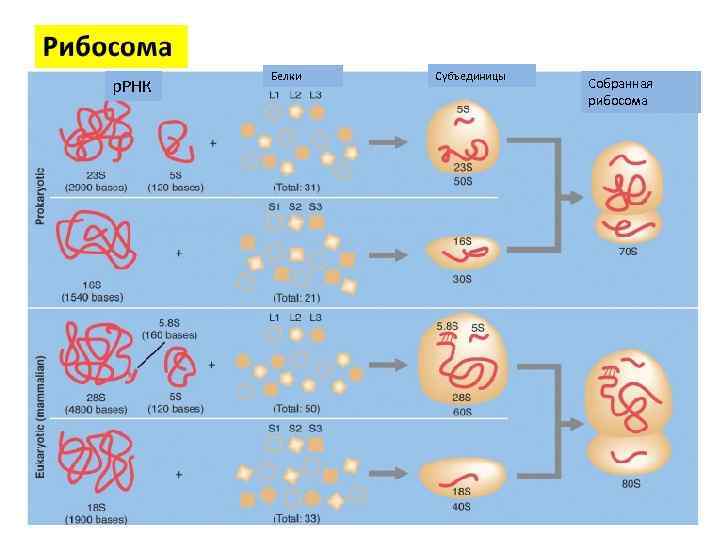
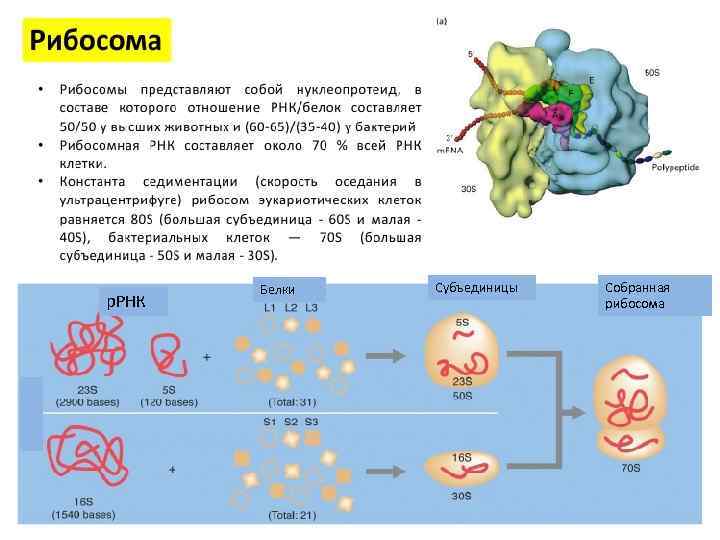 р. РНК Белки Субъединицы Собранная рибосома
р. РНК Белки Субъединицы Собранная рибосома
 Отличия рибосом прокариот и эукариот р. РНК – одноцепочечная структура длиной от 100 до 3 000 нуклеотидов в зависимости от конкретных типов р. РНК Рибосомы на 40 % состоят из р. РНК и на 60 % - из рибосомальных белков
Отличия рибосом прокариот и эукариот р. РНК – одноцепочечная структура длиной от 100 до 3 000 нуклеотидов в зависимости от конкретных типов р. РНК Рибосомы на 40 % состоят из р. РНК и на 60 % - из рибосомальных белков
 • р. РНК – однонитчатая цепь длиной от 100 до 2 900 нуклеотидов в зависимости от типов р. РНК. В рибосоме 40 составляет р. РНК и 60% рибосомальные белки.
• р. РНК – однонитчатая цепь длиной от 100 до 2 900 нуклеотидов в зависимости от типов р. РНК. В рибосоме 40 составляет р. РНК и 60% рибосомальные белки.
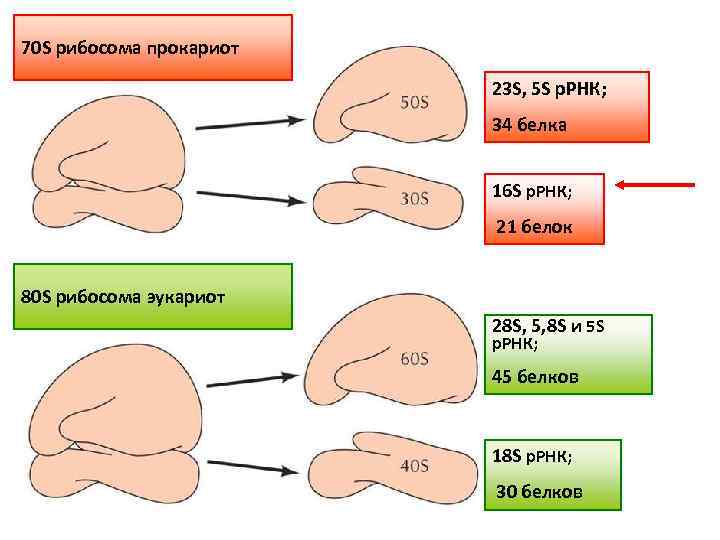 70 S рибосома прокариот 23 S, 5 S р. РНК; 34 белка 16 S р. РНК; 21 белок 80 S рибосома эукариот 28 S, 5, 8 S и 5 S р. РНК; 45 белков 18 S р. РНК; 30 белков
70 S рибосома прокариот 23 S, 5 S р. РНК; 34 белка 16 S р. РНК; 21 белок 80 S рибосома эукариот 28 S, 5, 8 S и 5 S р. РНК; 45 белков 18 S р. РНК; 30 белков
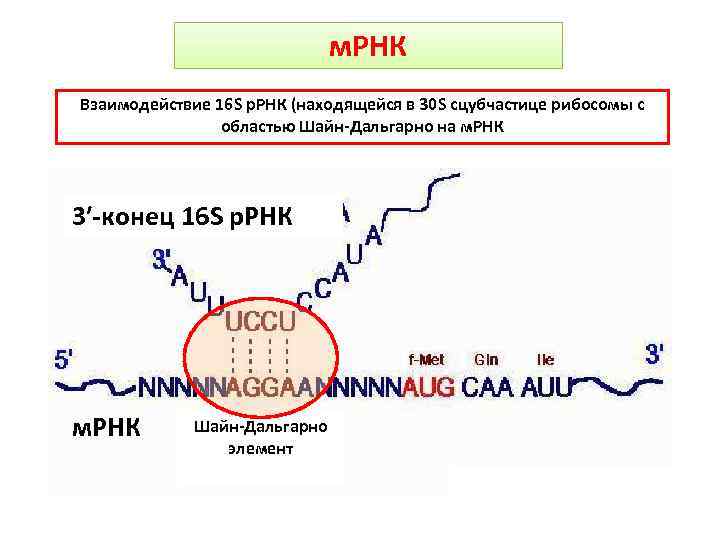 м. РНК Взаимодействие 16 S р. РНК (находящейся в 30 S сцубчастице рибосомы с областью Шайн-Дальгарно на м. РНК 3′-конец 16 S р. РНК м. РНК Шайн-Дальгарно элемент
м. РНК Взаимодействие 16 S р. РНК (находящейся в 30 S сцубчастице рибосомы с областью Шайн-Дальгарно на м. РНК 3′-конец 16 S р. РНК м. РНК Шайн-Дальгарно элемент
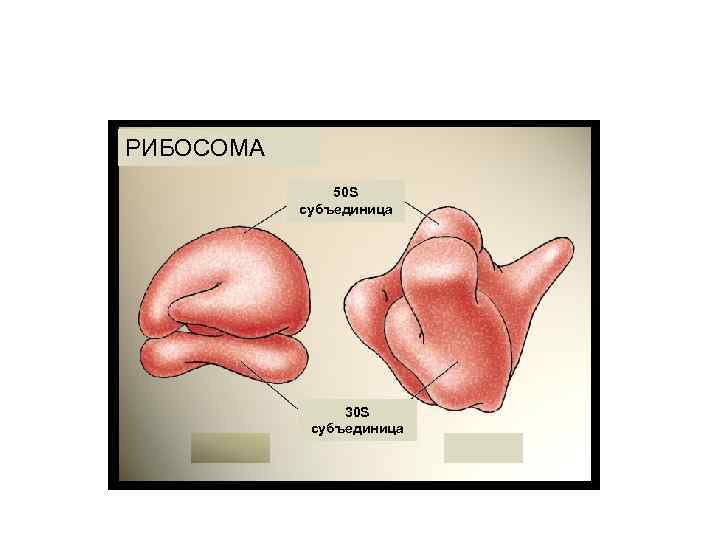 РИБОСОМА 50 S субъединица 30 S субъединица
РИБОСОМА 50 S субъединица 30 S субъединица
 Сотрудникам Лос-Аламосской национальной лаборатории удалось создать динамическую модель работы рибосомы, синтезирующей молекулу белка. Чтобы воспроизвести крохотную долю одного из фундаментальных биологических процессов, американским исследователям понадобился суперкомпьютер мощность 768 микропроцессоров, работавших в течение 260 дней. Им пришлось учитывать взаимодействие 2, 64 миллионов атомов, из которых на модель собственно рибосомы пришлась лишь четверть миллиона, а остальные изображали молекулы воды внутри и снаружи рибосомы. В течение 9 месяцев американским исследователям удалось «снять» 20 миллионов кадров, отражающих лишь 2 наносекунды из жизни рибосомы.
Сотрудникам Лос-Аламосской национальной лаборатории удалось создать динамическую модель работы рибосомы, синтезирующей молекулу белка. Чтобы воспроизвести крохотную долю одного из фундаментальных биологических процессов, американским исследователям понадобился суперкомпьютер мощность 768 микропроцессоров, работавших в течение 260 дней. Им пришлось учитывать взаимодействие 2, 64 миллионов атомов, из которых на модель собственно рибосомы пришлась лишь четверть миллиона, а остальные изображали молекулы воды внутри и снаружи рибосомы. В течение 9 месяцев американским исследователям удалось «снять» 20 миллионов кадров, отражающих лишь 2 наносекунды из жизни рибосомы.
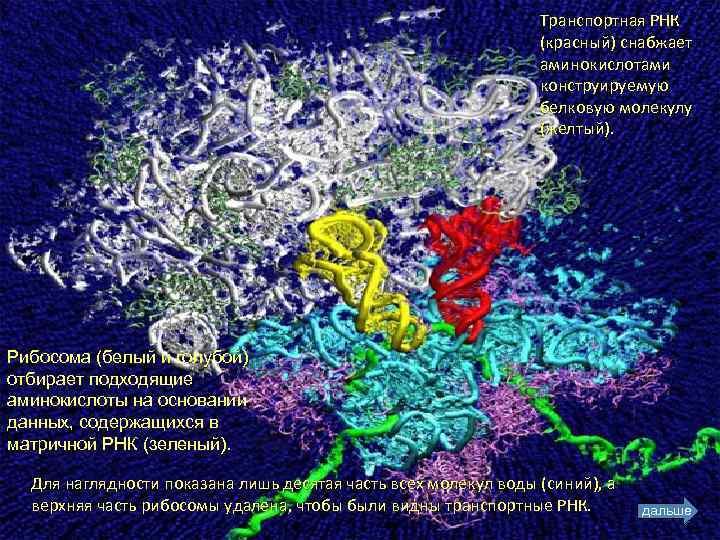 Транспортная РНК (красный) снабжает аминокислотами конструируемую белковую молекулу (желтый). Рибосома (белый и голубой) отбирает подходящие аминокислоты на основании данных, содержащихся в матричной РНК (зеленый). Для наглядности показана лишь десятая часть всех молекул воды (синий), а верхняя часть рибосомы удалена, чтобы были видны транспортные РНК. дальше
Транспортная РНК (красный) снабжает аминокислотами конструируемую белковую молекулу (желтый). Рибосома (белый и голубой) отбирает подходящие аминокислоты на основании данных, содержащихся в матричной РНК (зеленый). Для наглядности показана лишь десятая часть всех молекул воды (синий), а верхняя часть рибосомы удалена, чтобы были видны транспортные РНК. дальше
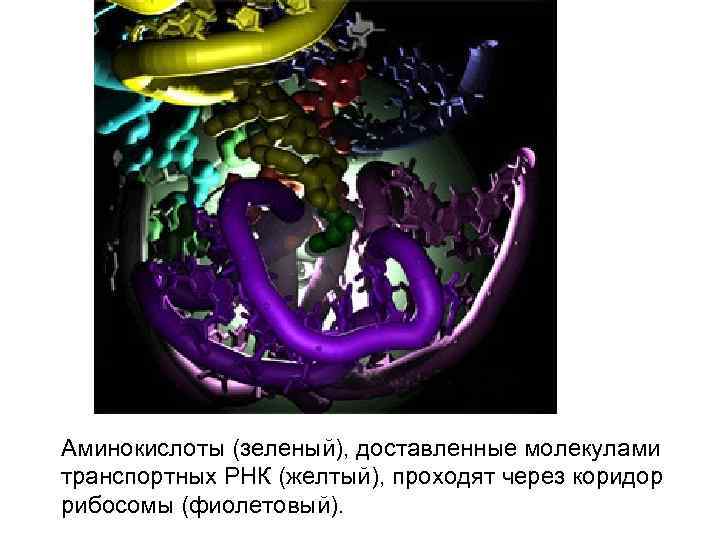 Аминокислоты (зеленый), доставленные молекулами транспортных РНК (желтый), проходят через коридор рибосомы (фиолетовый).
Аминокислоты (зеленый), доставленные молекулами транспортных РНК (желтый), проходят через коридор рибосомы (фиолетовый).
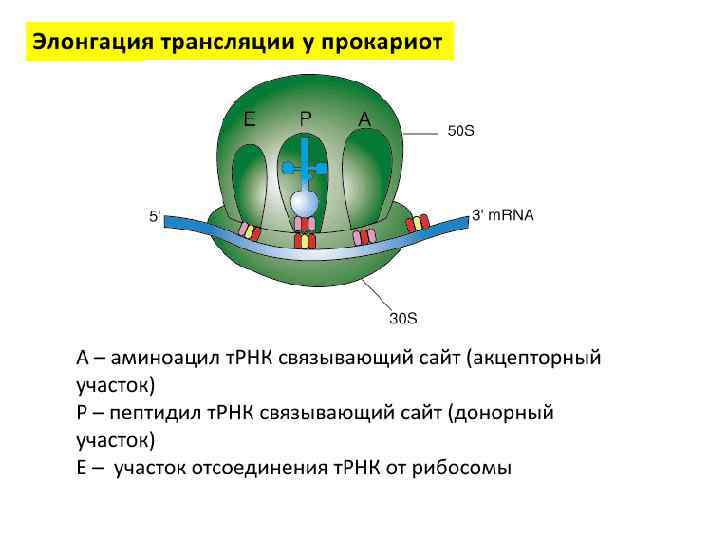
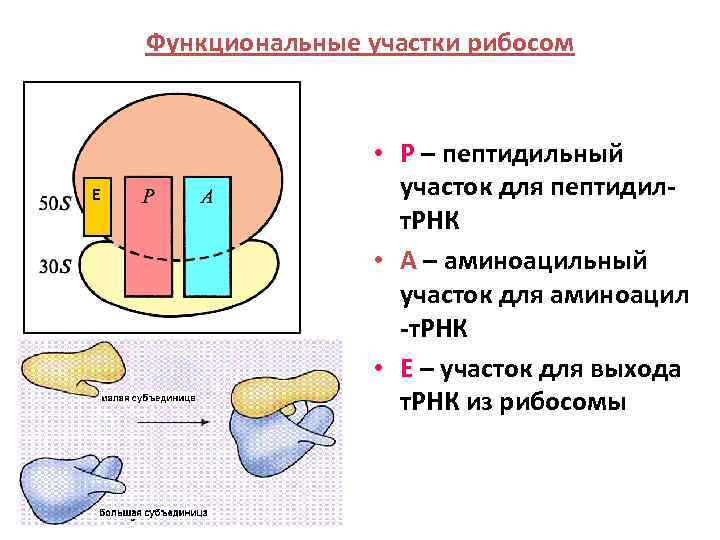 Функциональные участки рибосом E • Р – пептидильный участок для пептидилт. РНК • А – аминоацильный участок для аминоацил -т. РНК • Е – участок для выхода т. РНК из рибосомы
Функциональные участки рибосом E • Р – пептидильный участок для пептидилт. РНК • А – аминоацильный участок для аминоацил -т. РНК • Е – участок для выхода т. РНК из рибосомы
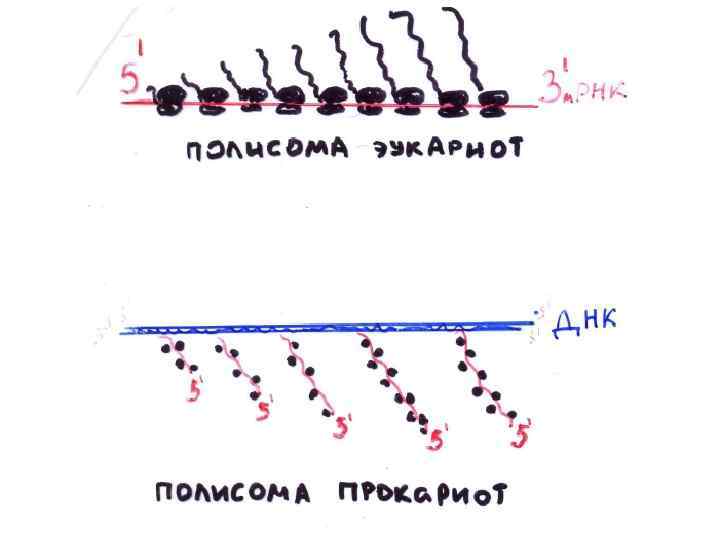
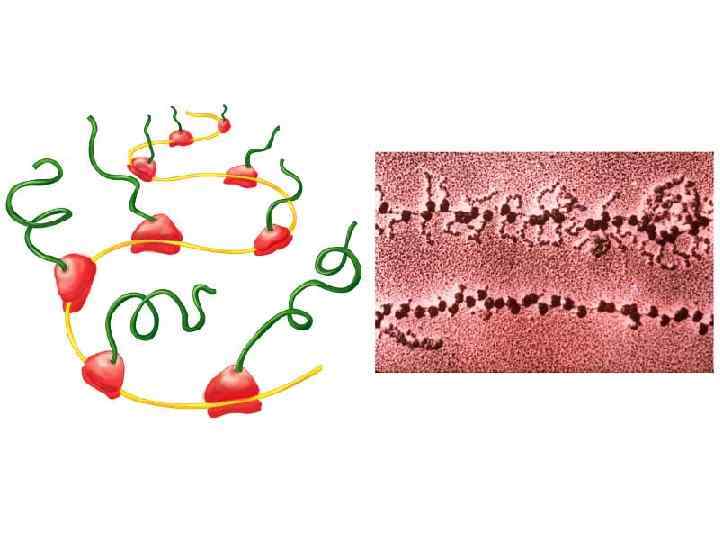
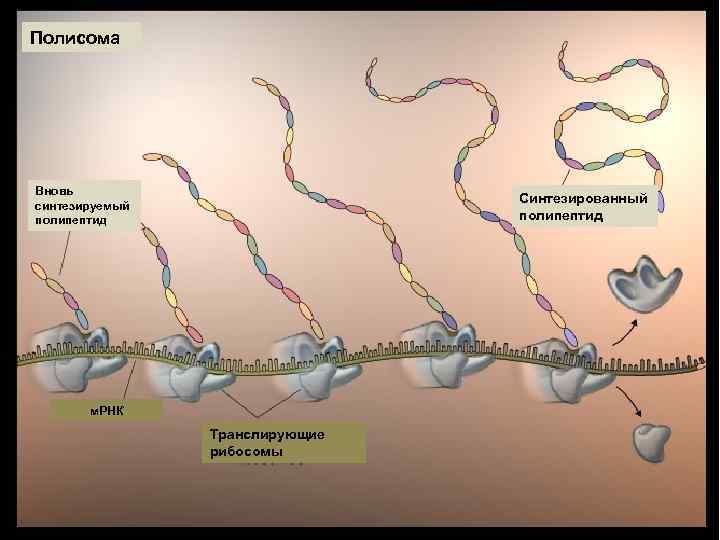 Полисома Вновь синтезируемый полипептид Синтезированный полипептид м. РНК Транслирующие рибосомы
Полисома Вновь синтезируемый полипептид Синтезированный полипептид м. РНК Транслирующие рибосомы
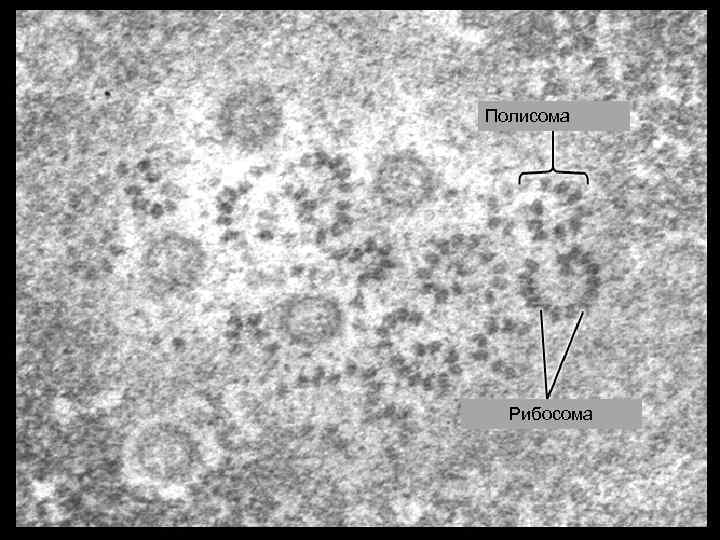 Полисома Рибосома
Полисома Рибосома
 Этапы трансляции 1. Инциация. 2. Элонгация. 3. Терминация.
Этапы трансляции 1. Инциация. 2. Элонгация. 3. Терминация.
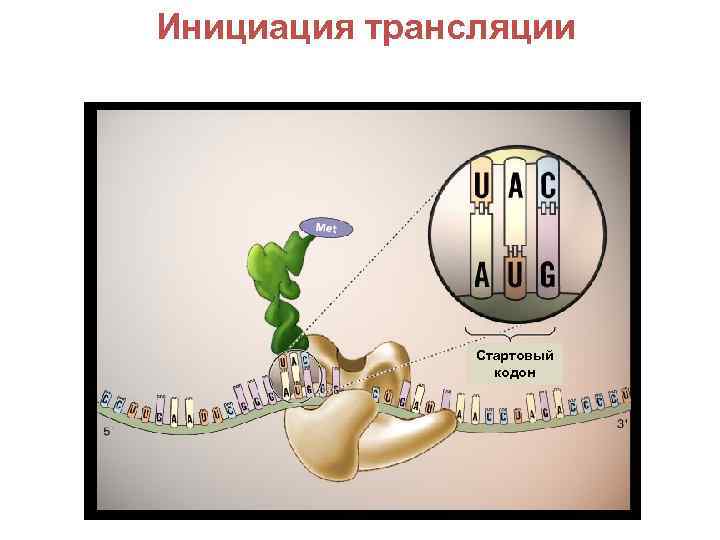 Инициация трансляции Стартовый кодон
Инициация трансляции Стартовый кодон
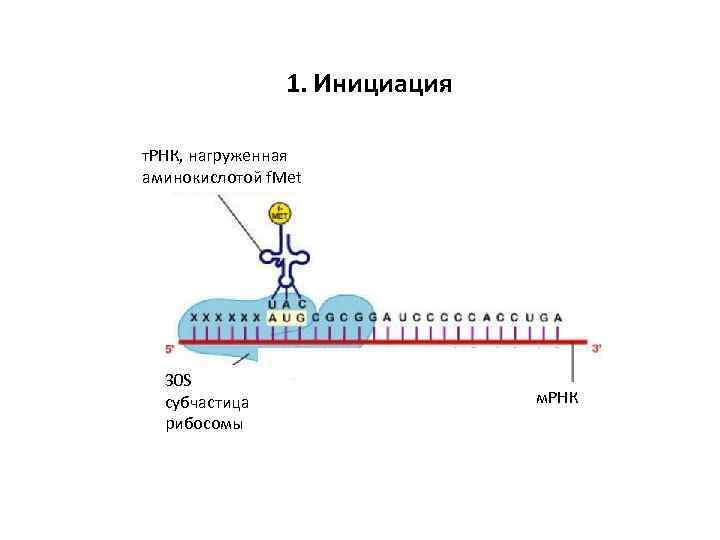 1. Инициация цация т. РНК, нагруженная аминокислотой f. Met 30 S субчастица рибосомы м. РНК
1. Инициация цация т. РНК, нагруженная аминокислотой f. Met 30 S субчастица рибосомы м. РНК


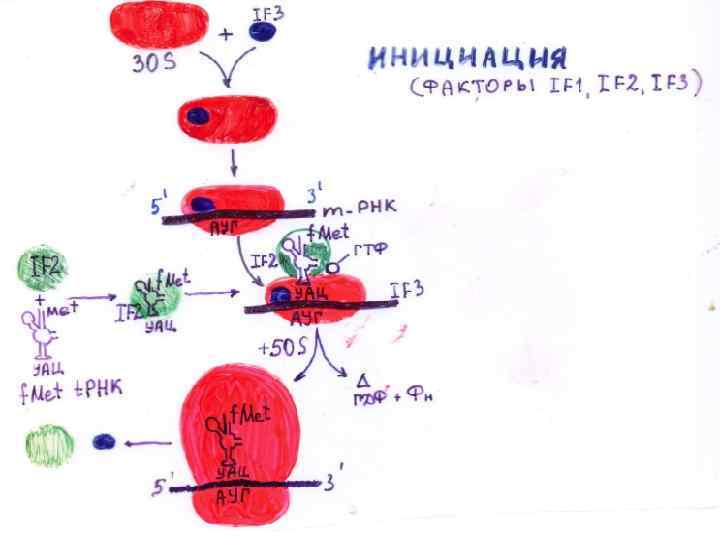
 На стадии инициации в процессе трансляции у бактерий E. coli участвуют три белковых фактора – IF-1, IF-2 и IF-3. w IF-3 -фактор прикрепляется к 30 S-субчастице рибосомы и способствует его взаимодействию с м. РНК. w F-1 -фактор закрывает А-сайт на 30 S-субчастице рибосомы, обеспечивая тем самым посадку первой f. Met-t. RNAf. Met на Рсайт рибосомы и защищая А-сайт от посадки какой-либо другой нагруженой аминокислотой TРНК. w IF-2 – это маленький ГТФ связывающий белок, который в форме IF-2 -ГТФ прикрепляется к нагруженой метионином f. Mett. RNAf. Met и помогает ей сесть на рибосому (на малую субчастицу). w Кроме того, IF-3 помогает t. RNAf. Met правильно осуществить взаимодействие с инициирующим кодоном AUG на м. РНК.
На стадии инициации в процессе трансляции у бактерий E. coli участвуют три белковых фактора – IF-1, IF-2 и IF-3. w IF-3 -фактор прикрепляется к 30 S-субчастице рибосомы и способствует его взаимодействию с м. РНК. w F-1 -фактор закрывает А-сайт на 30 S-субчастице рибосомы, обеспечивая тем самым посадку первой f. Met-t. RNAf. Met на Рсайт рибосомы и защищая А-сайт от посадки какой-либо другой нагруженой аминокислотой TРНК. w IF-2 – это маленький ГТФ связывающий белок, который в форме IF-2 -ГТФ прикрепляется к нагруженой метионином f. Mett. RNAf. Met и помогает ей сесть на рибосому (на малую субчастицу). w Кроме того, IF-3 помогает t. RNAf. Met правильно осуществить взаимодействие с инициирующим кодоном AUG на м. РНК.
 w Когда большая субчастица рибосомы прикрепляется к малой субчастице, происходит гидролиз ГТФ, что приводит к диссоциации IF 2 ГДФ и диссоциации IF 1. Таким образом, большая субчастица рибосомы служит как «ГТФ-аза активирующий белок» для IF-2. w Когда две субчастицы рибосомы оказываются соединенными вместе, м. РНК оказывается в канале, который образуется между субчастицами рибосомы.
w Когда большая субчастица рибосомы прикрепляется к малой субчастице, происходит гидролиз ГТФ, что приводит к диссоциации IF 2 ГДФ и диссоциации IF 1. Таким образом, большая субчастица рибосомы служит как «ГТФ-аза активирующий белок» для IF-2. w Когда две субчастицы рибосомы оказываются соединенными вместе, м. РНК оказывается в канале, который образуется между субчастицами рибосомы.
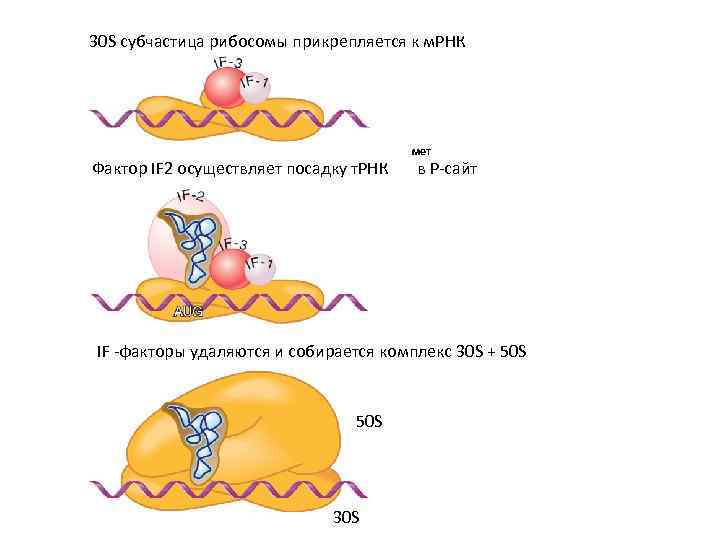 30 S субчастица рибосомы прикрепляется к м. РНК Фактор IF 2 осуществляет посадку т. РНК мет в Р-сайт IF -факторы удаляются и собирается комплекс 30 S + 50 S 30 S
30 S субчастица рибосомы прикрепляется к м. РНК Фактор IF 2 осуществляет посадку т. РНК мет в Р-сайт IF -факторы удаляются и собирается комплекс 30 S + 50 S 30 S
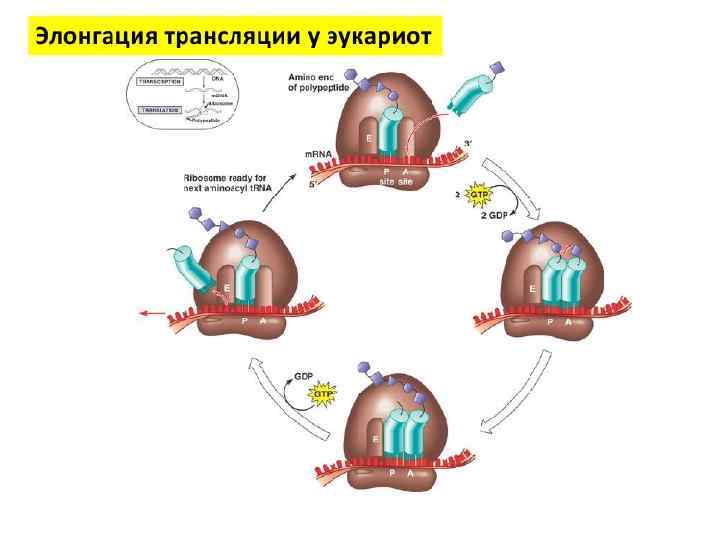
 Второй этап синтеза белка – элонгация, требует участия факторов элонгации: EF-Tu EF-Ts EF-G EF-Tu и EF-G являются маленькими ГТФсвязывающими белками.
Второй этап синтеза белка – элонгация, требует участия факторов элонгации: EF-Tu EF-Ts EF-G EF-Tu и EF-G являются маленькими ГТФсвязывающими белками.
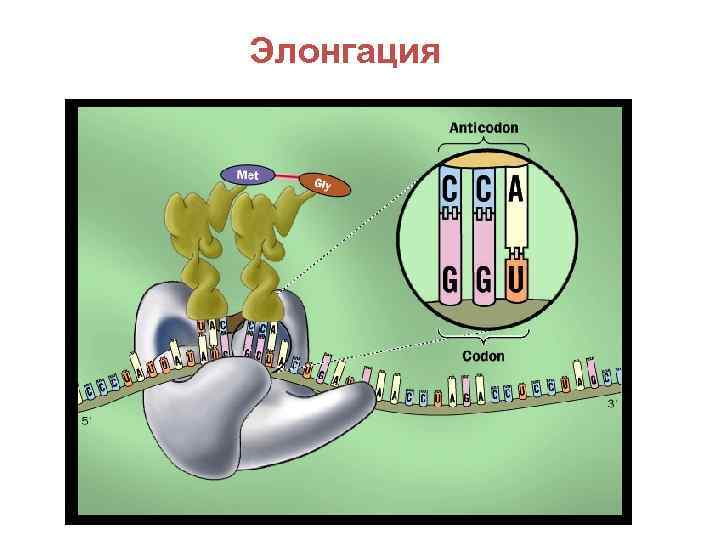 Элонгация
Элонгация
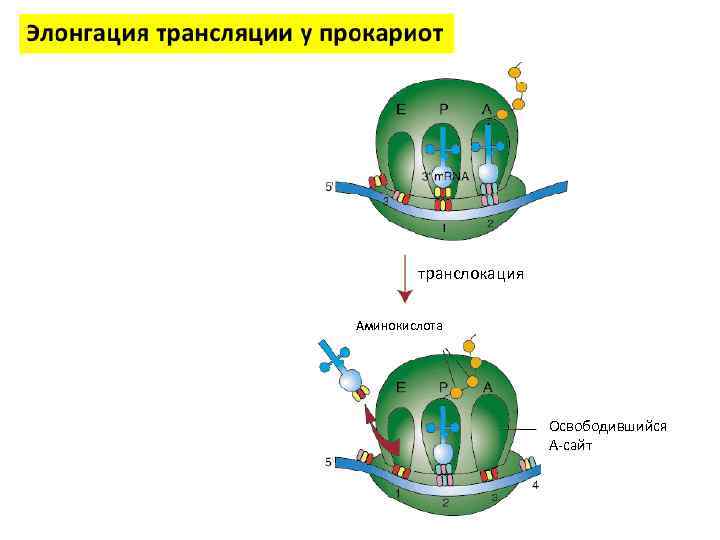 транслокация Аминокислота Освободившийся А-сайт
транслокация Аминокислота Освободившийся А-сайт
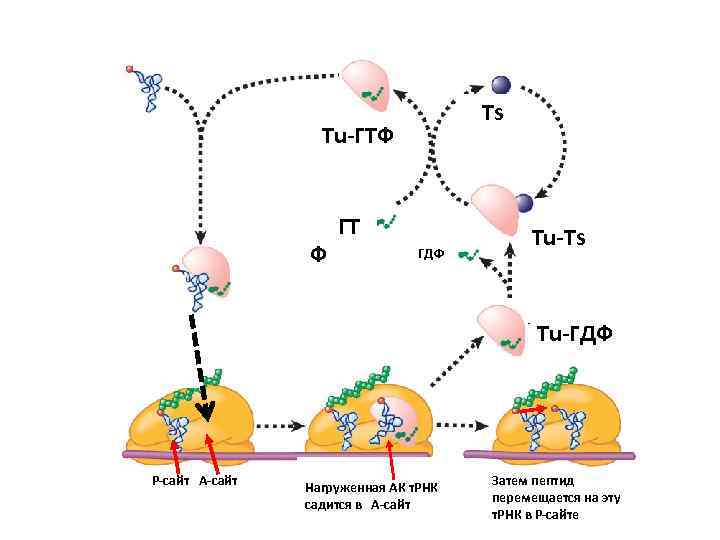 Ts Tu-ГТФ ГТ Ф ГДФ Tu-Ts Tu-ГДФ Р-сайт А-сайт Нагруженная АК т. РНК садится в А-сайт Затем пептид перемещается на эту т. РНК в Р-сайте
Ts Tu-ГТФ ГТ Ф ГДФ Tu-Ts Tu-ГДФ Р-сайт А-сайт Нагруженная АК т. РНК садится в А-сайт Затем пептид перемещается на эту т. РНК в Р-сайте
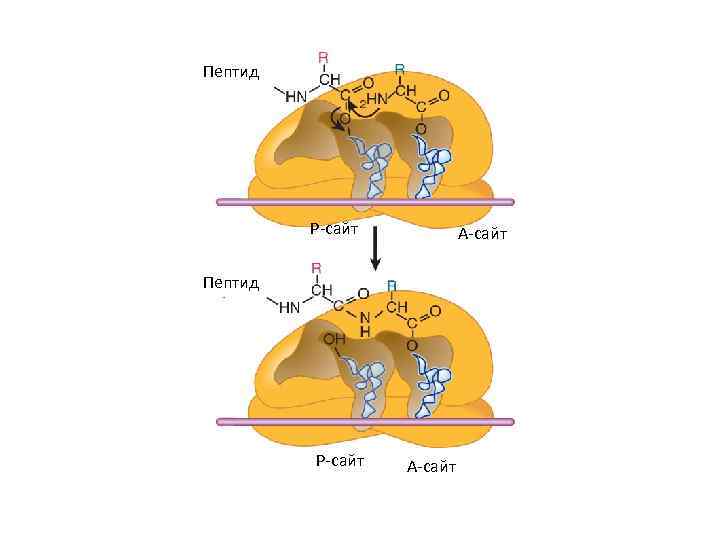 Пептид Р-сайт А-сайт
Пептид Р-сайт А-сайт
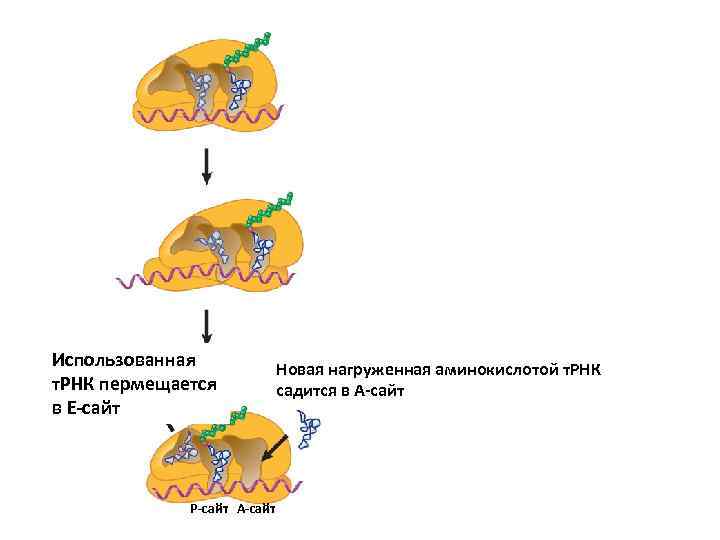 Использованная т. РНК пермещается в Е-сайт Р-сайт А-сайт Новая нагруженная аминокислотой т. РНК садится в А-сайт
Использованная т. РНК пермещается в Е-сайт Р-сайт А-сайт Новая нагруженная аминокислотой т. РНК садится в А-сайт
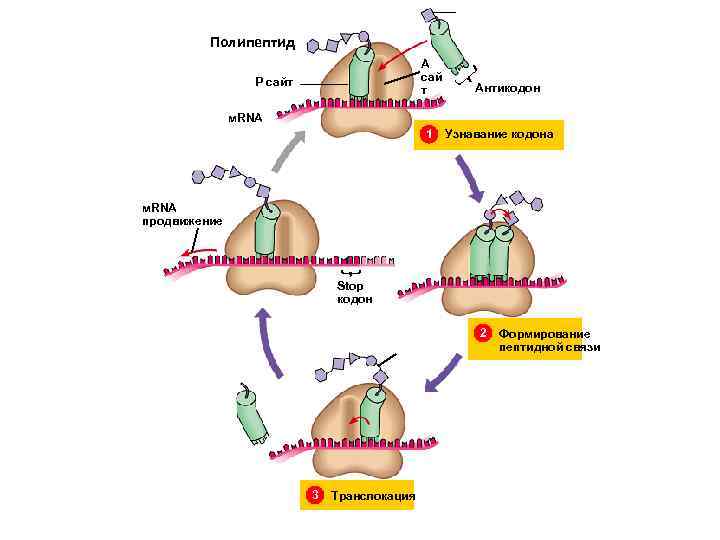 Полипептид Polypeptide A сай т P сайт Антикодон м. RNA 1 Узнавание кодона м. RNA продвижение Stop кодон 2 3 Транслокация Формирование пептидной связи
Полипептид Polypeptide A сай т P сайт Антикодон м. RNA 1 Узнавание кодона м. RNA продвижение Stop кодон 2 3 Транслокация Формирование пептидной связи


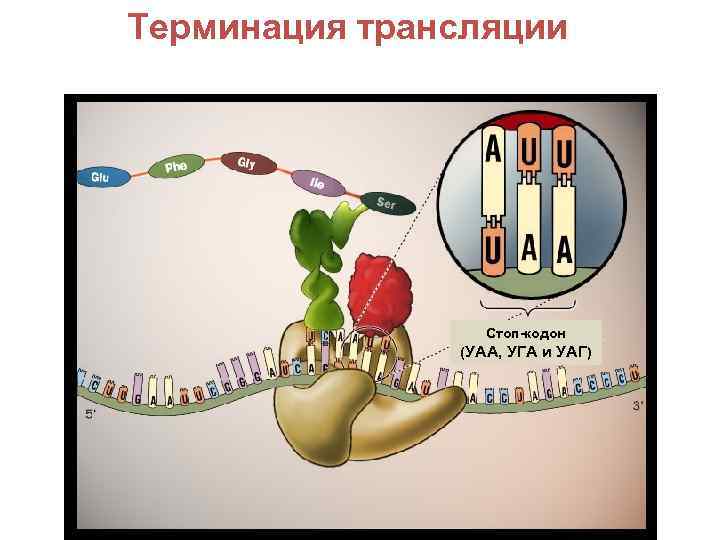 Терминация трансляции Стоп-кодон (УАА, УГА и УАГ)
Терминация трансляции Стоп-кодон (УАА, УГА и УАГ)
 • Факторы терминации (releasing factors): RF 1, RF 2 и RF 3 и ГТФ
• Факторы терминации (releasing factors): RF 1, RF 2 и RF 3 и ГТФ

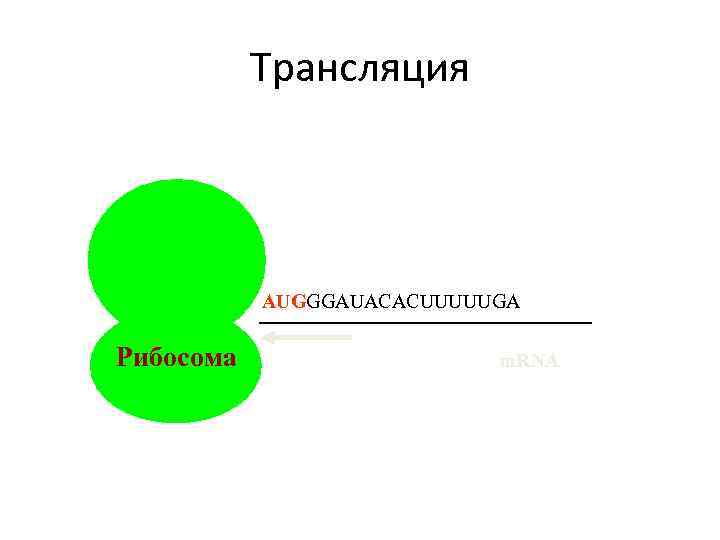 Трансляция AUGGGAUACACUUUUUGA Рибосома m. RNA
Трансляция AUGGGAUACACUUUUUGA Рибосома m. RNA
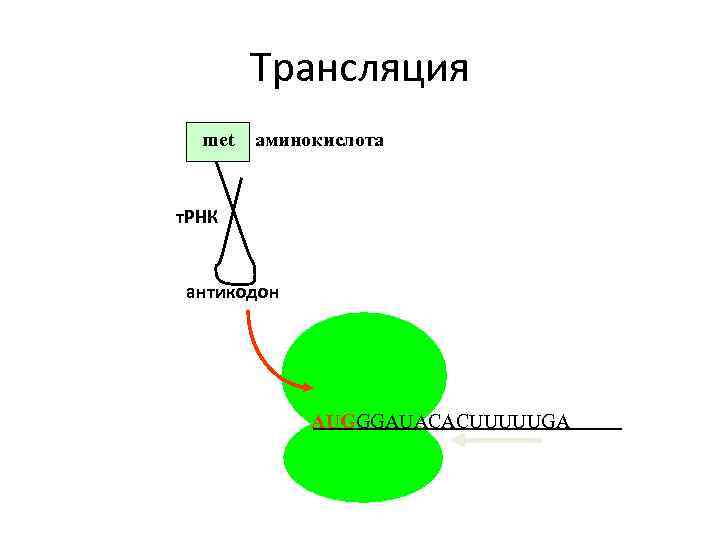 Трансляция met аминокислота т. РНК антикодон UAC AUGGGAUACACUUUUUGA
Трансляция met аминокислота т. РНК антикодон UAC AUGGGAUACACUUUUUGA
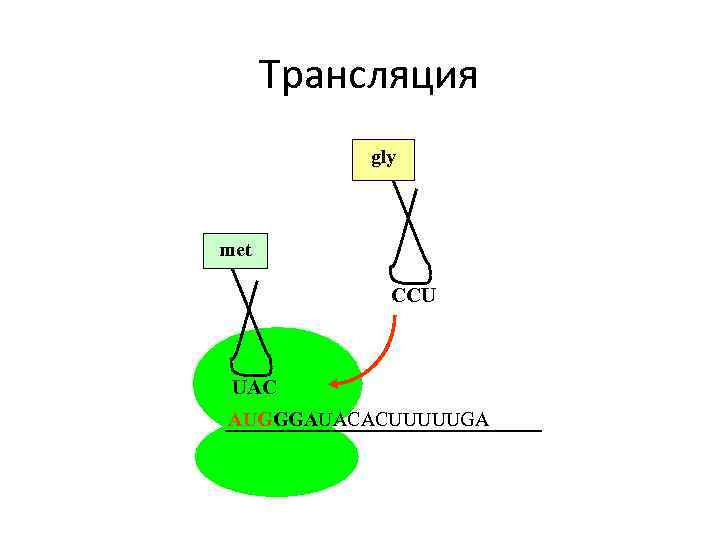 Translation 3 Трансляция gly met CCU UAC AUGGGAUACACUUUUUGA
Translation 3 Трансляция gly met CCU UAC AUGGGAUACACUUUUUGA
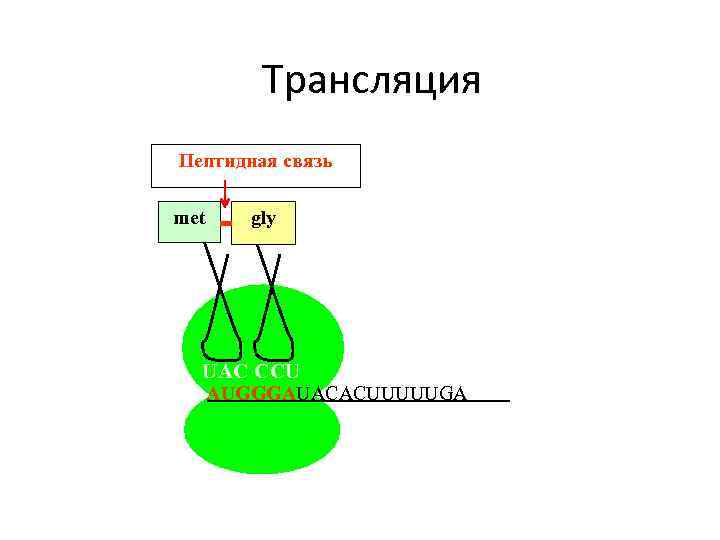 Translation 4 Трансляция Пептидная связь met gly UAC CCU AUGGGAUACACUUUUUGA
Translation 4 Трансляция Пептидная связь met gly UAC CCU AUGGGAUACACUUUUUGA
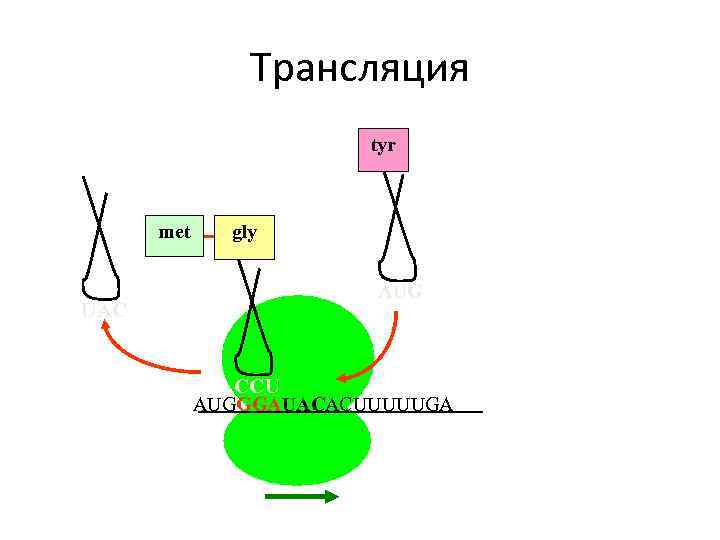 Трансляция tyr met UAC gly AUG CCU AUGGGAUACACUUUUUGA
Трансляция tyr met UAC gly AUG CCU AUGGGAUACACUUUUUGA
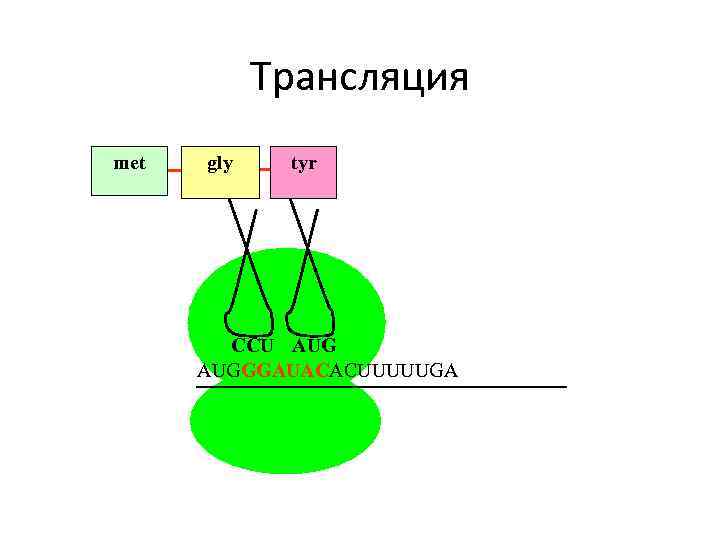 Трансляция met gly tyr CCU AUGGGAUACACUUUUUGA
Трансляция met gly tyr CCU AUGGGAUACACUUUUUGA
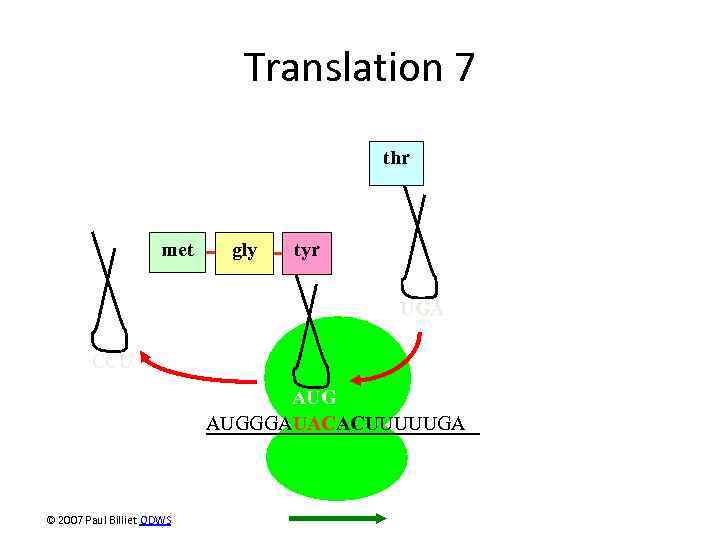 Translation 7 thr met gly tyr UGA CCU AUGGGAUACACUUUUUGA © 2007 Paul Billiet ODWS
Translation 7 thr met gly tyr UGA CCU AUGGGAUACACUUUUUGA © 2007 Paul Billiet ODWS
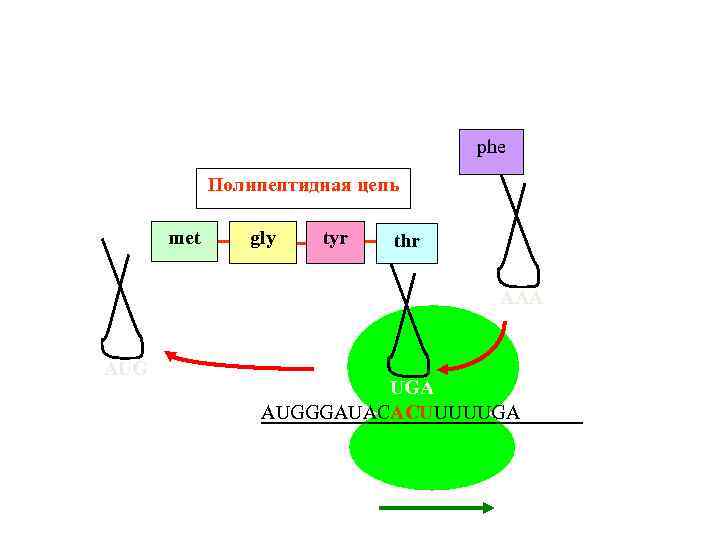 Translation 8 phe Полипептидная цепь met gly tyr thr AAA AUG UGA AUGGGAUACACUUUUUGA
Translation 8 phe Полипептидная цепь met gly tyr thr AAA AUG UGA AUGGGAUACACUUUUUGA
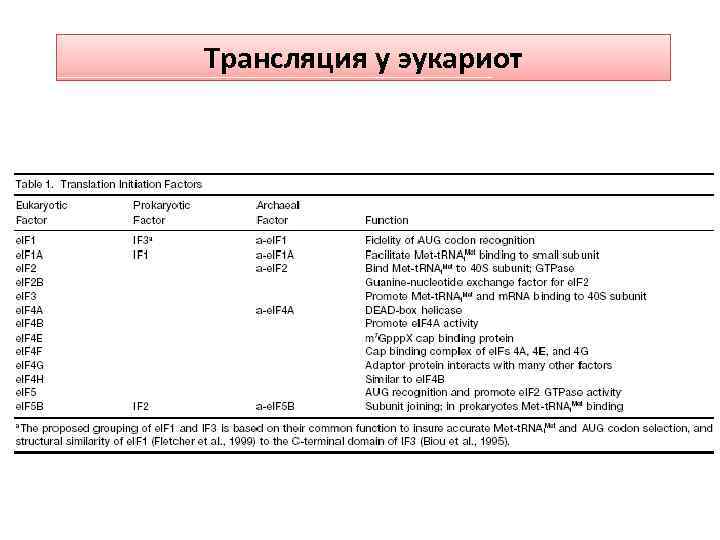
 Трансляция у эукариот
Трансляция у эукариот
 р. РНК Белки Субъединицы Собранная рибосома
р. РНК Белки Субъединицы Собранная рибосома



 Трансляция у эукариот
Трансляция у эукариот

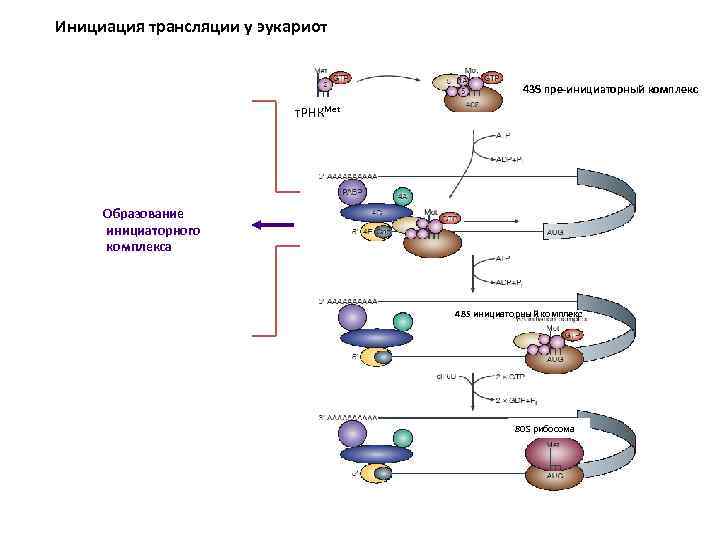 Инициация трансляции у эукариот 43 S пре-инициаторный комплекс т. РНКMet Образование инициаторного комплекса 48 S инициаторный комплекс 80 S рибосома
Инициация трансляции у эукариот 43 S пре-инициаторный комплекс т. РНКMet Образование инициаторного комплекса 48 S инициаторный комплекс 80 S рибосома
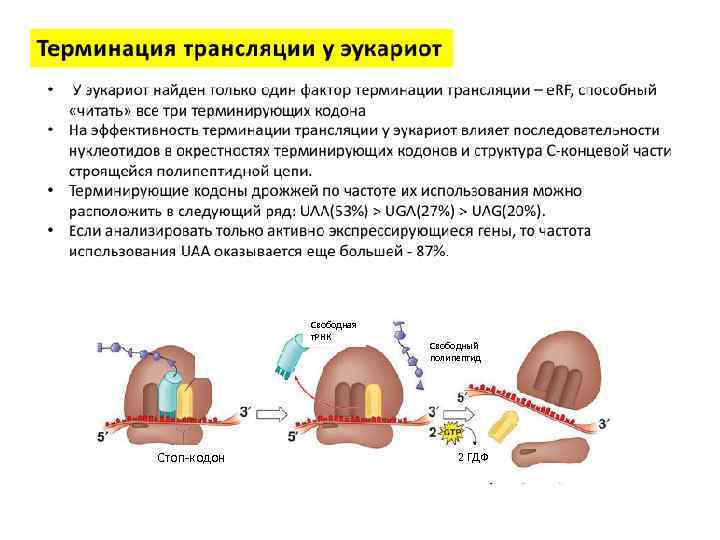 Свободная т. РНК Стоп-кодон Свободный полипептид 2 ГДФ
Свободная т. РНК Стоп-кодон Свободный полипептид 2 ГДФ
 Отличия трансляции прокариот и эукариот • Отличия имеются в процессе инициации трансляции. • Процессы элонгации и терминации трансляции в клетках эукариот и прокариот аналогичны, но у эукариот функции EF-Tu и EF-G выполняют белки e. EF 1α e. EF 2. • В терминации трансляции эукариот участвует один белковый фактор.
Отличия трансляции прокариот и эукариот • Отличия имеются в процессе инициации трансляции. • Процессы элонгации и терминации трансляции в клетках эукариот и прокариот аналогичны, но у эукариот функции EF-Tu и EF-G выполняют белки e. EF 1α e. EF 2. • В терминации трансляции эукариот участвует один белковый фактор.

 Антибактериальные антибиотики, в частности, стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Было высказано предположение, что эти антибиотики обусловливают ошибки в трансляции м. РНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами: например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате чего образуется аномальный белок, что приводит к гибели бактерий.
Антибактериальные антибиотики, в частности, стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Было высказано предположение, что эти антибиотики обусловливают ошибки в трансляции м. РНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами: например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате чего образуется аномальный белок, что приводит к гибели бактерий.
 Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70 S рибосоме (меньше тормозится синтез в 80 S рибосоме). Они легко проникают через клеточную мембрану. Считают, что тетрациклины тормозят связывание аминоацил-т. РНК с аминоацильным центром в 50 S рибосоме. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70 S рибосоме (меньше тормозится синтез в 80 S рибосоме). Они легко проникают через клеточную мембрану. Считают, что тетрациклины тормозят связывание аминоацил-т. РНК с аминоацильным центром в 50 S рибосоме. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
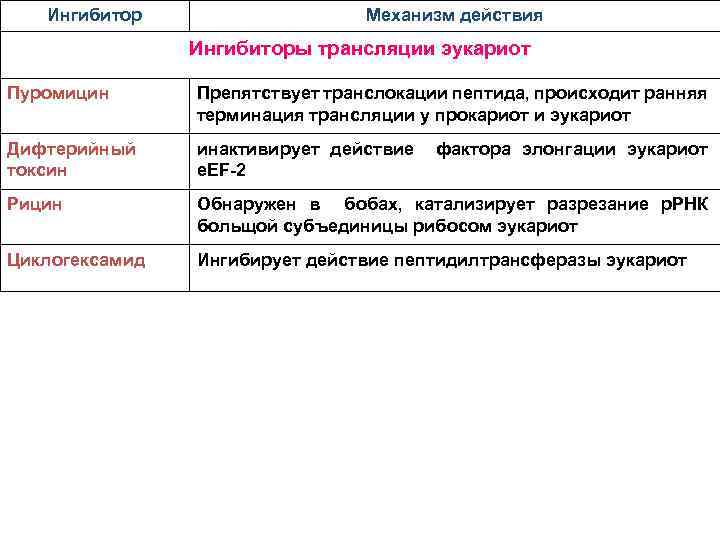 Ингибитор Механизм действия Ингибиторы трансляции эукариот Пуромицин Препятствует транслокации пептида, происходит ранняя терминация трансляции у прокариот и эукариот Дифтерийный токсин инактивирует действие е. EF-2 Рицин Обнаружен в бобах, катализирует разрезание р. РНК больщой субъединицы рибосом эукариот Циклогексамид Ингибирует действие пептидилтрансферазы эукариот фактора элонгации эукариот
Ингибитор Механизм действия Ингибиторы трансляции эукариот Пуромицин Препятствует транслокации пептида, происходит ранняя терминация трансляции у прокариот и эукариот Дифтерийный токсин инактивирует действие е. EF-2 Рицин Обнаружен в бобах, катализирует разрезание р. РНК больщой субъединицы рибосом эукариот Циклогексамид Ингибирует действие пептидилтрансферазы эукариот фактора элонгации эукариот
 Под действием дифтерийного токсина происходит ингибирование синтеза белков в клетках слизистой оболочки зева и гортани энтеротоксином возбудителя дифтерии Corynebacterium diphteriae. Некоторые штаммы этого патогенного микроорганизма получают ген токсина от бактериального вируса, называемого β-фагом, который инфицирует бактерию и индуцирует синтез токсина. В цитоплазме клеток хозяина под влиянием протеолитических ферментов токсин расщепляется на 2 фрагмента, один из которых является ферментом АДФ-рибозилтрансферазой. Этот фермент катализирует АДФрибозилирование и инактивацию фактора элонгации EF-2 по реакции: EF-2 + NAD+ → АДФ-рибозил-ЕF-2 + никотинамид + Н+. В условиях in vitro эта реакция обратима, но при р. Н и концентрации никотинамида, которые существуют в клетках, она становится необратимой. Модификация фактора EF-2 нарушает транслокацию рибосом, ведёт к прекращению биосинтеза белков в инфицированных клетках и к их гибели. С действием токсина связаны основные симптомы дифтерии.
Под действием дифтерийного токсина происходит ингибирование синтеза белков в клетках слизистой оболочки зева и гортани энтеротоксином возбудителя дифтерии Corynebacterium diphteriae. Некоторые штаммы этого патогенного микроорганизма получают ген токсина от бактериального вируса, называемого β-фагом, который инфицирует бактерию и индуцирует синтез токсина. В цитоплазме клеток хозяина под влиянием протеолитических ферментов токсин расщепляется на 2 фрагмента, один из которых является ферментом АДФ-рибозилтрансферазой. Этот фермент катализирует АДФрибозилирование и инактивацию фактора элонгации EF-2 по реакции: EF-2 + NAD+ → АДФ-рибозил-ЕF-2 + никотинамид + Н+. В условиях in vitro эта реакция обратима, но при р. Н и концентрации никотинамида, которые существуют в клетках, она становится необратимой. Модификация фактора EF-2 нарушает транслокацию рибосом, ведёт к прекращению биосинтеза белков в инфицированных клетках и к их гибели. С действием токсина связаны основные симптомы дифтерии.
 Резистентность многих животных к дифтерийному токсину, вероятнее всего, обусловлена трудностью или полным отсутствием проникновения (транспорта) токсина через мембрану клеток. Чрезвычайно токсичен белок рицин, выделенный из клещевины обыкновенной. Он представляет собой Nгликозилазу, которая удаляет один остаток аденина из 28 S р. РНК большой субъединицы рибосомы и ингибирует синтез белка у эукариотов. Рицин - белковый компонент касторового масла, иногда используемого в качестве слабительного средства. Из-за высокой токсичности рицина лечение касторовым маслом проводят короткими курсами, так как длительное употребление может вызвать нарушение работы кишечника и даже гибель больного.
Резистентность многих животных к дифтерийному токсину, вероятнее всего, обусловлена трудностью или полным отсутствием проникновения (транспорта) токсина через мембрану клеток. Чрезвычайно токсичен белок рицин, выделенный из клещевины обыкновенной. Он представляет собой Nгликозилазу, которая удаляет один остаток аденина из 28 S р. РНК большой субъединицы рибосомы и ингибирует синтез белка у эукариотов. Рицин - белковый компонент касторового масла, иногда используемого в качестве слабительного средства. Из-за высокой токсичности рицина лечение касторовым маслом проводят короткими курсами, так как длительное употребление может вызвать нарушение работы кишечника и даже гибель больного.
 Генетический код
Генетический код
 Многообразие жизни обусловлено разнообразием белковых молекул, выполняющих различные биологические функции. Структура белков определяется набором и порядком расположения аминокислот в пептидных цепях. Набор и порядок аминокислот в пептидных цепях зашифрованы в молекуле ДНК с помощью генетического кода
Многообразие жизни обусловлено разнообразием белковых молекул, выполняющих различные биологические функции. Структура белков определяется набором и порядком расположения аминокислот в пептидных цепях. Набор и порядок аминокислот в пептидных цепях зашифрованы в молекуле ДНК с помощью генетического кода
 Генетический код – это единая система записи наследственной информации в виде последовательности нуклеотидов в ДНК или м. РНК, которая определяет последовательность аминокислот в белке
Генетический код – это единая система записи наследственной информации в виде последовательности нуклеотидов в ДНК или м. РНК, которая определяет последовательность аминокислот в белке
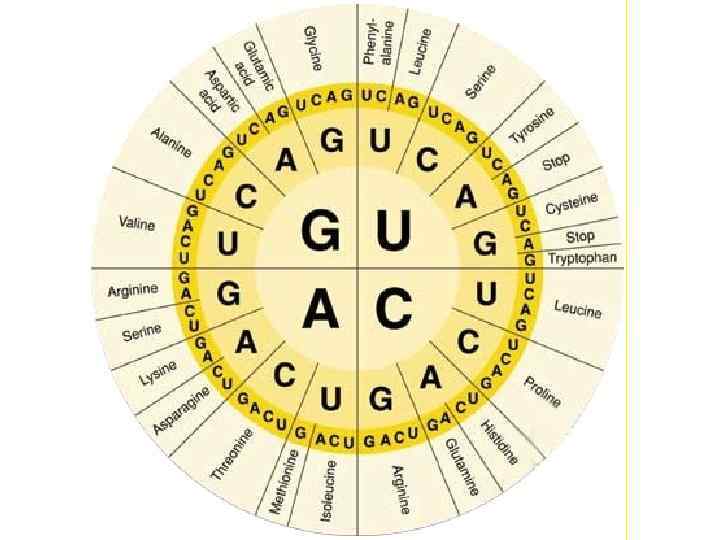
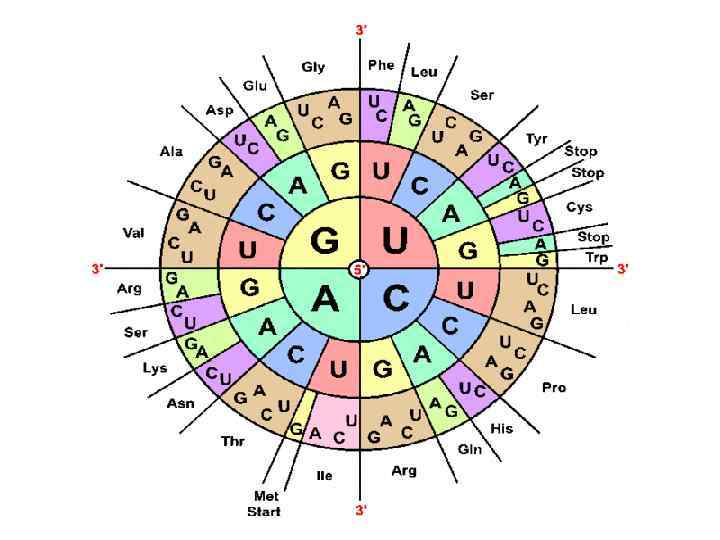

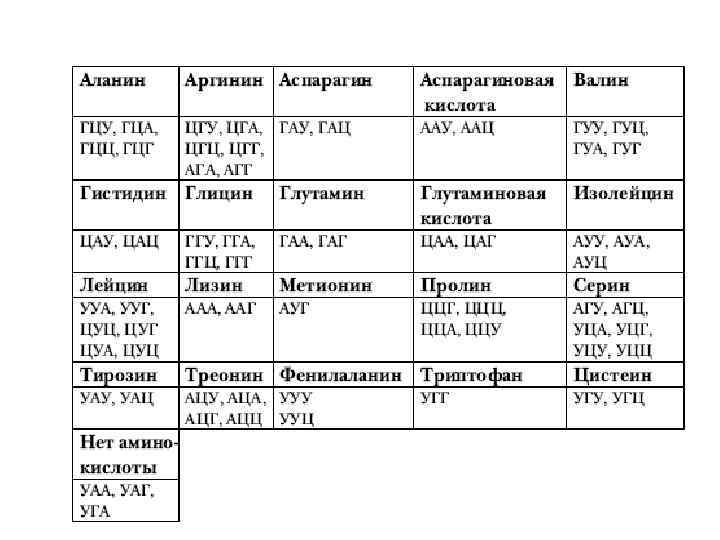

 Свойства генетического кода: 1. Триплетность: каждая аминокислота кодируется триплетом нуклеотидов ДНК и соответствующим кодоном м. РНК. 2. Однозначность: один кодон соответствует одной аминокислоте. 3. Непрерывность: кодоны м. РНК не отделены друг от друга (отсутствуют «запятые» ). 4. Вырожденность (избыточность): одна аминокислота может кодироваться разными кодонами. 5. Неперекрываемость: каждый нуклеотид в м. РНК принадлежит только одному кодону (исключения обнаружены у вирусов). 6. Универсальность: генетический код одинаков для всех организмов. 7. Колинеарность: последовательность триплетов в ДНК соответствует последовательности аминокислот в белке. 8. Инициирующим кодоном является АУГ (редко ГУГ). 9. Терминирующими кодонами являются УАА, УГА, УАГ.
Свойства генетического кода: 1. Триплетность: каждая аминокислота кодируется триплетом нуклеотидов ДНК и соответствующим кодоном м. РНК. 2. Однозначность: один кодон соответствует одной аминокислоте. 3. Непрерывность: кодоны м. РНК не отделены друг от друга (отсутствуют «запятые» ). 4. Вырожденность (избыточность): одна аминокислота может кодироваться разными кодонами. 5. Неперекрываемость: каждый нуклеотид в м. РНК принадлежит только одному кодону (исключения обнаружены у вирусов). 6. Универсальность: генетический код одинаков для всех организмов. 7. Колинеарность: последовательность триплетов в ДНК соответствует последовательности аминокислот в белке. 8. Инициирующим кодоном является АУГ (редко ГУГ). 9. Терминирующими кодонами являются УАА, УГА, УАГ.
 Генетический код триплетный: каждая аминокислота кодируется триплетом нуклеотидов ДНК и соответствующим кодоном м. РНК Первое предположение о строении генетического кода появилась уже в 1954 г. Георгий Гамов предположил, что кодирование информации в молекулах ДНК осуществляется сочетаниями нескольких нуклеотидов. Очевидно, что однозначного соответствия « 1 нуклеотид - 1 аминокислота» в коде быть не может, так как в этом случае должно было быть только 4 аминокислоты. Дуплетный код « 2 нуклеотида – одна аминокислота» соответствовал бы только 16 -и аминокислотам. Лишь триплетный код обеспечивает шифровку 20 различных аминокислот. Четыре нуклеотида в случае триплетного кода дают 64 варианта триплетов.
Генетический код триплетный: каждая аминокислота кодируется триплетом нуклеотидов ДНК и соответствующим кодоном м. РНК Первое предположение о строении генетического кода появилась уже в 1954 г. Георгий Гамов предположил, что кодирование информации в молекулах ДНК осуществляется сочетаниями нескольких нуклеотидов. Очевидно, что однозначного соответствия « 1 нуклеотид - 1 аминокислота» в коде быть не может, так как в этом случае должно было быть только 4 аминокислоты. Дуплетный код « 2 нуклеотида – одна аминокислота» соответствовал бы только 16 -и аминокислотам. Лишь триплетный код обеспечивает шифровку 20 различных аминокислот. Четыре нуклеотида в случае триплетного кода дают 64 варианта триплетов.
 Соображения Г. Гамова: 1 4 = 4 – кодон из одного нуклеотида может кодировать только 4 аминокислоты. 42=16 – кодон из двух нуклеотидов может кодировать только 16 аминокислот. 43=64 – триплетный кодон достаточен с избытком для кодирования 20 аминокислот.
Соображения Г. Гамова: 1 4 = 4 – кодон из одного нуклеотида может кодировать только 4 аминокислоты. 42=16 – кодон из двух нуклеотидов может кодировать только 16 аминокислот. 43=64 – триплетный кодон достаточен с избытком для кодирования 20 аминокислот.
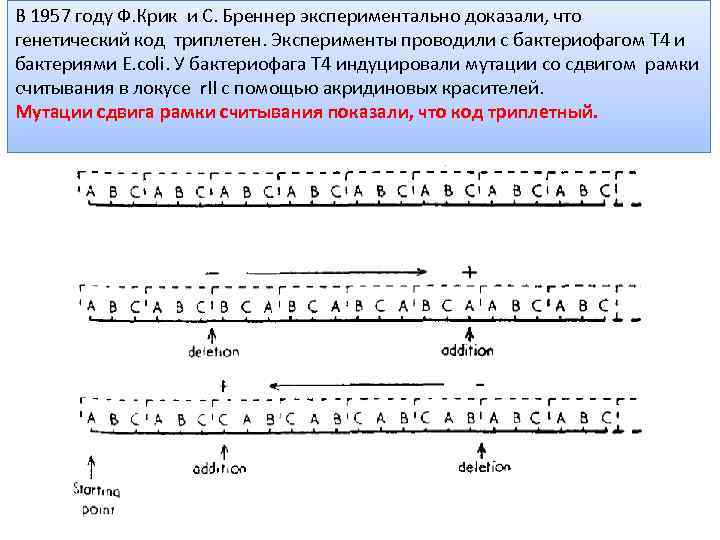 В 1957 году Ф. Крик и С. Бреннер экспериментально доказали, что генетический код триплетен. Эксперименты проводили с бактериофагом Т 4 и бактериями E. coli. У бактериофага Т 4 индуцировали мутации со сдвигом рамки считывания в локусе r. II с помощью акридиновых красителей. Мутации сдвига рамки считывания показали, что код триплетный.
В 1957 году Ф. Крик и С. Бреннер экспериментально доказали, что генетический код триплетен. Эксперименты проводили с бактериофагом Т 4 и бактериями E. coli. У бактериофага Т 4 индуцировали мутации со сдвигом рамки считывания в локусе r. II с помощью акридиновых красителей. Мутации сдвига рамки считывания показали, что код триплетный.
 • тройные мутанты из одного класса, (+)¤(+) и (–)¤(–), дают восстановление к дикому типу CUACUACUACGUACUACUACUACUACU Leu. Arg. Thr ¤ CUACUACUACGUACUACUACUACU Leu. Arg. Thr двойной мутант – нет функции CUACAUCUA│CGU│ACUACU│ACG│UACUACUACUAC Leu. Arg. Thr. Gln. Tyr ¤ CUACUACUACUACUACGUAGCUACUACUACU Leu. Arg. Thr тройной мутант – слабая функция CUACUACUACGUACUACUACGUACUACUACUA Leu. Arg. Thr. Tyr. Val. Leu
• тройные мутанты из одного класса, (+)¤(+) и (–)¤(–), дают восстановление к дикому типу CUACUACUACGUACUACUACUACUACU Leu. Arg. Thr ¤ CUACUACUACGUACUACUACUACU Leu. Arg. Thr двойной мутант – нет функции CUACAUCUA│CGU│ACUACU│ACG│UACUACUACUAC Leu. Arg. Thr. Gln. Tyr ¤ CUACUACUACUACUACGUAGCUACUACUACU Leu. Arg. Thr тройной мутант – слабая функция CUACUACUACGUACUACUACGUACUACUACUA Leu. Arg. Thr. Tyr. Val. Leu
 . Генетический код однозначный: один кодон соответствует одной аминокислоте Бесклеточная система синтеза пептидов - к экстрактам E. сoli, способным к бесклеточному синтезу белка, добавляли полирибонуклеотиды, которые выполняли роль м. РНК. В 1961 г. биохимики М. Ниренберг и Г. Маттеи изучали синтез белков в бесклеточной системе E. coli. В каждой из 20 пробирок имелись все клеточные компоненты бактерии (кроме нуклеиновых кислот) и все 20 аминокислот, одна из которых содержала радиоактивную метку. В одном из экспериментов в качестве матрицы добавили в реакционную смесь полиуридиловую кислоту (РНК, состоящую из UUUUUUU). В результате в 1000 раз увеличилось количество белка, содержащего меченую аминокислоту фенилаланин. Был сделан вывод, что фенилаланин кодируется трилетом UUU. Подобным образом было показано, что кодон ААА кодирует лизин, кодон ГГГ – глицин.
. Генетический код однозначный: один кодон соответствует одной аминокислоте Бесклеточная система синтеза пептидов - к экстрактам E. сoli, способным к бесклеточному синтезу белка, добавляли полирибонуклеотиды, которые выполняли роль м. РНК. В 1961 г. биохимики М. Ниренберг и Г. Маттеи изучали синтез белков в бесклеточной системе E. coli. В каждой из 20 пробирок имелись все клеточные компоненты бактерии (кроме нуклеиновых кислот) и все 20 аминокислот, одна из которых содержала радиоактивную метку. В одном из экспериментов в качестве матрицы добавили в реакционную смесь полиуридиловую кислоту (РНК, состоящую из UUUUUUU). В результате в 1000 раз увеличилось количество белка, содержащего меченую аминокислоту фенилаланин. Был сделан вывод, что фенилаланин кодируется трилетом UUU. Подобным образом было показано, что кодон ААА кодирует лизин, кодон ГГГ – глицин.
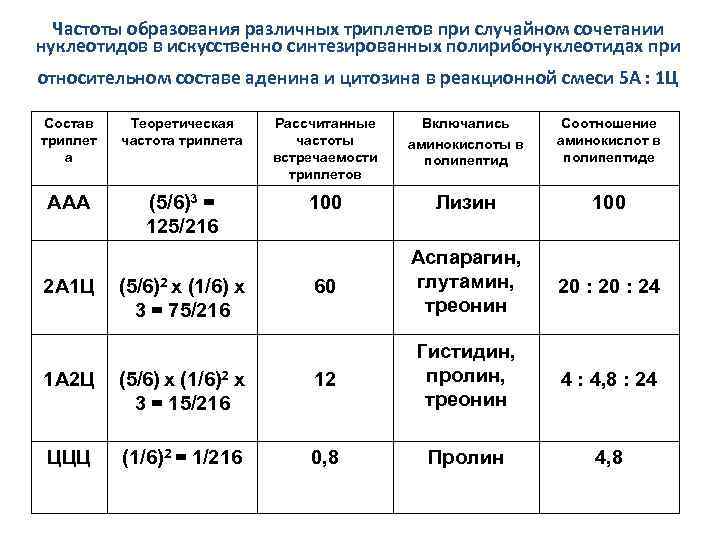 Частоты образования различных триплетов при случайном сочетании нуклеотидов в искусственно синтезированных полирибонуклеотидах при относительном составе аденина и цитозина в реакционной смеси 5 А : 1 Ц Состав триплет а Теоретическая частота триплета Рассчитанные частоты встречаемости триплетов Включались аминокислоты в полипептид Соотношение аминокислот в полипептиде ААА (5/6)3 = 125/216 100 Лизин 100 60 Аспарагин, глутамин, треонин 20 : 24 4 : 4, 8 : 24 4, 8 2 А 1 Ц (5/6)2 х (1/6) х 3 = 75/216 1 А 2 Ц (5/6) х (1/6)2 х 3 = 15/216 12 Гистидин, пролин, треонин ЦЦЦ (1/6)2 = 1/216 0, 8 Пролин
Частоты образования различных триплетов при случайном сочетании нуклеотидов в искусственно синтезированных полирибонуклеотидах при относительном составе аденина и цитозина в реакционной смеси 5 А : 1 Ц Состав триплет а Теоретическая частота триплета Рассчитанные частоты встречаемости триплетов Включались аминокислоты в полипептид Соотношение аминокислот в полипептиде ААА (5/6)3 = 125/216 100 Лизин 100 60 Аспарагин, глутамин, треонин 20 : 24 4 : 4, 8 : 24 4, 8 2 А 1 Ц (5/6)2 х (1/6) х 3 = 75/216 1 А 2 Ц (5/6) х (1/6)2 х 3 = 15/216 12 Гистидин, пролин, треонин ЦЦЦ (1/6)2 = 1/216 0, 8 Пролин
 Определение связывания т. РНК, специфичных для каждой из 20 АМК с синтезированными 64 триплетами. Это позволило идентифицировать 50 кодонов. В 1964 г М. Ниренберг и Ф. Ледер разработали метод связывания на рибосомах в бесклеточной системе аминоацил-т-РНК с м. РНК матрицами, состоящими из 2 -х и 3 -х нуклеотидов) с заданным порядком оснований. Все динуклеотиды оказались неэффективными в связывании т-РНК. Тринуклеотиды же обеспечивали присоединение аминоацил-т-РНК к матрице РНК. Тем самым окончательно была доказана триплетность кода. Полученные комплексы подвергали фильтрованию через мелкопористый фильтр, пропускавший отдельные компоненты, связавшиеся аминоацил-т-РНК, нагруженные определенной аминокислотой, оседали на фильтре. Эти комплексы мини-т-РНК + аминокислота позволили определить соответствие между аминокислотой и типом мини-т-РНК. Метод позволял перепробовать и все возможные триплеты по одному. В результате уже через год были испытаны все 64 триплета. Почти все
Определение связывания т. РНК, специфичных для каждой из 20 АМК с синтезированными 64 триплетами. Это позволило идентифицировать 50 кодонов. В 1964 г М. Ниренберг и Ф. Ледер разработали метод связывания на рибосомах в бесклеточной системе аминоацил-т-РНК с м. РНК матрицами, состоящими из 2 -х и 3 -х нуклеотидов) с заданным порядком оснований. Все динуклеотиды оказались неэффективными в связывании т-РНК. Тринуклеотиды же обеспечивали присоединение аминоацил-т-РНК к матрице РНК. Тем самым окончательно была доказана триплетность кода. Полученные комплексы подвергали фильтрованию через мелкопористый фильтр, пропускавший отдельные компоненты, связавшиеся аминоацил-т-РНК, нагруженные определенной аминокислотой, оседали на фильтре. Эти комплексы мини-т-РНК + аминокислота позволили определить соответствие между аминокислотой и типом мини-т-РНК. Метод позволял перепробовать и все возможные триплеты по одному. В результате уже через год были испытаны все 64 триплета. Почти все
 Было показано, что из 64 возможных триплетов 61 кодирует различные аминокислоты; а 3 триплета (УАА, УГА, УАГ) получили название бессмысленных, или «нонсенстриплетов» Они не кодируют аминокислот, но выполняют функцию знаков препинания при считывании наследственной информации.
Было показано, что из 64 возможных триплетов 61 кодирует различные аминокислоты; а 3 триплета (УАА, УГА, УАГ) получили название бессмысленных, или «нонсенстриплетов» Они не кодируют аминокислот, но выполняют функцию знаков препинания при считывании наследственной информации.

 Генетический код непрерывный: кодоны на м. РНК не отделены друг от друга (отсутствуют «запятые» ) Важнейшими характеристиками генетического кода являются его непрерывность и неперекрываемость кодонов при считывании. Это означает, что последовательность нуклеотидов считывается триплет за триплетом без пропусков, при этом соседние триплеты не перекрывают друга, т. е. каждый отдельный нуклеотид входит в состав только одного триплета при заданной рамке считывания. Доказательством неперекрываемости генетического кода является замена только одной аминокислоты в пептиде при замене одного нуклеотида в ДНК. В случае включения нуклеотида в несколько перекрывающихся триплетов его замена влекла бы за собой замену 2 или 3 -х рядом стоящих аминокислот в пептидной цепи.
Генетический код непрерывный: кодоны на м. РНК не отделены друг от друга (отсутствуют «запятые» ) Важнейшими характеристиками генетического кода являются его непрерывность и неперекрываемость кодонов при считывании. Это означает, что последовательность нуклеотидов считывается триплет за триплетом без пропусков, при этом соседние триплеты не перекрывают друга, т. е. каждый отдельный нуклеотид входит в состав только одного триплета при заданной рамке считывания. Доказательством неперекрываемости генетического кода является замена только одной аминокислоты в пептиде при замене одного нуклеотида в ДНК. В случае включения нуклеотида в несколько перекрывающихся триплетов его замена влекла бы за собой замену 2 или 3 -х рядом стоящих аминокислот в пептидной цепи.
 кодон м. РНК кодон
кодон м. РНК кодон
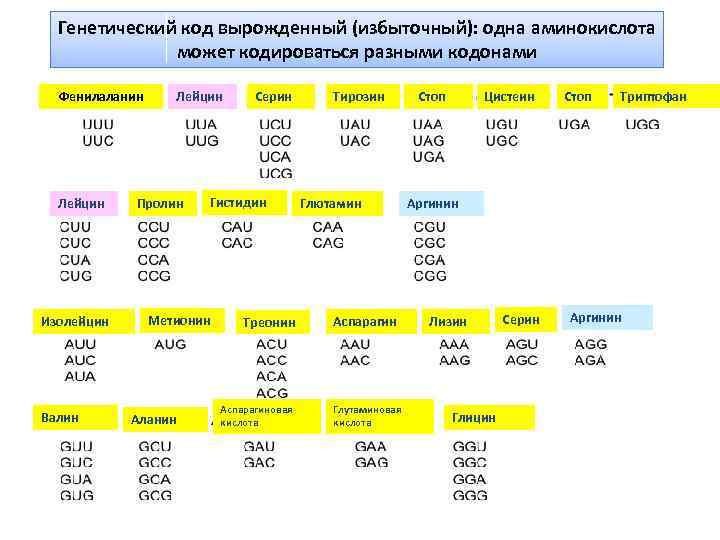 Генетический код вырожденный (избыточный): одна аминокислота может кодироваться разными кодонами Фенилаланин Лейцин Изолейцин Валин Лейцин Пролин Гистидин Метионин Аланин Серин Треонин Аспарагиновая кислота Тирозин Глютамин Аспарагин Глутаминовая кислота Стоп Цистеин Стоп Триптофан Аргинин Лизин Глицин Серин Аргинин
Генетический код вырожденный (избыточный): одна аминокислота может кодироваться разными кодонами Фенилаланин Лейцин Изолейцин Валин Лейцин Пролин Гистидин Метионин Аланин Серин Треонин Аспарагиновая кислота Тирозин Глютамин Аспарагин Глутаминовая кислота Стоп Цистеин Стоп Триптофан Аргинин Лизин Глицин Серин Аргинин
 Обращает на себя внимание избыточность кода, проявляющаяся в том, что многие аминокислоты шифруются несколькими триплетами. Это свойство триплетного кода, названное вырожденностью, имеет очень важное значение: мутационные изменения молекулы ДНК типа замены одного нуклеотида на другой далеко не всегда изменяет смысл триплета. Возникшее таким образом новое сочетание из трех нуклеотидов часто кодирует ту же самую аминокислоту. Иными словами, вырожденность кода повышает его запас прочности в случае возникновения генных мутаций.
Обращает на себя внимание избыточность кода, проявляющаяся в том, что многие аминокислоты шифруются несколькими триплетами. Это свойство триплетного кода, названное вырожденностью, имеет очень важное значение: мутационные изменения молекулы ДНК типа замены одного нуклеотида на другой далеко не всегда изменяет смысл триплета. Возникшее таким образом новое сочетание из трех нуклеотидов часто кодирует ту же самую аминокислоту. Иными словами, вырожденность кода повышает его запас прочности в случае возникновения генных мутаций.
 Генетический код универсальный – он практически одинаков для всех организмов Универсальность генетического кода свидетельствует о единстве происхождения всего многообразия живых форм на Земле в процессе биологической эволюции. Отличия генетического кода обнаружены у митохондрий и пластид. Это свидетельствует в пользу дивергентности эволюции кода на ранних этапах существования жизни. В митохондриальных ДНК различных видов организмов отмечаются некоторые отклонения от генетического кода.
Генетический код универсальный – он практически одинаков для всех организмов Универсальность генетического кода свидетельствует о единстве происхождения всего многообразия живых форм на Земле в процессе биологической эволюции. Отличия генетического кода обнаружены у митохондрий и пластид. Это свидетельствует в пользу дивергентности эволюции кода на ранних этапах существования жизни. В митохондриальных ДНК различных видов организмов отмечаются некоторые отклонения от генетического кода.
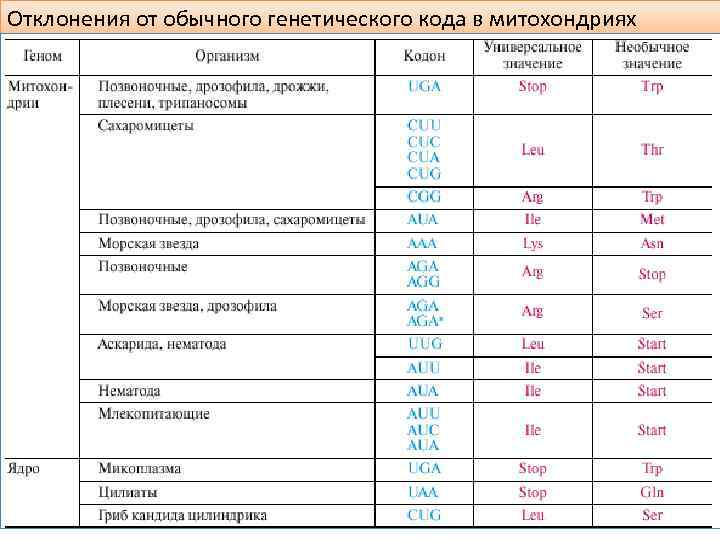 Отклонения от обычного генетического кода в митохондриях
Отклонения от обычного генетического кода в митохондриях
 Колинеарность генетического кода: последовательность триплетов в ДНК соответствует последовательности аминокислот в белке
Колинеарность генетического кода: последовательность триплетов в ДНК соответствует последовательности аминокислот в белке


