Ox-Red процеси.ppt
- Количество слайдов: 36
 ПРОЦЕСИ ОКИСЛЕННЯВІДНОВЛЕННЯ
ПРОЦЕСИ ОКИСЛЕННЯВІДНОВЛЕННЯ
 Поняття “окислення” пов`язувалось з реакціями перетворення елементів в оксиди, а “відновлення” – з отриманням елементів із оксидів 2 Cu + O 2 → 2 Cu. O + H 2 → Cu + H 2 O Ця теорія отримала назву “киснева”, але вона не охоплювала реакцій, які йшли без участі кисню. На початку ХХ століття на зміну кисневій теорії прийшла електронна
Поняття “окислення” пов`язувалось з реакціями перетворення елементів в оксиди, а “відновлення” – з отриманням елементів із оксидів 2 Cu + O 2 → 2 Cu. O + H 2 → Cu + H 2 O Ця теорія отримала назву “киснева”, але вона не охоплювала реакцій, які йшли без участі кисню. На початку ХХ століття на зміну кисневій теорії прийшла електронна
 Окиснення та відновлення пов`язані між собою, бо в реакціях електрони переходять від одного атома до іншого окисником називається елемент, котрий в реакції приймає електрони і відновлюється, відновником – елемент, котрий в реакції віддає електрони і окислюється. Сu 0 - відновник
Окиснення та відновлення пов`язані між собою, бо в реакціях електрони переходять від одного атома до іншого окисником називається елемент, котрий в реакції приймає електрони і відновлюється, відновником – елемент, котрий в реакції віддає електрони і окислюється. Сu 0 - відновник
 ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ Електродні потенціали виникають на межі рідина-метал Me ⇆ Men++ ne
ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ Електродні потенціали виникають на межі рідина-метал Me ⇆ Men++ ne
 Різниця потенціалів між металом та рідкою фазою в момент рівноваги називається електродним потенціалом. Е або φ Величина Е залежить від: - природи металу та природи розчинника - температури - концентрації компонентів системи - тиску
Різниця потенціалів між металом та рідкою фазою в момент рівноваги називається електродним потенціалом. Е або φ Величина Е залежить від: - природи металу та природи розчинника - температури - концентрації компонентів системи - тиску

 Якщо залізну пластинку занурити у розчин солі міді: Fe + Cu. SO 4 → Fe. SO 4 + Cu Fe 0 + Cu+2 → Fe+2 + Cu 0 Процес протікає самодовільно
Якщо залізну пластинку занурити у розчин солі міді: Fe + Cu. SO 4 → Fe. SO 4 + Cu Fe 0 + Cu+2 → Fe+2 + Cu 0 Процес протікає самодовільно

 Напрямок окисно-відновних процесів залежить від “сили” окисників та відновників Мірою “сили” окисників та відновників являються електродні потенціали Якщо метал помістити не в воду, а в водний розчин його солі, то іони металу змістять рівновагу і електродний потенціал зміниться
Напрямок окисно-відновних процесів залежить від “сили” окисників та відновників Мірою “сили” окисників та відновників являються електродні потенціали Якщо метал помістити не в воду, а в водний розчин його солі, то іони металу змістять рівновагу і електродний потенціал зміниться
 Залежність електродного потенціалу від концентрації іонів метала визначають за формулою Нернста: R - універсальна газова стала; Т - темпертура; n - заряд іона; F - число Фарадея(F=96485 кг/моль); a(Men+) - активна концентрація іонів метала
Залежність електродного потенціалу від концентрації іонів метала визначають за формулою Нернста: R - універсальна газова стала; Т - темпертура; n - заряд іона; F - число Фарадея(F=96485 кг/моль); a(Men+) - активна концентрація іонів метала
 Формула Нернста показує залежність електродного потенціалу від активної концентрації іонів металу
Формула Нернста показує залежність електродного потенціалу від активної концентрації іонів металу
 Чим більша a(Men+ ), тим більше рівновага Me ⇆ Men++ ne зміщена в бік повернення іонів металу на металеву пластинку, тим більш позитивним буде значення електродного потенціалу a(X)=1 моль/л Р=101, 325 к. Па Е = Е 0 – стандартний електродний потенціал
Чим більша a(Men+ ), тим більше рівновага Me ⇆ Men++ ne зміщена в бік повернення іонів металу на металеву пластинку, тим більш позитивним буде значення електродного потенціалу a(X)=1 моль/л Р=101, 325 к. Па Е = Е 0 – стандартний електродний потенціал
 Електрод – це окисно-відновна система, в якій здійснюється рівновага між окисленою та відновленою формами одного й того ж елемента (зазвичай на твердому носієві) n+ Me + ne ⇆ Me + + 2 e ⇆ H (Pt) 2 H 2 Cl 2 + 2 e ⇆ 2 Cl-(графіт) Fe 3+ + 1 e ⇆ Fe 2+(Pt)
Електрод – це окисно-відновна система, в якій здійснюється рівновага між окисленою та відновленою формами одного й того ж елемента (зазвичай на твердому носієві) n+ Me + ne ⇆ Me + + 2 e ⇆ H (Pt) 2 H 2 Cl 2 + 2 e ⇆ 2 Cl-(графіт) Fe 3+ + 1 e ⇆ Fe 2+(Pt)
 Абсолютні значення електродних потенціалів визначити неможливо, і тому визначають їх відносні значення, порівнюючи з потенціалом стандартного водневого електрода
Абсолютні значення електродних потенціалів визначити неможливо, і тому визначають їх відносні значення, порівнюючи з потенціалом стандартного водневого електрода
 Гальванічний елемент – це система, що складається з двох електродів, в яких рівновага між окисленою та відновленою формами зміщується за рахунок переходу електронів від одного електрода до іншого. В гальванічних елементах енергія хімічних реакцій перетворюється в електричну
Гальванічний елемент – це система, що складається з двох електродів, в яких рівновага між окисленою та відновленою формами зміщується за рахунок переходу електронів від одного електрода до іншого. В гальванічних елементах енергія хімічних реакцій перетворюється в електричну
 Гальванічний елемент Даніеля-Якобі складається з мідного та цинкового електродів На електродах встановлюється рівновага ⇆ Zn Cu 2+ + 2 e ⇆ Cu Zn 2+ + 2 e Е 1 Е 2 Е 1 ≠ Е 2 Розчини Zn. SO 4 та Cu. SO 4 розділені електролітичним ключем, який не дозволяє їм змішуватись, але дає можливість переходу електронів із розчину в розчин
Гальванічний елемент Даніеля-Якобі складається з мідного та цинкового електродів На електродах встановлюється рівновага ⇆ Zn Cu 2+ + 2 e ⇆ Cu Zn 2+ + 2 e Е 1 Е 2 Е 1 ≠ Е 2 Розчини Zn. SO 4 та Cu. SO 4 розділені електролітичним ключем, який не дозволяє їм змішуватись, але дає можливість переходу електронів із розчину в розчин

 Після з`єднання електродів металічним провідником рівновага зміщується електрони переходять з цинкового електроду на мідний Zn - 2 e → Zn 2+ Cu 2+ + 2 e → Cu 0 Е 1 < Е 2
Після з`єднання електродів металічним провідником рівновага зміщується електрони переходять з цинкового електроду на мідний Zn - 2 e → Zn 2+ Cu 2+ + 2 e → Cu 0 Е 1 < Е 2

 Схема гальванічного елемента (-) Zn / Zn 2+ // Cu 2+ / Cu (+) Рушійну силу, завдяки якій відбувається переміщення електронів у зовнішньому колі елемента, називають електрорушійною силою (ЕРС) Її можна виміряти спеціальними приладами ЕРС елемента Даніеля-Якобі =?
Схема гальванічного елемента (-) Zn / Zn 2+ // Cu 2+ / Cu (+) Рушійну силу, завдяки якій відбувається переміщення електронів у зовнішньому колі елемента, називають електрорушійною силою (ЕРС) Її можна виміряти спеціальними приладами ЕРС елемента Даніеля-Якобі =?
 ЕРС (ΔЕ) гальванічного елемента дорівнює різниці електродних потенціалів ΔЕ = Епоз – Енег Негативний електрод в гальванічному елементі віддає електрони, тому являється відновником, позитивний електрод приймає електрони і являється окисником ΔЕ = Еок - Евідн
ЕРС (ΔЕ) гальванічного елемента дорівнює різниці електродних потенціалів ΔЕ = Епоз – Енег Негативний електрод в гальванічному елементі віддає електрони, тому являється відновником, позитивний електрод приймає електрони і являється окисником ΔЕ = Еок - Евідн
 Реакція буде протікати самодовільно тільки у тому випадку, якщо окисник має більш позитивний потенціал, ніж відновник, тобто ΔЕ > 0 Для самодовільних реакцій ΔЕ = Еок - Евідн завжди позитивна Еок - ? Евідн - ?
Реакція буде протікати самодовільно тільки у тому випадку, якщо окисник має більш позитивний потенціал, ніж відновник, тобто ΔЕ > 0 Для самодовільних реакцій ΔЕ = Еок - Евідн завжди позитивна Еок - ? Евідн - ?
 Визначення стандартних електродних потенціалів Абсолютні значення електродних потенціалів визначити неможливо, і тому визначають їх відносні значення, порівнюючи з потенціалом стандартного водневого електрода
Визначення стандартних електродних потенціалів Абсолютні значення електродних потенціалів визначити неможливо, і тому визначають їх відносні значення, порівнюючи з потенціалом стандартного водневого електрода
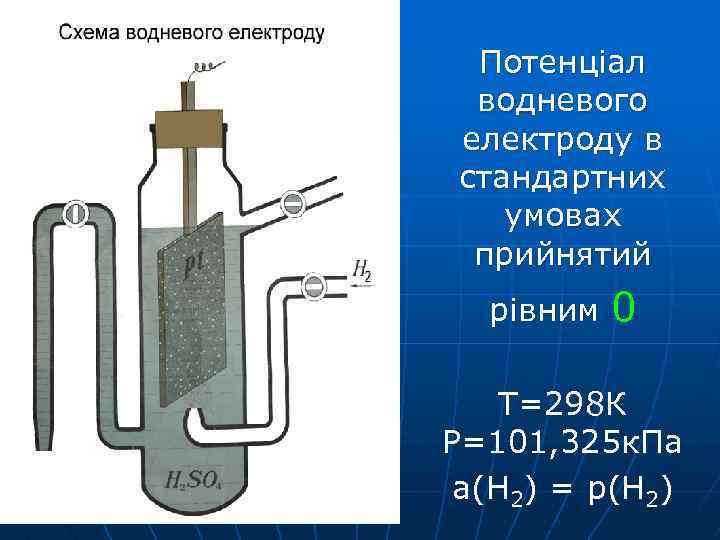 Потенціал водневого електроду в стандартних умовах прийнятий рівним 0 Т=298 К Р=101, 325 к. Па а(Н 2) = р(Н 2)
Потенціал водневого електроду в стандартних умовах прийнятий рівним 0 Т=298 К Р=101, 325 к. Па а(Н 2) = р(Н 2)


 Для експериментального знаходження стандартного електродного потенціалу цинкового електрода необхідно визначити ЕРС гальванічного елемента, що складається з цинкового і водневого електродів: (-) Zn / Zn 2+ // H+ / H 2(Pt) (+)
Для експериментального знаходження стандартного електродного потенціалу цинкового електрода необхідно визначити ЕРС гальванічного елемента, що складається з цинкового і водневого електродів: (-) Zn / Zn 2+ // H+ / H 2(Pt) (+)
 В цьому елементі негативним електродом являється цинковий, тому Zn віддає електрони і виступає в ролі відновника: Zn → Zn 2+ + 2 e Електрони по зовнішньому ланцюгу рухаються до позитивного водневого електроду і відновлюють іони водню: 2 H+ + 2 e → H 2
В цьому елементі негативним електродом являється цинковий, тому Zn віддає електрони і виступає в ролі відновника: Zn → Zn 2+ + 2 e Електрони по зовнішньому ланцюгу рухаються до позитивного водневого електроду і відновлюють іони водню: 2 H+ + 2 e → H 2
 Джерелом електричного току в даному гальванічному елементі являється реакція: Zn + 2 H+ → Zn 2+ + H 2 ЕРС такого елемента в стандартних умовах Оскільки потенціал водневого електроду то потенціал цинкового електрода
Джерелом електричного току в даному гальванічному елементі являється реакція: Zn + 2 H+ → Zn 2+ + H 2 ЕРС такого елемента в стандартних умовах Оскільки потенціал водневого електроду то потенціал цинкового електрода

 В гальванічному елементі з водневим і мідним електродами визначають потенціал мідного електрода: (-) (Pt)H 2 / H+ // Cu 2+ / Cu (+) Н 2 → 2 H+ + 2 e Cu 2+ + 2 e = Cu ЕРС елемента в стандартних умовах
В гальванічному елементі з водневим і мідним електродами визначають потенціал мідного електрода: (-) (Pt)H 2 / H+ // Cu 2+ / Cu (+) Н 2 → 2 H+ + 2 e Cu 2+ + 2 e = Cu ЕРС елемента в стандартних умовах
 Значення стандартних електродних потенціалів наводяться в довідниках. Відновлювальні властивості або відновлювальна “сила” тим більші, чим більш негативне значення має відповідний електродний потенціал. Окислювальні властивості або окислювальна “сила” зростають із зростанням значень електродних потенціалів.
Значення стандартних електродних потенціалів наводяться в довідниках. Відновлювальні властивості або відновлювальна “сила” тим більші, чим більш негативне значення має відповідний електродний потенціал. Окислювальні властивості або окислювальна “сила” зростають із зростанням значень електродних потенціалів.
 За значеннями стандартних електродних потенціалів можна розрахувати ЕРС будь-якого гальванічного елементу в стандартних умовах. Для елемента Даніеля-Якобі
За значеннями стандартних електродних потенціалів можна розрахувати ЕРС будь-якого гальванічного елементу в стандартних умовах. Для елемента Даніеля-Якобі
 НАПРЯМ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ За значеннями окисно-відновних потенціалів можна визначати напрям окисно-відновних реакцій в водних розчинах за стандартних умов Чи буде іон Fe 3+ достатньо сильним окисником, щоб окислити металічну мідь? 2 Fe 3+ + Сu → 2 Fe 2+ + Cu 2+
НАПРЯМ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ За значеннями окисно-відновних потенціалів можна визначати напрям окисно-відновних реакцій в водних розчинах за стандартних умов Чи буде іон Fe 3+ достатньо сильним окисником, щоб окислити металічну мідь? 2 Fe 3+ + Сu → 2 Fe 2+ + Cu 2+
 Fe 3+ + е → Fe 2+ Е 0 = +0, 77 В Cu 0 - 2 е → Сu 2+ Е 0 = +0, 34 В Потенціал окисника більш позитивний, ніж потенціал відновника ∆Е = Еок – Евідн = 0, 77 - 0, 34 = 0, 53 В > 0 реакція протікає самодовільно
Fe 3+ + е → Fe 2+ Е 0 = +0, 77 В Cu 0 - 2 е → Сu 2+ Е 0 = +0, 34 В Потенціал окисника більш позитивний, ніж потенціал відновника ∆Е = Еок – Евідн = 0, 77 - 0, 34 = 0, 53 В > 0 реакція протікає самодовільно
 Чи буде йод окислювати іони Fe 2+ до Fe 3+ ? 2 Fe 2++J 2 → 2 Fe 3++2 JJ 2 + 2 e → 2 JFe 2+ - e → Fe 3+ E 0 ок = +0, 53 В E 0 відн = +0, 77 В ЕРС = Е 0 ок - Е 0 відн = -0, 24 В < 0 Реакція самодовільно протікати не буде
Чи буде йод окислювати іони Fe 2+ до Fe 3+ ? 2 Fe 2++J 2 → 2 Fe 3++2 JJ 2 + 2 e → 2 JFe 2+ - e → Fe 3+ E 0 ок = +0, 53 В E 0 відн = +0, 77 В ЕРС = Е 0 ок - Е 0 відн = -0, 24 В < 0 Реакція самодовільно протікати не буде


