Природа твердого тела.ppt
- Количество слайдов: 168
 Природа твердого тела Свойства твердых тел – как физический, так и химические зависят от их атомной и электронной структуры. Основные типы связей: ионная, ковалентная, металлическая и ван-дер-ваальсовая. Однако это упрощенный подход, чаще всего химическая связь носит промежуточный характер.
Природа твердого тела Свойства твердых тел – как физический, так и химические зависят от их атомной и электронной структуры. Основные типы связей: ионная, ковалентная, металлическая и ван-дер-ваальсовая. Однако это упрощенный подход, чаще всего химическая связь носит промежуточный характер.
 Межатомные силы • Образование химической связи можно представить, рассматривая силы взаимодействия между атомами (ионами). Когда атомы удалены друг от друга на бесконечное расстояние, сила действующая между ними, равна нулю. • При сближении атомов возникают силы притяжения и отталкивания.
Межатомные силы • Образование химической связи можно представить, рассматривая силы взаимодействия между атомами (ионами). Когда атомы удалены друг от друга на бесконечное расстояние, сила действующая между ними, равна нулю. • При сближении атомов возникают силы притяжения и отталкивания.
 • В результате потенциальная энергия взаимодействия в зависимости от расстояния между атомами принимает либо положительное, либо отрицательное значение. На достаточно больших притяжения, расстояниях возникающие электростатического атомами. действую силы вследствие взаимодействия между
• В результате потенциальная энергия взаимодействия в зависимости от расстояния между атомами принимает либо положительное, либо отрицательное значение. На достаточно больших притяжения, расстояниях возникающие электростатического атомами. действую силы вследствие взаимодействия между
 • При меньших преобладать силы расстояниях начинают отталкивания между одноименными зарядами атомов, и суммарная потенциальная энергия становится положительной (так как для сближения атомов необходимо затратить работу).
• При меньших преобладать силы расстояниях начинают отталкивания между одноименными зарядами атомов, и суммарная потенциальная энергия становится положительной (так как для сближения атомов необходимо затратить работу).
 • Полную потенциальную энергию можно представить в виде суммы двух членов: • V = - /rn + /rm • где r – расстояние между атомами, и константы, характеризующие силы отталкивания и притяжения, m и n – постоянные, характерные для данного типа взаимодействия
• Полную потенциальную энергию можно представить в виде суммы двух членов: • V = - /rn + /rm • где r – расстояние между атомами, и константы, характеризующие силы отталкивания и притяжения, m и n – постоянные, характерные для данного типа взаимодействия
 • Расстояние r, соответствующее минимуму потенциальной энергии, равновесному межатомному расстоянию при 00 К, так как силы притяжения и отталкивания в этой точке полностью уравновешены.
• Расстояние r, соответствующее минимуму потенциальной энергии, равновесному межатомному расстоянию при 00 К, так как силы притяжения и отталкивания в этой точке полностью уравновешены.
 Ионная связь • Если один из пары взаимодействующих атомов в достаточной мере электроположителен, а другой – электроотрицательный, то первый атом может передать валентный электрон второму атому. Вследствие электростатического взаимодействия противоположно заряженных ионов возникает сила притяжения и образуется ионная связь.
Ионная связь • Если один из пары взаимодействующих атомов в достаточной мере электроположителен, а другой – электроотрицательный, то первый атом может передать валентный электрон второму атому. Вследствие электростатического взаимодействия противоположно заряженных ионов возникает сила притяжения и образуется ионная связь.
 • Каждый ион в кристалле стремится окружить себя ионами противоположного знака заряда, а ионы одноименно заряженные занимают более удаленные положения. Хорошо известным примером служит решетка хлористого натрия (рис. 2 а). Электронная конфигурация ионов натрия и хлора аналогична электронной конфигурации атомов инертных газов – неона и аргона
• Каждый ион в кристалле стремится окружить себя ионами противоположного знака заряда, а ионы одноименно заряженные занимают более удаленные положения. Хорошо известным примером служит решетка хлористого натрия (рис. 2 а). Электронная конфигурация ионов натрия и хлора аналогична электронной конфигурации атомов инертных газов – неона и аргона
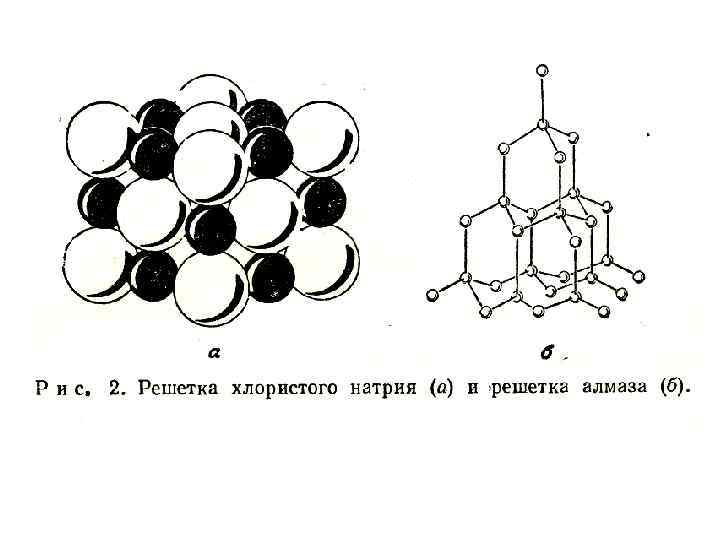
 • Так как заполнены, электронные заряды приблизительно в оболочки ионах сферически. кристалле комбинации заряженных ионов распределены В ионном противоположно обычно не удается отождествить с индивидуальными молекулами, вследствие регулярного чередования в узлах решетки ионов различного сорта.
• Так как заполнены, электронные заряды приблизительно в оболочки ионах сферически. кристалле комбинации заряженных ионов распределены В ионном противоположно обычно не удается отождествить с индивидуальными молекулами, вследствие регулярного чередования в узлах решетки ионов различного сорта.
 • В следствие сильного электростатического взаимодействия между ионами связь в ионных кристаллах очень прочная. Такие вещества характеризуются высокой прочностью, твердостью и высокой температурой плавления.
• В следствие сильного электростатического взаимодействия между ионами связь в ионных кристаллах очень прочная. Такие вещества характеризуются высокой прочностью, твердостью и высокой температурой плавления.
 Ковалентная связь • Образование ковалентной связи между атомами можно представить как обобществление электронов, принадлежащих одному или обоим атомам, в результате перекрывании связывающих орбиталей, которое понижает энергию системы.
Ковалентная связь • Образование ковалентной связи между атомами можно представить как обобществление электронов, принадлежащих одному или обоим атомам, в результате перекрывании связывающих орбиталей, которое понижает энергию системы.
 • Этот тип связи обычно встречающийся в органических молекулах, хорошо описывает углерод-углеродную и углерод-водородную связи. Одинарные связи образуются при обобществлении двух электронов, а образование двойной и тройной связи связано с обобществлением электронов. четырех или шести
• Этот тип связи обычно встречающийся в органических молекулах, хорошо описывает углерод-углеродную и углерод-водородную связи. Одинарные связи образуются при обобществлении двух электронов, а образование двойной и тройной связи связано с обобществлением электронов. четырех или шести
 • Ковалентные связи обладают направленным характером, как это видно на примере тетраэдрической конфигурации связей углерода в органических молекулах и в твердых телах таких как алмаз и графит.
• Ковалентные связи обладают направленным характером, как это видно на примере тетраэдрической конфигурации связей углерода в органических молекулах и в твердых телах таких как алмаз и графит.
 • В ковалентной электроны связи обычно обобществленные заполняют внешнюю электронную оболочку каждого атома. В алмазе, например, каждый атом углерода тетраэдрически окружен четырьмя ближайшими соседними атомами
• В ковалентной электроны связи обычно обобществленные заполняют внешнюю электронную оболочку каждого атома. В алмазе, например, каждый атом углерода тетраэдрически окружен четырьмя ближайшими соседними атомами
 • Четыре валентных электрона каждого атома углерода с конфигурацией 2 s 22 p 2 обобществлены с электронами четырех ближайших атомов углерода, по одному электрону от каждого атома на одну связь. Такое обобществление приводит к заполнению валентной оболочки каждого атома, так как в образовании связи участвуют все восемь электронов.
• Четыре валентных электрона каждого атома углерода с конфигурацией 2 s 22 p 2 обобществлены с электронами четырех ближайших атомов углерода, по одному электрону от каждого атома на одну связь. Такое обобществление приводит к заполнению валентной оболочки каждого атома, так как в образовании связи участвуют все восемь электронов.
 • Все четыре связи равноценны, объясняется это смешиванием 2 s- и 2 p- орбиталей (sp 3 гибридизация). Спаренные электроны, осуществляющие связь, имеют противоположно направленные спины: один обладает спином, направленным “вверх”, направленным “вниз” а дргой спином,
• Все четыре связи равноценны, объясняется это смешиванием 2 s- и 2 p- орбиталей (sp 3 гибридизация). Спаренные электроны, осуществляющие связь, имеют противоположно направленные спины: один обладает спином, направленным “вверх”, направленным “вниз” а дргой спином,
 • Ковалентная связь очень прочная; об этом говорят высокая прочность и твердость и высокие температуры плавления, таких веществ как алмаз. Внутримолекулярные связи в простых органических молекулах также прочные.
• Ковалентная связь очень прочная; об этом говорят высокая прочность и твердость и высокие температуры плавления, таких веществ как алмаз. Внутримолекулярные связи в простых органических молекулах также прочные.
 • Низкую температуру плавления и низкую механическую прочность таких молекул можно рассматривать как следствие слабых межмолекулярных связей, которые не являются ковалентными. • Кроме чисто ионных и чисто ковалентных связей, имеются также связи, которые по своему характеру занимают промежуточное положение.
• Низкую температуру плавления и низкую механическую прочность таких молекул можно рассматривать как следствие слабых межмолекулярных связей, которые не являются ковалентными. • Кроме чисто ионных и чисто ковалентных связей, имеются также связи, которые по своему характеру занимают промежуточное положение.
 Металлическая связь • Связь в металле следует рассматривать с учетом всех атомов твердого тела как целого, считая, что валентные электроны всех атомов принадлежат всему кристаллу. • Многие свойства металлов можно объяснить с помощью теории свободного электрона.
Металлическая связь • Связь в металле следует рассматривать с учетом всех атомов твердого тела как целого, считая, что валентные электроны всех атомов принадлежат всему кристаллу. • Многие свойства металлов можно объяснить с помощью теории свободного электрона.
 • Согласно заряженные этой ионы кристаллическую теории положительно металла решетку, и образуют эта решетка погружена в электронный “газ”, заполняющий весь кристалл. Устойчивость системы обусловлена электростатическим взаимодействием между ионами и электронами. • Валентные ионы в металлах делокализованы.
• Согласно заряженные этой ионы кристаллическую теории положительно металла решетку, и образуют эта решетка погружена в электронный “газ”, заполняющий весь кристалл. Устойчивость системы обусловлена электростатическим взаимодействием между ионами и электронами. • Валентные ионы в металлах делокализованы.
 • Возможность свободного перемещения валентных электронов в металле обуславливает его высокую электропроводность. • Энергия связи в щелочных металлах значительно меньше, чем в ионных кристаллах, частично из-за большого межатомного расстояния, такие металлы легко деформируются.
• Возможность свободного перемещения валентных электронов в металле обуславливает его высокую электропроводность. • Энергия связи в щелочных металлах значительно меньше, чем в ионных кристаллах, частично из-за большого межатомного расстояния, такие металлы легко деформируются.
 • Переходные металлы имеют более высокие температуры плавления и обладают очень высокой прочностью. В таких металлах частично заполненные внутренние электронные оболочки также вносят существенный вклад в образование связи
• Переходные металлы имеют более высокие температуры плавления и обладают очень высокой прочностью. В таких металлах частично заполненные внутренние электронные оболочки также вносят существенный вклад в образование связи
 Молекулярные кристаллы • Слабые Ван-дер-ваальсовые силы также могут быть силами сцепления, посредством которых осуществляется связь в твердом теле. • Эти силы обусловлены слабым притяжением, возникающим электрическими между диполями, мгновенными возникающих вследствие движения электронов в атомах или молекуле
Молекулярные кристаллы • Слабые Ван-дер-ваальсовые силы также могут быть силами сцепления, посредством которых осуществляется связь в твердом теле. • Эти силы обусловлены слабым притяжением, возникающим электрическими между диполями, мгновенными возникающих вследствие движения электронов в атомах или молекуле
 • Усреднение флуктуаций по времени дает нулевой дипольный момент. И поскольку эти силы притяжения незначительны, связь в молекулярных кристаллах слабая. (Инертные газы в твердом молекулярные состоянии). кристаллы Подобные характеризуются низкими температурами плавления и невысокой прочностью.
• Усреднение флуктуаций по времени дает нулевой дипольный момент. И поскольку эти силы притяжения незначительны, связь в молекулярных кристаллах слабая. (Инертные газы в твердом молекулярные состоянии). кристаллы Подобные характеризуются низкими температурами плавления и невысокой прочностью.
 Кристаллы с водородной связью • Обычно атом водорода образует только одну связь, но в определенных результирующий возникающий условиях положительный на атоме водорода заряд, при образовании такой связи, может притягиваться к соседнему сильному электроотрицательному атому и образовывать вторую связь.
Кристаллы с водородной связью • Обычно атом водорода образует только одну связь, но в определенных результирующий возникающий условиях положительный на атоме водорода заряд, при образовании такой связи, может притягиваться к соседнему сильному электроотрицательному атому и образовывать вторую связь.
 • Обе связи в действительности могут быть эквивалентны вследствие “резонанса” между состояниями, в которых электрон находится на одном из двух соседних атомов. Такие относительно слабые связи образуются во льду, в дигидрофосфате калия и др.
• Обе связи в действительности могут быть эквивалентны вследствие “резонанса” между состояниями, в которых электрон находится на одном из двух соседних атомов. Такие относительно слабые связи образуются во льду, в дигидрофосфате калия и др.
 Энергия решетки ионного кристалла • В идеальном обладает кристалле энергией, которая каждый ион определяется суммарным взаимодействием его со всеми другими ионами кристалла. Кулоновская энергия взаимодействия между двумя ионами, имеющими заряд q и находящихся расстоянии r друг от друга, равна q 2/r. на
Энергия решетки ионного кристалла • В идеальном обладает кристалле энергией, которая каждый ион определяется суммарным взаимодействием его со всеми другими ионами кристалла. Кулоновская энергия взаимодействия между двумя ионами, имеющими заряд q и находящихся расстоянии r друг от друга, равна q 2/r. на
 • Если принять, что энергия отталкивания зависит от расстояния между двумя атомами в степени n (таким образом, только взаимодействия между двумя ближайшими атомами сколько-нибудь существенны), полная энергия для одного иона выразится: • E = - Aq 2/r + B/rn (1. 2) то
• Если принять, что энергия отталкивания зависит от расстояния между двумя атомами в степени n (таким образом, только взаимодействия между двумя ближайшими атомами сколько-нибудь существенны), полная энергия для одного иона выразится: • E = - Aq 2/r + B/rn (1. 2) то
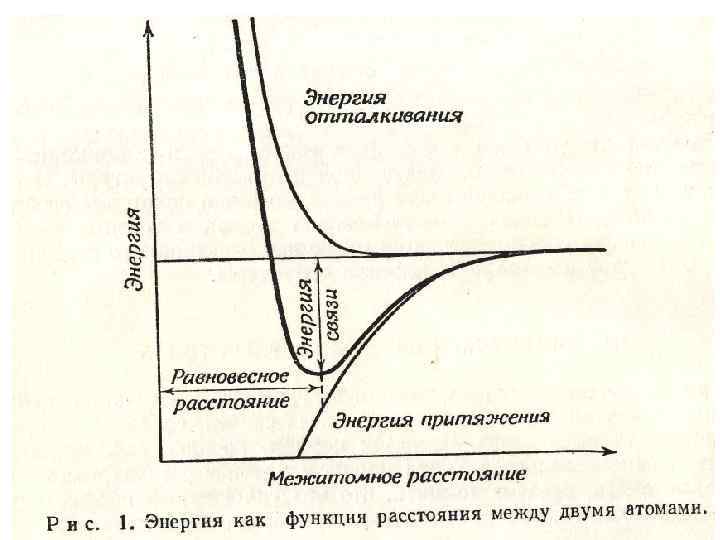
 где А – постоянная, зависящая от геометрии данной кристаллической структуры; В и n – постоянные для данного соединения. Полная энергия кристалла, состоящего из 2 N ионов, равна NE. Зависимость Е от постоянных решетки для совокупности ионов имеет общий вид, показанный на рис. 1.
где А – постоянная, зависящая от геометрии данной кристаллической структуры; В и n – постоянные для данного соединения. Полная энергия кристалла, состоящего из 2 N ионов, равна NE. Зависимость Е от постоянных решетки для совокупности ионов имеет общий вид, показанный на рис. 1.
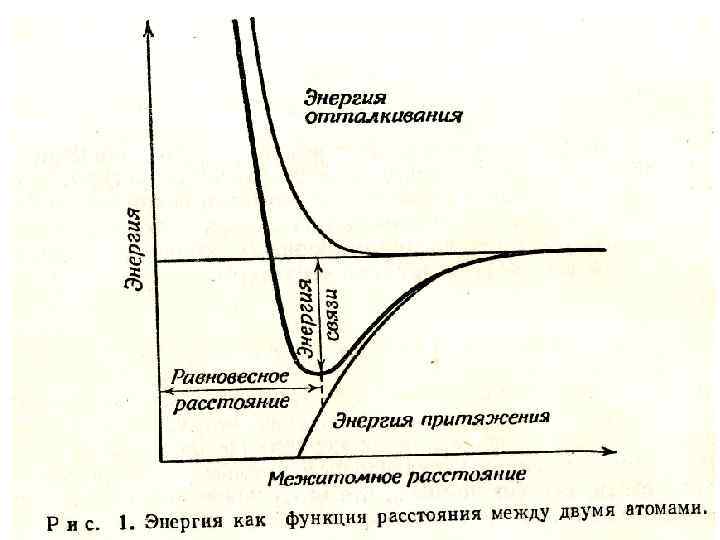
 • Так как равновесное расстояние между ионами соответствует минимуму на энергетической кривой, при r = a производная равна нулю. Следовательно: • (а) • (b) •
• Так как равновесное расстояние между ионами соответствует минимуму на энергетической кривой, при r = a производная равна нулю. Следовательно: • (а) • (b) •
 • Уравнение (1. 2) для полной энергии решетки имеет следующий вид: • Так как N, A, q и a известны, для того, чтобы рассчитать энергию решетки остается определить только n. Это можно сделать, измерив сжимаемость К кристалла поскольку
• Уравнение (1. 2) для полной энергии решетки имеет следующий вид: • Так как N, A, q и a известны, для того, чтобы рассчитать энергию решетки остается определить только n. Это можно сделать, измерив сжимаемость К кристалла поскольку
 • N =1 + 9 ca 4/Kq 2 A • с – геометрический фактор для данной решетки и • K = -1/V (d. V/d. P), полученные таким образом значения энергии согласовывались решетки с определенными величинами. хорошо экспериментально
• N =1 + 9 ca 4/Kq 2 A • с – геометрический фактор для данной решетки и • K = -1/V (d. V/d. P), полученные таким образом значения энергии согласовывались решетки с определенными величинами. хорошо экспериментально
 • Экспериментальные решеток можно значения вычислить, зная энергии теплоты образования соединений, теплоты сублимации компонентов, энергию ионизации и сродство к электрону электроположительных и электроотрицательных компонентов. Так, для хлорида натрия
• Экспериментальные решеток можно значения вычислить, зная энергии теплоты образования соединений, теплоты сублимации компонентов, энергию ионизации и сродство к электрону электроположительных и электроотрицательных компонентов. Так, для хлорида натрия

 Структура кристаллов • Кристаллическая решетка представляет собой сетку из регулярно повторяющихся в пространстве и параллельно размещенных узлов. В периодической решетке перемещение всех атомов в определенном направлении приводит к точному структуры. повторению первоначальной
Структура кристаллов • Кристаллическая решетка представляет собой сетку из регулярно повторяющихся в пространстве и параллельно размещенных узлов. В периодической решетке перемещение всех атомов в определенном направлении приводит к точному структуры. повторению первоначальной
 • Периодическая решетка характеризуется тремя главными трансляционными векторами: а, b, с, т. е. расположение атомов в любом положении r’ неотличимо от расположения атомов в точке r: • r’ = r + n 1 a + n 2 b + n 3 c • n 1, n 2 и n 3 – произвольные целые числа
• Периодическая решетка характеризуется тремя главными трансляционными векторами: а, b, с, т. е. расположение атомов в любом положении r’ неотличимо от расположения атомов в точке r: • r’ = r + n 1 a + n 2 b + n 3 c • n 1, n 2 и n 3 – произвольные целые числа
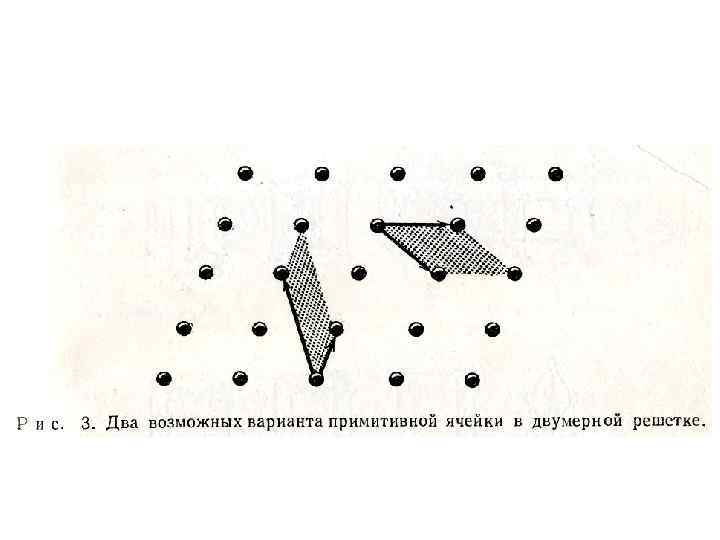
 • Направления векторов а, b и с можно использовать для обозначения осей кристалла, а величины векторов могут быть наименьшими из тех, которые удовлетворят изложенным выше требованиям. В действительности существует неограниченное число альтернатив, два возможных выбора векторов для двумерной решетки показаны на рис. 3
• Направления векторов а, b и с можно использовать для обозначения осей кристалла, а величины векторов могут быть наименьшими из тех, которые удовлетворят изложенным выше требованиям. В действительности существует неограниченное число альтернатив, два возможных выбора векторов для двумерной решетки показаны на рис. 3
 • Примитивные векторы а, b и c определяют параллелепипед, который представляет собой примитивную ячейку решетки, так как узлы имеются только в углах параллелепипеда и являются общими с непосредственно примыкающими параллелепипедами. Примитивная повторяющаяся ячейка может единица элементарная ячейка. быть объема выбрана решетки как –
• Примитивные векторы а, b и c определяют параллелепипед, который представляет собой примитивную ячейку решетки, так как узлы имеются только в углах параллелепипеда и являются общими с непосредственно примыкающими параллелепипедами. Примитивная повторяющаяся ячейка может единица элементарная ячейка. быть объема выбрана решетки как –
 • Решетка в целом может быть образована простой трансляцией ребер элементарной ячейки. Постоянные ячейки – это размеры элементарной ячейки. • Элементарную ячейку можно выбрать более чем одним способом.
• Решетка в целом может быть образована простой трансляцией ребер элементарной ячейки. Постоянные ячейки – это размеры элементарной ячейки. • Элементарную ячейку можно выбрать более чем одним способом.
 • На рис. 4 а показано расположение атомов в гранецентрированной кубической решетке. • Удобным способом выбора элементарной ячейки служит размещение атомов в каждом углу куба и в центре каждой грани; такова, например, структура кристаллического никеля
• На рис. 4 а показано расположение атомов в гранецентрированной кубической решетке. • Удобным способом выбора элементарной ячейки служит размещение атомов в каждом углу куба и в центре каждой грани; такова, например, структура кристаллического никеля
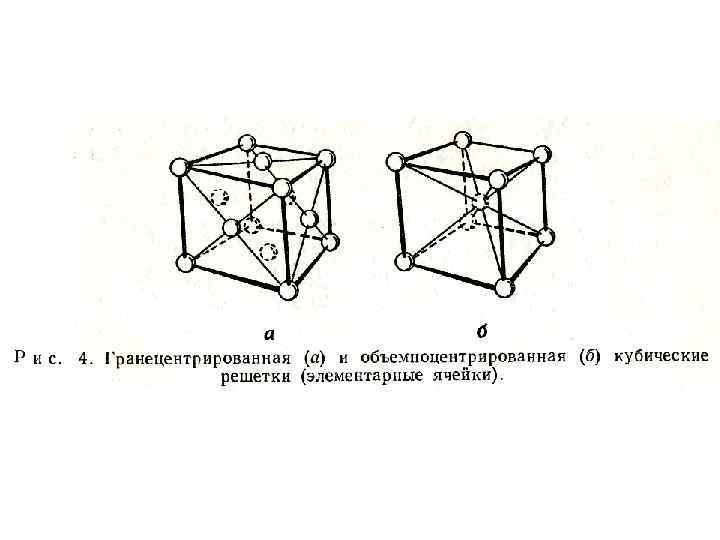
 • Железо кристаллизуется с образованием объемно центрированной решетки (рис. 4 б). • Помимо трансляции известны и другие геометрические операции, с помощью которых можно описать периодическую решетку. • Если решетка совмещается сама с собой при повороте на определенный угол вокруг некоторой оси, то говорят о существовании оси симметрии.
• Железо кристаллизуется с образованием объемно центрированной решетки (рис. 4 б). • Помимо трансляции известны и другие геометрические операции, с помощью которых можно описать периодическую решетку. • Если решетка совмещается сама с собой при повороте на определенный угол вокруг некоторой оси, то говорят о существовании оси симметрии.
 • Для угла поворота 60, 90, 120, 180 и 3600 это соответственно ось шестого, четвертого, третьего, второго и первого порядка. Никакие другие вращения к совмещению не приводят. Другими элементами симметрии являются отражения точек решетки в точках и плоскостях.
• Для угла поворота 60, 90, 120, 180 и 3600 это соответственно ось шестого, четвертого, третьего, второго и первого порядка. Никакие другие вращения к совмещению не приводят. Другими элементами симметрии являются отражения точек решетки в точках и плоскостях.
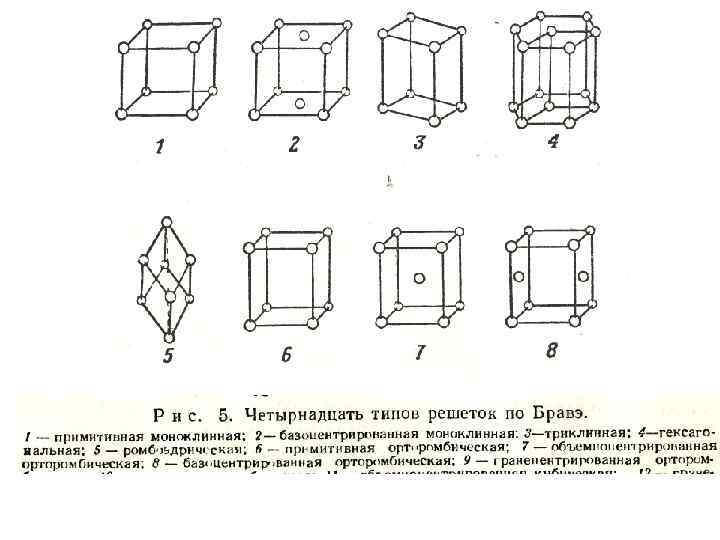
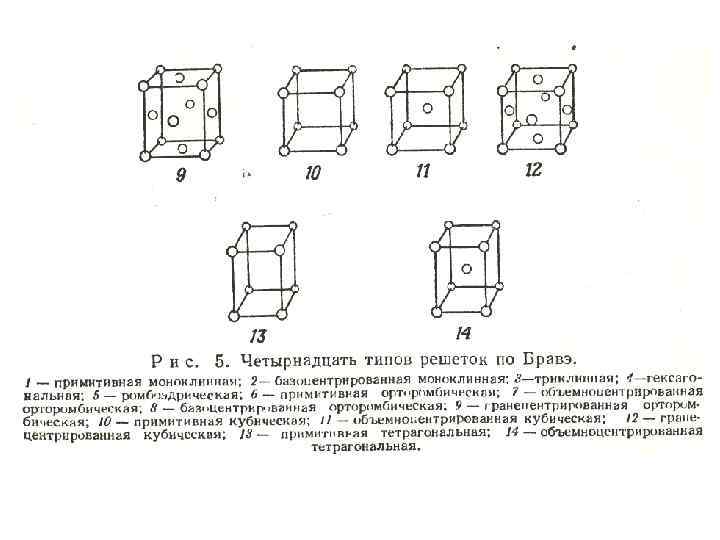
 • Если отражение всех узлов решетки в какой либо точке приводит к их совмещению, то говорят о центре симметрии, или центре инверсии. Если к тому же результату приводит отражение в плоскости, то говорят оплоскости симметрии. • Бравэ показал, что всего возможных типов решетки (рис. 5) имеется 14
• Если отражение всех узлов решетки в какой либо точке приводит к их совмещению, то говорят о центре симметрии, или центре инверсии. Если к тому же результату приводит отражение в плоскости, то говорят оплоскости симметрии. • Бравэ показал, что всего возможных типов решетки (рис. 5) имеется 14
 • Наиболее кристалла с удобно рассматривать использованием структуру плоскостей. Ряд параллельных плоскостей, проходящих через узлы решетки, можно обозначить с помощью индексов Миллера, определяемых следующим образом. Находят пересечение плоскости с тремя основными осями кристалла и обозначают элементарной ячейки. их как длины ребер
• Наиболее кристалла с удобно рассматривать использованием структуру плоскостей. Ряд параллельных плоскостей, проходящих через узлы решетки, можно обозначить с помощью индексов Миллера, определяемых следующим образом. Находят пересечение плоскости с тремя основными осями кристалла и обозначают элементарной ячейки. их как длины ребер
 • Обратные значения этих величин умножают на соответствующие числа так. чтобы получить три наименьших возможных целых числа. Это и есть индексы Миллера, обозначаемы как h, k, l. Так, на рис. 6 показаны плоскости (100), (111) для простой кубической решетки.
• Обратные значения этих величин умножают на соответствующие числа так. чтобы получить три наименьших возможных целых числа. Это и есть индексы Миллера, обозначаемы как h, k, l. Так, на рис. 6 показаны плоскости (100), (111) для простой кубической решетки.
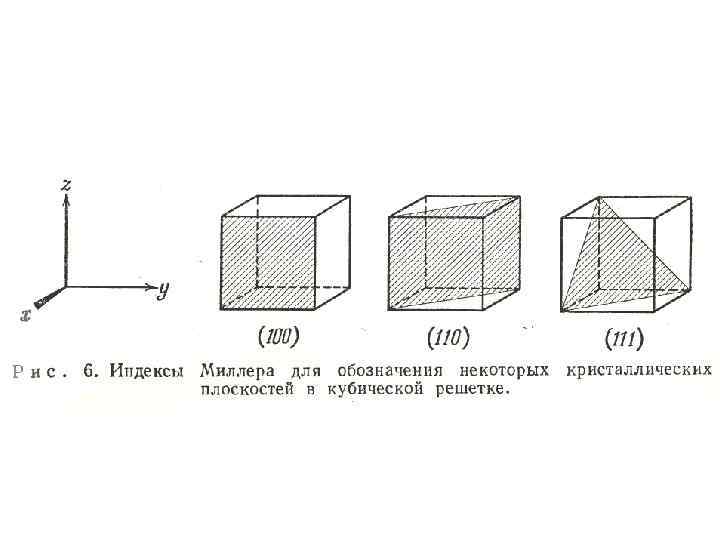
 • Плоскость (110) отсекает на осях x и y отрезки, равные длине ребер элементарной ячейки и расположена параллельно оси z. • Направления в кристалле описываются подобным же образом тремя индексами в соответствии с компонентами направления, т. е. осями.
• Плоскость (110) отсекает на осях x и y отрезки, равные длине ребер элементарной ячейки и расположена параллельно оси z. • Направления в кристалле описываются подобным же образом тремя индексами в соответствии с компонентами направления, т. е. осями.
![• Так, положительное направление оси x обозначается как [100], отрицательное направление оси z • Так, положительное направление оси x обозначается как [100], отрицательное направление оси z](https://present5.com/presentation/4173120_164167337/image-55.jpg) • Так, положительное направление оси x обозначается как [100], отрицательное направление оси z обозначается [001¯], направление перпендикулярное плоскости (111) в кубической решетке, обозначается как [111]. В кубической решетке все направления для данного набора индексов [uvw], перпендикулярны плоскости с тем же самым набором индексов (uvw)
• Так, положительное направление оси x обозначается как [100], отрицательное направление оси z обозначается [001¯], направление перпендикулярное плоскости (111) в кубической решетке, обозначается как [111]. В кубической решетке все направления для данного набора индексов [uvw], перпендикулярны плоскости с тем же самым набором индексов (uvw)
 Элементарные кристаллические структуры • Известно много различных кристаллических структур. Одна из них – структура алмаза. Подобную структуру имеют и полупроводники – кремний и германий. В структуре цинковой обманки Zn. S атомы расположены точно также, но элементы чередуются, так что каждый катион окружен тетраэдрически четырьмя анионами и наоборот.
Элементарные кристаллические структуры • Известно много различных кристаллических структур. Одна из них – структура алмаза. Подобную структуру имеют и полупроводники – кремний и германий. В структуре цинковой обманки Zn. S атомы расположены точно также, но элементы чередуются, так что каждый катион окружен тетраэдрически четырьмя анионами и наоборот.
 • Для галогенидов щелочных металлов характерны две структуры: структура типа хлорида натрия и хлорида цезия. гранецентрированную Хлористый кубическую натрий имеет структуру, где атомы натрия и хлора принадлежат соответственно двум взаимно проникающим гранецентрированным кубическим решеткам, смещенным относительно друга на расстояние, равное половине диагонали куба
• Для галогенидов щелочных металлов характерны две структуры: структура типа хлорида натрия и хлорида цезия. гранецентрированную Хлористый кубическую натрий имеет структуру, где атомы натрия и хлора принадлежат соответственно двум взаимно проникающим гранецентрированным кубическим решеткам, смещенным относительно друга на расстояние, равное половине диагонали куба
 • В структуре хлористого цезия атомы цезия и хлора принадлежат простым кубическим решеткам, также смещенным одна относительно другой на расстоянии половины диагонали куба, так что атомы одного сорта лежат в объемноцентрированных узлах по отношению к другой подрешетке
• В структуре хлористого цезия атомы цезия и хлора принадлежат простым кубическим решеткам, также смещенным одна относительно другой на расстоянии половины диагонали куба, так что атомы одного сорта лежат в объемноцентрированных узлах по отношению к другой подрешетке
 • Существует два способа наиболее плотной упаковки шаров одинакового размера. Эти способы показаны на рис. 7. На вершине слоя А из гексагонально упакованных атомов расположен второй слой В, причем каждый шар этого слоя находится в контакте с тремя шарами нижнего слоя.
• Существует два способа наиболее плотной упаковки шаров одинакового размера. Эти способы показаны на рис. 7. На вершине слоя А из гексагонально упакованных атомов расположен второй слой В, причем каждый шар этого слоя находится в контакте с тремя шарами нижнего слоя.
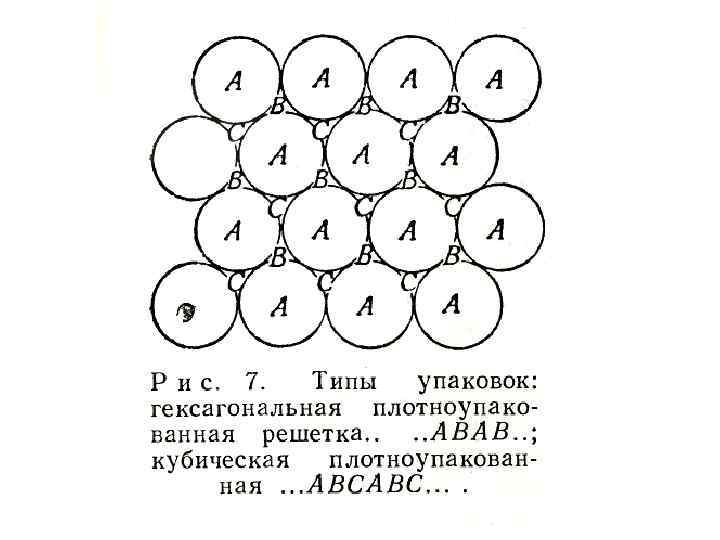
 • Третий слой теперь можно разместить либо над слоем А, либо над слоем В. Если слои располагаются АВАВАВ, в последовательности расположение атомов гексагональное плотноупакованное. Если же слои располагаются в последовательности АВСАВСАВС, расположение кубическое плотноупакованное. атомов
• Третий слой теперь можно разместить либо над слоем А, либо над слоем В. Если слои располагаются АВАВАВ, в последовательности расположение атомов гексагональное плотноупакованное. Если же слои располагаются в последовательности АВСАВСАВС, расположение кубическое плотноупакованное. атомов
 Атомные радиусы, упаковка • При изучении кристаллической структуры и способа упаковки важно установить объем, занимаемый атомами или ионами твердого тела. Рассматривая ионы в галогенидах щелочных металлов в виде жестких сфер, можно приписать ионный радиус каждому из ионов, а межионные расстояния в кристаллах в виде простой суммы соответствующих ионных радиусов.
Атомные радиусы, упаковка • При изучении кристаллической структуры и способа упаковки важно установить объем, занимаемый атомами или ионами твердого тела. Рассматривая ионы в галогенидах щелочных металлов в виде жестких сфер, можно приписать ионный радиус каждому из ионов, а межионные расстояния в кристаллах в виде простой суммы соответствующих ионных радиусов.
 • Полинг предложил полуэмпирический радиус для ионных радиусов, который можно использовать для этой цели. В настоящее время такие ряды составлены и для ковалентных радиусов.
• Полинг предложил полуэмпирический радиус для ионных радиусов, который можно использовать для этой цели. В настоящее время такие ряды составлены и для ковалентных радиусов.
 • Если предположить, что устойчивая структура образуется только в том случае, когда меньший по размерам катион соприкасается с более крупными анионами, окружающими его в октаэдрической координации, то последующий расчет отношения радиусов показывает, что в гранецентрированной структуре Na. Cl радиус катиона должен составлять 0, 414 радиуса аниона (рис. 8)
• Если предположить, что устойчивая структура образуется только в том случае, когда меньший по размерам катион соприкасается с более крупными анионами, окружающими его в октаэдрической координации, то последующий расчет отношения радиусов показывает, что в гранецентрированной структуре Na. Cl радиус катиона должен составлять 0, 414 радиуса аниона (рис. 8)
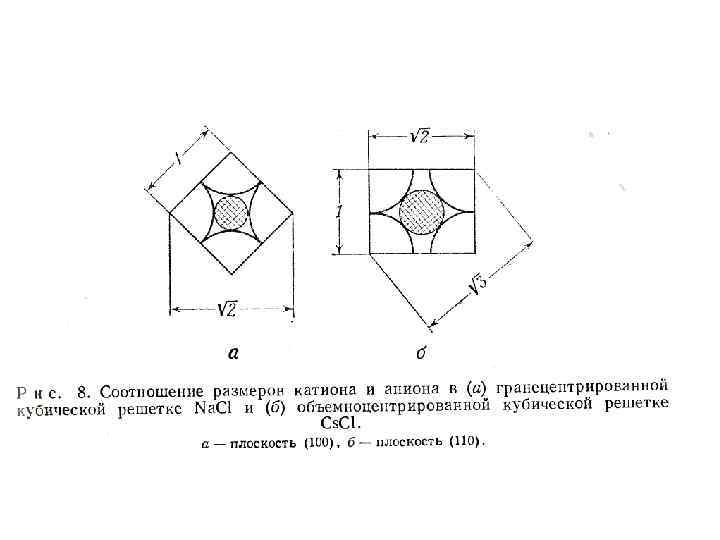
 • Однако, если отношение составляет 0, 732, меньший по размерам ион должен касаться больших шаров в объмноцентрированной структуре Cs. Cl с кубической координацией, что приводит к более плотной упаковке. Так, структура Na. Cl типична для таких соединений как Na. Cl, KBr и Na. F для них наблюдается следующее отношение радиусов 0, 52, 0, 68 и 0, 44
• Однако, если отношение составляет 0, 732, меньший по размерам ион должен касаться больших шаров в объмноцентрированной структуре Cs. Cl с кубической координацией, что приводит к более плотной упаковке. Так, структура Na. Cl типична для таких соединений как Na. Cl, KBr и Na. F для них наблюдается следующее отношение радиусов 0, 52, 0, 68 и 0, 44
 • В то же время Cs. Cl и Cs. I, для которых отношения радиусов равны 0, 93 и 0, 82 имеют структуру Cs. Cl. • Полинг предложил ряд правил, которые определяют возможную упаковку для ионных соединений на основании связи между размером иона и координационным числом.
• В то же время Cs. Cl и Cs. I, для которых отношения радиусов равны 0, 93 и 0, 82 имеют структуру Cs. Cl. • Полинг предложил ряд правил, которые определяют возможную упаковку для ионных соединений на основании связи между размером иона и координационным числом.
 Полиморфизм, изоморфизм • Полиморфизмом называется способность соединений кристаллизоваться в нескольких структурных формах. • Два различных, но химически подобных вещества с одинаковой кристаллической структурой называются изоморфными.
Полиморфизм, изоморфизм • Полиморфизмом называется способность соединений кристаллизоваться в нескольких структурных формах. • Два различных, но химически подобных вещества с одинаковой кристаллической структурой называются изоморфными.
 • Когда два вещества химически совершенно различны, но имеют одинаковую структуру, их называют изоструктурными.
• Когда два вещества химически совершенно различны, но имеют одинаковую структуру, их называют изоструктурными.
 Твердые растворы • Важной элементов особенностью и соединений изоморфных является их способность образовывать твердые растворы. Самый простой пример – сплавы металлов
Твердые растворы • Важной элементов особенностью и соединений изоморфных является их способность образовывать твердые растворы. Самый простой пример – сплавы металлов
 • Если кристаллические структуры подобны, а химическая природа совершенно различна, образование твердых растворов маловероятно. • Когда два катиона или аниона в изоморфных соединениях имеют одинаковый размер, а анионы (катионы) идентичны или близки по размерам, твердые растворы образуются во всем интервале концентраций и ионы распределены в узлах решетки.
• Если кристаллические структуры подобны, а химическая природа совершенно различна, образование твердых растворов маловероятно. • Когда два катиона или аниона в изоморфных соединениях имеют одинаковый размер, а анионы (катионы) идентичны или близки по размерам, твердые растворы образуются во всем интервале концентраций и ионы распределены в узлах решетки.
 • Если размеры соединениях ионов различны, в изоморфных имеется лишь ограниченная область существования твердых растворов. • Известно несколько способов образования твердых растворов: замещение, внедрение и вычитания.
• Если размеры соединениях ионов различны, в изоморфных имеется лишь ограниченная область существования твердых растворов. • Известно несколько способов образования твердых растворов: замещение, внедрение и вычитания.
 • Ni. O и раствор Co. O представляет собой твердый замещения, в котором Ni и Co беспорядочно распределены по катионным узлам решетки. Образование подобных твердых растворов возможно при условии близости химической природы и атомных размеров двух составляющих.
• Ni. O и раствор Co. O представляет собой твердый замещения, в котором Ni и Co беспорядочно распределены по катионным узлам решетки. Образование подобных твердых растворов возможно при условии близости химической природы и атомных размеров двух составляющих.
 • В твердом растворе другого типа – твердом растворе внедрения – растворенные атомы размещаются в междоузлиях решетки. Пример – атомы C, N и H в металлах. • Возможность образования растворов внедрения зависит от соотношения размеров атомов
• В твердом растворе другого типа – твердом растворе внедрения – растворенные атомы размещаются в междоузлиях решетки. Пример – атомы C, N и H в металлах. • Возможность образования растворов внедрения зависит от соотношения размеров атомов
 • Твердый раствор внедрения образуется при растворении атомов малых размеров в рыхлых решетках. • Твердые растворы вычитания образуются при удалении из соединения одной из составляющих, например при постепенной потери кислорода окислами переходных металлов нестехиометрических соединений. в ряду
• Твердый раствор внедрения образуется при растворении атомов малых размеров в рыхлых решетках. • Твердые растворы вычитания образуются при удалении из соединения одной из составляющих, например при постепенной потери кислорода окислами переходных металлов нестехиометрических соединений. в ряду
 • Образование твердых растворов внедрения всегда приводит к увеличению плотности по сравнению с чистым веществом. При образовании твердых растворов вычитания плотность уменьшается. Образования твердых растворов заменьшения может сопровождаться как увеличением, так и уменьшением плотности. Зная атомные массы элементов, плотность растворов легко рассчитать.
• Образование твердых растворов внедрения всегда приводит к увеличению плотности по сравнению с чистым веществом. При образовании твердых растворов вычитания плотность уменьшается. Образования твердых растворов заменьшения может сопровождаться как увеличением, так и уменьшением плотности. Зная атомные массы элементов, плотность растворов легко рассчитать.
 Определение структуры кристалла • Полные и точные данные о структуре кристалла получают, используя метод, основанный на дифракции рентгеновских лучей • Отражение рентгеновских лучей кристаллом • Атомы, лежащие в плоскостях кристалла, могут частично отражать падающие рентгеновские лучи, т. к. каждый атом служит центром рассеяния.
Определение структуры кристалла • Полные и точные данные о структуре кристалла получают, используя метод, основанный на дифракции рентгеновских лучей • Отражение рентгеновских лучей кристаллом • Атомы, лежащие в плоскостях кристалла, могут частично отражать падающие рентгеновские лучи, т. к. каждый атом служит центром рассеяния.
 • Периодичность определенной решетки направленности приводит к рассеянного пучка. Можно рассчитать разность хода для лучей, входящих кристалл под углом и отраженных следующими кристаллическими плоскостями, находящихся одна от другой на расстоянии а, равному кристаллической решетки (рис. 9). параметру
• Периодичность определенной решетки направленности приводит к рассеянного пучка. Можно рассчитать разность хода для лучей, входящих кристалл под углом и отраженных следующими кристаллическими плоскостями, находящихся одна от другой на расстоянии а, равному кристаллической решетки (рис. 9). параметру
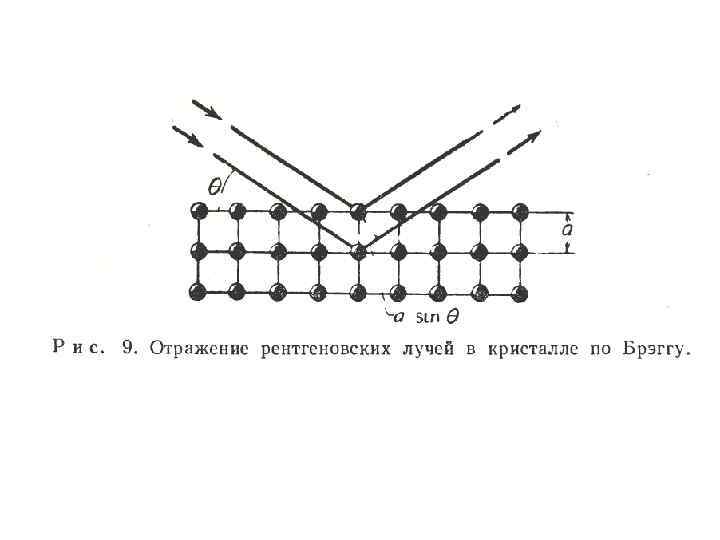
 • Разность хода лучей равна 2 а sin , и если она равна целому числу длин волн, отраженных или дифрагированных, лучи по-прежнему будут находится в фазе и будут образовывать общий волновой фронт. • Таким образом, отражение рентгеновских лучей кристаллом возможно при условии: • 2 а sin = n , где n целое число
• Разность хода лучей равна 2 а sin , и если она равна целому числу длин волн, отраженных или дифрагированных, лучи по-прежнему будут находится в фазе и будут образовывать общий волновой фронт. • Таким образом, отражение рентгеновских лучей кристаллом возможно при условии: • 2 а sin = n , где n целое число
 • При тех значениях угла , при которых это условие не выполняется, отраженные волны не образуют общего волнового фронта и интенсивность пучка резко падает. • Ориентируя кристалл определенным образом, можно найти постоянные решетки и размеры элементарной ячейки.
• При тех значениях угла , при которых это условие не выполняется, отраженные волны не образуют общего волнового фронта и интенсивность пучка резко падает. • Ориентируя кристалл определенным образом, можно найти постоянные решетки и размеры элементарной ячейки.
 • Зная плотность кристалла, можно вычислить массу элементарной ячейки, а зная химический состав кристалла и атомную массу элементов, можно определить число атомов в элементарной ячейке. • Дифракционная картина определить тип симметрии кристалла. позволяет
• Зная плотность кристалла, можно вычислить массу элементарной ячейки, а зная химический состав кристалла и атомную массу элементов, можно определить число атомов в элементарной ячейке. • Дифракционная картина определить тип симметрии кристалла. позволяет
 • Атомы различного сорта в зависимости от числа электронов обладают рассеивать различной рентгеновские лучи, способностью что выражается фактором рассеяния. • Общая интенсивность пучка, дифрагированного элементарной ячейкой, состоит из вкладов различных атомов, а усиление или ослабление интенсивности объясняется расположением рассеяния. тем или атомов иным или геометрическим различием факторов
• Атомы различного сорта в зависимости от числа электронов обладают рассеивать различной рентгеновские лучи, способностью что выражается фактором рассеяния. • Общая интенсивность пучка, дифрагированного элементарной ячейкой, состоит из вкладов различных атомов, а усиление или ослабление интенсивности объясняется расположением рассеяния. тем или атомов иным или геометрическим различием факторов
 Экспериментальные методы • В основу всех известных в настоящее время экспериментальных методов положен закон Брэгга. В методе вращающегося кристалла небольшой монокристалл с помощью соответствующего устройства для его вращения устанавливают на пути монохроматического пучка рентгеновских лучей.
Экспериментальные методы • В основу всех известных в настоящее время экспериментальных методов положен закон Брэгга. В методе вращающегося кристалла небольшой монокристалл с помощью соответствующего устройства для его вращения устанавливают на пути монохроматического пучка рентгеновских лучей.
 • Вокруг кристалла устанавливается фотопленка, ее располагают в виде цилиндра относительно оси вращения. Всякий раз, когда во время вращения кристалла выполняется условие Брэгга, на пленке появляется линия. • Для определения параметра решетки используют угол между направлением рентгеновского пучка и дифракционной линией.
• Вокруг кристалла устанавливается фотопленка, ее располагают в виде цилиндра относительно оси вращения. Всякий раз, когда во время вращения кристалла выполняется условие Брэгга, на пленке появляется линия. • Для определения параметра решетки используют угол между направлением рентгеновского пучка и дифракционной линией.
 • В методе Лауэ кристалл неподвижен, но первичный пучок содержит рентгеновские лучи, длины волн которых лежат в пределах некоторого интервала. На атомах металла дифрагируют лучи с той длиной волны, для которой имеется соответствующее межплоскостное расстояние в кристалле при данном фиксированном значении угла .
• В методе Лауэ кристалл неподвижен, но первичный пучок содержит рентгеновские лучи, длины волн которых лежат в пределах некоторого интервала. На атомах металла дифрагируют лучи с той длиной волны, для которой имеется соответствующее межплоскостное расстояние в кристалле при данном фиксированном значении угла .
 • При исследовании вещества по методу Дебая -Шеррера используют не монокристалл, а тонкоизмельченный Монохроматический порошок. пучок тонкоизмельченный порошок. направляют на
• При исследовании вещества по методу Дебая -Шеррера используют не монокристалл, а тонкоизмельченный Монохроматический порошок. пучок тонкоизмельченный порошок. направляют на
 • Благодаря тому, кристаллов имеются что в все расположении возможные ориентации, среди них найдутся и такие, которые будут удовлетворять условию Брэгга, и дифрагированные лучи образуют серии концентрических конусов относительно оси рентгеновского пучка.
• Благодаря тому, кристаллов имеются что в все расположении возможные ориентации, среди них найдутся и такие, которые будут удовлетворять условию Брэгга, и дифрагированные лучи образуют серии концентрических конусов относительно оси рентгеновского пучка.
 • Фотопленку помещают так, чтобы она пересекала эти конусы и позволяла измерять углы , при которых наблюдается дифракция. • Методы нейтронов дифракции аналогичны электронов методу или дифракции рентгеновских лучей, но иногда они обладают некоторыми преимуществами.
• Фотопленку помещают так, чтобы она пересекала эти конусы и позволяла измерять углы , при которых наблюдается дифракция. • Методы нейтронов дифракции аналогичны электронов методу или дифракции рентгеновских лучей, но иногда они обладают некоторыми преимуществами.
 • Коротковолновое электронное излучение позволяет добиться более высокого разрешения, чем рентгеновские лучи, используют при небольших образцов. и исследовании Метод обычно его структуры дифракции нейтронов позволяет исследовать вещества с легкими ядрами, такими. как протоны, полезен он и при изучении магнитных структур.
• Коротковолновое электронное излучение позволяет добиться более высокого разрешения, чем рентгеновские лучи, используют при небольших образцов. и исследовании Метод обычно его структуры дифракции нейтронов позволяет исследовать вещества с легкими ядрами, такими. как протоны, полезен он и при изучении магнитных структур.
 Скрытнокристаллические и некристаллические твердые тела • Не всегда структура твердого тела достаточна проста, и часто имеется непериодическое расположение атомов, или имеются структуры, в которых наблюдается лишь ближний порядок
Скрытнокристаллические и некристаллические твердые тела • Не всегда структура твердого тела достаточна проста, и часто имеется непериодическое расположение атомов, или имеются структуры, в которых наблюдается лишь ближний порядок
 Аморфное твердое тело • Аморфное твердое тело отличается от монокристалла тем, что расположение атомов в нем полностью разупорядочено. Это может быть следствием недостаточной подвижности атомов при недостаточная кристаллизации, подвижность так как препятствует упорядоченному расположению атомов.
Аморфное твердое тело • Аморфное твердое тело отличается от монокристалла тем, что расположение атомов в нем полностью разупорядочено. Это может быть следствием недостаточной подвижности атомов при недостаточная кристаллизации, подвижность так как препятствует упорядоченному расположению атомов.
 Стекла • Наиболее типичным примером аморфных веществ являются стекла. Стекло - это наиболее древний из синтетических материалов, используемых человечеством. Сведения о стекле накапливались много веков, но научный подход зародился лишь в XIX в. благодаря работам Фарадея, М. В. Ломоносова и др.
Стекла • Наиболее типичным примером аморфных веществ являются стекла. Стекло - это наиболее древний из синтетических материалов, используемых человечеством. Сведения о стекле накапливались много веков, но научный подход зародился лишь в XIX в. благодаря работам Фарадея, М. В. Ломоносова и др.
 • Стеклообразное состояние можно сравнить с замороженной жидкостью, в которой вследствие повышенной вязкости рост регулярных кристаллов затруднен. С точки зрения структуры, стекло – это аморфное твердое тело, в котором отсутствует дальний порядок и периодичность в расположении атомов. Существует широкий круг материалов, которые образуют стекла.
• Стеклообразное состояние можно сравнить с замороженной жидкостью, в которой вследствие повышенной вязкости рост регулярных кристаллов затруднен. С точки зрения структуры, стекло – это аморфное твердое тело, в котором отсутствует дальний порядок и периодичность в расположении атомов. Существует широкий круг материалов, которые образуют стекла.
 • Вязкость температуры расплава несколько плавления является выше важным фактором в процессе стеклования. Вязкость определяется структурой и типом химических связей. Так, расплавленный оксид кремния имеет полимерную структуру с прочными связями Si-O
• Вязкость температуры расплава несколько плавления является выше важным фактором в процессе стеклования. Вязкость определяется структурой и типом химических связей. Так, расплавленный оксид кремния имеет полимерную структуру с прочными связями Si-O
 • Для того, чтобы такая жидкость закристаллизовалась необходимо разрушить и переориентировать прочные химические связи и произвести перегруппировку атомов. По мере повышения температуры происходит постепенный разрыв связей, приводящий к размягчению стекла уменьшению вязкости. и постепенному
• Для того, чтобы такая жидкость закристаллизовалась необходимо разрушить и переориентировать прочные химические связи и произвести перегруппировку атомов. По мере повышения температуры происходит постепенный разрыв связей, приводящий к размягчению стекла уменьшению вязкости. и постепенному
 • При охлаждении в расплавах могут протекать два различных процесса. Либо расплав кристаллизуется при температуре плавления или несколько ниже этой температуры, либо он значительно переохлаждается и без кристаллизации переходит в стеклообразное состояние. На рис. 18. 2. приведены температурные зависимости объема в системах, в которых идет кристаллизация и стеклообразование. Изменение объема для нестеклообразующей зависимостью авсd системы описывается
• При охлаждении в расплавах могут протекать два различных процесса. Либо расплав кристаллизуется при температуре плавления или несколько ниже этой температуры, либо он значительно переохлаждается и без кристаллизации переходит в стеклообразное состояние. На рис. 18. 2. приведены температурные зависимости объема в системах, в которых идет кристаллизация и стеклообразование. Изменение объема для нестеклообразующей зависимостью авсd системы описывается
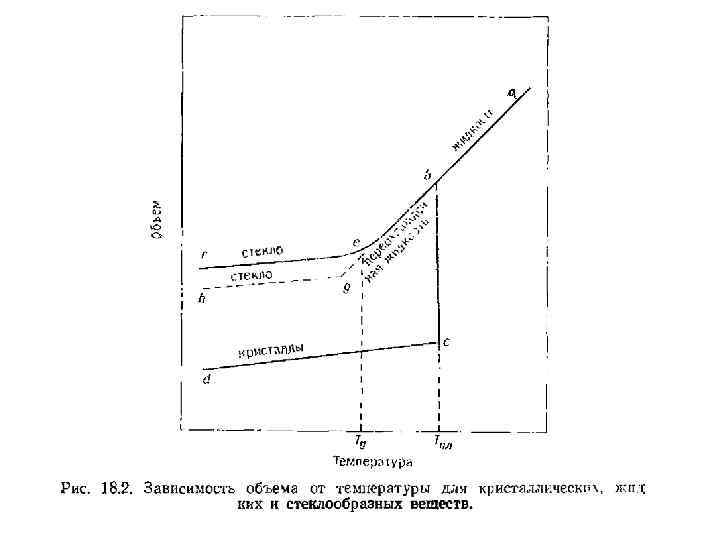
 • При температуре Тпл начинается кристаллизация (отрезок вс), хотя иногда из-за кинетических затруднений может происходить переохлаждение расплава. Больший наклон отрезка ав по сравнению сd связан с тем, что коэффициент термического расширения жидкости обычно больше, чем твердого тела.
• При температуре Тпл начинается кристаллизация (отрезок вс), хотя иногда из-за кинетических затруднений может происходить переохлаждение расплава. Больший наклон отрезка ав по сравнению сd связан с тем, что коэффициент термического расширения жидкости обычно больше, чем твердого тела.
 • Изменение объема стеклообразующей системы показано на рис. кривыми abef и abgf. В области ве существует переохлажденная незамороженная жидкость. В этой области при любой температуре жидкость быстро достигает состояния внутреннего равновесия и тем не менее это состояние является метастабильным.
• Изменение объема стеклообразующей системы показано на рис. кривыми abef и abgf. В области ве существует переохлажденная незамороженная жидкость. В этой области при любой температуре жидкость быстро достигает состояния внутреннего равновесия и тем не менее это состояние является метастабильным.
 • При понижении температуры вязкость жидкости возрастает, пока не достигнет значения, при котором внутренне равновесие жидкости уже не устанавливается. Расположения атомов в такой переохлажденной жидкости как бы замораживается и вещество становится таким же твердым и хрупким как и кристаллическое тело.
• При понижении температуры вязкость жидкости возрастает, пока не достигнет значения, при котором внутренне равновесие жидкости уже не устанавливается. Расположения атомов в такой переохлажденной жидкости как бы замораживается и вещество становится таким же твердым и хрупким как и кристаллическое тело.
 • Такое изменение свойств при переходе из расплава в стеклообразное состояние происходит при некоторой (точнее области), температурной температуре в называемой температурой стеклования Tg. В определенных условиях стекло может начать кристаллизоваться, этот процесс называется расстекловыванием.
• Такое изменение свойств при переходе из расплава в стеклообразное состояние происходит при некоторой (точнее области), температурной температуре в называемой температурой стеклования Tg. В определенных условиях стекло может начать кристаллизоваться, этот процесс называется расстекловыванием.
 • Наиболее общий пример стеклообразного вещества – Si. O 2. Как показано на рис. 10, основу структуры Si. O 2 составляет трехмерная сетка, построенная хаотичное из расположение тетраэдров цепей Si. O 4, облегчает проникновение других ионов в пустоты.
• Наиболее общий пример стеклообразного вещества – Si. O 2. Как показано на рис. 10, основу структуры Si. O 2 составляет трехмерная сетка, построенная хаотичное из расположение тетраэдров цепей Si. O 4, облегчает проникновение других ионов в пустоты.
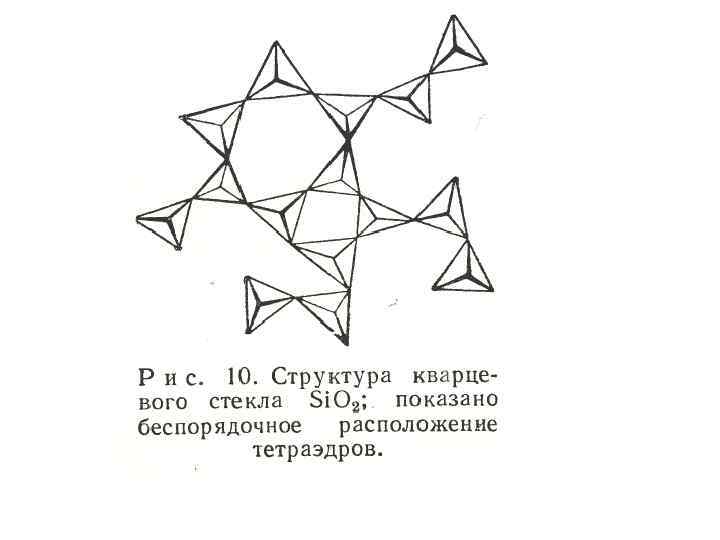
 • Нерегулярная структура сеток приводит к изменениям в межатомных расстояниях, и к изменению силы связи внутри твердого тела. Поэтому в отличие от кристаллических веществ у стекол разрыв связей происходит не при одной температуре, и отсутствуют четкие температуры плавления.
• Нерегулярная структура сеток приводит к изменениям в межатомных расстояниях, и к изменению силы связи внутри твердого тела. Поэтому в отличие от кристаллических веществ у стекол разрыв связей происходит не при одной температуре, и отсутствуют четкие температуры плавления.
 • Помимо Si. O 2 стеклообразующими являются оксиды B 2 O 3, Ge. O 2, P 2 O 3. Элементы, образующие эти оксиды характеризуются средними значениями электроотрицательности. Характер связей в этих соединениях смешанный, а их структуры представляют собой полимерный каркас.
• Помимо Si. O 2 стеклообразующими являются оксиды B 2 O 3, Ge. O 2, P 2 O 3. Элементы, образующие эти оксиды характеризуются средними значениями электроотрицательности. Характер связей в этих соединениях смешанный, а их структуры представляют собой полимерный каркас.
 • Некоторые оксиды, например As 2 O 3, Sb 2 O 3 переходят в стеклообразное состояние лишь при очень большой скорости охлаждения расплава. Такие оксиды как Al 2 O 3, Ga 2 O 3, Bi 2 O 3, Se. O 2, Te. O 2 называются условными стеклообразователями, так как сами по себе они стекла не образуют, но в присутствии других оксидов могут формировать стеклообразные фазы.
• Некоторые оксиды, например As 2 O 3, Sb 2 O 3 переходят в стеклообразное состояние лишь при очень большой скорости охлаждения расплава. Такие оксиды как Al 2 O 3, Ga 2 O 3, Bi 2 O 3, Se. O 2, Te. O 2 называются условными стеклообразователями, так как сами по себе они стекла не образуют, но в присутствии других оксидов могут формировать стеклообразные фазы.
 • Например в системе Ca. O - Al 2 O 3 существует область составов, в которой при охлаждении расплава образуются стекла. • Расплавы всех стеклообразующих оксидов характеризуются высокой вязкостью (порядка 107 Па). Вязкость расплава определяется структурой и типом химических связей. Расплавленный оксид кремния имеет аморфную полимерную структуру с прочными связями Si-O.
• Например в системе Ca. O - Al 2 O 3 существует область составов, в которой при охлаждении расплава образуются стекла. • Расплавы всех стеклообразующих оксидов характеризуются высокой вязкостью (порядка 107 Па). Вязкость расплава определяется структурой и типом химических связей. Расплавленный оксид кремния имеет аморфную полимерную структуру с прочными связями Si-O.
 • За счет этого удается, например модифицировать стекло такими окислами, как Pb. O; ионы тетраэдрами свинца Si. O 4, располагаются при этом между относительное содержание кислорода в сетках увеличивается вдвое. • Структура и свойства силикатных стекол в сильной степени зависит от природы второго оксида.
• За счет этого удается, например модифицировать стекло такими окислами, как Pb. O; ионы тетраэдрами свинца Si. O 4, располагаются при этом между относительное содержание кислорода в сетках увеличивается вдвое. • Структура и свойства силикатных стекол в сильной степени зависит от природы второго оксида.
 • При введении оксидов щелочных металлов (или щелочноземельных) силикатная сетка все больше и больше разрушается с увеличением их содержания. Это приводит к уменьшению вязкости трехмерная расплава. структура, Вероятна а образуется катионы занимают пустоты в каркасе (рис. 18. 8). натрия
• При введении оксидов щелочных металлов (или щелочноземельных) силикатная сетка все больше и больше разрушается с увеличением их содержания. Это приводит к уменьшению вязкости трехмерная расплава. структура, Вероятна а образуется катионы занимают пустоты в каркасе (рис. 18. 8). натрия
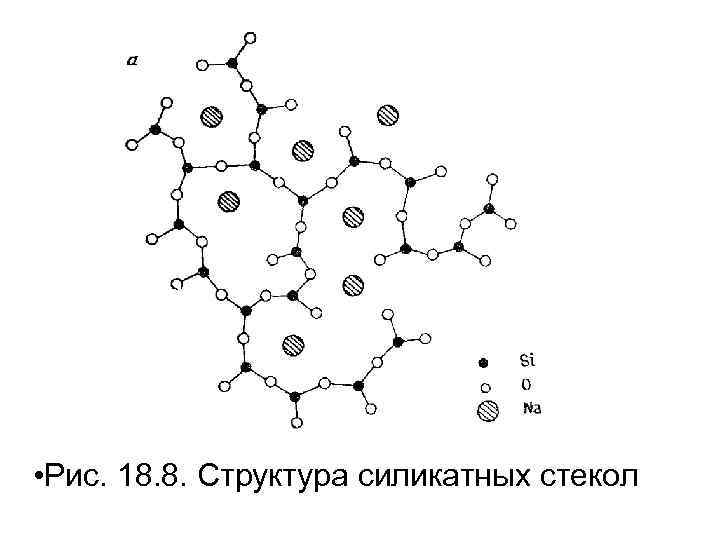 • Рис. 18. 8. Структура силикатных стекол
• Рис. 18. 8. Структура силикатных стекол
 • Окислы других металлов, добавленные к Si. O 2, например B 2 O 3, действует иначе, так как они фактически входят в сетчатую структуру. в комбинации с Si. O 2, сетки содержат тетраэдры Si. O 4 и треугольники BO 3.
• Окислы других металлов, добавленные к Si. O 2, например B 2 O 3, действует иначе, так как они фактически входят в сетчатую структуру. в комбинации с Si. O 2, сетки содержат тетраэдры Si. O 4 и треугольники BO 3.
 • Таким образом, стеклообразуюшего замещение им при оксида оксидов введении происходит кремния, так что беспорядочная трехмерная структура сохраняется. В этом случае при охлаждении не происходит расстекловывания и область стеклообразования расширяется.
• Таким образом, стеклообразуюшего замещение им при оксида оксидов введении происходит кремния, так что беспорядочная трехмерная структура сохраняется. В этом случае при охлаждении не происходит расстекловывания и область стеклообразования расширяется.
 • B 2 O 3 сам может образовывать сетчатую структуру, в которой каждый атом бора находится в триангулярной координации по отношению к трем атомам кислорода;
• B 2 O 3 сам может образовывать сетчатую структуру, в которой каждый атом бора находится в триангулярной координации по отношению к трем атомам кислорода;
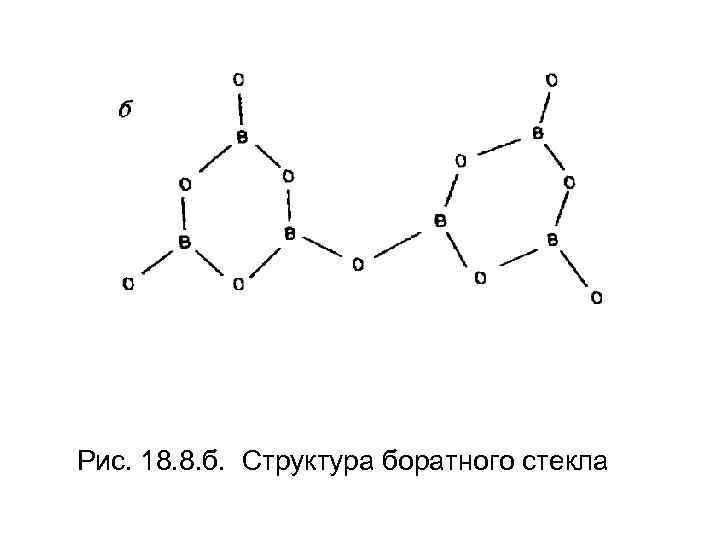 Рис. 18. 8. б. Структура боратного стекла
Рис. 18. 8. б. Структура боратного стекла
 Полимеры Высокомолекулярные соединения, в которых более или менее регулярно чередуется большое число одинаковых или неодинаковых атомных группировок, соединенных химическими связями в длинные цепи, имеющие боковые ответвления, а также пространственные сетки называются полимерами. в
Полимеры Высокомолекулярные соединения, в которых более или менее регулярно чередуется большое число одинаковых или неодинаковых атомных группировок, соединенных химическими связями в длинные цепи, имеющие боковые ответвления, а также пространственные сетки называются полимерами. в
 • Сложность полимеров методами, молекулярной затрудняет используемыми низкомолекулярных структуры исследовать при веществ. их изучении Однако к настоящему времени достигнуты значительные успехи в вопросе изучения полимерных материалов. морфологии
• Сложность полимеров методами, молекулярной затрудняет используемыми низкомолекулярных структуры исследовать при веществ. их изучении Однако к настоящему времени достигнуты значительные успехи в вопросе изучения полимерных материалов. морфологии
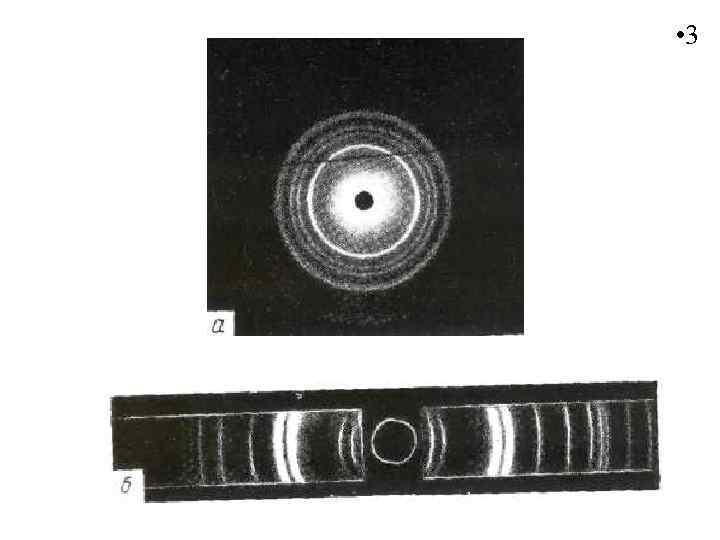
 Первичная оценка физического состояния материала состоит в отнесении его к классу кристаллических или аморфных тел. Обычно это делают с помощью метода рентгеноструктурного анализа. Рентгенограммы кристаллического полимера содержат большее или меньшее число довольно резко выраженных концентрических колец.
Первичная оценка физического состояния материала состоит в отнесении его к классу кристаллических или аморфных тел. Обычно это делают с помощью метода рентгеноструктурного анализа. Рентгенограммы кристаллического полимера содержат большее или меньшее число довольно резко выраженных концентрических колец.
 • 3
• 3
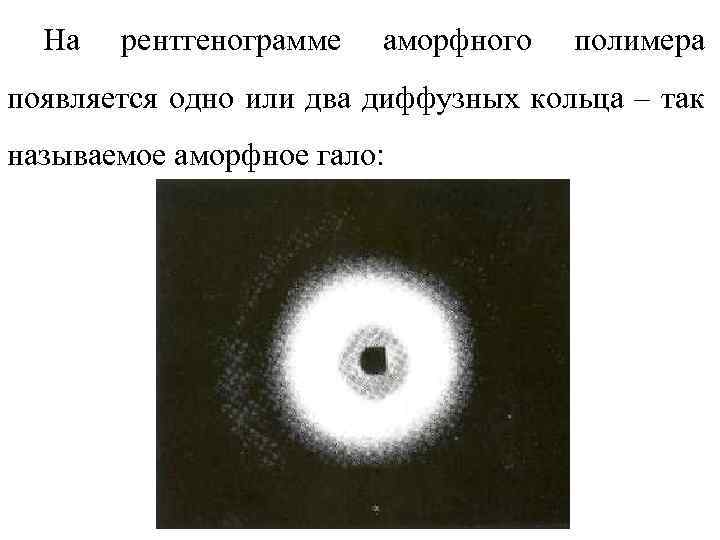 На рентгенограмме аморфного полимера появляется одно или два диффузных кольца – так называемое аморфное гало:
На рентгенограмме аморфного полимера появляется одно или два диффузных кольца – так называемое аморфное гало:
 Предельным кристаллических случаем упорядочения полимеров является образование идеальных кристаллических тел – монокристаллов.
Предельным кристаллических случаем упорядочения полимеров является образование идеальных кристаллических тел – монокристаллов.
 В полимерах отклонения от строгого порядка могут быть связаны как с нарушениями строгой регулярности строения цепи, так и с тем, что связанность атомов в длинную цепь препятствует их свободной диффузии, необходимой для образования идеального кристалла. Поэтому в полимерах всегда чередуются области большего или меньшего порядка и отделить их друг от друга нельзя.
В полимерах отклонения от строгого порядка могут быть связаны как с нарушениями строгой регулярности строения цепи, так и с тем, что связанность атомов в длинную цепь препятствует их свободной диффузии, необходимой для образования идеального кристалла. Поэтому в полимерах всегда чередуются области большего или меньшего порядка и отделить их друг от друга нельзя.
 • 6 Степени кристалличности: C = Cа(1 - x) + Ckx где С – измеряемый показатель некоего свойства полимера, Cа и Ck – значения этого показателя для чисто аморфного и чисто кристаллического полимера, х – доля кристаллического полимера. Отсюда степень кристалличности полимера составит (%) К = 100 х = Степень кристалличности представляет собой некоторую усредненную, интегральную оценку структуры материала.
• 6 Степени кристалличности: C = Cа(1 - x) + Ckx где С – измеряемый показатель некоего свойства полимера, Cа и Ck – значения этого показателя для чисто аморфного и чисто кристаллического полимера, х – доля кристаллического полимера. Отсюда степень кристалличности полимера составит (%) К = 100 х = Степень кристалличности представляет собой некоторую усредненную, интегральную оценку структуры материала.
 • 7 Полная характеристика строения вещества основана на детальном изучении его морфологии, т. е. совокупности наблюдаемых структурных образований, их формы и границ, взаимного расположения и иерархии (способа построения более сложных из более простых).
• 7 Полная характеристика строения вещества основана на детальном изучении его морфологии, т. е. совокупности наблюдаемых структурных образований, их формы и границ, взаимного расположения и иерархии (способа построения более сложных из более простых).
 К основным кристаллических различные морфологическим полимеров монокристаллы формам относятся (пластинчатые, фибриллярные, глобулярные) и сферолиты, и некоторые промежуточные образования.
К основным кристаллических различные морфологическим полимеров монокристаллы формам относятся (пластинчатые, фибриллярные, глобулярные) и сферолиты, и некоторые промежуточные образования.
 Простейшим первичным элементом любой морфологической формы кристаллического полимера является кристаллографическая ячейка, информацию о которой получают на основании рентгенографического исследования. Она характеризуется строго определенными размерами – расстояниями между атомами, или периодами (параметрами) решетки a, b, c и углами α, β, γ между плоскостями, в которых лежат эти атомы.
Простейшим первичным элементом любой морфологической формы кристаллического полимера является кристаллографическая ячейка, информацию о которой получают на основании рентгенографического исследования. Она характеризуется строго определенными размерами – расстояниями между атомами, или периодами (параметрами) решетки a, b, c и углами α, β, γ между плоскостями, в которых лежат эти атомы.
 • Типичным примером кристаллической ячейки, образующейся в полимерах, является орторомбическая пространственная элементарная ячейка полиэтилена.
• Типичным примером кристаллической ячейки, образующейся в полимерах, является орторомбическая пространственная элементарная ячейка полиэтилена.
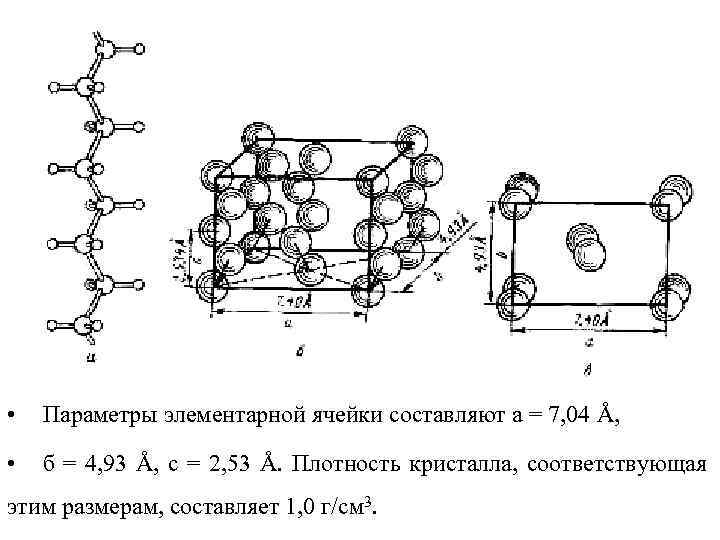 • 9 • Параметры элементарной ячейки составляют а = 7, 04 Å, • б = 4, 93 Å, с = 2, 53 Å. Плотность кристалла, соответствующая этим размерам, составляет 1, 0 г/см 3.
• 9 • Параметры элементарной ячейки составляют а = 7, 04 Å, • б = 4, 93 Å, с = 2, 53 Å. Плотность кристалла, соответствующая этим размерам, составляет 1, 0 г/см 3.
 В отличие от полиэтилена для линейных цепей с объемными боковыми заместителями характерна не плоская зигзагообразная, а спиральная конформация макромолекулярных цепей, входящих в кристалл. Для полимеров, как и для низкомолекулярных веществ, характерно явление полиморфизма, когда одно и то же вещество способно кристаллических формах. существовать в различных
В отличие от полиэтилена для линейных цепей с объемными боковыми заместителями характерна не плоская зигзагообразная, а спиральная конформация макромолекулярных цепей, входящих в кристалл. Для полимеров, как и для низкомолекулярных веществ, характерно явление полиморфизма, когда одно и то же вещество способно кристаллических формах. существовать в различных
 • Различное взаимное расположение кристаллических ячеек приводит к образованию высших структурных кристаллического форм состояния в пределах вещества, определяющих морфологию кристаллического полимера
• Различное взаимное расположение кристаллических ячеек приводит к образованию высших структурных кристаллического форм состояния в пределах вещества, определяющих морфологию кристаллического полимера
 Если кристаллическое тело целиком построено из элементарных ячеек, которые могут быть совмещены друг с другом путем только параллельного переноса вдоль ребер на расстояния, равные периодам, в соответствующих направлениях, то это тело представляет собой монокристалл. Способность высокомолекулярных веществ образовывать монокристаллы была впервые установлена в 1957 году Келлера. независимыми работами Фишера, Тилла и
Если кристаллическое тело целиком построено из элементарных ячеек, которые могут быть совмещены друг с другом путем только параллельного переноса вдоль ребер на расстояния, равные периодам, в соответствующих направлениях, то это тело представляет собой монокристалл. Способность высокомолекулярных веществ образовывать монокристаллы была впервые установлена в 1957 году Келлера. независимыми работами Фишера, Тилла и
 • Простейшие монокристаллы представляют собой монослойные плоские пластины (ламели) часто ромбовидной формы толщиной 100 Å и длиной сторон до 1 мкм. Оси а и б кристаллической ячейки соответствуют длинной и короткой диагоналям ромба, а ось с, вдоль которой направлены макромолекулярные цепи, перпендикулярна плоскости кристалла.
• Простейшие монокристаллы представляют собой монослойные плоские пластины (ламели) часто ромбовидной формы толщиной 100 Å и длиной сторон до 1 мкм. Оси а и б кристаллической ячейки соответствуют длинной и короткой диагоналям ромба, а ось с, вдоль которой направлены макромолекулярные цепи, перпендикулярна плоскости кристалла.
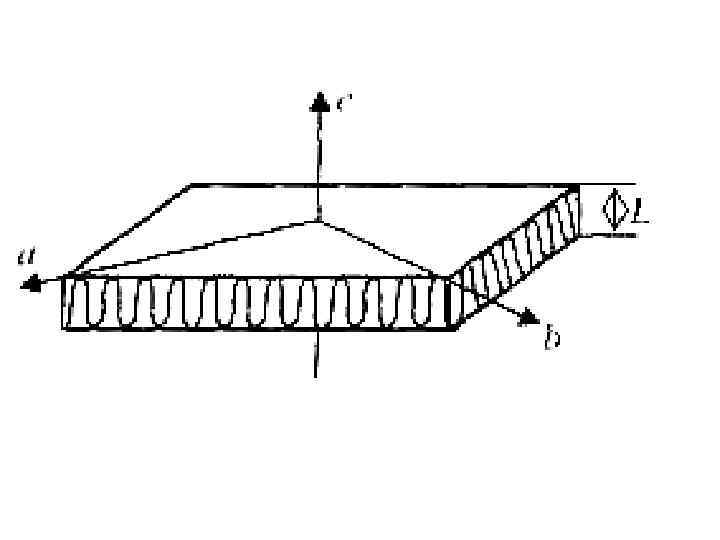
 Поскольку длина макромолекул превышает десятки тысяч ангстрем, а толщина кристалла не превышает 200 Å, цепь может уложится в кристалл только повернувшись на поверхности кристалла на 1800.
Поскольку длина макромолекул превышает десятки тысяч ангстрем, а толщина кристалла не превышает 200 Å, цепь может уложится в кристалл только повернувшись на поверхности кристалла на 1800.

 Цепь находится в складчатой конформации. В пределах кристалла толщиной 120 Å каждая складка содержит приблизительно 100 атомов углерода. Основным параметром является длина складки. Возвращение цепи в кристалл может проходить по-разному.
Цепь находится в складчатой конформации. В пределах кристалла толщиной 120 Å каждая складка содержит приблизительно 100 атомов углерода. Основным параметром является длина складки. Возвращение цепи в кристалл может проходить по-разному.
 Кристаллизация в условиях максимально, приближающихся к равновесным (при степенях переохлаждения ~ 10), приводит к формированию совершенных монокристаллов, построенных из выпрямленных. Размер оси с не менее 200 Å. Это равновесная (термодинамически предпочтительная) форма кристалла. Ее получают:
Кристаллизация в условиях максимально, приближающихся к равновесным (при степенях переохлаждения ~ 10), приводит к формированию совершенных монокристаллов, построенных из выпрямленных. Размер оси с не менее 200 Å. Это равновесная (термодинамически предпочтительная) форма кристалла. Ее получают:
 1. Кристаллизацией под высоким гидростатическим давлением (500 – 1000 МПа). 2. Длительным (в течение нескольких недель отжигом полимера при температуре близкой к температуре плавления). 3. Отжигом высокоориентированного (растянутого 1500 %) полимера, под высоким давлением (700 МПа) в области температур близких к Тпл.
1. Кристаллизацией под высоким гидростатическим давлением (500 – 1000 МПа). 2. Длительным (в течение нескольких недель отжигом полимера при температуре близкой к температуре плавления). 3. Отжигом высокоориентированного (растянутого 1500 %) полимера, под высоким давлением (700 МПа) в области температур близких к Тпл.
 Кристаллизация при охлаждении расплава с одновременным напряжений наложением приводит к больших структуре кебаба” или шашлыкоподобной : “шиш-
Кристаллизация при охлаждении расплава с одновременным напряжений наложением приводит к больших структуре кебаба” или шашлыкоподобной : “шиш-
 • Структурные образования типа “шиш-кебаба” полиэтилене (а) и схема расположения цепей в них (б). в
• Структурные образования типа “шиш-кебаба” полиэтилене (а) и схема расположения цепей в них (б). в
 Получающиеся кристаллизации в различных структурные условиях образования представляют собой различные правильно ограненные морфологические формы: террасоподобные кристаллы, полые пирамиды, дендритные образования.
Получающиеся кристаллизации в различных структурные условиях образования представляют собой различные правильно ограненные морфологические формы: террасоподобные кристаллы, полые пирамиды, дендритные образования.
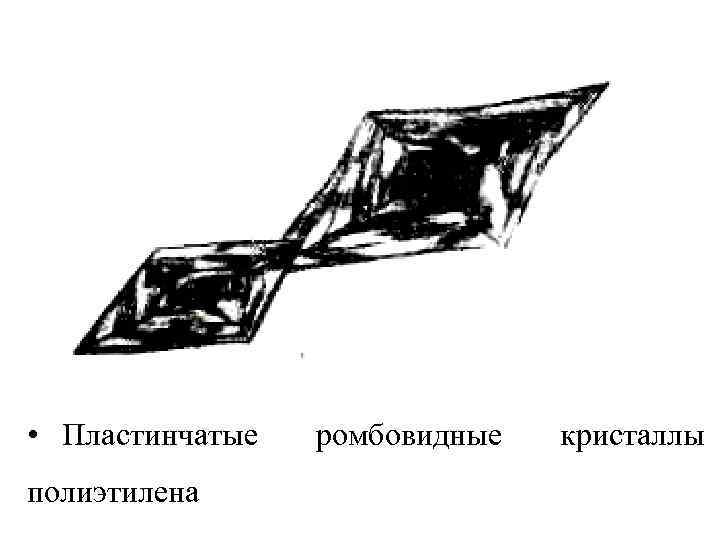 • Пластинчатые полиэтилена ромбовидные кристаллы
• Пластинчатые полиэтилена ромбовидные кристаллы
 • 19 Различные типы реальных монокристаллов полиэтилена. а – террасоподобные. б – пирамидальные, в – дендритные.
• 19 Различные типы реальных монокристаллов полиэтилена. а – террасоподобные. б – пирамидальные, в – дендритные.
 Из растворов повышенной концентрации образуются, характерные только для полимеров кристаллические структуры в виде многогранников (их называют эдритами и аксиалитами) или овалов (овойды).
Из растворов повышенной концентрации образуются, характерные только для полимеров кристаллические структуры в виде многогранников (их называют эдритами и аксиалитами) или овалов (овойды).
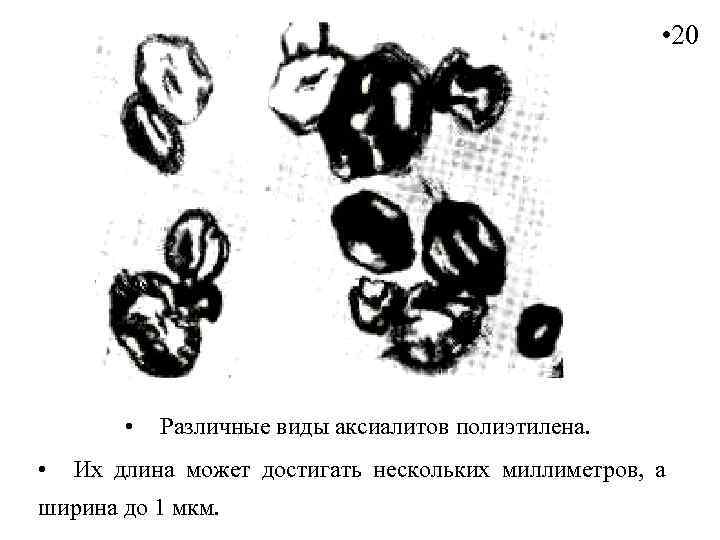 • 20 • • Различные виды аксиалитов полиэтилена. Их длина может достигать нескольких миллиметров, а ширина до 1 мкм.
• 20 • • Различные виды аксиалитов полиэтилена. Их длина может достигать нескольких миллиметров, а ширина до 1 мкм.
 • 21 В условиях, препятствующих формированию пластинчатых монокристаллов, (при высоких скоростях испарения растворителя из относительно концентрированных растворов) происходит формирование фибриллярных кристаллов, напоминающих по внешнему виду ленты. Толщина фибриллярных кристаллов 100 – 200 Å, длина достигает нескольких микрон.
• 21 В условиях, препятствующих формированию пластинчатых монокристаллов, (при высоких скоростях испарения растворителя из относительно концентрированных растворов) происходит формирование фибриллярных кристаллов, напоминающих по внешнему виду ленты. Толщина фибриллярных кристаллов 100 – 200 Å, длина достигает нескольких микрон.
 В глобулярных кристаллах узлы решетки образуются отдельными макромолекулами в свернутых или клубкообразных, глобулярных конформациях. Взаимное расположение глобул в пространстве вполне регулярно. Формирование глобулярных характерно для биополимеров. кристаллов
В глобулярных кристаллах узлы решетки образуются отдельными макромолекулами в свернутых или клубкообразных, глобулярных конформациях. Взаимное расположение глобул в пространстве вполне регулярно. Формирование глобулярных характерно для биополимеров. кристаллов
 При исследовании многих кристаллических полимеров методами световой микроскопии обнаруживаются структуры, типичный приведен на рис. : вид которых
При исследовании многих кристаллических полимеров методами световой микроскопии обнаруживаются структуры, типичный приведен на рис. : вид которых
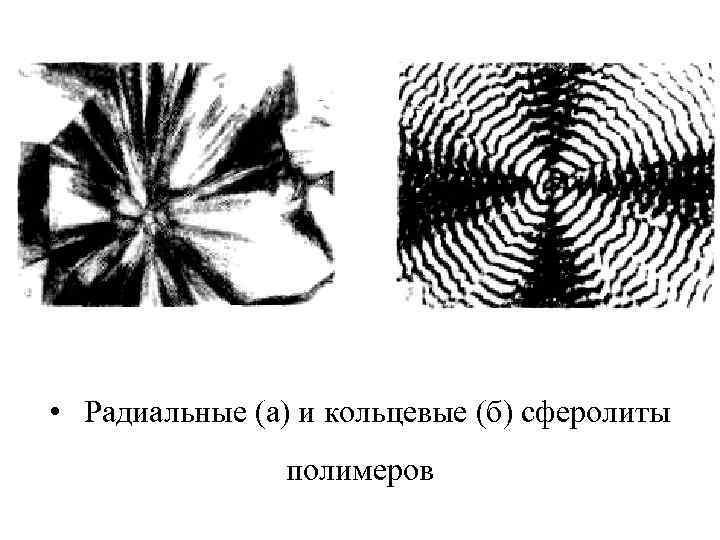 • Радиальные (а) и кольцевые (б) сферолиты полимеров
• Радиальные (а) и кольцевые (б) сферолиты полимеров
 Такие сферические образования, симметричные построенные из радиально расположенных, расходящихся от центра лучей, называются сферолитами. Наиболее хорошо сферолиты различимы при рассмотрении тонких пленок или срезов полимеров в световом микроскопе в поляризованном свете (видны типичные для сферолитов картинки).
Такие сферические образования, симметричные построенные из радиально расположенных, расходящихся от центра лучей, называются сферолитами. Наиболее хорошо сферолиты различимы при рассмотрении тонких пленок или срезов полимеров в световом микроскопе в поляризованном свете (видны типичные для сферолитов картинки).
 • Простейшие структурные элементы внутри сферолита связаны между собой большим числом межструктурных проходных макромолекул связей или в виде пучков
• Простейшие структурные элементы внутри сферолита связаны между собой большим числом межструктурных проходных макромолекул связей или в виде пучков
 • Межструктурные связи в сферолитной структуре полиэтилена.
• Межструктурные связи в сферолитной структуре полиэтилена.
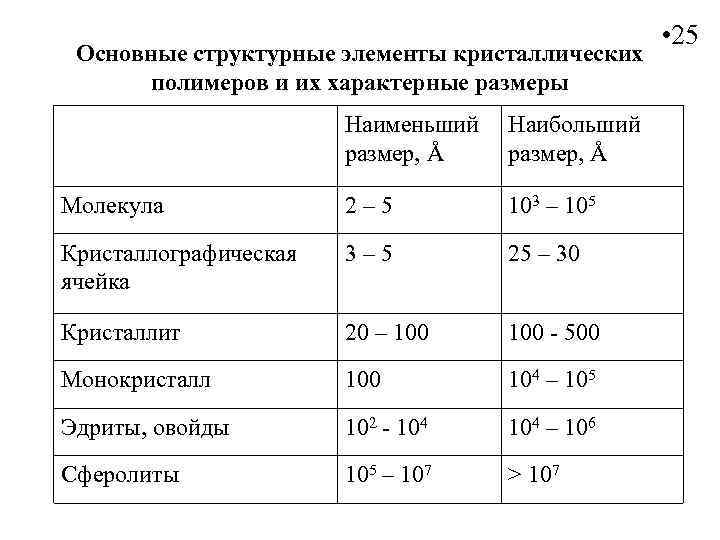 Основные структурные элементы кристаллических полимеров и их характерные размеры Наименьший размер, Å Наибольший размер, Å Молекула 2– 5 103 – 105 Кристаллографическая ячейка 3– 5 25 – 30 Кристаллит 20 – 100 - 500 Монокристалл 100 104 – 105 Эдриты, овойды 102 - 104 – 106 Сферолиты 105 – 107 > 107 • 25
Основные структурные элементы кристаллических полимеров и их характерные размеры Наименьший размер, Å Наибольший размер, Å Молекула 2– 5 103 – 105 Кристаллографическая ячейка 3– 5 25 – 30 Кристаллит 20 – 100 - 500 Монокристалл 100 104 – 105 Эдриты, овойды 102 - 104 – 106 Сферолиты 105 – 107 > 107 • 25
 • 26 Ориентированное состояние полимеров Принципиальная особенность строения полимерных цепей – чрезвычайно резкая анизотропия их продольных и поперечных размеров – приводит к существованию специфического для полимеров – ориентированного состояния.
• 26 Ориентированное состояние полимеров Принципиальная особенность строения полимерных цепей – чрезвычайно резкая анизотропия их продольных и поперечных размеров – приводит к существованию специфического для полимеров – ориентированного состояния.
 Это состояние характеризуется расположением осей цепных макромолекул преимущественно вдоль одного направления, что приводит к анизотропии свойств материалов.
Это состояние характеризуется расположением осей цепных макромолекул преимущественно вдоль одного направления, что приводит к анизотропии свойств материалов.
 В результате ориентационной неориентированный изотропный вытяжке полимер одноосно растягивается в 5 – 10 раз при комнатной температуре ориентированное образуются и состояние. фибриллярные переходит В в результате образования диаметром 100 – 200 Å, ориентированных в направлении вытяжки.
В результате ориентационной неориентированный изотропный вытяжке полимер одноосно растягивается в 5 – 10 раз при комнатной температуре ориентированное образуются и состояние. фибриллярные переходит В в результате образования диаметром 100 – 200 Å, ориентированных в направлении вытяжки.
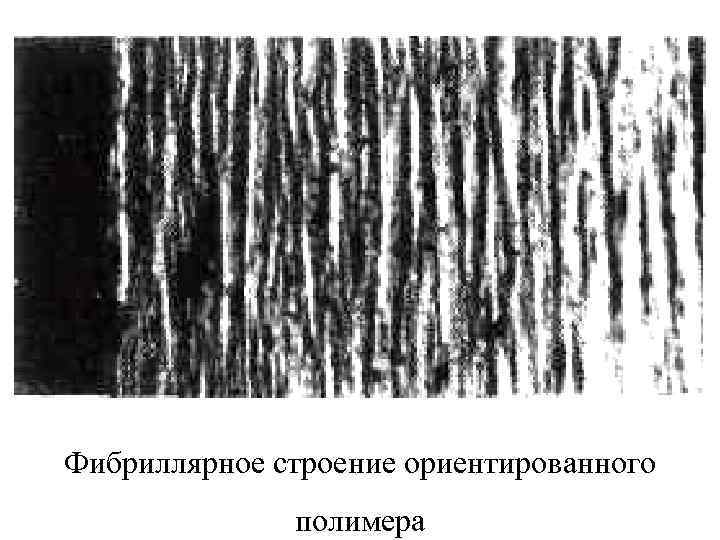 Фибриллярное строение ориентированного полимера
Фибриллярное строение ориентированного полимера
 • 28 Фибриллы – гетерогенны. Вдоль их оси более или менее регулярно чередуются участки большей (кристаллиты) или меньшей (аморфные прослойки) плотности - модель Петерлина.
• 28 Фибриллы – гетерогенны. Вдоль их оси более или менее регулярно чередуются участки большей (кристаллиты) или меньшей (аморфные прослойки) плотности - модель Петерлина.
 • Для ориентированного полимера при его растяжении вдоль направления ориентации характерны существенно более высокие значения прочности и модуля упругости, а также более сравнению с низкая деформируемость изотропным по материалом. Ориентированное состояние полимеров имеет основное значение для волокон и пленок.
• Для ориентированного полимера при его растяжении вдоль направления ориентации характерны существенно более высокие значения прочности и модуля упругости, а также более сравнению с низкая деформируемость изотропным по материалом. Ориентированное состояние полимеров имеет основное значение для волокон и пленок.
 • 29 • Модель Петерлина строения ориентированных полимеров
• 29 • Модель Петерлина строения ориентированных полимеров
 Аморфные полимеры • 30 Для полимеров характерен непрерывный переход по степени упорядоченности от идеального порядка – монокристалла – к абсолютно неупорядоченному состоянию. Для многих полимерных систем не отмечается рефлексов, соответствующих кристаллографической решетки.
Аморфные полимеры • 30 Для полимеров характерен непрерывный переход по степени упорядоченности от идеального порядка – монокристалла – к абсолютно неупорядоченному состоянию. Для многих полимерных систем не отмечается рефлексов, соответствующих кристаллографической решетки.
 Это полимеры, которые не могут кристаллизоваться (нерегулярность цепи, стерические затруднения), но и для кристаллизующихся полимеров быстрым охлаждением можно зафиксировать неравновесную структуру. В этом случае может быть получен как полностью аморфный полимер, так и материал, в котором сосуществуют кристаллические и аморфные области. Эти все случаи некристаллического или аморфного полимера.
Это полимеры, которые не могут кристаллизоваться (нерегулярность цепи, стерические затруднения), но и для кристаллизующихся полимеров быстрым охлаждением можно зафиксировать неравновесную структуру. В этом случае может быть получен как полностью аморфный полимер, так и материал, в котором сосуществуют кристаллические и аморфные области. Эти все случаи некристаллического или аморфного полимера.
 В аморфных полимерах существует ближний порядок в расположении макромолекул, что связано с флуктуациями плотности. Приводит к возникновению роев и ассоциатов. Некристаллическое состояние нельзя рассматривать как полностью неупорядоченное. (высокая скорость кристаллизации). Каргин, Слонимский и Китайгородский предложили “пачечную” модель строения аморфных полимеров.
В аморфных полимерах существует ближний порядок в расположении макромолекул, что связано с флуктуациями плотности. Приводит к возникновению роев и ассоциатов. Некристаллическое состояние нельзя рассматривать как полностью неупорядоченное. (высокая скорость кристаллизации). Каргин, Слонимский и Китайгородский предложили “пачечную” модель строения аморфных полимеров.
 Пачка – набор почти параллельно уложенных макромолекул с большими продольными размерами. Идеи Каргина сыграли определенную роль в развитии представлений о строении полимеров. Метод темнопольной электронной микроскопии способствовал развитию представлений о строении аморфных полимеров.
Пачка – набор почти параллельно уложенных макромолекул с большими продольными размерами. Идеи Каргина сыграли определенную роль в развитии представлений о строении полимеров. Метод темнопольной электронной микроскопии способствовал развитию представлений о строении аморфных полимеров.
 • 32 Использование этого метода показало, что подобно кристаллическим образованиям, в аморфном состоянии полимеров существует домен размером 30 – 100 Å. В пределах такого домена прослеживается ближний порядок, выраженный в параллельном расположении цепей, принимающих конформацию. складчатую
• 32 Использование этого метода показало, что подобно кристаллическим образованиям, в аморфном состоянии полимеров существует домен размером 30 – 100 Å. В пределах такого домена прослеживается ближний порядок, выраженный в параллельном расположении цепей, принимающих конформацию. складчатую
 Домены связаны между собой проходными цепями и соединены подобно бусинам в ожерелье. Кроме них в аморфном полимере существуют области. истинно Обнаружение неупорядоченные трех основных составляющих аморфного полимера: доменов, проходных цепей и неупорядоченной области привело Иея к изображенной на рис. : построению модели,
Домены связаны между собой проходными цепями и соединены подобно бусинам в ожерелье. Кроме них в аморфном полимере существуют области. истинно Обнаружение неупорядоченные трех основных составляющих аморфного полимера: доменов, проходных цепей и неупорядоченной области привело Иея к изображенной на рис. : построению модели,
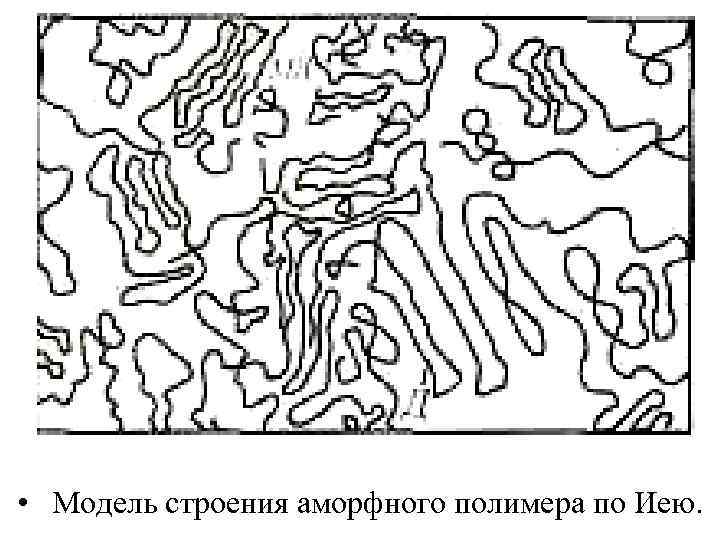 • Модель строения аморфного полимера по Иею.
• Модель строения аморфного полимера по Иею.
 В последнее время эти представления нашли дальнейшее развитие в моделе Матвеева – обосновывает Аскадского, появление которая глобулярных структур в аморфном полимере.
В последнее время эти представления нашли дальнейшее развитие в моделе Матвеева – обосновывает Аскадского, появление которая глобулярных структур в аморфном полимере.


