Строение белковой молекулы1прионы.ppt
- Количество слайдов: 13

Прионы — «нестандартные» биологические репликаторы, представляющие собой особым образом свернутые молекулы прионного белка Pr. P. Этот белок в норме присутствует на мембранах нейронов и выполняет функции, связанные с передачей сигналов Прионы представляют собой неправильно свернутые молекулы прионного белка Pr. P, способные «размножаться» , превращая нормальные молекулы Pr. P в подобие самих себя. Безобидный прионный белок превращается в смертоносный прион в результате «неправильного сворачивания» не вызывает иммунного ответа,

Строение белковой молекулы


На микроскопических снимках — прионные белки, возбудители коровьего бешенства.

Структура «нормального» (слева) и «аномального» (справа) прионного белка. Нормальный клеточный прионовый белок играет чрезвычайно важную роль в жизнедеятельности организма: участвует в передаче нервных импульсов и в поддержании суточных ритмов, регулируя циклы активности и покоя в клетках, органах и в организме в целом. Нормальная клеточная изоформа приона (Pr. P ) — это белок с м. м. 33 -35 к. Д. Его концентрация в норме достигает 1 мкг/г ткани мозга. Белок является мембранной молекулой

Человеческий Pr. P состоит из 253 аминокислот. Из них 40% аминокислот находится в составе α-спиралей и 3% — в виде β-структур. В молекуле приона установлено наличие 4 αспиральных доменов -H 1, H 2, HЗ и H 4. Домен H 1 соответствует трансмембранному участку и отсутствует у искусственно созданных рекомбинантных секретируемых форм. M-конец прионового белка связывает два атома меди. Медь влияет на содержание α-спирали в белке. Предполагается, что накопление в нервной ткани прионовых белков может привести к нарушению метаболизма меди вследствие его повышенного связывания. Снижение уровня меди может приводить к дисфункции ЦНС, как это показано для человека и животных, но не доказано в отношении прионов .


Инфекционная форма приона (Pr. P ) также обнаруживается на поверхности нервных клеток, но в гораздо больших концентрациях — более 10 мкг/г ткани мозга. Pr. P имеет ту же первичную структуру, что и Pr. P , но отличается от нормального белка вторичной и третичной структурой — то есть характером укладки полипептидной цепи. В структуре Pr. P , в отличие от Pr. P , обнаруживается существенно больше β-складчатых структур (43%) при одновременном уменьшении содержания ? -спиралей. Белок Pr. P является конформационным изомером нормального прионового белка. Изменение конформации происходит при непосредственном взаимодействии нормального и прионового белка.

И вот в 1997 году группа Тер-Аванесяна нашла такое доказательство. Опыт был поставлен в среде без ДНК. К Sup 35 добавляли некоторое количество белка, находящегося в «аномальной» пространственной форме. Через некоторое время весь белок оказывался в «аномальной» конформации. Этот белок снова добавляли к «нормальному» , и он опять переводил его в «аномальную» форму. Так повторялось много раз, пока доля исходного «аномального» белка не оказалась совершенно ничтожной, так что стало ясно: «аномальный» белок, образованный из «нормального» , способен передавать свою пространственную форму другому, «нормальному» , белку. Итак, был открыт новый механизм передачи наследственной информации — белковая наследственность.

За доказательство небактериальной инфекционной природы куру, скрепи и болезни Крейцфельдта-Якоба в 1976 году Гайдушеку была присуждена Нобелевская премия. Стэнли Прузинер обнаружил, что абсолютно одинаковые по химическому составу прионные белки могут находиться в двух разных пространственных формах. Разница между такими белками отчасти напоминает разницу между сырым и вареным белком обыкновенного куриного яйца. Если белок находится в «нормальной» форме, он хорошо растворяется и выполняет в организме свойственную ему функцию. Напротив, белок, находящийся в «аномальной» пространственной форме, образует нерастворимые агрегаты, слипается. Но самым важным — и уникальным — свойством прионов является следующее: белок, находящийся в «аномальной» форме, столкнувшись с «нормальным» белком, переводит его в свою, «аномальную» , форму. Это и является сутью прионного типа инфекции: «больной» белок заражает «здоровый» , который начинает слипаться и, накапливаясь, заполняет клетки мозга, препятствуя их работе. Причины изначального появления в организме белка в «аномальной» форме пока не установлены. Обе формы белка кодируются одним геном, поэтому вполне вероятно, что на образование «аномальной» формы могут влиять внешние воздействия (например, есть гипотеза, что к появлению «аномального» приона в организме может привести высокая температура, перенесенная человеком).

Молекулярно-генетические исследования с использованием трансгенов показали, что Pr. P действует в качестве матрицы для рефолдинга (изменения конформационной структуры) Pr. P в Pr. P. В этом процессе принимает участие дополнительный белок (X-фактор), который, по всей вероятности, является шапероном (вспомогательным белком, поддерживающим конформационное состояние белка). В ходе превращения нормального клеточного прионового белка в Pr. P , часть его α-спиральных и неупорядоченных участков переходит в форму βструктуры. Наиболее существенным является то, что при этом аминокислотная последовательность остается соответствующей нормальному белку.
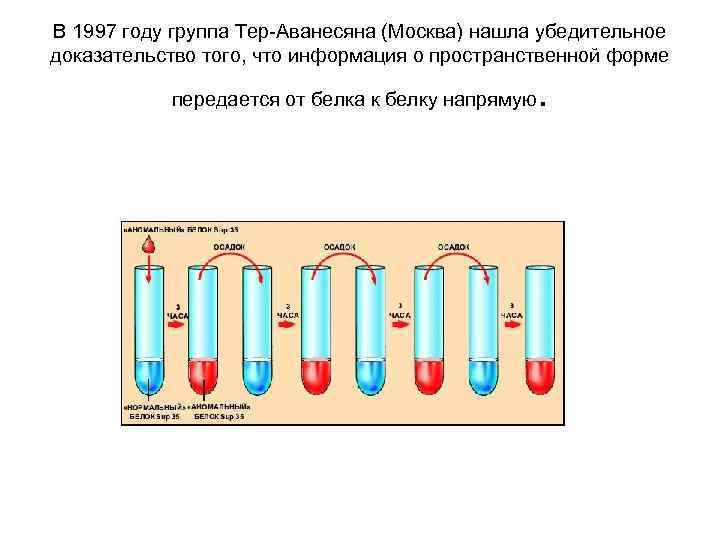
В 1997 году группа Тер-Аванесяна (Москва) нашла убедительное доказательство того, что информация о пространственной форме передается от белка к белку напрямую .

стала первой страной, где объявилась новая смертельная болезнь коров — коровье бешенство (нейродегенеративное заболевание). Через зараженное мясо болезнь передавалась и человеку. Американский биохимик Стэнли Прузинер
Строение белковой молекулы1прионы.ppt