c4a92f514385a1f6f6e1aed935e759d5.ppt
- Количество слайдов: 53
 Презентация по химии Положение металлов в периодической системе химических элементов Д. И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Выполнила учитель высшей квалификационной категории МКОУ СОШ № 10 г. Бирюсинска Федотова Марина Владимировна г. Бирюсиснск, 2015 1
Презентация по химии Положение металлов в периодической системе химических элементов Д. И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Выполнила учитель высшей квалификационной категории МКОУ СОШ № 10 г. Бирюсинска Федотова Марина Владимировна г. Бирюсиснск, 2015 1
 ЗДРАВСТВУЙТЕ!
ЗДРАВСТВУЙТЕ!
 Положение металлов в периодической системе химических элементов Д. И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов.
Положение металлов в периодической системе химических элементов Д. И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов.
 Эпиграф урока: «Мощь и сила науки – во множестве фактов, цель – в обобщении этого множества» Д. И. Менделеев
Эпиграф урока: «Мощь и сила науки – во множестве фактов, цель – в обобщении этого множества» Д. И. Менделеев
 Удивительный мир металлов
Удивительный мир металлов
 Цели урока: Рассмотреть положение металлов в ПСХЭ; Выяснить особенности строения атомов металлов; Познакомиться с физическими свойствами металлов; Выяснить, от чего зависят физические свойства; Рассмотреть, как связаны физические свойства и использование металлов.
Цели урока: Рассмотреть положение металлов в ПСХЭ; Выяснить особенности строения атомов металлов; Познакомиться с физическими свойствами металлов; Выяснить, от чего зависят физические свойства; Рассмотреть, как связаны физические свойства и использование металлов.
 Из 109 элементов ПСХЭ ? являются металлами: они выделены голубым, зелёным и розовым цветом (кроме H и He)
Из 109 элементов ПСХЭ ? являются металлами: они выделены голубым, зелёным и розовым цветом (кроме H и He)
 Положение металлов в Периодической системе химических элементов Условная граница между элементамиметаллами и элементами-неметаллами проходит по диагонали: B(бор) – Si(кремний) – As(мышьяк) – Te(теллур) – At (астат)
Положение металлов в Периодической системе химических элементов Условная граница между элементамиметаллами и элементами-неметаллами проходит по диагонали: B(бор) – Si(кремний) – As(мышьяк) – Te(теллур) – At (астат)
 Малое количество электронов на внешнем слое (в основном от 1 до 3) и сравнительно большие радиусы атомов элементовметаллов способствуют тому, что они отдают электроны внешнего (и предвнешнего) электронного слоя, превращаясь в положительно заряженные ионы. В главной подгруппе: -радиус атома увеличивается; -восстановительные свойства усиливаются; -металлические свойства усиливаются. В периоде: -радиус атома уменьшается; -восстановительные свойства уменьшаются; -металлические свойства ослабевают.
Малое количество электронов на внешнем слое (в основном от 1 до 3) и сравнительно большие радиусы атомов элементовметаллов способствуют тому, что они отдают электроны внешнего (и предвнешнего) электронного слоя, превращаясь в положительно заряженные ионы. В главной подгруппе: -радиус атома увеличивается; -восстановительные свойства усиливаются; -металлические свойства усиливаются. В периоде: -радиус атома уменьшается; -восстановительные свойства уменьшаются; -металлические свойства ослабевают.
 Загадочная пауза Он в теченье многих лет был причиной многих бед. Был металл серебристо-белым, в соединении стал мелом. К восьмой группе отнесен, в честь России назван он. «Камнем» назван он людьми, но попробуй-ка возьми. Из него солдатик твой, не болеет он «чумой» .
Загадочная пауза Он в теченье многих лет был причиной многих бед. Был металл серебристо-белым, в соединении стал мелом. К восьмой группе отнесен, в честь России назван он. «Камнем» назван он людьми, но попробуй-ка возьми. Из него солдатик твой, не болеет он «чумой» .
 Кристаллическая решетка Металлическими называют решётки, в узлах которых находятся атомы и ионы металла, между ними свободные (обобществленные) электроны.
Кристаллическая решетка Металлическими называют решётки, в узлах которых находятся атомы и ионы металла, между ними свободные (обобществленные) электроны.
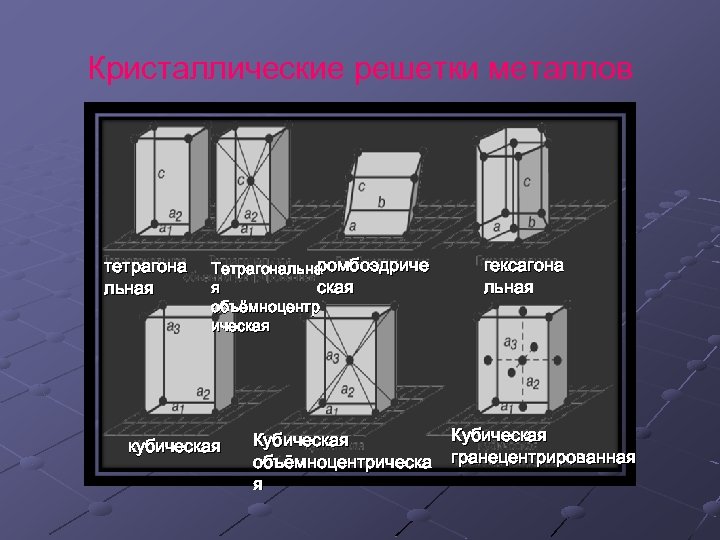 Кристаллические решетки металлов тетрагона льная ромбоэдриче Тетрагональна я ская объёмноцентр ическая кубическая Кубическая объёмноцентрическа я гексагона льная Кубическая гранецентрированная
Кристаллические решетки металлов тетрагона льная ромбоэдриче Тетрагональна я ская объёмноцентр ическая кубическая Кубическая объёмноцентрическа я гексагона льная Кубическая гранецентрированная
 Физические свойства металлов Агрегатное состояние (твердость) Пластичность Электрическая проводимость Теплопроводность Металлический блеск Плотность
Физические свойства металлов Агрегатное состояние (твердость) Пластичность Электрическая проводимость Теплопроводность Металлический блеск Плотность
 Пластичность Смещение слоев в кристаллических решетках металлов при механическом воздействии
Пластичность Смещение слоев в кристаллических решетках металлов при механическом воздействии
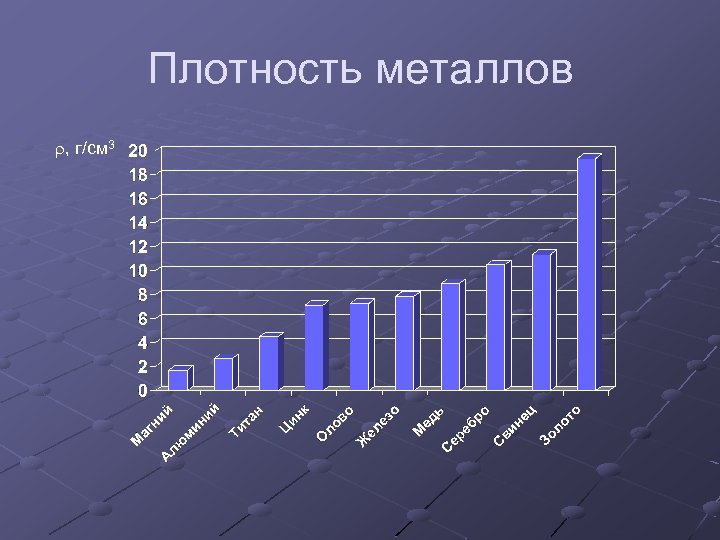 Плотность металлов r, г/см 3
Плотность металлов r, г/см 3
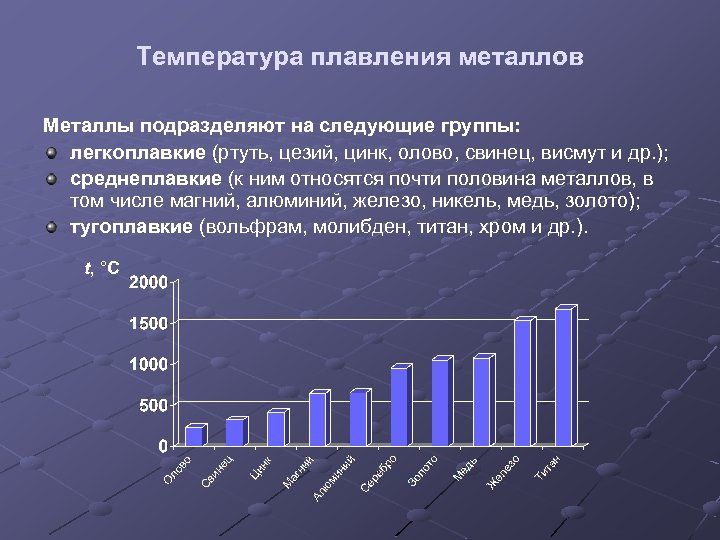 Температура плавления металлов Металлы подразделяют на следующие группы: легкоплавкие (ртуть, цезий, цинк, олово, свинец, висмут и др. ); среднеплавкие (к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото); тугоплавкие (вольфрам, молибден, титан, хром и др. ). t, °C
Температура плавления металлов Металлы подразделяют на следующие группы: легкоплавкие (ртуть, цезий, цинк, олово, свинец, висмут и др. ); среднеплавкие (к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото); тугоплавкие (вольфрам, молибден, титан, хром и др. ). t, °C
 Металл галлий, твердый слиток которого лежит на столе, имеет низкую температуру плавления и становится жидким от тепла руки.
Металл галлий, твердый слиток которого лежит на столе, имеет низкую температуру плавления и становится жидким от тепла руки.
 Твердость металлов Твердость – это характеристика металла, отражающая его прочность и пластичность. Количественной оценкой является число твердости (НВ). Значения твердости некоторых металлов по Бринеллю приведены на диаграмме. HB
Твердость металлов Твердость – это характеристика металла, отражающая его прочность и пластичность. Количественной оценкой является число твердости (НВ). Значения твердости некоторых металлов по Бринеллю приведены на диаграмме. HB

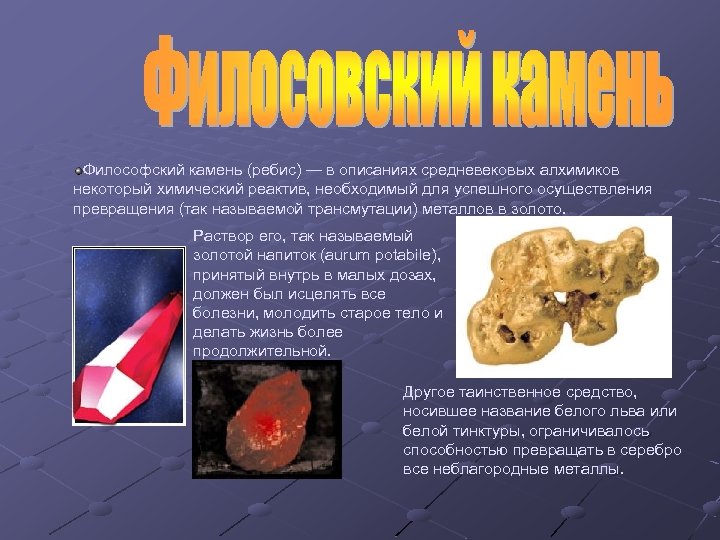 Философский камень (ребис) — в описаниях средневековых алхимиков некоторый химический реактив, необходимый для успешного осуществления превращения (так называемой трансмутации) металлов в золото. Раствор его, так называемый золотой напиток (аurum potabile), принятый внутрь в малых дозах, должен был исцелять все болезни, молодить старое тело и делать жизнь более продолжительной. Другое таинственное средство, носившее название белого льва или белой тинктуры, ограничивалось способностью превращать в серебро все неблагородные металлы.
Философский камень (ребис) — в описаниях средневековых алхимиков некоторый химический реактив, необходимый для успешного осуществления превращения (так называемой трансмутации) металлов в золото. Раствор его, так называемый золотой напиток (аurum potabile), принятый внутрь в малых дозах, должен был исцелять все болезни, молодить старое тело и делать жизнь более продолжительной. Другое таинственное средство, носившее название белого льва или белой тинктуры, ограничивалось способностью превращать в серебро все неблагородные металлы.
 С давних времен золото считалось металлом богов, особенно бога солнца. Бога солнца Ра называли также "золотая гора, которая озаряет землю". В представлении египтян тела богов были из чистого золота, и сам металл мог придавать божественные способности тому, кто его носил. иероглиф золота Усопшим царского происхождения надевали на лицо золотые маски, в то время как простые люди должны были довольствоваться желтой краской. Гробницу фараона, богато украшенную золотом, называли "золотой дом".
С давних времен золото считалось металлом богов, особенно бога солнца. Бога солнца Ра называли также "золотая гора, которая озаряет землю". В представлении египтян тела богов были из чистого золота, и сам металл мог придавать божественные способности тому, кто его носил. иероглиф золота Усопшим царского происхождения надевали на лицо золотые маски, в то время как простые люди должны были довольствоваться желтой краской. Гробницу фараона, богато украшенную золотом, называли "золотой дом".
 Калифорнийская золотая лихорадка (1848— 1855) началась в январе 1848, когда золото было обнаружено вблизи лесопилки на реке Американ. Ривер. Как только новость об обнаружении распространилась, около 300 тысяч человек прибыли в Калифорнию из других штатов. Золотая лихорадка также привлекла десятки тысяч добровольцев из стран Латинской Америки, Европы, Австралии и Азии. Было обнаружено золото на сумму в несколько миллиардов сегодняшних долларов, что привело к увеличению состояния некоторых старателей. Другие, однако, вернулись домой с пустыми руками.
Калифорнийская золотая лихорадка (1848— 1855) началась в январе 1848, когда золото было обнаружено вблизи лесопилки на реке Американ. Ривер. Как только новость об обнаружении распространилась, около 300 тысяч человек прибыли в Калифорнию из других штатов. Золотая лихорадка также привлекла десятки тысяч добровольцев из стран Латинской Америки, Европы, Австралии и Азии. Было обнаружено золото на сумму в несколько миллиардов сегодняшних долларов, что привело к увеличению состояния некоторых старателей. Другие, однако, вернулись домой с пустыми руками.
 В зависимости от цвета, в золотой сплав входят следующие металлы: Белое золото – палладий, никель, платина Желтое золото – серебро, медь (в другом процентном соотношении) Красное золото – серебро, медь Белое золото – палладий, никель, платина
В зависимости от цвета, в золотой сплав входят следующие металлы: Белое золото – палладий, никель, платина Желтое золото – серебро, медь (в другом процентном соотношении) Красное золото – серебро, медь Белое золото – палладий, никель, платина
 Чистое золото — мягкий металл жёлтого цвета. В тонких плёнках золото просвечивает зелёным. Золото обладает исключительно высокой теплопроводностью и низким сопротивлением. Золото – очень тяжелый металл: шар из чистого золота диаметром 46 мм имеет Литровая бутыль, заполненная массу 1 кг. золотым песком, весит приблизительно 16 кг. Золото очень ковко и тягуче. Из кусочка золота весом в один грамм можно вытянуть проволоку длиной в три километра или изготовить золотую фольгу в 500 раз тоньше человеческого волоса (0, 0001 мм). Мягкость чистого золота настолько велика, что его можно царапать ногтем.
Чистое золото — мягкий металл жёлтого цвета. В тонких плёнках золото просвечивает зелёным. Золото обладает исключительно высокой теплопроводностью и низким сопротивлением. Золото – очень тяжелый металл: шар из чистого золота диаметром 46 мм имеет Литровая бутыль, заполненная массу 1 кг. золотым песком, весит приблизительно 16 кг. Золото очень ковко и тягуче. Из кусочка золота весом в один грамм можно вытянуть проволоку длиной в три километра или изготовить золотую фольгу в 500 раз тоньше человеческого волоса (0, 0001 мм). Мягкость чистого золота настолько велика, что его можно царапать ногтем.
 По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо, как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия используются очень широко. Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе. Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов. Золочение металлов широко используется в качестве метода защиты от коррозии. Золото зарегистрировано в качестве пищевой добавки
По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо, как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия используются очень широко. Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе. Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов. Золочение металлов широко используется в качестве метода защиты от коррозии. Золото зарегистрировано в качестве пищевой добавки
 Золото может быть в умелых руках гибким и податливым, как воск…
Золото может быть в умелых руках гибким и податливым, как воск…
 «Золото ослепительно блестело, скульптура выглядела так, как будто ее только что принесли из мастерской. . . Лицо ее было сделано из чистого золота, глаза из аргонита и обсидиана, брови и веки — из стекла цвета лазурита. Это лицо напоминало своей неподвижностью маску, и в то же время оно было словно живое» . Это описание золотой маски, покрывающей мумию фараона Тутанхамона, принадлежит перу К. Керама, автора книги «Боги, гробницы и ученые» .
«Золото ослепительно блестело, скульптура выглядела так, как будто ее только что принесли из мастерской. . . Лицо ее было сделано из чистого золота, глаза из аргонита и обсидиана, брови и веки — из стекла цвета лазурита. Это лицо напоминало своей неподвижностью маску, и в то же время оно было словно живое» . Это описание золотой маски, покрывающей мумию фараона Тутанхамона, принадлежит перу К. Керама, автора книги «Боги, гробницы и ученые» .
 Золото привлекало своим солнечным блеском. Золото блестит даже в темную, серую погоду, показывает повсюду победу сил света над силами тьмы.
Золото привлекало своим солнечным блеском. Золото блестит даже в темную, серую погоду, показывает повсюду победу сил света над силами тьмы.
 Медь История цивилизаций Древнего Египта, Древней Греции, Вавилона и других государств неразрывно связанна с историей металлов и их сплавов. Установлено, что египтяне за несколько тысячелетий до нашей эры уже умели изготавливать изделия из меди
Медь История цивилизаций Древнего Египта, Древней Греции, Вавилона и других государств неразрывно связанна с историей металлов и их сплавов. Установлено, что египтяне за несколько тысячелетий до нашей эры уже умели изготавливать изделия из меди
 В синем небе, колокольнями проколотом, – Медный колокол, медный колокол, – То ль возрадовался, то ли осерчал… В. Высоцкий
В синем небе, колокольнями проколотом, – Медный колокол, медный колокол, – То ль возрадовался, то ли осерчал… В. Высоцкий
 Православный храм в Бирюсинске Колокольня храма Воскресения Господня в г. Бирюсинске
Православный храм в Бирюсинске Колокольня храма Воскресения Господня в г. Бирюсинске
 Физические свойства меди Медь – тягучий вязкий металл светло-розового света, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток. Отличается хорошими литейными качествами.
Физические свойства меди Медь – тягучий вязкий металл светло-розового света, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток. Отличается хорошими литейными качествами.
 2 млн 300 тыс. каменных глыб, из которых сложена пирамида Хеопса, добыты и обтесаны медным инструментом…
2 млн 300 тыс. каменных глыб, из которых сложена пирамида Хеопса, добыты и обтесаны медным инструментом…
 Из представителей животного мира наибольшее количество меди содержат устрицы, осьминоги и некоторые моллюски. Медь входит в состав их дыхательного пигмента – гемоцианина.
Из представителей животного мира наибольшее количество меди содержат устрицы, осьминоги и некоторые моллюски. Медь входит в состав их дыхательного пигмента – гемоцианина.
 У меди было много преимуществ перед камнем и деревом. Во-первых это ковкость и плавкость. Металл поддавался любой обработке и принимал нужную форму. Во-вторых это более эффективный материал. Ведь разрубить дерево проще медным топором, чем долбить камнем. А в-третьих это возможность дальнейшего развития для человека, шанс встать на новую ступень развития.
У меди было много преимуществ перед камнем и деревом. Во-первых это ковкость и плавкость. Металл поддавался любой обработке и принимал нужную форму. Во-вторых это более эффективный материал. Ведь разрубить дерево проще медным топором, чем долбить камнем. А в-третьих это возможность дальнейшего развития для человека, шанс встать на новую ступень развития.
 Медь применялась в изготовлении предметов искусства.
Медь применялась в изготовлении предметов искусства.
 Всего этого человек не достиг бы, если бы не открыл свойства меди. Благодаря ним он смог намного улучшить орудия труда, усовершенствовать свои ремёсла, что сильно ускорило прогресс и дало начало новому веку.
Всего этого человек не достиг бы, если бы не открыл свойства меди. Благодаря ним он смог намного улучшить орудия труда, усовершенствовать свои ремёсла, что сильно ускорило прогресс и дало начало новому веку.
 «Век 19, железный, Воистину жестокий век! Тобою в мрак ночной, беззвездный Беспечный брошен человек!» (А. Блок)
«Век 19, железный, Воистину жестокий век! Тобою в мрак ночной, беззвездный Беспечный брошен человек!» (А. Блок)
 Физические свойства Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0 С Температура кипения около 2800 0 С При температуре ниже 770 0 С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается» .
Физические свойства Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0 С Температура кипения около 2800 0 С При температуре ниже 770 0 С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается» .
 Метеориты, украшения, монеты из железа
Метеориты, украшения, монеты из железа
 Памятник железу – Эйфелева башня
Памятник железу – Эйфелева башня
 Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина крови, соединения железа применяют для лечения малокровия, истощении, упадке сил. Основным источником железа для человека является пища. Его много в зеленых овощах, мясе, сухофруктах, шоколаде.
Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина крови, соединения железа применяют для лечения малокровия, истощении, упадке сил. Основным источником железа для человека является пища. Его много в зеленых овощах, мясе, сухофруктах, шоколаде.
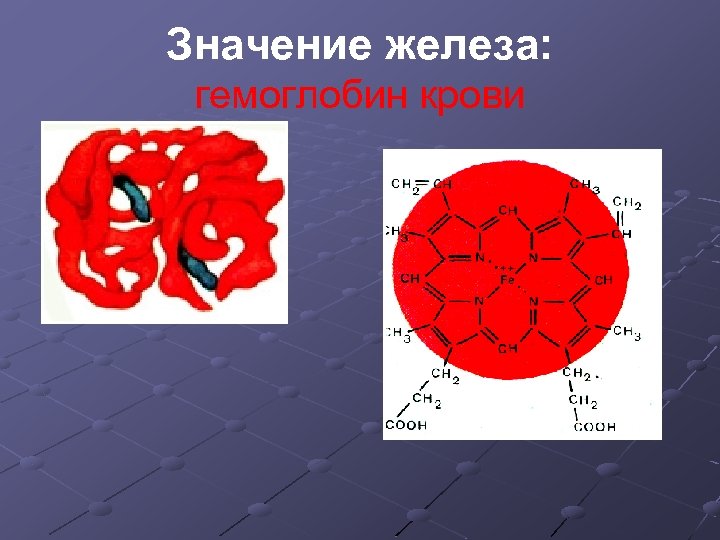 Значение железа: гемоглобин крови
Значение железа: гемоглобин крови
 Какой металл самый-самый? Самый легкий металл – Li (ρ =0, 53 г/см 3). Самый тяжелый металл – Os (ρ=22, 5 г/см 3). Самый легкоплавкий металл – Hg (tпл = – 38, 87 °С). Самый тугоплавкий металл – W (tпл = 3410 °С). Самый мягкий металл – Cs. Самый твердый металл – Cr.
Какой металл самый-самый? Самый легкий металл – Li (ρ =0, 53 г/см 3). Самый тяжелый металл – Os (ρ=22, 5 г/см 3). Самый легкоплавкий металл – Hg (tпл = – 38, 87 °С). Самый тугоплавкий металл – W (tпл = 3410 °С). Самый мягкий металл – Cs. Самый твердый металл – Cr.
 Проверь свои знания Вопрос № 1 Какому металлу соответствует строение атома 2 е, 8 е, 2 е 1) Na 2) Mg 3) Li
Проверь свои знания Вопрос № 1 Какому металлу соответствует строение атома 2 е, 8 е, 2 е 1) Na 2) Mg 3) Li
 Вопрос № 2 Пластичность металлов обусловлена: 1) Смещением слоев в кристалле относительно друга. 2) Жидким агрегатным состоянием; 3) Не большим атомным радиусом
Вопрос № 2 Пластичность металлов обусловлена: 1) Смещением слоев в кристалле относительно друга. 2) Жидким агрегатным состоянием; 3) Не большим атомным радиусом
 Вопрос № 3 Какие частицы находятся в узлах металлической кристаллической решетки 1) Электроны; 2) Атомы; 3) Атомы и ион - металлы
Вопрос № 3 Какие частицы находятся в узлах металлической кристаллической решетки 1) Электроны; 2) Атомы; 3) Атомы и ион - металлы
 Вопрос № 4 На внешнем энергетическом уровне металлов находится; 1) 3 -5 электронов; 2) 1 -3 электрона; 3) 2 -4 электрона
Вопрос № 4 На внешнем энергетическом уровне металлов находится; 1) 3 -5 электронов; 2) 1 -3 электрона; 3) 2 -4 электрона
 Вопрос № 5 Атомам металлов характерна: 1) Восстановительная способность (отдавать внешние электроны); 2) Окислительная способность (принимать внешние электроны); 3) В реакциях инертны
Вопрос № 5 Атомам металлов характерна: 1) Восстановительная способность (отдавать внешние электроны); 2) Окислительная способность (принимать внешние электроны); 3) В реакциях инертны
 КЛЮЧ К ТЕСТУ 1 -2 2 -1 3 -3 4 -2 5 -1
КЛЮЧ К ТЕСТУ 1 -2 2 -1 3 -3 4 -2 5 -1
 Рефлексия Я узнал (а) много нового. Мне это пригодится в жизни. На уроке было над чем, подумать. На все возникшие у меня в ходе урока вопросы я получил (а) ответы. На уроке я поработал (а) добросовестно и цели урока достиг(ла).
Рефлексия Я узнал (а) много нового. Мне это пригодится в жизни. На уроке было над чем, подумать. На все возникшие у меня в ходе урока вопросы я получил (а) ответы. На уроке я поработал (а) добросовестно и цели урока достиг(ла).
 Домашнее задание: Параграф 5, 6 составить ребусы или загадки про металлы, сообщения про сплавы меди и железа, составить презентацию по теме «Сплавы»
Домашнее задание: Параграф 5, 6 составить ребусы или загадки про металлы, сообщения про сплавы меди и железа, составить презентацию по теме «Сплавы»
 Спасибо за работу!
Спасибо за работу!


