Презентация на тему: Ритуксимаб — современная терапия неходжкинских





























rituksimab.pptx
- Размер: 6.2 Мб
- Автор:
- Количество слайдов: 33
Описание презентации Презентация на тему: Ритуксимаб — современная терапия неходжкинских по слайдам
 Презентация на тему: Ритуксимаб — современная терапия неходжкинских лимфом. Выполнила студентка 9 группы 5 курса лечебного факультета Виноградова Р. С.
Презентация на тему: Ритуксимаб — современная терапия неходжкинских лимфом. Выполнила студентка 9 группы 5 курса лечебного факультета Виноградова Р. С.
 Содержание презентации: 1. Введение 2. История создания препарата 3. Торговое описание препарата 4. Физико-химическая характеристика препарата 5. Характеристика CD 20 -АГ 6. Фармакология 7. Показания к применению 8. Противопоказания к применению 9. Побочное действие препарата 10. Правила приготовления и хранения раствора 11. Стандартный режим дозирования
Содержание презентации: 1. Введение 2. История создания препарата 3. Торговое описание препарата 4. Физико-химическая характеристика препарата 5. Характеристика CD 20 -АГ 6. Фармакология 7. Показания к применению 8. Противопоказания к применению 9. Побочное действие препарата 10. Правила приготовления и хранения раствора 11. Стандартный режим дозирования
 Неходжкинские лимфомы (НХЛ) — это злокачественные опухоли лимфоидной ткани, которые объединяют целый ряд хронических лимфопролиферативных заболеваний, отличающихся между собой по степени злокачественности, характеру, объему поражения, особенностям клинического течения и характеризуются клональной пролиферацией В- или Т-лимфоцитов. За последние 40 лет подходы к лечению НХЛ значительно изменились: от назначения лучевой терапии (60– 80 -е годы прошлого века) и монохимиотерапии алкилирующими цитостатическими препаратами (хлорамбуцил, циклофосфамид) к назначению курсов полихимиотерапии (ПХТ) по схемам CHOP, CVP, СНОЕР и прочих и высокодозовой химиотерапии (ВДХТ) с трансплантацией костного мозга (ТКМ). При проведении рандомизированных исследований было доказано, что использование современных протоколов лечения больных с НХЛ позволяет увеличить уровень общих ответов на терапию, общую выживаемость больных, длительность ремиссии и уменьшить вероятность возникновения рецидива.
Неходжкинские лимфомы (НХЛ) — это злокачественные опухоли лимфоидной ткани, которые объединяют целый ряд хронических лимфопролиферативных заболеваний, отличающихся между собой по степени злокачественности, характеру, объему поражения, особенностям клинического течения и характеризуются клональной пролиферацией В- или Т-лимфоцитов. За последние 40 лет подходы к лечению НХЛ значительно изменились: от назначения лучевой терапии (60– 80 -е годы прошлого века) и монохимиотерапии алкилирующими цитостатическими препаратами (хлорамбуцил, циклофосфамид) к назначению курсов полихимиотерапии (ПХТ) по схемам CHOP, CVP, СНОЕР и прочих и высокодозовой химиотерапии (ВДХТ) с трансплантацией костного мозга (ТКМ). При проведении рандомизированных исследований было доказано, что использование современных протоколов лечения больных с НХЛ позволяет увеличить уровень общих ответов на терапию, общую выживаемость больных, длительность ремиссии и уменьшить вероятность возникновения рецидива.
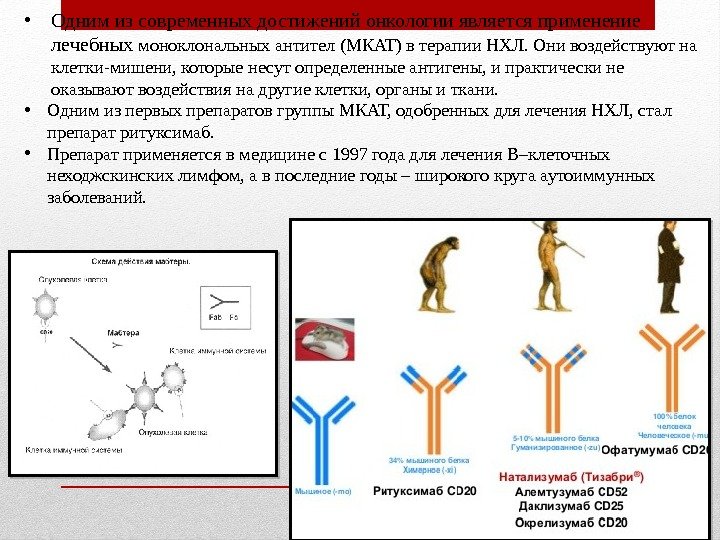
 • Одним из современных достижений онкологии является применение лечебных моноклональных антител (МКАТ) в терапии НХЛ. Они воздействуют на клетки-мишени, которые несут определенные антигены, и практически не оказывают воздействия на другие клетки, органы и ткани. • Одним из первых препаратов группы МКАТ, одобренных для лечения НХЛ, стал препарат ритуксимаб. • Препарат применяется в медицине с 1997 года для лечения В–клеточных неходжскинских лимфом, а в последние годы – широкого круга аутоиммунных заболеваний.
• Одним из современных достижений онкологии является применение лечебных моноклональных антител (МКАТ) в терапии НХЛ. Они воздействуют на клетки-мишени, которые несут определенные антигены, и практически не оказывают воздействия на другие клетки, органы и ткани. • Одним из первых препаратов группы МКАТ, одобренных для лечения НХЛ, стал препарат ритуксимаб. • Препарат применяется в медицине с 1997 года для лечения В–клеточных неходжскинских лимфом, а в последние годы – широкого круга аутоиммунных заболеваний.
 • Ритуксимаб был разработан IDEC Pharmaceuticals под названием IDEC-С 2 В 8. • Патент США был выдан в 1998 году. На основе клинических испытаний по безопасности и эффективности препарата, в 1997 году Ритуксимаб был одобрен FDA США для лечения В-клеточной неходжкинской лимфомы, устойчивой к другим режимам химиотерапии. • Ритуксимаб в сочетании с химиотерапией CHOP (циклофосфамид, гидроксидаунорубицин, онковин, винкристин, преднизолон), превосходит CHOP в лечении диффузной лимфомы В-клеток и многих других В-клеточных лимфом. • В 2010 году препарат был одобрен Европейской Комиссией для поддерживающего лечения после первоначального лечения фолликулярной лимфомы. • Ритуксимаб в настоящее время совместно выпускается на рынок компаниями Biogen Idec и Genentech в США, Hoffmann-La Roche в Канаде и Европейском союзе, Chugai Pharmaceuticals, Zenyaku Kogyo в Японии и Aryo. Gen в Иране. История создания препарата
• Ритуксимаб был разработан IDEC Pharmaceuticals под названием IDEC-С 2 В 8. • Патент США был выдан в 1998 году. На основе клинических испытаний по безопасности и эффективности препарата, в 1997 году Ритуксимаб был одобрен FDA США для лечения В-клеточной неходжкинской лимфомы, устойчивой к другим режимам химиотерапии. • Ритуксимаб в сочетании с химиотерапией CHOP (циклофосфамид, гидроксидаунорубицин, онковин, винкристин, преднизолон), превосходит CHOP в лечении диффузной лимфомы В-клеток и многих других В-клеточных лимфом. • В 2010 году препарат был одобрен Европейской Комиссией для поддерживающего лечения после первоначального лечения фолликулярной лимфомы. • Ритуксимаб в настоящее время совместно выпускается на рынок компаниями Biogen Idec и Genentech в США, Hoffmann-La Roche в Канаде и Европейском союзе, Chugai Pharmaceuticals, Zenyaku Kogyo в Японии и Aryo. Gen в Иране. История создания препарата

 Ритуксимаб (торговые названия Ритуксан, Мабтера и Zytux) представляет собой химерное моноклональное антитело против белка CD 20, который располагается на поверхности В-клеток иммунной системы (малигнизированных и нормальных). Ритуксимаб разрушает В-клетки и поэтому используется для лечения заболеваний, которые характеризуются избыточным количеством В-клеток, гиперактивных В-клеток, или дисфункциональных В-клеток, в том числе лимфомы, лейкозы, отторжения трансплантата и аутоиммунные расстройства. Ритуксимаб-Rituximabum (род. Rituximabi) • Фармакологическая группа: Противоопухолевый иммуномодулирующий препарат. Моноклональные антитела
Ритуксимаб (торговые названия Ритуксан, Мабтера и Zytux) представляет собой химерное моноклональное антитело против белка CD 20, который располагается на поверхности В-клеток иммунной системы (малигнизированных и нормальных). Ритуксимаб разрушает В-клетки и поэтому используется для лечения заболеваний, которые характеризуются избыточным количеством В-клеток, гиперактивных В-клеток, или дисфункциональных В-клеток, в том числе лимфомы, лейкозы, отторжения трансплантата и аутоиммунные расстройства. Ритуксимаб-Rituximabum (род. Rituximabi) • Фармакологическая группа: Противоопухолевый иммуномодулирующий препарат. Моноклональные антитела
 • Прозрачная или слегка опалесцирующая, бесцветная или светло-желтого цвета жидкость. • Применение: внутривенное вливание, подкожное введение (с 2014 г. ) • Биодоступность 100% (внутривенно) • Период полураспада: от 30 до 400 часов (в зависимости от дозы и продолжительности лечения) • Экскреция: неопределенная: может пройти фагоцитоз и катаболизм в ретикулоэндотелиальной системе. Торговое описание препарата
• Прозрачная или слегка опалесцирующая, бесцветная или светло-желтого цвета жидкость. • Применение: внутривенное вливание, подкожное введение (с 2014 г. ) • Биодоступность 100% (внутривенно) • Период полураспада: от 30 до 400 часов (в зависимости от дозы и продолжительности лечения) • Экскреция: неопределенная: может пройти фагоцитоз и катаболизм в ретикулоэндотелиальной системе. Торговое описание препарата
 • Химерные антитела вырабатываются культурой суспензии клеток млекопитающих (яичниками китайского хомяка) и очищаются с помощью аффинной хроматографии и ионообмена с применением особых процедур инактивации и удаления вирусов. • По структуре ритуксимаб относится к иммуноглобулинам класса G 1 (Ig. G 1 каппа), его молекула содержит мышиные вариабельные фрагменты легких и тяжелых цепей и человеческий постоянный сегмент. • Ритуксимаб состоит из 2 тяжелых цепей из 451 аминокислот и 2 легких цепей из 213 аминокислот и имеет молекулярную массу примерно 145 к. Д. • Ритуксимаб имеет специфичность к CD 20 антигену. Аффинность ритуксимаба к CD 20 антигену примерно 8 н. М. • Физико-химическая характеристика препарата
• Химерные антитела вырабатываются культурой суспензии клеток млекопитающих (яичниками китайского хомяка) и очищаются с помощью аффинной хроматографии и ионообмена с применением особых процедур инактивации и удаления вирусов. • По структуре ритуксимаб относится к иммуноглобулинам класса G 1 (Ig. G 1 каппа), его молекула содержит мышиные вариабельные фрагменты легких и тяжелых цепей и человеческий постоянный сегмент. • Ритуксимаб состоит из 2 тяжелых цепей из 451 аминокислот и 2 легких цепей из 213 аминокислот и имеет молекулярную массу примерно 145 к. Д. • Ритуксимаб имеет специфичность к CD 20 антигену. Аффинность ритуксимаба к CD 20 антигену примерно 8 н. М. • Физико-химическая характеристика препарата
 CD 20 — поверхностный антиген, который экспрессируется более чем на 90% лимфоцитов, не исчезает и не трансформируется на неопластических клетках. • Этот антиген является негликозилированным мембранным белком В-лимфоцитов с молекулярной массой 35 к. Да, участвующим во внутриклеточной передаче сигнала, дифференцировании В-лимфоцитов и мобилизации кальциевых каналов. • Этот антиген появляется как ранний маркер дифференцирования В-клеточной линии и экспрессируется с разной антигенной плотностью как на нормальных, так и на злокачественных популяциях В-лимфоцитов. • Антитела против CD 20 -антигена были получены для применения как в исследовательской работе, так и в практике терапии В-клеточных лимфом. Характеристика CD 20 -АГ
CD 20 — поверхностный антиген, который экспрессируется более чем на 90% лимфоцитов, не исчезает и не трансформируется на неопластических клетках. • Этот антиген является негликозилированным мембранным белком В-лимфоцитов с молекулярной массой 35 к. Да, участвующим во внутриклеточной передаче сигнала, дифференцировании В-лимфоцитов и мобилизации кальциевых каналов. • Этот антиген появляется как ранний маркер дифференцирования В-клеточной линии и экспрессируется с разной антигенной плотностью как на нормальных, так и на злокачественных популяциях В-лимфоцитов. • Антитела против CD 20 -антигена были получены для применения как в исследовательской работе, так и в практике терапии В-клеточных лимфом. Характеристика CD 20 -АГ
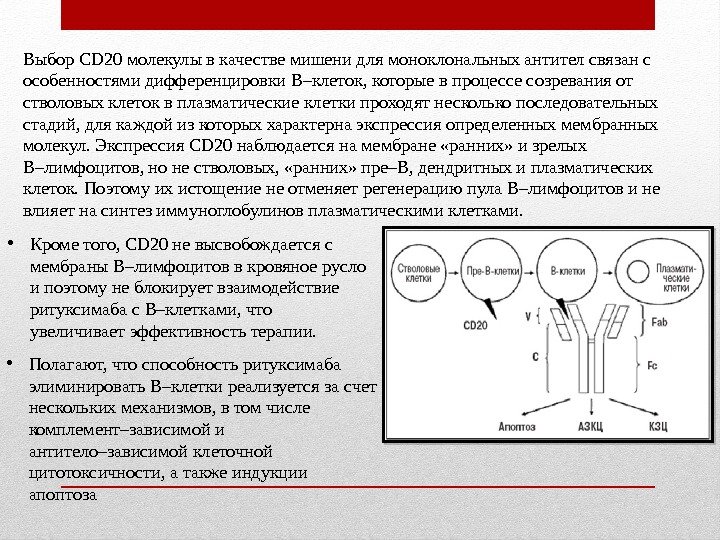
 Выбор CD 20 молекулы в качестве мишени для моноклональных антител связан с особенностями дифференцировки В–клеток, которые в процессе созревания от стволовых клеток в плазматические клетки проходят несколько последовательных стадий, для каждой из которых характерна экспрессия определенных мембранных молекул. Экспрессия CD 20 наблюдается на мембране «ранних» и зрелых В–лимфоцитов, но не стволовых, «ранних» пре–В, дендритных и плазматических клеток. Поэтому их истощение не отменяет регенерацию пула В–лимфоцитов и не влияет на синтез иммуноглобулинов плазматическими клетками. • Кроме того, CD 20 не высвобождается с мембраны В–лимфоцитов в кровяное русло и поэтому не блокирует взаимодействие ритуксимаба с В–клетками, что увеличивает эффективность терапии. • Полагают, что способность ритуксимаба элиминировать В–клетки реализуется за счет нескольких механизмов, в том числе комплемент–зависимой и антитело–зависимой клеточной цитотоксичности, а также индукции апоптоза
Выбор CD 20 молекулы в качестве мишени для моноклональных антител связан с особенностями дифференцировки В–клеток, которые в процессе созревания от стволовых клеток в плазматические клетки проходят несколько последовательных стадий, для каждой из которых характерна экспрессия определенных мембранных молекул. Экспрессия CD 20 наблюдается на мембране «ранних» и зрелых В–лимфоцитов, но не стволовых, «ранних» пре–В, дендритных и плазматических клеток. Поэтому их истощение не отменяет регенерацию пула В–лимфоцитов и не влияет на синтез иммуноглобулинов плазматическими клетками. • Кроме того, CD 20 не высвобождается с мембраны В–лимфоцитов в кровяное русло и поэтому не блокирует взаимодействие ритуксимаба с В–клетками, что увеличивает эффективность терапии. • Полагают, что способность ритуксимаба элиминировать В–клетки реализуется за счет нескольких механизмов, в том числе комплемент–зависимой и антитело–зависимой клеточной цитотоксичности, а также индукции апоптоза
 Фармакология (фармакологическое действие – противоопухолевое). • Fab-фрагмент ритуксимаба связывается с CD 20 -антигеном на лимфоцитах. • CD 20 широко экспрессируется на В-клетках, начиная от ранних пре-В клеток до поздних в дифференцировке, но отсутствует на окончательно дифференцированных плазматических клетках. • Ритуксимаб имеет тенденцию присоединяться к одной стороне раковых В-клеток, образуя колпачок и вытягивая белки на эту сторону. Наличие колпачка изменяет эффективность естественных клеток-киллеров в уничтожении этих больных клеток. Когда естественные клетки-киллеры присоединяются к колпачку, существует 80% шанс убить клетку. В противоположность этому, если у В-клетки нет этого асимметричного кластера белка, она погибает только в 40% случаев. Были обнаружены следующие эффекты: 1. Fc часть ритуксимаба опосредует антителозависимую клеточную цитотоксичность (опосредованную одним или более Fc рецепторами на поверхности гранулоцитов, макрофагов и НК-клеток. ) и комплементзависимую цитотоксичность (вследствие C 1 q-связывания) 2. Ритуксимаб оказывает общее регуляторное воздействие на клеточный цикл. 3. Он увеличивает комплекс гистосовместимости II и молекулы адгезии LFA-1 и LFA-3 (лимфоцитарный функциональный антиген). 4. Вызывает выделение CD 23. 5. Подавляет рецептор В-клеток. 6. Индуцирует апоптоз клеток CD 20+.
Фармакология (фармакологическое действие – противоопухолевое). • Fab-фрагмент ритуксимаба связывается с CD 20 -антигеном на лимфоцитах. • CD 20 широко экспрессируется на В-клетках, начиная от ранних пре-В клеток до поздних в дифференцировке, но отсутствует на окончательно дифференцированных плазматических клетках. • Ритуксимаб имеет тенденцию присоединяться к одной стороне раковых В-клеток, образуя колпачок и вытягивая белки на эту сторону. Наличие колпачка изменяет эффективность естественных клеток-киллеров в уничтожении этих больных клеток. Когда естественные клетки-киллеры присоединяются к колпачку, существует 80% шанс убить клетку. В противоположность этому, если у В-клетки нет этого асимметричного кластера белка, она погибает только в 40% случаев. Были обнаружены следующие эффекты: 1. Fc часть ритуксимаба опосредует антителозависимую клеточную цитотоксичность (опосредованную одним или более Fc рецепторами на поверхности гранулоцитов, макрофагов и НК-клеток. ) и комплементзависимую цитотоксичность (вследствие C 1 q-связывания) 2. Ритуксимаб оказывает общее регуляторное воздействие на клеточный цикл. 3. Он увеличивает комплекс гистосовместимости II и молекулы адгезии LFA-1 и LFA-3 (лимфоцитарный функциональный антиген). 4. Вызывает выделение CD 23. 5. Подавляет рецептор В-клеток. 6. Индуцирует апоптоз клеток CD 20+.
 • Ритуксимаб связывается с лимфоидными клетками тимуса, белой пульпы селезенки и большинством В-лимфоцитов периферической крови и лимфатических узлов. • Медиана числа B-клеток в периферической крови после первого введения ритуксимаба снижается до уровня ниже нормы, а через 6– 9 мес начинает восстанавливаться, возвращаясь к норме к 12 мес после завершения терапии.
• Ритуксимаб связывается с лимфоидными клетками тимуса, белой пульпы селезенки и большинством В-лимфоцитов периферической крови и лимфатических узлов. • Медиана числа B-клеток в периферической крови после первого введения ритуксимаба снижается до уровня ниже нормы, а через 6– 9 мес начинает восстанавливаться, возвращаясь к норме к 12 мес после завершения терапии.
 1. Неходжкинская лимфома: — рецидивирующая или химиоустойчивая В-клеточная, CD 20 -положительная неходжкинская лимфома низкой степени злокачественности или фолликулярная; — фолликулярная лимфома III-IV стадии в комбинации с химиотерапией у ранее нелеченных пациентов; — фолликулярная лимфома в качестве поддерживающей терапии после ответа на индукционную терапию; — CD 20 -положительная диффузная В-крупноклеточная неходжкинская лимфома в комбинации с химиотерапией по схеме CHOP. 2. Хронический лимфолейкоз: — хронический лимфолейкоз в комбинации с химиотерапией у пациентов, ранее не получавших стандартную терапию; — рецидивирующий или химиоустойчивый хронический лимфолейкоз в комбинации с химиотерапией. Показания к применению препарата
1. Неходжкинская лимфома: — рецидивирующая или химиоустойчивая В-клеточная, CD 20 -положительная неходжкинская лимфома низкой степени злокачественности или фолликулярная; — фолликулярная лимфома III-IV стадии в комбинации с химиотерапией у ранее нелеченных пациентов; — фолликулярная лимфома в качестве поддерживающей терапии после ответа на индукционную терапию; — CD 20 -положительная диффузная В-крупноклеточная неходжкинская лимфома в комбинации с химиотерапией по схеме CHOP. 2. Хронический лимфолейкоз: — хронический лимфолейкоз в комбинации с химиотерапией у пациентов, ранее не получавших стандартную терапию; — рецидивирующий или химиоустойчивый хронический лимфолейкоз в комбинации с химиотерапией. Показания к применению препарата
 3. Ревматоидный артрит: — среднетяжелый и тяжелый ревматоидный артрит (активная форма) у взрослых в комбинации с метотрексатом при непереносимости или неадекватном ответе на текущие режимы терапии, включающие один или более ингибиторов ФНОα, в т. ч. для торможения рентгенологически доказанной деструкции суставов. 4. Гранулематоз с полиангиитом (гранулематоз Вегенера) и микроскопический полиангиит — тяжелые формы активного гранулематоза с полиангиитом (гранулематоза Вегенера) и микроскопического полиангиита в комбинации с ГКС. Число В-клеток в периферической крови после первого введения препарата снижается ниже нормы и начинает восстанавливаться у пациентов с гематологическими злокачественными заболеваниями через 6 месяцев, достигая нормальных значений через 9 -12 месяцев после завершения терапии.
3. Ревматоидный артрит: — среднетяжелый и тяжелый ревматоидный артрит (активная форма) у взрослых в комбинации с метотрексатом при непереносимости или неадекватном ответе на текущие режимы терапии, включающие один или более ингибиторов ФНОα, в т. ч. для торможения рентгенологически доказанной деструкции суставов. 4. Гранулематоз с полиангиитом (гранулематоз Вегенера) и микроскопический полиангиит — тяжелые формы активного гранулематоза с полиангиитом (гранулематоза Вегенера) и микроскопического полиангиита в комбинации с ГКС. Число В-клеток в периферической крови после первого введения препарата снижается ниже нормы и начинает восстанавливаться у пациентов с гематологическими злокачественными заболеваниями через 6 месяцев, достигая нормальных значений через 9 -12 месяцев после завершения терапии.
 Побочные действия препарата Фатальные инфузионные реакции. Имеются сообщения о летальных исходах в течение 24 ч после инфузии ритуксимаба. Эти летальные случаи были следствием развития комплекса инфузионных реакций, включая гипоксию, инфильтрацию легких, острый респираторный дистресс-синдром, инфаркт миокарда, фибрилляцию желудочков или кардиогенный шок. Примерно 80% фатальных инфузионных реакций наблюдались в течение первой инфузии Инфузионные реакции. У большинства в ходе первой инфузии в пределах 30– 120 мин. , исчезают после замедления или прерывания введения препарата и проведения поддерживающих мероприятий в т. ч. в/в введений физиологического раствора, дифенгидрамина и парацетамола: лихорадка и озноб/дрожь, тошнота, зуд, ангионевротический отек, астения, гипотензия, головная боль, бронхоспазм, раздражение в горле, ринит, крапивница, сыпь, рвота, миалгия, головокружение, гипертензия. Инфекционные осложнения. Истощению пула B-клеток и уменьшению уровней иммуноглобулинов в сыворотке.
Побочные действия препарата Фатальные инфузионные реакции. Имеются сообщения о летальных исходах в течение 24 ч после инфузии ритуксимаба. Эти летальные случаи были следствием развития комплекса инфузионных реакций, включая гипоксию, инфильтрацию легких, острый респираторный дистресс-синдром, инфаркт миокарда, фибрилляцию желудочков или кардиогенный шок. Примерно 80% фатальных инфузионных реакций наблюдались в течение первой инфузии Инфузионные реакции. У большинства в ходе первой инфузии в пределах 30– 120 мин. , исчезают после замедления или прерывания введения препарата и проведения поддерживающих мероприятий в т. ч. в/в введений физиологического раствора, дифенгидрамина и парацетамола: лихорадка и озноб/дрожь, тошнота, зуд, ангионевротический отек, астения, гипотензия, головная боль, бронхоспазм, раздражение в горле, ринит, крапивница, сыпь, рвота, миалгия, головокружение, гипертензия. Инфекционные осложнения. Истощению пула B-клеток и уменьшению уровней иммуноглобулинов в сыворотке.
 Реакции со стороны слизистых оболочек и кожи. Эти реакции включают паранеопластическую, синдром Стивенса-Джонсона, лихеноидный дерматит, везикулезно-буллезный дерматит, токсический эпидермальный некролиз. Начало проявления этих реакций в отмеченных случаях варьировало от 1 до 13 нед после введения ритуксимаба. Осложнения со стороны почек. Введение ритуксимаба иногда сопровождалось тяжелой почечной токсичностью, включая ОПН. Частота развития почечной токсичности была выше у больных с большим числом циркулирующих злокачественных лимфоцитов и при высокой опухолевой нагрузке, а также у пациентов, которым при проведении клинических испытаний одновременно назначали цисплатин. Синдром лизиса опухоли. Ритуксимаб вызывает быстрый лизис доброкачественных и злокачественных CD 20 -положительных клеток. Описано появление симптомов, характерных для синдрома лизиса опухоли (острая почечная недостаточность, гиперкалиемия, гипокальциемия, гиперурикемия, гиперфосфатемия), в течение 12– 24 ч после первой инфузии ритуксимаба.
Реакции со стороны слизистых оболочек и кожи. Эти реакции включают паранеопластическую, синдром Стивенса-Джонсона, лихеноидный дерматит, везикулезно-буллезный дерматит, токсический эпидермальный некролиз. Начало проявления этих реакций в отмеченных случаях варьировало от 1 до 13 нед после введения ритуксимаба. Осложнения со стороны почек. Введение ритуксимаба иногда сопровождалось тяжелой почечной токсичностью, включая ОПН. Частота развития почечной токсичности была выше у больных с большим числом циркулирующих злокачественных лимфоцитов и при высокой опухолевой нагрузке, а также у пациентов, которым при проведении клинических испытаний одновременно назначали цисплатин. Синдром лизиса опухоли. Ритуксимаб вызывает быстрый лизис доброкачественных и злокачественных CD 20 -положительных клеток. Описано появление симптомов, характерных для синдрома лизиса опухоли (острая почечная недостаточность, гиперкалиемия, гипокальциемия, гиперурикемия, гиперфосфатемия), в течение 12– 24 ч после первой инфузии ритуксимаба.
 Сердечно-сосудистые нежелательные явления. Сердечно-сосудистые реакции 3 -й и 4 -й степени тяжести включают гипотензию. Описаны редкие, фатальные случаи сердечной недостаточности с развитием симптоматики спустя недели после начала лечения ритуксимабом. Легочная симптоматика. Усиление кашля, ринит, бронхоспазм, диспноэ, синусит. Реактивация гепатита В. Сообщалось о реактивации вируса гепатита В с развитием фульминантного гепатита, печеночной недостаточности и смерти у нескольких пациентов с гематологической злокачественностью, получавших терапию ритуксимабом. Иммунные/аутоиммунные нежелательные реакции. Сообщалось о таких реакциях, как увеит, зрительный неврит у пациентов с системным васкулитом, плеврит у пациентов с волчаночноподобным синдромом, сывороточная болезнь с полиартикулярным артритом и васкулит с сыпью. Менее общие наблюдавшиеся побочные эффекты (1 -5 %). Ажитация, анорексия, артрит, конъюнктивит, депрессия, диспепсия, эдема, гиперкинезия, гипертензия, гипестезия, гипогликемия, боль в месте инъекции, инсомния, нарушение слезоотделения, недомогание, раздражительность, неврит, нейропатия, парестезия, сонливость, вертиго, понижение массы тела.
Сердечно-сосудистые нежелательные явления. Сердечно-сосудистые реакции 3 -й и 4 -й степени тяжести включают гипотензию. Описаны редкие, фатальные случаи сердечной недостаточности с развитием симптоматики спустя недели после начала лечения ритуксимабом. Легочная симптоматика. Усиление кашля, ринит, бронхоспазм, диспноэ, синусит. Реактивация гепатита В. Сообщалось о реактивации вируса гепатита В с развитием фульминантного гепатита, печеночной недостаточности и смерти у нескольких пациентов с гематологической злокачественностью, получавших терапию ритуксимабом. Иммунные/аутоиммунные нежелательные реакции. Сообщалось о таких реакциях, как увеит, зрительный неврит у пациентов с системным васкулитом, плеврит у пациентов с волчаночноподобным синдромом, сывороточная болезнь с полиартикулярным артритом и васкулит с сыпью. Менее общие наблюдавшиеся побочные эффекты (1 -5 %). Ажитация, анорексия, артрит, конъюнктивит, депрессия, диспепсия, эдема, гиперкинезия, гипертензия, гипестезия, гипогликемия, боль в месте инъекции, инсомния, нарушение слезоотделения, недомогание, раздражительность, неврит, нейропатия, парестезия, сонливость, вертиго, понижение массы тела.
 1. гиперчувствительность к ритуксимабу, любому компоненту препарата или белкам мыши; 2. острые инфекционные заболевания; 3. выраженный первичный или вторичный иммунодефицит; 4. тяжелая сердечная недостаточность (IV класс по классификации NYHA) при ревматоидном артрите; 5. детский и подростковый возраст до 18 лет (эффективность и безопасность не установлены); 6. беременность; 7. период грудного вскармливания; Противопоказания к применению препарата Ограничения к применению: Высокая опухолевая нагрузка (размеры очагов более 10 см), опухолевая инфильтрация легких, легочная недостаточность в анамнезе, сердечно-сосудистые заболевания (стенокардия, аритмия), нейтропения (менее 1500 клеток/мкл), тромбоцитопения (менее 75000 клеток/мкл), детский возраст (безопасность и эффективность применения у детей не установлены).
1. гиперчувствительность к ритуксимабу, любому компоненту препарата или белкам мыши; 2. острые инфекционные заболевания; 3. выраженный первичный или вторичный иммунодефицит; 4. тяжелая сердечная недостаточность (IV класс по классификации NYHA) при ревматоидном артрите; 5. детский и подростковый возраст до 18 лет (эффективность и безопасность не установлены); 6. беременность; 7. период грудного вскармливания; Противопоказания к применению препарата Ограничения к применению: Высокая опухолевая нагрузка (размеры очагов более 10 см), опухолевая инфильтрация легких, легочная недостаточность в анамнезе, сердечно-сосудистые заболевания (стенокардия, аритмия), нейтропения (менее 1500 клеток/мкл), тромбоцитопения (менее 75000 клеток/мкл), детский возраст (безопасность и эффективность применения у детей не установлены).
 • Необходимое количество препарата набирают в асептических условиях и разводят до расчетной концентрации (1 -4 мг/мл) в инфузионном флаконе (пакете) с 0. 9% раствором натрия хлорида для инфузий или 5% раствором декстрозы (растворы должны быть стерильными и апирогенными). • Т. к. препарат не содержит консервантов, приготовленный раствор необходимо использовать немедленно. • Приготовленный инфузионный раствор физически и химически стабилен в течение 12 ч при комнатной температуре или в течение не более 24 ч при температуре от 2° до 8°С. • Препарат вводят только в/в капельно, через отдельный катетер! Вводить препарат в/в струйно или болюсно нельзя! • Рекомендуемая начальная скорость первой инфузии 50 мг/ч, в дальнейшем ее можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч. • Последующие инфузии можно начинать со скорости 100 мг/ч и увеличивать ее на 100 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. • Коррекция дозы в ходе терапии • Снижать дозу ритуксимаба не рекомендуется. Если препарат вводится в комбинации с химиотерапией, снижение дозы химиотерапевтических препаратов проводят в соответствии со стандартными рекомендациями. Правила приготовления и хранения раствора
• Необходимое количество препарата набирают в асептических условиях и разводят до расчетной концентрации (1 -4 мг/мл) в инфузионном флаконе (пакете) с 0. 9% раствором натрия хлорида для инфузий или 5% раствором декстрозы (растворы должны быть стерильными и апирогенными). • Т. к. препарат не содержит консервантов, приготовленный раствор необходимо использовать немедленно. • Приготовленный инфузионный раствор физически и химически стабилен в течение 12 ч при комнатной температуре или в течение не более 24 ч при температуре от 2° до 8°С. • Препарат вводят только в/в капельно, через отдельный катетер! Вводить препарат в/в струйно или болюсно нельзя! • Рекомендуемая начальная скорость первой инфузии 50 мг/ч, в дальнейшем ее можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч. • Последующие инфузии можно начинать со скорости 100 мг/ч и увеличивать ее на 100 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. • Коррекция дозы в ходе терапии • Снижать дозу ритуксимаба не рекомендуется. Если препарат вводится в комбинации с химиотерапией, снижение дозы химиотерапевтических препаратов проводят в соответствии со стандартными рекомендациями. Правила приготовления и хранения раствора
 • Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол; антигистаминный препарат, например, дифенгидрамин). • Если Мабтера применяется не в комбинации с химиотерапией, содержащей ГКС, то в состав премедикации также входят ГКС. Первоначальная терапия: • Монотерапия взрослых больных: 375 мг/м 2 1 раз в неделю, в течение 4 недель. • В комбинации с химиотерапией по любой схеме: 375 мг/м 2 в первый день цикла химиотерапии после в/в введения ГКС в качестве компонента терапии, в течение: — 8 циклов (цикл: 21 день) при схеме R-CVP (ритуксимаб, циклофосфамид, винкристин, преднизолон); — 8 циклов (цикл: 28 дней) при схеме R-MCP (ритуксимаб, митоксантрон, хлорамбуцил, преднизолон); — 8 циклов (цикл: 21 день) при схеме R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин, преднизолон); в случае достижения полной ремиссии после 4 цикла возможно ограничиться 6 циклами; — 6 циклов (цикл: 21 день) при схеме R-CHVP-Interferon (ритуксимаб, циклофосфамид, доксорубицин, тенипозид, преднизолон+интерферон). Стандартный режим дозирования Неходжкинская лимфома низкой степени злокачественности или фолликулярная
• Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол; антигистаминный препарат, например, дифенгидрамин). • Если Мабтера применяется не в комбинации с химиотерапией, содержащей ГКС, то в состав премедикации также входят ГКС. Первоначальная терапия: • Монотерапия взрослых больных: 375 мг/м 2 1 раз в неделю, в течение 4 недель. • В комбинации с химиотерапией по любой схеме: 375 мг/м 2 в первый день цикла химиотерапии после в/в введения ГКС в качестве компонента терапии, в течение: — 8 циклов (цикл: 21 день) при схеме R-CVP (ритуксимаб, циклофосфамид, винкристин, преднизолон); — 8 циклов (цикл: 28 дней) при схеме R-MCP (ритуксимаб, митоксантрон, хлорамбуцил, преднизолон); — 8 циклов (цикл: 21 день) при схеме R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин, преднизолон); в случае достижения полной ремиссии после 4 цикла возможно ограничиться 6 циклами; — 6 циклов (цикл: 21 день) при схеме R-CHVP-Interferon (ритуксимаб, циклофосфамид, доксорубицин, тенипозид, преднизолон+интерферон). Стандартный режим дозирования Неходжкинская лимфома низкой степени злокачественности или фолликулярная
 Повторное применение в случае рецидива (у пациентов, ответивших на первый курс терапии): 375 мг/м 2 1 раз в неделю, в течение 4 недель. Поддерживающая терапия (после ответа на индукционную терапию): — у ранее нелеченных пациентов: 375 мг/м 2 1 раз в 2 месяца, не более 2 лет (12 инфузий). При появлении признаков прогрессирования заболевания терапию препаратом Мабтера следует прекратить; — при рецидивирующей или химиоустойчивой лимфоме: 375 мг/м 2 1 раз в 3 месяца, не более 2 лет. При появлении признаков прогрессирования заболевания терапию препаратом Мабтера следует прекратить.
Повторное применение в случае рецидива (у пациентов, ответивших на первый курс терапии): 375 мг/м 2 1 раз в неделю, в течение 4 недель. Поддерживающая терапия (после ответа на индукционную терапию): — у ранее нелеченных пациентов: 375 мг/м 2 1 раз в 2 месяца, не более 2 лет (12 инфузий). При появлении признаков прогрессирования заболевания терапию препаратом Мабтера следует прекратить; — при рецидивирующей или химиоустойчивой лимфоме: 375 мг/м 2 1 раз в 3 месяца, не более 2 лет. При появлении признаков прогрессирования заболевания терапию препаратом Мабтера следует прекратить.
 • Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол; антигистаминный препарат, например, дифенгидрамин). • Если Мабтера применяется не в комбинации с химиотерапией, содержащей ГКС, то в состав премедикации также входят ГКС. • В комбинации с химиотерапией по схеме CHOP: 375 мг/м 2 в первый день каждого цикла химиотерапии после в/в введения ГКС, 8 циклов. • Другие компоненты схемы CHOP (циклофосфамид, доксорубицин и винкристин) вводят после назначения препарата Мабтера. Диффузная В-крупноклеточная неходжкинская лимфома Стандартный режим дозирования
• Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол; антигистаминный препарат, например, дифенгидрамин). • Если Мабтера применяется не в комбинации с химиотерапией, содержащей ГКС, то в состав премедикации также входят ГКС. • В комбинации с химиотерапией по схеме CHOP: 375 мг/м 2 в первый день каждого цикла химиотерапии после в/в введения ГКС, 8 циклов. • Другие компоненты схемы CHOP (циклофосфамид, доксорубицин и винкристин) вводят после назначения препарата Мабтера. Диффузная В-крупноклеточная неходжкинская лимфома Стандартный режим дозирования
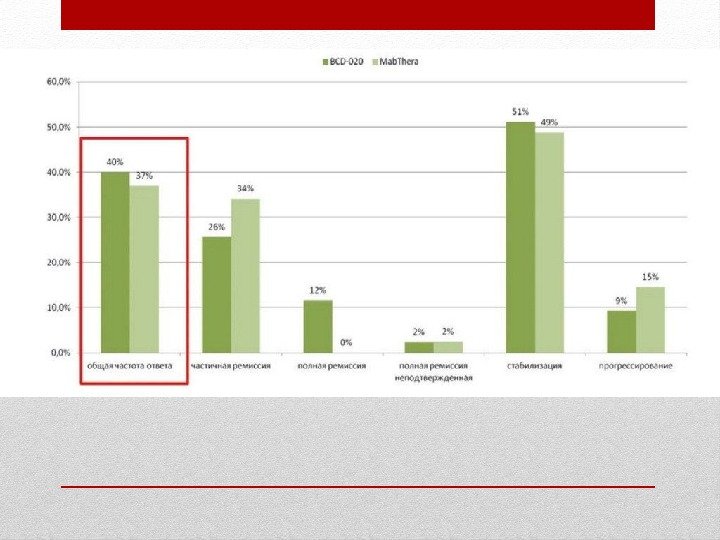
 В исследования были включены больные (N=296) c рецидивирующей или резистентной к терапии B-клеточной НХЛ низкой степени злокачественности. • Режимы дозирования были различными: больные получали ритуксимаб в дозе 375 мг/м 2 в виде в/в инфузий, проводимых с интервалом в одну неделю — 4 инфузии (N=166), либо 8 (N=37). • Клинически эти исследования также различались, как первоначальное лечение, первоначальное лечение при большой опухолевой массе, повторное лечение. Начальная терапия, 4 еженедельных введения. Суммарная частота ремиссии составила 48%, полной ремиссии — 6%, частичной ремиссии — 42%. Медиана времени до начала ответа на терапию была 50 дней и медиана времени до прогрессирования заболевания у больных, отвечающих на терапию, равнялась 11, 2 мес. Связанные с заболеванием признаки и симптомы (включая В-симптомы) присутствовали у 23% (39/166) пациентов в начале исследования и исчезали у 64% (25/39) из этих пациентов. Начальная терапия, 8 еженедельных введений. суммарная частота ремиссии составила 57%, полной ремиссии — 14%, частичной ремиссии — 43%, медиана времени до прогрессирования заболевания у больных, отвечающих на терапию — 13, 4 мес. Клинические исследования
В исследования были включены больные (N=296) c рецидивирующей или резистентной к терапии B-клеточной НХЛ низкой степени злокачественности. • Режимы дозирования были различными: больные получали ритуксимаб в дозе 375 мг/м 2 в виде в/в инфузий, проводимых с интервалом в одну неделю — 4 инфузии (N=166), либо 8 (N=37). • Клинически эти исследования также различались, как первоначальное лечение, первоначальное лечение при большой опухолевой массе, повторное лечение. Начальная терапия, 4 еженедельных введения. Суммарная частота ремиссии составила 48%, полной ремиссии — 6%, частичной ремиссии — 42%. Медиана времени до начала ответа на терапию была 50 дней и медиана времени до прогрессирования заболевания у больных, отвечающих на терапию, равнялась 11, 2 мес. Связанные с заболеванием признаки и симптомы (включая В-симптомы) присутствовали у 23% (39/166) пациентов в начале исследования и исчезали у 64% (25/39) из этих пациентов. Начальная терапия, 8 еженедельных введений. суммарная частота ремиссии составила 57%, полной ремиссии — 14%, частичной ремиссии — 43%, медиана времени до прогрессирования заболевания у больных, отвечающих на терапию — 13, 4 мес. Клинические исследования
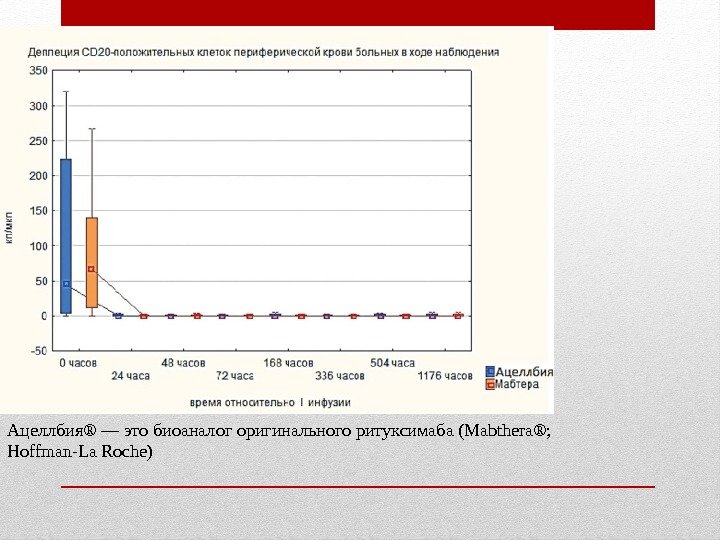
 Ацеллбия® — это биоаналог оригинального ритуксимаба (Mabthera®; Hoffman-La Roche)
Ацеллбия® — это биоаналог оригинального ритуксимаба (Mabthera®; Hoffman-La Roche)

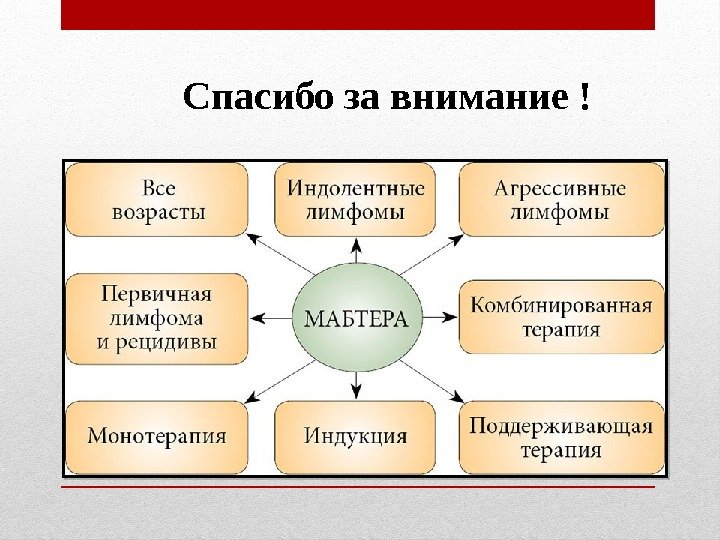
 Спасибо за внимание !
Спасибо за внимание !
 https: // druginfo. nlm. nih. gov/drugportal/name/Rituxim ab https: //toxnet. nlm. nih. gov / https: //www. ncbi. nlm. nih. gov / https: //www. pubmedhealth/
https: // druginfo. nlm. nih. gov/drugportal/name/Rituxim ab https: //toxnet. nlm. nih. gov / https: //www. ncbi. nlm. nih. gov / https: //www. pubmedhealth/
 Что делает Ритуксимаб? (пенсильвания) Это моноклональное антитело против молекулы CD 20, расположенной на мембране В-лимфоцитов. Ритуксимаб связывается с В-лимфоцитами и убивает их. Однако, при этом гибнут не только аутореактивные лимфоциты, но и хорошие тоже. И получается, что препарат подавляет в организме весь В-клеточный иммунитет. А как сделать так, чтобы вырубить только ауто-реактивные лимфоциты, а нормальные не трогать? До сих пор решения этой проблемы не было. Но скоро может появиться… chimericantigenreceptor Вкратце, суть метода в том, что исследователь берет цитотоксический Т-лимфоцит и заменяет его природный Т-клеточный рецептор на другую конструкцию, например так: то, что внутри Т-лимфоцита – будет от Т-клеточного рецептора, а то, что снаружи – от моноклонального антитела против определенной мишени. Что это дает? Это позволяет «натравить» Т-лимфоцит на нативный антиген (представленный без комплекса МНС), например, на рецептор В-лимфоцита специфичный против ауто-антигена. Антитело – это растворимая форма В-клеточного рецептора, расположенного на мембране В-клетки. Если ты помнишь – каждый зрелый В- и Т-лимфоцит имеет рецепторы и способен продуцировать антитела только против одной конкретной мишени. Например, против Dsg 3. Значит, чтобы победить болезнь – не нужно вырубать все В-лимфоциты, нужно убить только те, что несут на своей мембране В-клеточный рецептор против Dsg 3.
Что делает Ритуксимаб? (пенсильвания) Это моноклональное антитело против молекулы CD 20, расположенной на мембране В-лимфоцитов. Ритуксимаб связывается с В-лимфоцитами и убивает их. Однако, при этом гибнут не только аутореактивные лимфоциты, но и хорошие тоже. И получается, что препарат подавляет в организме весь В-клеточный иммунитет. А как сделать так, чтобы вырубить только ауто-реактивные лимфоциты, а нормальные не трогать? До сих пор решения этой проблемы не было. Но скоро может появиться… chimericantigenreceptor Вкратце, суть метода в том, что исследователь берет цитотоксический Т-лимфоцит и заменяет его природный Т-клеточный рецептор на другую конструкцию, например так: то, что внутри Т-лимфоцита – будет от Т-клеточного рецептора, а то, что снаружи – от моноклонального антитела против определенной мишени. Что это дает? Это позволяет «натравить» Т-лимфоцит на нативный антиген (представленный без комплекса МНС), например, на рецептор В-лимфоцита специфичный против ауто-антигена. Антитело – это растворимая форма В-клеточного рецептора, расположенного на мембране В-клетки. Если ты помнишь – каждый зрелый В- и Т-лимфоцит имеет рецепторы и способен продуцировать антитела только против одной конкретной мишени. Например, против Dsg 3. Значит, чтобы победить болезнь – не нужно вырубать все В-лимфоциты, нужно убить только те, что несут на своей мембране В-клеточный рецептор против Dsg 3.
 Исследователи взяли цитотоксический Т-лимфоцит и создали конструкцию CAR-T, в которой внешняя часть бывшего Т-клеточного рецептора была заменена на молекулу Dsg 3, а внутренняя была изменена так, чтобы усилить цитотоксические способности. Что получилось? Получился Т-лимфоцит-убийца, который подманивает ауто-реактивный В-лимфоцит как будто бы молекулой Dsg 3. В-лимфоцит своими рецепторами против Dsg 3 связывается с химерической конструкцией измененного цитотоксического Т-лимфоцита, и далее Т-лимфоцит делает то, для чего он предназначен – убивает В-лимфоцит. *Ритуксимаб (Мабтера) 100 мг цена 1 упаковка- 890 евро
Исследователи взяли цитотоксический Т-лимфоцит и создали конструкцию CAR-T, в которой внешняя часть бывшего Т-клеточного рецептора была заменена на молекулу Dsg 3, а внутренняя была изменена так, чтобы усилить цитотоксические способности. Что получилось? Получился Т-лимфоцит-убийца, который подманивает ауто-реактивный В-лимфоцит как будто бы молекулой Dsg 3. В-лимфоцит своими рецепторами против Dsg 3 связывается с химерической конструкцией измененного цитотоксического Т-лимфоцита, и далее Т-лимфоцит делает то, для чего он предназначен – убивает В-лимфоцит. *Ритуксимаб (Мабтера) 100 мг цена 1 упаковка- 890 евро
 Персонализированная терапия излечила рак крови у мышей Американские ученые разработали новый метод прицельной персонализированной терапии В-клеточных лимфом. Результаты их работы опубликованы в Proceedings of the National Academy of Sciences. Сотрудники Стэнфордского университета выбрали в качестве мишени для терапии вариабельный участок В-клеточного рецептора, известный как идиотип. Он высокоспецифичен для клеток опухоли и отличается от здоровых В-лимфоцитов. В то же время, идиотип опухолевых клеток индивидуален для конкретного пациента, что делает применение готовых моноклональных антител непрактичным. Исследователи предложили определять структуру идиотипа у каждого пациента. Затем в существующих библиотеках подбирается небольшой пептид со сродством к этому идиотипу, который синтезируют химически. В это время у пациента забирают антитела и отделяют от них неизменяемые фрагменты, способные к кристаллизации (Fc). Синтезированный пептид химически связывают с Fc, получая высокоспецифическое в отношении конкретной опухоли полусинтетическое пептидное антитело (peptibody).
Персонализированная терапия излечила рак крови у мышей Американские ученые разработали новый метод прицельной персонализированной терапии В-клеточных лимфом. Результаты их работы опубликованы в Proceedings of the National Academy of Sciences. Сотрудники Стэнфордского университета выбрали в качестве мишени для терапии вариабельный участок В-клеточного рецептора, известный как идиотип. Он высокоспецифичен для клеток опухоли и отличается от здоровых В-лимфоцитов. В то же время, идиотип опухолевых клеток индивидуален для конкретного пациента, что делает применение готовых моноклональных антител непрактичным. Исследователи предложили определять структуру идиотипа у каждого пациента. Затем в существующих библиотеках подбирается небольшой пептид со сродством к этому идиотипу, который синтезируют химически. В это время у пациента забирают антитела и отделяют от них неизменяемые фрагменты, способные к кристаллизации (Fc). Синтезированный пептид химически связывают с Fc, получая высокоспецифическое в отношении конкретной опухоли полусинтетическое пептидное антитело (peptibody).
 В ходе эксперимента in vitro пептидные антитела в течение 24 часов активировали в опухолевых клетках фермент апоптоза каспазу-3, что приводило к их гибели. Кроме того, полусинтетические молекулы активировали фагоцитоз клеток опухоли макрофагами, причем делали это более сильно и специфично, чем моноклональные антитела к конкретному идиотипу и препарат ритуксимаб (моноклональное антитело к В-лимфоцитарному антигену CD 20). Эксперимент на иммунодефицитных мышах с пересаженной человеческой лимфомой показал, что период полувыведения пептидных антител из плазмы крови составляет около 24 часов. Их четырехкратное введение с интервалом в сутки привело к полному рассасыванию опухолей у всех животных, получивших терапию, при этом у мышей из контрольной группы наблюдался интенсивный рост новообразований. «Пептидные антитела втрое меньше обычных антител по молекулярной массе, что обеспечивает их лучшее проникновение в ткани; они позволяют одной молекуле содержать более двух антигенсвязывающих участков, что повышает авидность к мишени» , — пишут исследователи.
В ходе эксперимента in vitro пептидные антитела в течение 24 часов активировали в опухолевых клетках фермент апоптоза каспазу-3, что приводило к их гибели. Кроме того, полусинтетические молекулы активировали фагоцитоз клеток опухоли макрофагами, причем делали это более сильно и специфично, чем моноклональные антитела к конкретному идиотипу и препарат ритуксимаб (моноклональное антитело к В-лимфоцитарному антигену CD 20). Эксперимент на иммунодефицитных мышах с пересаженной человеческой лимфомой показал, что период полувыведения пептидных антител из плазмы крови составляет около 24 часов. Их четырехкратное введение с интервалом в сутки привело к полному рассасыванию опухолей у всех животных, получивших терапию, при этом у мышей из контрольной группы наблюдался интенсивный рост новообразований. «Пептидные антитела втрое меньше обычных антител по молекулярной массе, что обеспечивает их лучшее проникновение в ткани; они позволяют одной молекуле содержать более двух антигенсвязывающих участков, что повышает авидность к мишени» , — пишут исследователи.
 Рассасывание опухоли на 17 день терапии (Тх) и ее рост у нелеченной мыши (NT) James Torchia et al. , PNAS, 2016 Принцип действия методики James Torchia et al. , PNAS,
Рассасывание опухоли на 17 день терапии (Тх) и ее рост у нелеченной мыши (NT) James Torchia et al. , PNAS, 2016 Принцип действия методики James Torchia et al. , PNAS,

