Khimia_Elektiv_175.ppt
- Количество слайдов: 10
 Презентация на тему : «Природа водородной связи и ее влияние на свойства воды и водных растворов» Работа выполнена студентами группы № 175 1 курса стоматологического факультета
Презентация на тему : «Природа водородной связи и ее влияние на свойства воды и водных растворов» Работа выполнена студентами группы № 175 1 курса стоматологического факультета
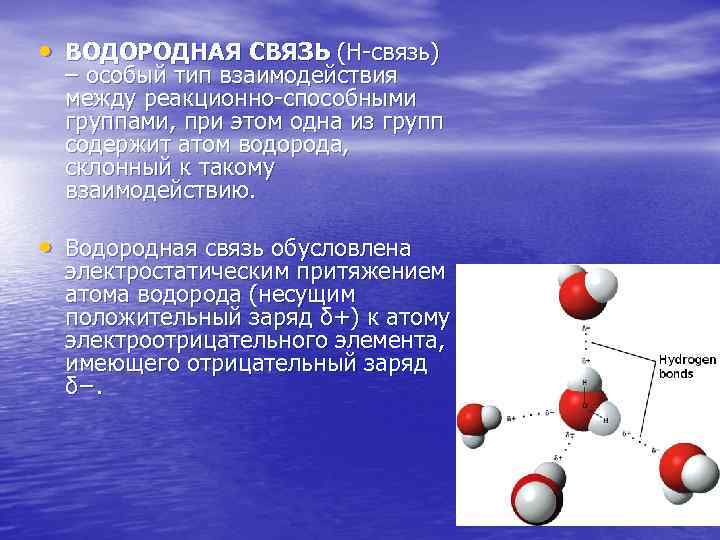 • ВОДОРОДНАЯ СВЯЗЬ (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. • Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−.
• ВОДОРОДНАЯ СВЯЗЬ (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. • Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−.
 • В большинстве случаев она слабее • ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи.
• В большинстве случаев она слабее • ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи.
 Особенности водородной связи. 1)При образовании водородных связей выделяется теплота - термохимическая мера энергии Н-связи 2)Расстояние между соседними атомами, участвующими в образовании водородной связи, значительно меньше суммы их ван-дер-ваальсовых радиусов. Так, в воде расстояние между атомами кислорода в системе О-Н…О составляет 0, 276 нм. Если принять, что длина ковалентной связи О-Н равна 0, 1 нм, то длина связи Н…О составит 0, 176 нм, то есть она значительно (примерно на 70%) длиннее ковалентной связи между этими атомами. Тем не менее связь Н…О оказывается значительно короче суммы ван-дер-ваальсовых радиусов, составляющих для водорода и кислорода соответственно 0, 12 и 0, 14 нм. 3)Водородная связь увеличивает длину связи Х-Н, что приводит к смещению соответствующей полосы валентных колебаний в ИКспектре в сторону более низких частот. Метод ИК-спектроскопии является главным методом изучения водородной связи.
Особенности водородной связи. 1)При образовании водородных связей выделяется теплота - термохимическая мера энергии Н-связи 2)Расстояние между соседними атомами, участвующими в образовании водородной связи, значительно меньше суммы их ван-дер-ваальсовых радиусов. Так, в воде расстояние между атомами кислорода в системе О-Н…О составляет 0, 276 нм. Если принять, что длина ковалентной связи О-Н равна 0, 1 нм, то длина связи Н…О составит 0, 176 нм, то есть она значительно (примерно на 70%) длиннее ковалентной связи между этими атомами. Тем не менее связь Н…О оказывается значительно короче суммы ван-дер-ваальсовых радиусов, составляющих для водорода и кислорода соответственно 0, 12 и 0, 14 нм. 3)Водородная связь увеличивает длину связи Х-Н, что приводит к смещению соответствующей полосы валентных колебаний в ИКспектре в сторону более низких частот. Метод ИК-спектроскопии является главным методом изучения водородной связи.
 Особенности водородной связи. 4) При образовании водородной связи полярность связи Х-Н возрастает, что приводит к повышению дипольного момента молекулярного комплекса 5)Протоны, участвующие в водородной связи, характеризуются более низкой электронной плотностью, поэтому они деэкранируются, что приводит к существенному смещению соответствующих резонансных сигналов в спектрах ЯМР 1 Н в слабое поле. 6) Для межмолекулярных водородных связей обнаружено смещение кислотно-основного равновесия молекулярный комплекс ионная пара вправо при повышении полярности растворителя.
Особенности водородной связи. 4) При образовании водородной связи полярность связи Х-Н возрастает, что приводит к повышению дипольного момента молекулярного комплекса 5)Протоны, участвующие в водородной связи, характеризуются более низкой электронной плотностью, поэтому они деэкранируются, что приводит к существенному смещению соответствующих резонансных сигналов в спектрах ЯМР 1 Н в слабое поле. 6) Для межмолекулярных водородных связей обнаружено смещение кислотно-основного равновесия молекулярный комплекс ионная пара вправо при повышении полярности растворителя.
 Аномалии свойств, обусловленные наличием водородной связи • Водородные связи являются причиной уникального • свойства воды - при плавлении ее плотность возрастает. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода - из других молекул воды. В результате образуется очень рыхлая "ажурная" структура. Вот почему лед такой легкий. При плавлении льда около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание, с одной стороны, должно вызывать увеличение объема воды. Это происходит со всеми веществами.
Аномалии свойств, обусловленные наличием водородной связи • Водородные связи являются причиной уникального • свойства воды - при плавлении ее плотность возрастает. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода - из других молекул воды. В результате образуется очень рыхлая "ажурная" структура. Вот почему лед такой легкий. При плавлении льда около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание, с одной стороны, должно вызывать увеличение объема воды. Это происходит со всеми веществами.
 • Но, с другой стороны, водородные связи продолжают разрушаться, а это должно приводить к уменьшению объема воды. В результате плотность воды изменяется неравномерно. Наибольшее значение (1, 00 г/мл) она имеет при температуре 4 o. С. Такова зимняя температура вблизи дна пресноводных водоемов, где скапливается вода с максимальной плотностью. При замерзании вода расширяется и занимает больший объем. Плотность льда (0, 92 г/мл) - меньше, чем плотность жидкой воды. Поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
• Но, с другой стороны, водородные связи продолжают разрушаться, а это должно приводить к уменьшению объема воды. В результате плотность воды изменяется неравномерно. Наибольшее значение (1, 00 г/мл) она имеет при температуре 4 o. С. Такова зимняя температура вблизи дна пресноводных водоемов, где скапливается вода с максимальной плотностью. При замерзании вода расширяется и занимает больший объем. Плотность льда (0, 92 г/мл) - меньше, чем плотность жидкой воды. Поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
 Влияние водородной связи на свойства воды. • Водородные связи образуются и возникают между положительными и отрицательными полюсами разных молекул воды, то есть положительно заряженные атомы водородаодной молекулы притягиваются к отрицательно заряженным атомам кислорода другой молекулы воды. Но так как атомов водорода в одной молекуле воды два, то одна молекула может связать не менее трех других молекул воды, за счет двух атомов водорода и одного атома кислорода. Именно водородные связи и играют большую роль в возникновении воды. • За счет водородных связей, вода может запросто организоваться в кристаллические структуры даже в жидком состоянии, а кристаллы имеют уже совсем другие свойства, чем неупорядоченная вода.
Влияние водородной связи на свойства воды. • Водородные связи образуются и возникают между положительными и отрицательными полюсами разных молекул воды, то есть положительно заряженные атомы водородаодной молекулы притягиваются к отрицательно заряженным атомам кислорода другой молекулы воды. Но так как атомов водорода в одной молекуле воды два, то одна молекула может связать не менее трех других молекул воды, за счет двух атомов водорода и одного атома кислорода. Именно водородные связи и играют большую роль в возникновении воды. • За счет водородных связей, вода может запросто организоваться в кристаллические структуры даже в жидком состоянии, а кристаллы имеют уже совсем другие свойства, чем неупорядоченная вода.
 Влияние водородной связи на свойства веществ Водородные связи влияют на физические (т. кип. и т. пл. , летучесть, вязкость, спектральные характеристики) и химические (кислотноосновные) свойства соединений. Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH 3 OH, С 2 Н 5 ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются. Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность.
Влияние водородной связи на свойства веществ Водородные связи влияют на физические (т. кип. и т. пл. , летучесть, вязкость, спектральные характеристики) и химические (кислотноосновные) свойства соединений. Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH 3 OH, С 2 Н 5 ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются. Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность.
 Водородные связи играют исключительно важную роль в формировании пространственной структуры биополимеров (белков, полисахаридов, нуклеиновых кислот), что в значительной степени определяет их биологические функции.
Водородные связи играют исключительно важную роль в формировании пространственной структуры биополимеров (белков, полисахаридов, нуклеиновых кислот), что в значительной степени определяет их биологические функции.


