1536117.pptx
- Количество слайдов: 36
 Презентация на Тему: Основные методы кристаллизации. Кристаллизаторы Выполнил: Студент 3 Курса Тищенко С. А.
Презентация на Тему: Основные методы кристаллизации. Кристаллизаторы Выполнил: Студент 3 Курса Тищенко С. А.
 Содержание: 1. Общие сведения о Кристаллизации 2. Равновесие при Кристаллизации 3. Кинетика процесса Кристаллизации 4. Факторы, влияющие на процесс кристаллизации 5. Кристаллизаторы
Содержание: 1. Общие сведения о Кристаллизации 2. Равновесие при Кристаллизации 3. Кинетика процесса Кристаллизации 4. Факторы, влияющие на процесс кристаллизации 5. Кристаллизаторы
 Общие сведения Кристаллизация представляет собой процесс выделения твердой фазы из растворов, расплавов или паров. Кристаллы – однородные твердые вещества различной геометрической формы, ограниченной плоскими гранями.
Общие сведения Кристаллизация представляет собой процесс выделения твердой фазы из растворов, расплавов или паров. Кристаллы – однородные твердые вещества различной геометрической формы, ограниченной плоскими гранями.
 Продукт, получаемый в результате кристаллизации, представляет собой сыпучую массу кристаллов различного размера. Внешняя геометрическая форма кристаллов специфична для каждого вещества. Характерной особенностью кристаллического строения вещества является определенное, периодически повторяющееся в трех измерениях расположение ионов, атомов или молекул, образующих кристаллическую решетку.
Продукт, получаемый в результате кристаллизации, представляет собой сыпучую массу кристаллов различного размера. Внешняя геометрическая форма кристаллов специфична для каждого вещества. Характерной особенностью кристаллического строения вещества является определенное, периодически повторяющееся в трех измерениях расположение ионов, атомов или молекул, образующих кристаллическую решетку.
 • В основу классификации кристаллов положена их симметрия. Известно 32 вида симметрии кристаллов. Для удобства они сгруппированы в семь кристаллографических форм, или сингоний (кубическая, тригональная, тетрагональная, гексагональная, орторомбическая, моноклинная, триклинная), и три категории: высокая, к ней относится первая форма; средняя и низкая (относятся следующие формы по три).
• В основу классификации кристаллов положена их симметрия. Известно 32 вида симметрии кристаллов. Для удобства они сгруппированы в семь кристаллографических форм, или сингоний (кубическая, тригональная, тетрагональная, гексагональная, орторомбическая, моноклинная, триклинная), и три категории: высокая, к ней относится первая форма; средняя и низкая (относятся следующие формы по три).
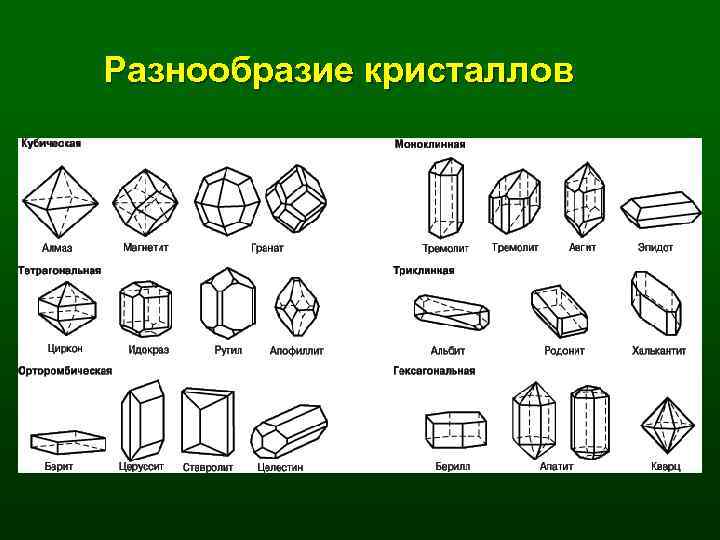 Разнообразие кристаллов
Разнообразие кристаллов
 В зависимости от условий кристаллизации (температуры, давления и др. ), одно и то же вещество может образовывать разные по симметрии и форме кристаллы, называемые полиморфными разновидностями или модификациями.
В зависимости от условий кристаллизации (температуры, давления и др. ), одно и то же вещество может образовывать разные по симметрии и форме кристаллы, называемые полиморфными разновидностями или модификациями.
 Полиморфная разновидность кварца
Полиморфная разновидность кварца
 В химической технологии наибольший интерес представляет процесс кристаллизации из растворов для получения различных веществ высокой чистоты. Проведение такого процесса в промышленном масштабе с одновременным получением большого числа кристаллов называется массовой кристаллизацией.
В химической технологии наибольший интерес представляет процесс кристаллизации из растворов для получения различных веществ высокой чистоты. Проведение такого процесса в промышленном масштабе с одновременным получением большого числа кристаллов называется массовой кристаллизацией.
 Очень важными в теории процессов растворения и кристаллизации являются понятия о ненасыщенном, насыщенном и пересыщенном растворах. Ненасыщенным называется такой раствор, который способен в данных условиях растворить в себе некоторое количество содержащегося в нем вещества. К насыщенным относятся растворы, которые не изменяют своего состава, находясь в контакте с кристаллами растворенных в них веществ. Содержание растворенного вещества в насыщенном растворе соответствует его растворимости при данных условиях.
Очень важными в теории процессов растворения и кристаллизации являются понятия о ненасыщенном, насыщенном и пересыщенном растворах. Ненасыщенным называется такой раствор, который способен в данных условиях растворить в себе некоторое количество содержащегося в нем вещества. К насыщенным относятся растворы, которые не изменяют своего состава, находясь в контакте с кристаллами растворенных в них веществ. Содержание растворенного вещества в насыщенном растворе соответствует его растворимости при данных условиях.
 Пересыщенным называется раствор, в котором содержание какого либо вещества в растворенном виде превышает его растворимость в данных условиях.
Пересыщенным называется раствор, в котором содержание какого либо вещества в растворенном виде превышает его растворимость в данных условиях.
 Растворение – это процесс, обратный кристаллизации; в ряде химических производств он имеет самостоятельное значение. Путем чередования процессов кристаллизации и растворения (перекристаллизации) получают наиболее чистые продукты.
Растворение – это процесс, обратный кристаллизации; в ряде химических производств он имеет самостоятельное значение. Путем чередования процессов кристаллизации и растворения (перекристаллизации) получают наиболее чистые продукты.

 Равновесие при Кристаллизации Поведение системы кристалл раствор или кристалл расплав в широком интервале температур, давлений и концентраций отображает диаграмма состояния, или фазовая диаграмма, на которой графически изображаются равновесие между различными фазами данной системы.
Равновесие при Кристаллизации Поведение системы кристалл раствор или кристалл расплав в широком интервале температур, давлений и концентраций отображает диаграмма состояния, или фазовая диаграмма, на которой графически изображаются равновесие между различными фазами данной системы.
 Число степеней свободы в условиях равновесия системы устанавливается правилом фаз Гиббса: С=К Ф+2, Где С – число степей свободы системы; , К, Ф– число компонентов и фаз, образующих систему. Число степеней свободы С данной системы соответствует числу независимых параметров, характеризующих эту систему (температура, давление, концентрация).
Число степеней свободы в условиях равновесия системы устанавливается правилом фаз Гиббса: С=К Ф+2, Где С – число степей свободы системы; , К, Ф– число компонентов и фаз, образующих систему. Число степеней свободы С данной системы соответствует числу независимых параметров, характеризующих эту систему (температура, давление, концентрация).
 Область П под кривой ASC соответствует парообразному нафталину. Область, ограниченная кривой BSC , соответствует области, в которой жидкая фаза стабильна. Область, ограниченная кривой ASB, соответствует области давлений и температур, при которых твердая фаза стабильна. На рис. 7. 1 приведена диаграмма состояния для нафталина, отражающая равновесные соотношения между паром, жидкостью и твердой фазой.
Область П под кривой ASC соответствует парообразному нафталину. Область, ограниченная кривой BSC , соответствует области, в которой жидкая фаза стабильна. Область, ограниченная кривой ASB, соответствует области давлений и температур, при которых твердая фаза стабильна. На рис. 7. 1 приведена диаграмма состояния для нафталина, отражающая равновесные соотношения между паром, жидкостью и твердой фазой.
 Кинетика процесса Кристаллизации Выделяют три основные стадии процесса кристаллизации: создание пересыщения исходной системы, зарождение центров кристаллизации и рост кристаллов.
Кинетика процесса Кристаллизации Выделяют три основные стадии процесса кристаллизации: создание пересыщения исходной системы, зарождение центров кристаллизации и рост кристаллов.
 Зарождение кристаллов. Интенсивность зарождения кристаллов характеризуют ско ростью их зарождения, под которой понимают количество центров кристаллизации (зародышей), возникающих в единице объема за единицу времени. Зародыши в пересыщенных или переохлажденных растворах образуются самопроизвольно за счет образования ассоциаций частиц при столкновении в растворе отдельных атомов, ионов или молекул растворенного вещества. Постепенно внутри этого скопления частички упорядочиваются, располагаясь в узлах кристаллической решетки.
Зарождение кристаллов. Интенсивность зарождения кристаллов характеризуют ско ростью их зарождения, под которой понимают количество центров кристаллизации (зародышей), возникающих в единице объема за единицу времени. Зародыши в пересыщенных или переохлажденных растворах образуются самопроизвольно за счет образования ассоциаций частиц при столкновении в растворе отдельных атомов, ионов или молекул растворенного вещества. Постепенно внутри этого скопления частички упорядочиваются, располагаясь в узлах кристаллической решетки.
 В большом объеме пересыщенного раствора величина пересыщения не везде одинакова: в некоторых местах (точках объема) она большая (именно здесь возникают зародыши), а в других отсутствует.
В большом объеме пересыщенного раствора величина пересыщения не везде одинакова: в некоторых местах (точках объема) она большая (именно здесь возникают зародыши), а в других отсутствует.
 Процесс образования зародыша чаще всего протекает с выделением тепла. Энергия иона, движущегося в растворе, больше энергии неподвижного иона, находящегося в кристалле, поэтому в том микрообъеме раствора, где образовался зародыш, температура может быть несколько выше средней температуры раствора, а концентрация – ниже средней. Если зародыш не вывести из этого объема, то он может раствориться. Неустойчивостью зародышей подтверждается тот факт, что в неподвижном растворе зародыш иногда не возникает даже при высоком пресыщении. Однако стоит только стряхнуть такой раствор – он сразу же мутнеет от большого количества возникающих зародышей.
Процесс образования зародыша чаще всего протекает с выделением тепла. Энергия иона, движущегося в растворе, больше энергии неподвижного иона, находящегося в кристалле, поэтому в том микрообъеме раствора, где образовался зародыш, температура может быть несколько выше средней температуры раствора, а концентрация – ниже средней. Если зародыш не вывести из этого объема, то он может раствориться. Неустойчивостью зародышей подтверждается тот факт, что в неподвижном растворе зародыш иногда не возникает даже при высоком пресыщении. Однако стоит только стряхнуть такой раствор – он сразу же мутнеет от большого количества возникающих зародышей.
 Кроме температуры раствора и перемешивания на скорость процесса зародышеобразования оказывает влияние присутствие примесей – растворимых и нерастворимых. Частицы нерастворимых примесей, присутствующие в пересыщенном растворе, иногда могут служить центрами, вокруг которых формируются зародыши кристаллов. Чем ближе структура кристаллической решетки твердой частички к структуре кристаллизующего вещества, тем вероятнее, что эта частица будет центром зародыша кристалла.
Кроме температуры раствора и перемешивания на скорость процесса зародышеобразования оказывает влияние присутствие примесей – растворимых и нерастворимых. Частицы нерастворимых примесей, присутствующие в пересыщенном растворе, иногда могут служить центрами, вокруг которых формируются зародыши кристаллов. Чем ближе структура кристаллической решетки твердой частички к структуре кристаллизующего вещества, тем вероятнее, что эта частица будет центром зародыша кристалла.
 Если в растворе присутствуют поверхностно активные вещества (ПАВ, например, мыло, стиральные порошки), то они могут существенно замедлять скорость процесса зародышеобразования, скапливаясь на поверхности и препятствуя их росту. После упорядочения внутренней структуры зародыш продолжает расти уже как кристалл.
Если в растворе присутствуют поверхностно активные вещества (ПАВ, например, мыло, стиральные порошки), то они могут существенно замедлять скорость процесса зародышеобразования, скапливаясь на поверхности и препятствуя их росту. После упорядочения внутренней структуры зародыш продолжает расти уже как кристалл.
 Существуют два основных механизма роста кристаллов: слоистый и блоковый. При слоистом росте на поверхности граней кристалла кристаллизующееся вещество отлагается слоями. При малом пресыщении новый слой начинает расти после полного разрастания старого слоя. Однако при большом пересыщении новые слои могут начинать расти до окончания полного разрастания нижнего слоя. При высоких пересыщениях, которые обычно имеют место в современных непрерывнодействующих кристаллизаторах, к поверхности кристалла прирастают уже не отдельные ионы, а их скопления – блоки. Рост кристаллов происходит одновременно по всем граням, однако при различных линейных скоростях роста отдельных граней. Одни из них исчезают, другие – развиваются, что приводит к изменению внешнего вида кристалла.
Существуют два основных механизма роста кристаллов: слоистый и блоковый. При слоистом росте на поверхности граней кристалла кристаллизующееся вещество отлагается слоями. При малом пресыщении новый слой начинает расти после полного разрастания старого слоя. Однако при большом пересыщении новые слои могут начинать расти до окончания полного разрастания нижнего слоя. При высоких пересыщениях, которые обычно имеют место в современных непрерывнодействующих кристаллизаторах, к поверхности кристалла прирастают уже не отдельные ионы, а их скопления – блоки. Рост кристаллов происходит одновременно по всем граням, однако при различных линейных скоростях роста отдельных граней. Одни из них исчезают, другие – развиваются, что приводит к изменению внешнего вида кристалла.
 Слоистый рост кристаллов
Слоистый рост кристаллов
 Блочный рост кристаллов
Блочный рост кристаллов
 Факторы, влияющие на процесс кристаллизации Форма кристаллов определяется природой кристаллизуемого вещества и зависит также от наличия примесей в растворе. Например, гидроокись бария Ba(OH)2∙ 8 H 2 O кристаллизуется в виде очень тонких круглых дисков. Кристаллы такой формы затем плохо фильтруются и медленно отстаиваются, а также легко дробятся при транспортировке, сушке и т. д. При хранении они легко слеживаются. Гораздо лучшими качествами эти кристаллы обладали бы, если бы они имели форму куба или сферы.
Факторы, влияющие на процесс кристаллизации Форма кристаллов определяется природой кристаллизуемого вещества и зависит также от наличия примесей в растворе. Например, гидроокись бария Ba(OH)2∙ 8 H 2 O кристаллизуется в виде очень тонких круглых дисков. Кристаллы такой формы затем плохо фильтруются и медленно отстаиваются, а также легко дробятся при транспортировке, сушке и т. д. При хранении они легко слеживаются. Гораздо лучшими качествами эти кристаллы обладали бы, если бы они имели форму куба или сферы.
 Гидроокись Бария
Гидроокись Бария
 Крупность кристаллического продукта (размер кристаллов) определяется соотношением скоростей процессов зародышеобразования и роста кристаллов. Чем больше выделяющегося из раствора вещества расходуется на образование зародышей кристаллов и меньше – на рост уже имеющихся кристаллов, тем ниже средневзвешенный размер кристаллов продукта. Для получения крупнокристаллического продукта необходимо каким либо способом уменьшить скорость процесса зародышеобразования, а скорость роста кристаллов сохранить неизменной или увеличить.
Крупность кристаллического продукта (размер кристаллов) определяется соотношением скоростей процессов зародышеобразования и роста кристаллов. Чем больше выделяющегося из раствора вещества расходуется на образование зародышей кристаллов и меньше – на рост уже имеющихся кристаллов, тем ниже средневзвешенный размер кристаллов продукта. Для получения крупнокристаллического продукта необходимо каким либо способом уменьшить скорость процесса зародышеобразования, а скорость роста кристаллов сохранить неизменной или увеличить.
 Кристаллизаторы Применяемые в промышленности кристаллизаторы можно разделить на три группы: изогидрические, вакуумные и выпарные. Выбор той или иной конструкции зависит от многих факторов: общей технологической схемы производства, физико химических свойств раствора, производительности и т. п.
Кристаллизаторы Применяемые в промышленности кристаллизаторы можно разделить на три группы: изогидрические, вакуумные и выпарные. Выбор той или иной конструкции зависит от многих факторов: общей технологической схемы производства, физико химических свойств раствора, производительности и т. п.
 Изогидрические кристаллизаторы применяются при проведении процесса кристаллизации солей, растворимость которых значительно уменьшается с понижением температуры. Раствор в таких кристаллизаторах охлаждается при постоянном количестве растворителя до температуры ниже температуры насыщения. В результате охлаждения раствор становится пересыщенным, что приводит к возникновению кристаллизации.
Изогидрические кристаллизаторы применяются при проведении процесса кристаллизации солей, растворимость которых значительно уменьшается с понижением температуры. Раствор в таких кристаллизаторах охлаждается при постоянном количестве растворителя до температуры ниже температуры насыщения. В результате охлаждения раствор становится пересыщенным, что приводит к возникновению кристаллизации.
 Кристаллизатор периодического действия представляет собой цилиндрический аппарат с охлаждающей рубашкой. Горячий насыщенный раствор заливается в аппарат 1 с непрерывно работающей мешалкой 2. После заполнения кристаллизатора в рубашку 3 подается охлаждающая вода. Образовавшаяся суспензия кристаллов сливается через разгрузочное устройство и направляется на фильтр или центрифугу для отделения кристаллов от маточного раствора.
Кристаллизатор периодического действия представляет собой цилиндрический аппарат с охлаждающей рубашкой. Горячий насыщенный раствор заливается в аппарат 1 с непрерывно работающей мешалкой 2. После заполнения кристаллизатора в рубашку 3 подается охлаждающая вода. Образовавшаяся суспензия кристаллов сливается через разгрузочное устройство и направляется на фильтр или центрифугу для отделения кристаллов от маточного раствора.
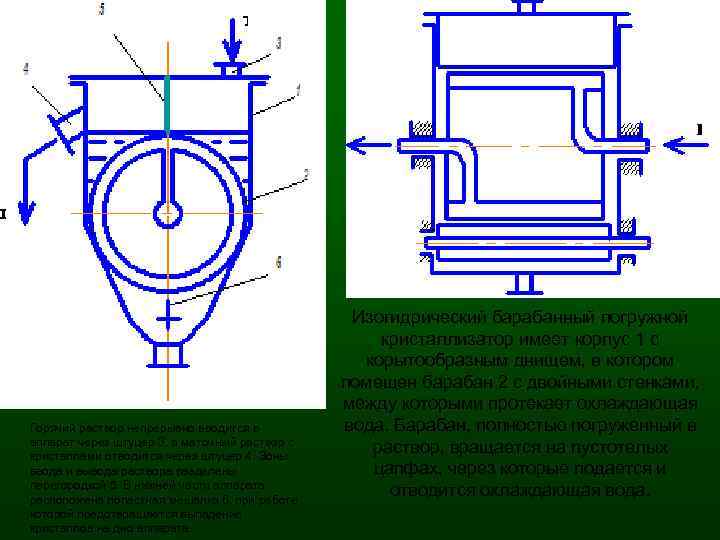 Горячий раствор непрерывно вводится в аппарат через штуцер 3, а маточный раствор с кристаллами отводится через штуцер 4. Зоны ввода и вывода раствора разделены перегородкой 5. В нижней части аппарата расположена лопастная мешалка 6, при работе которой предотвращается выпадение кристаллов на дно аппарата. Изогидрический барабанный погружной кристаллизатор имеет корпус 1 с корытообразным днищем, в котором помещен барабан 2 с двойными стенками, между которыми протекает охлаждающая вода. Барабан, полностью погруженный в раствор, вращается на пустотелых цапфах, через которые подается и отводится охлаждающая вода.
Горячий раствор непрерывно вводится в аппарат через штуцер 3, а маточный раствор с кристаллами отводится через штуцер 4. Зоны ввода и вывода раствора разделены перегородкой 5. В нижней части аппарата расположена лопастная мешалка 6, при работе которой предотвращается выпадение кристаллов на дно аппарата. Изогидрический барабанный погружной кристаллизатор имеет корпус 1 с корытообразным днищем, в котором помещен барабан 2 с двойными стенками, между которыми протекает охлаждающая вода. Барабан, полностью погруженный в раствор, вращается на пустотелых цапфах, через которые подается и отводится охлаждающая вода.
 Изогидрический кристаллизатор с псевдоожиженным слоем кристаллов. В кристаллизаторах этого типа возможно регулирование размеров получаемых кристаллов. Кристаллизатор состоит из корпуса 1, циркуляционного насоса 2, теплообменника 3 и отстойника для мелких кристаллов 4. Горячий раствор поступает через штуцер 5 во всасывающую циркуляционную трубу 6 и смешивается с циркулирующим по замкнутому контуру маточным раствором. Протекая через холодильник 3, раствор охлаждается и становится пересыщенным. Пересыщенный раствор по трубе 7 поступает в нижнюю часть корпуса кристаллизатора и поднимается вверх, поддерживая растущие кристаллы во взвешенном состоянии. По мере движения раствора через псевдоожиженный слой кристаллов его пересыщение снижается. Готовый кристаллический продукт выводится из нижней части аппарата через штуцер 8.
Изогидрический кристаллизатор с псевдоожиженным слоем кристаллов. В кристаллизаторах этого типа возможно регулирование размеров получаемых кристаллов. Кристаллизатор состоит из корпуса 1, циркуляционного насоса 2, теплообменника 3 и отстойника для мелких кристаллов 4. Горячий раствор поступает через штуцер 5 во всасывающую циркуляционную трубу 6 и смешивается с циркулирующим по замкнутому контуру маточным раствором. Протекая через холодильник 3, раствор охлаждается и становится пересыщенным. Пересыщенный раствор по трубе 7 поступает в нижнюю часть корпуса кристаллизатора и поднимается вверх, поддерживая растущие кристаллы во взвешенном состоянии. По мере движения раствора через псевдоожиженный слой кристаллов его пересыщение снижается. Готовый кристаллический продукт выводится из нижней части аппарата через штуцер 8.
 Вакуумные кристаллизаторы представляют собой аппараты, в которых раствор охлаждается вследствие адиабатического испарения части растворителя. На испарение расходуется тепло от раствора, который при этом охлаждается до температуры, соответствующей его температуре кипения при данном остаточном давлении.
Вакуумные кристаллизаторы представляют собой аппараты, в которых раствор охлаждается вследствие адиабатического испарения части растворителя. На испарение расходуется тепло от раствора, который при этом охлаждается до температуры, соответствующей его температуре кипения при данном остаточном давлении.
 Выпарные кристаллизаторы применяют для кристаллизации солей, растворимость которых мало меняется с изменением температуры. При этом процесс осуществляется путем удаления части растворителя при выпаривании раствора. Конструкции выпарных кристаллизаторов аналогичны конструкциям выпарных аппаратов. Вакуум-выпарной кристаллизатор с псевдоожиженным слоем кристаллов. Тепло, необходимое для испарения растворителя, подводится к раствору через греющую камеру 12.
Выпарные кристаллизаторы применяют для кристаллизации солей, растворимость которых мало меняется с изменением температуры. При этом процесс осуществляется путем удаления части растворителя при выпаривании раствора. Конструкции выпарных кристаллизаторов аналогичны конструкциям выпарных аппаратов. Вакуум-выпарной кристаллизатор с псевдоожиженным слоем кристаллов. Тепло, необходимое для испарения растворителя, подводится к раствору через греющую камеру 12.
 Конец
Конец


