 Презентация на тему: «Неметаллы» Подготовила ученица 11 «А» класса МБОУ СОШ № 25 Корнева Виктория
Презентация на тему: «Неметаллы» Подготовила ученица 11 «А» класса МБОУ СОШ № 25 Корнева Виктория
 Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее: Кроме того, к неметаллам относят также водород и гелий.
Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее: Кроме того, к неметаллам относят также водород и гелий.
 Особенности атомного строения элементов-неметаллов. 1. Небольшой атомный радиус ( в сравнении с радиусами атомов-металлов одного с ними периода). 2. Большее число электронов на внешнем уровне (4 -8), исключения Н, Не, В. 3. Происходит заполнение электронами только внешнего энергетического уровня. 4. Для элементов-неметаллов характерны высокие значения электроотрицательности.
Особенности атомного строения элементов-неметаллов. 1. Небольшой атомный радиус ( в сравнении с радиусами атомов-металлов одного с ними периода). 2. Большее число электронов на внешнем уровне (4 -8), исключения Н, Не, В. 3. Происходит заполнение электронами только внешнего энергетического уровня. 4. Для элементов-неметаллов характерны высокие значения электроотрицательности.
 Неметаллов оказывается не слишком много – 22 элемента: Инертные газы Галогены Халькогены и немного из других подгрупп
Неметаллов оказывается не слишком много – 22 элемента: Инертные газы Галогены Халькогены и немного из других подгрупп
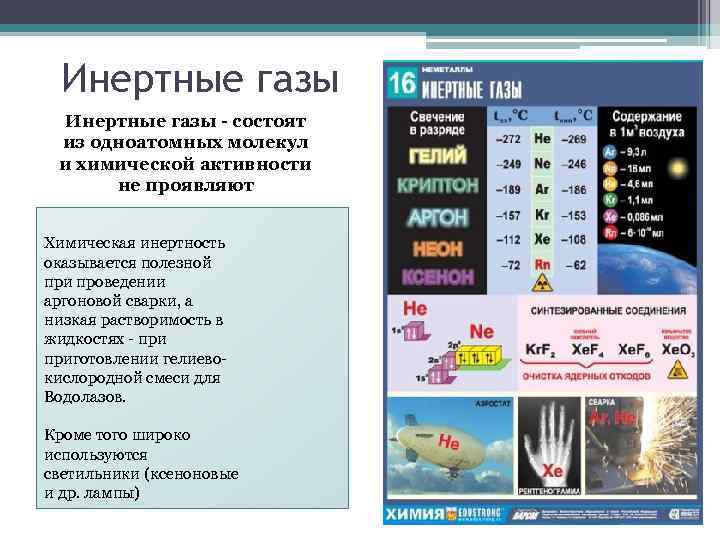 Инертные газы - состоят из одноатомных молекул и химической активности не проявляют Химическая инертность оказывается полезной при проведении аргоновой сварки, а низкая растворимость в жидкостях - приготовлении гелиевокислородной смеси для Водолазов. Кроме того широко используются светильники (ксеноновые и др. лампы)
Инертные газы - состоят из одноатомных молекул и химической активности не проявляют Химическая инертность оказывается полезной при проведении аргоновой сварки, а низкая растворимость в жидкостях - приготовлении гелиевокислородной смеси для Водолазов. Кроме того широко используются светильники (ксеноновые и др. лампы)
 Галогены существуют в виде двухатомных молекул. Эти вещества являются легколетучими, но силы взаимодействия между молекулами растут с ростом атомной массы сверху вниз в периодической таблице.
Галогены существуют в виде двухатомных молекул. Эти вещества являются легколетучими, но силы взаимодействия между молекулами растут с ростом атомной массы сверху вниз в периодической таблице.
 Халькогены Химические элементы 16 -й группы периодической таблицы химических элементов. В группу входят кислород O, сера S, селен Se, теллур Te, полоний Po и искусственно полученный ливерморий Lv. Бинарные соединения этих элементов с металлами носят общее название халькогенидов.
Халькогены Химические элементы 16 -й группы периодической таблицы химических элементов. В группу входят кислород O, сера S, селен Se, теллур Te, полоний Po и искусственно полученный ливерморий Lv. Бинарные соединения этих элементов с металлами носят общее название халькогенидов.
 Неметаллы – физические свойства • Газами в свободном состоянии являются также такие важнейшие неметаллы как: кислород, водород, азот.
Неметаллы – физические свойства • Газами в свободном состоянии являются также такие важнейшие неметаллы как: кислород, водород, азот.
 • Остальные неметаллы являются твердыми, так как используют возможность образовывать более чем одну связь. • Один и тот же элемент может образовывать несколько форм простого вещества, непохожих одна на другую. Такие формы носят название модификаций
• Остальные неметаллы являются твердыми, так как используют возможность образовывать более чем одну связь. • Один и тот же элемент может образовывать несколько форм простого вещества, непохожих одна на другую. Такие формы носят название модификаций
 Способы получения неметаллов • Некоторые неметаллы (простые вещества) присутствуют в окружающей среде и могут быть просто извлечены. Это прежде всего благородные газы, кислород и азот. • В качестве простых веществ можно найти месторождения углерода (графита) и серы. • Остальные неметаллы приходится извлекать из сложных соединений – проводить химическую реакцию.
Способы получения неметаллов • Некоторые неметаллы (простые вещества) присутствуют в окружающей среде и могут быть просто извлечены. Это прежде всего благородные газы, кислород и азот. • В качестве простых веществ можно найти месторождения углерода (графита) и серы. • Остальные неметаллы приходится извлекать из сложных соединений – проводить химическую реакцию.
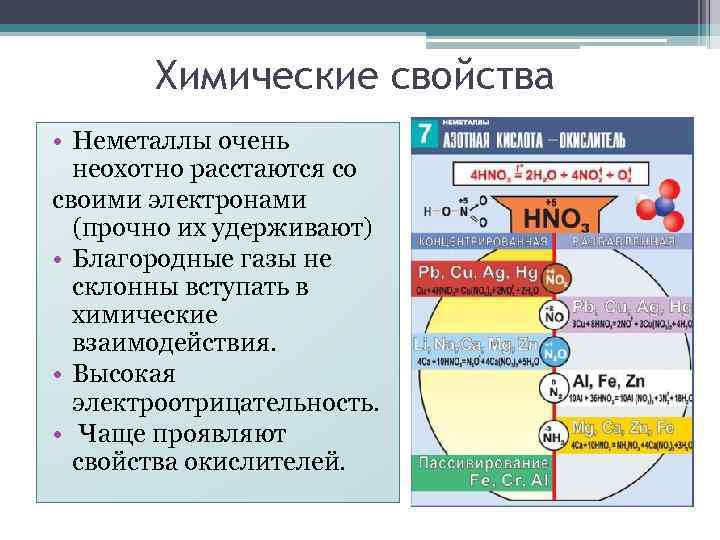 Химические свойства • Неметаллы очень неохотно расстаются со своими электронами (прочно их удерживают) • Благородные газы не склонны вступать в химические взаимодействия. • Высокая электроотрицательность. • Чаще проявляют свойства окислителей.
Химические свойства • Неметаллы очень неохотно расстаются со своими электронами (прочно их удерживают) • Благородные газы не склонны вступать в химические взаимодействия. • Высокая электроотрицательность. • Чаще проявляют свойства окислителей.
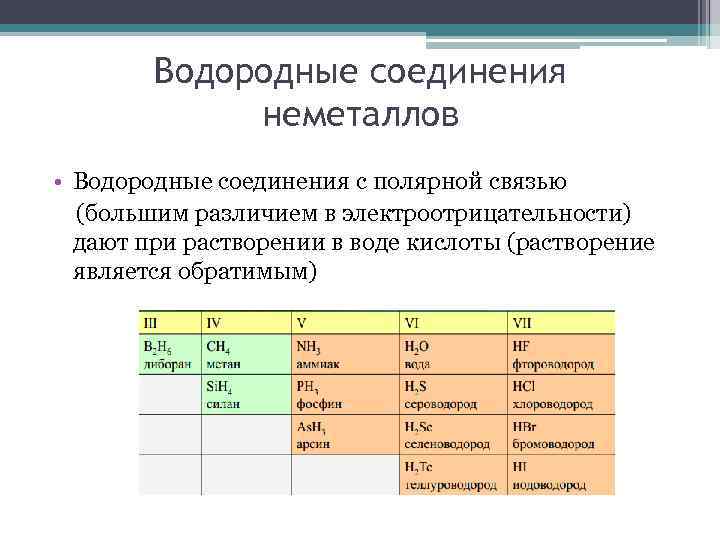 Водородные соединения неметаллов • Водородные соединения с полярной связью (большим различием в электроотрицательности) дают при растворении в воде кислоты (растворение является обратимым)
Водородные соединения неметаллов • Водородные соединения с полярной связью (большим различием в электроотрицательности) дают при растворении в воде кислоты (растворение является обратимым)
 СПАСИБО ЗА ВНИМАНИЕ
СПАСИБО ЗА ВНИМАНИЕ