Галогены. Муратов Ильдар. Гр.1211.ppt
- Количество слайдов: 19
 ПРЕЗЕНТАЦИЯ НА ТЕМУ: Галогены Выполнил: Муратов Ильдар Гр. 1211
ПРЕЗЕНТАЦИЯ НА ТЕМУ: Галогены Выполнил: Муратов Ильдар Гр. 1211
 ГАЛОГЕ НЫ — ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ 17 -Й ГРУППЫ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА (ПО УСТАРЕВШЕЙ КЛАССИФИКАЦИИ — ЭЛЕМЕНТЫ ГЛАВНОЙ ПОДГРУППЫ VII ГРУППЫ).
ГАЛОГЕ НЫ — ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ 17 -Й ГРУППЫ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА (ПО УСТАРЕВШЕЙ КЛАССИФИКАЦИИ — ЭЛЕМЕНТЫ ГЛАВНОЙ ПОДГРУППЫ VII ГРУППЫ).
 Фтор — элемент 17 -й группы периодической таблицы химических элементов, второго периода, с атомным номером 9[3]. Обозначается символом F (лат. Fluorum). Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор при нормальных условиях — двухатомный газ (формула F 2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Хлор — элемент 17 -й группы периодической таблицы химических элементов, третьего периода, с атомным номером 17[2]. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов. Простое вещество хлор при нормальных условиях — ядовитый газ желтоватозелёного цвета тяжелее воздуха, с резким запахом. Молекула хлора двухатомная (формула Cl 2). Бром— элемент 17 -й группы периодической таблицы химических элементов, четвёртого периода, с атомным номером 35[2]. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br 2).
Фтор — элемент 17 -й группы периодической таблицы химических элементов, второго периода, с атомным номером 9[3]. Обозначается символом F (лат. Fluorum). Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор при нормальных условиях — двухатомный газ (формула F 2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Хлор — элемент 17 -й группы периодической таблицы химических элементов, третьего периода, с атомным номером 17[2]. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов. Простое вещество хлор при нормальных условиях — ядовитый газ желтоватозелёного цвета тяжелее воздуха, с резким запахом. Молекула хлора двухатомная (формула Cl 2). Бром— элемент 17 -й группы периодической таблицы химических элементов, четвёртого периода, с атомным номером 35[2]. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br 2).
 Ио д (от др. -греч. — «фиолетовый» ) — элемент 17 -й группы периодической таблицы химических элементов, пятого периода, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I 2). Аста т (от др. -греч. ἄστατος — «неустойчивый» ) — элемент 17 -й группы периодической таблицы химических элементов, шестого периода, с атомным номером 85[2]. Обозначается символом At (лат. Astatium). Радиоактивен. Простое вещество астат при нормальных условиях — нестабильные кристаллы тёмносинего цвета. Молекула астата, по всей видимости, двухатомна (формула At 2). Унунсе птий или эка-астат — временное наименование для химического элемента с атомным номером 117. Временное обозначение — Uus. Период полураспада более устойчивого из двух известных изотопов 294 Uus составляет около 78 миллисекунд. Формально относится к галогенам, однако его химические свойства ещё не изучены и могут отличаться от характерных для этой группы элементов.
Ио д (от др. -греч. — «фиолетовый» ) — элемент 17 -й группы периодической таблицы химических элементов, пятого периода, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I 2). Аста т (от др. -греч. ἄστατος — «неустойчивый» ) — элемент 17 -й группы периодической таблицы химических элементов, шестого периода, с атомным номером 85[2]. Обозначается символом At (лат. Astatium). Радиоактивен. Простое вещество астат при нормальных условиях — нестабильные кристаллы тёмносинего цвета. Молекула астата, по всей видимости, двухатомна (формула At 2). Унунсе птий или эка-астат — временное наименование для химического элемента с атомным номером 117. Временное обозначение — Uus. Период полураспада более устойчивого из двух известных изотопов 294 Uus составляет около 78 миллисекунд. Формально относится к галогенам, однако его химические свойства ещё не изучены и могут отличаться от характерных для этой группы элементов.
 ФТОР Открытие фтора Выделение газообразного фтора из фторсодержащих веществ оказалось одной из самых трудных экспериментальных задач. Фтор обладает исключительной реакционной способностью; причем часто его взаимодействие с другими веществами происходит с воспламенением и взрывом. Первыми жертвами фтора были два члена Ирландской Академии наук братья Георг и Томас Нокс скончался от отравления фтороводородом, а Георг стал инвалидом. Следующей жертвой стал бельгийский химик П. Лайет. Мученическую смерть при проведении опытов по выделению фтора принял французский химик Джером Никлес. Отравились, надышавшись небольшими количествами фтороводорода, а также получили серьезные ожоги французские химики Жозеф Гей-Люссак, Луи Тенар и английский химик Гемфри Дэви. При попытках выделить фтор при помощи электролиза его соединений нанесли ущерб своему здоровью французский химик Эдмон Фреми и английский электрохимик Георг Гор. Только в 1886 году французскому химику Анри Муассану сравнительно безболезненно удалось получить фтор. Муассан случайно обнаружил, что при электролизе смеси жидкого безводного HF и гидродифторида калия (KHF 2) в платиновом сосуде на аноде выделяется светло-желтый газ со специфическим резким запахом. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз ученого был закрыт черной повязкой: Нобелевская премия по химии была присуждена Муассану в 1906 г "в признание большого объема исследований получения элемента фтора и введения в лабораторную и промышленную практику электрической печи, названной его именем". Анри Муассан (1852 – 1907
ФТОР Открытие фтора Выделение газообразного фтора из фторсодержащих веществ оказалось одной из самых трудных экспериментальных задач. Фтор обладает исключительной реакционной способностью; причем часто его взаимодействие с другими веществами происходит с воспламенением и взрывом. Первыми жертвами фтора были два члена Ирландской Академии наук братья Георг и Томас Нокс скончался от отравления фтороводородом, а Георг стал инвалидом. Следующей жертвой стал бельгийский химик П. Лайет. Мученическую смерть при проведении опытов по выделению фтора принял французский химик Джером Никлес. Отравились, надышавшись небольшими количествами фтороводорода, а также получили серьезные ожоги французские химики Жозеф Гей-Люссак, Луи Тенар и английский химик Гемфри Дэви. При попытках выделить фтор при помощи электролиза его соединений нанесли ущерб своему здоровью французский химик Эдмон Фреми и английский электрохимик Георг Гор. Только в 1886 году французскому химику Анри Муассану сравнительно безболезненно удалось получить фтор. Муассан случайно обнаружил, что при электролизе смеси жидкого безводного HF и гидродифторида калия (KHF 2) в платиновом сосуде на аноде выделяется светло-желтый газ со специфическим резким запахом. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз ученого был закрыт черной повязкой: Нобелевская премия по химии была присуждена Муассану в 1906 г "в признание большого объема исследований получения элемента фтора и введения в лабораторную и промышленную практику электрической печи, названной его именем". Анри Муассан (1852 – 1907
 ПОЛУЧЕНИЕ ФТОРА Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение. Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
ПОЛУЧЕНИЕ ФТОРА Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение. Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
 ХЛОР Первооткрывателем хлора оказался шведский аптекарь Карл Шееле, химическая интуиция которого была поистине поразительной, по словам французского химика Жана Батиста Дюма, Шееле "не мог прикоснуться к какому-либо телу без того, чтобы сделать открытие". В 32 года он был удостоен звания члена Стокгольмской академии наук, хотя был всего лишь аптекарским помощником, в том же году он получил место управляющего аптекой, принадлежавшей вдове Маргарите Соннеман, которая за два дня до смерти Шееле стала его женой. Вот как описал Шееле свой опыт, выполненный в 1774 году: "Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, окрасившим его в желтый цвет: Газ имел желтозеленый цвет, пронзительный запах": Современное обозначение этой реакции таково: Mn. O 2 + 4 HCl = Cl 2 + Mn. Cl 2 + 2 H 2 O. В 1812 году французский химик Гей-Люссак дал этому газу современное название - хлор, что в переводе с греческого означает желто-зеленый. Карл Вильгельм Шееле (1742 – 1786)
ХЛОР Первооткрывателем хлора оказался шведский аптекарь Карл Шееле, химическая интуиция которого была поистине поразительной, по словам французского химика Жана Батиста Дюма, Шееле "не мог прикоснуться к какому-либо телу без того, чтобы сделать открытие". В 32 года он был удостоен звания члена Стокгольмской академии наук, хотя был всего лишь аптекарским помощником, в том же году он получил место управляющего аптекой, принадлежавшей вдове Маргарите Соннеман, которая за два дня до смерти Шееле стала его женой. Вот как описал Шееле свой опыт, выполненный в 1774 году: "Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, окрасившим его в желтый цвет: Газ имел желтозеленый цвет, пронзительный запах": Современное обозначение этой реакции таково: Mn. O 2 + 4 HCl = Cl 2 + Mn. Cl 2 + 2 H 2 O. В 1812 году французский химик Гей-Люссак дал этому газу современное название - хлор, что в переводе с греческого означает желто-зеленый. Карл Вильгельм Шееле (1742 – 1786)
 ПОЛУЧЕНИЕ ХЛОРА Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение. Может быть получен при взаимодействии перманганата калия с соляной кислотой: Метод Шееле Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой: Электрохимические методы Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой:
ПОЛУЧЕНИЕ ХЛОРА Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение. Может быть получен при взаимодействии перманганата калия с соляной кислотой: Метод Шееле Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой: Электрохимические методы Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой:
 БРОМ Открытие брома Бром был открыт двадцатичетырехлетним лаборантом Антуаном. Жеромом Баларом. Балар изучал маточные рассолы южных соляных болот Франции. Во время одного из опытов, когда он подействовал на рассол хлором, он заметил появление весьма интенсивной желтой окраски, вызванной реакцией взаимодействия содержащегося в растворе бромида натрия с хлором. Через несколько лет напряженной работы Балар выделил необходимое количество темно-бурой жидкости, названной им муридом. В Парижской Академии наук Гей-Люссак и Тенар подтвердили открытие Баларом нового простого вещества, но нашли название неудачным и предложили свое - "бром", что в переводе с греческого означало зловонный. Впоследствии французский химик Шарль Жерар, не получивший кафедру химии во Французском колледже, которую передали Балару, высоко оценив открытие им брома, не смог удержаться от резкого восклицания : "Это не Балар открыт бром, а бром открыл Балара!" Антуан Жером Балар (1802 – 1876)
БРОМ Открытие брома Бром был открыт двадцатичетырехлетним лаборантом Антуаном. Жеромом Баларом. Балар изучал маточные рассолы южных соляных болот Франции. Во время одного из опытов, когда он подействовал на рассол хлором, он заметил появление весьма интенсивной желтой окраски, вызванной реакцией взаимодействия содержащегося в растворе бромида натрия с хлором. Через несколько лет напряженной работы Балар выделил необходимое количество темно-бурой жидкости, названной им муридом. В Парижской Академии наук Гей-Люссак и Тенар подтвердили открытие Баларом нового простого вещества, но нашли название неудачным и предложили свое - "бром", что в переводе с греческого означало зловонный. Впоследствии французский химик Шарль Жерар, не получивший кафедру химии во Французском колледже, которую передали Балару, высоко оценив открытие им брома, не смог удержаться от резкого восклицания : "Это не Балар открыт бром, а бром открыл Балара!" Антуан Жером Балар (1802 – 1876)
 ПОЛУЧЕНИЕ БРОМА Для получения брома используют морскую воду, озерные и подземные рассолы, а также щелока калийного производства. Бром получают химическим путём из рассола Br−:
ПОЛУЧЕНИЕ БРОМА Для получения брома используют морскую воду, озерные и подземные рассолы, а также щелока калийного производства. Бром получают химическим путём из рассола Br−:
 ЙОД В 1811 году французский химик-технолог и фармацевт Бернар Куртуа открыл иод. Друзья его рассказывают любопытные подробности этого открытия. У Куртуа был любимый кот, который во время обеда сидел обычно на плече своего хозяина. Куртуа часто обедал в лаборатории. В один из дней во время обеда кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около лабораторного стола. В одной бутылке Куртуа приготовил для опыта суспензию золы водорослей (содержащей иодид натрия) в этаноле, а в другой находилась концентрированная серная кислота. Бутылки разбились и жидкости смешались. С пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде мельчайших чернофиолетовых кристалликов с металлическим блеском и едким запахом. Это и был новый химический элемент иод. Бернар Куртуа (1777 – 1838 )
ЙОД В 1811 году французский химик-технолог и фармацевт Бернар Куртуа открыл иод. Друзья его рассказывают любопытные подробности этого открытия. У Куртуа был любимый кот, который во время обеда сидел обычно на плече своего хозяина. Куртуа часто обедал в лаборатории. В один из дней во время обеда кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около лабораторного стола. В одной бутылке Куртуа приготовил для опыта суспензию золы водорослей (содержащей иодид натрия) в этаноле, а в другой находилась концентрированная серная кислота. Бутылки разбились и жидкости смешались. С пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде мельчайших чернофиолетовых кристалликов с металлическим блеском и едким запахом. Это и был новый химический элемент иод. Бернар Куртуа (1777 – 1838 )
 ПОЛУЧЕНИЕ ЙОДА: 1. Переработка природных накопителей йода - морских водорослей и получение йода из их золы. 2. Получение йода из отходов селитряного производства - маточных растворов чилийской (натриевой) селитры, содержащей до 0, 4 % йода в виде йодата и йодида натрия. 3. Получение йода из природных йодсодержащих растворов, например воды некоторых соленых озер или попутных (буровых) нефтяных вод, содержащих обычно 20 -40 мг/л йода в виде йодидов (местами 1 литр этих вод содержит свыше 100 мг йода). 4. Ионитный способ, основанный на избирательном поглощении йода особыми химическими соединениями высокомолекулярными ионообменными смолами.
ПОЛУЧЕНИЕ ЙОДА: 1. Переработка природных накопителей йода - морских водорослей и получение йода из их золы. 2. Получение йода из отходов селитряного производства - маточных растворов чилийской (натриевой) селитры, содержащей до 0, 4 % йода в виде йодата и йодида натрия. 3. Получение йода из природных йодсодержащих растворов, например воды некоторых соленых озер или попутных (буровых) нефтяных вод, содержащих обычно 20 -40 мг/л йода в виде йодидов (местами 1 литр этих вод содержит свыше 100 мг йода). 4. Ионитный способ, основанный на избирательном поглощении йода особыми химическими соединениями высокомолекулярными ионообменными смолами.
 АСТАТ Предсказан (как «эка-иод» ) Д. И. Менделеевым. В 1931 Ф. Аллисон с сотрудниками (Алабамский политехнический институт) сообщили об открытии этого элемента в природе и предложили для него название «алабамин» (Ab), однако этот результат не подтвердился. Впервые астат был получен искусственно в 1940 Д. Корсоном, К. Р. Маккензи и Э. Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211 At они облучали висмут альфачастицами. В 1943— 1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов. В русской терминологии элемент до 1962 года назывался «астатин» . Также предлагались названия «гельветин» (в честь Гельвеции — древнего названия Швейцарии) и «лептин» (от греч. «слабый, шаткий» ).
АСТАТ Предсказан (как «эка-иод» ) Д. И. Менделеевым. В 1931 Ф. Аллисон с сотрудниками (Алабамский политехнический институт) сообщили об открытии этого элемента в природе и предложили для него название «алабамин» (Ab), однако этот результат не подтвердился. Впервые астат был получен искусственно в 1940 Д. Корсоном, К. Р. Маккензи и Э. Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211 At они облучали висмут альфачастицами. В 1943— 1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов. В русской терминологии элемент до 1962 года назывался «астатин» . Также предлагались названия «гельветин» (в честь Гельвеции — древнего названия Швейцарии) и «лептин» (от греч. «слабый, шаткий» ).
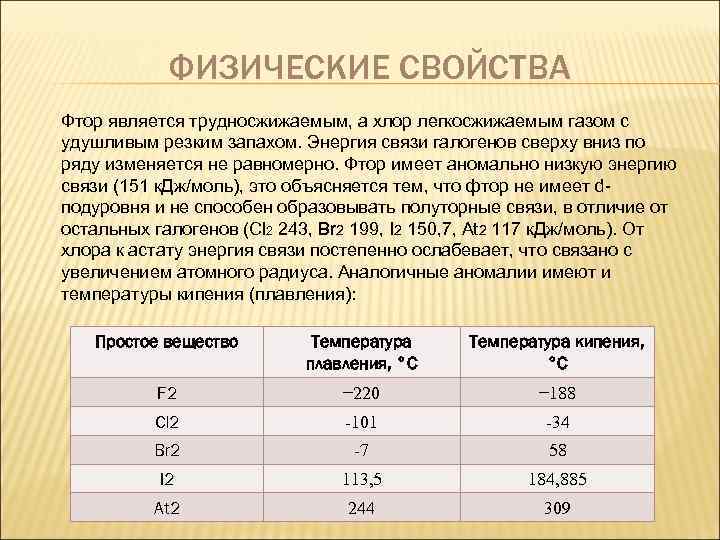 ФИЗИЧЕСКИЕ СВОЙСТВА Фтор является трудносжижаемым, а хлор легкосжижаемым газом с удушливым резким запахом. Энергия связи галогенов сверху вниз по ряду изменяется не равномерно. Фтор имеет аномально низкую энергию связи (151 к. Дж/моль), это объясняется тем, что фтор не имеет dподуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (Cl 2 243, Br 2 199, I 2 150, 7, At 2 117 к. Дж/моль). От хлора к астату энергия связи постепенно ослабевает, что связано с увеличением атомного радиуса. Аналогичные аномалии имеют и температуры кипения (плавления): Простое вещество Температура плавления, °C Температура кипения, °C F 2 − 220 − 188 Cl 2 -101 -34 Br 2 -7 58 I 2 113, 5 184, 885 At 2 244 309
ФИЗИЧЕСКИЕ СВОЙСТВА Фтор является трудносжижаемым, а хлор легкосжижаемым газом с удушливым резким запахом. Энергия связи галогенов сверху вниз по ряду изменяется не равномерно. Фтор имеет аномально низкую энергию связи (151 к. Дж/моль), это объясняется тем, что фтор не имеет dподуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (Cl 2 243, Br 2 199, I 2 150, 7, At 2 117 к. Дж/моль). От хлора к астату энергия связи постепенно ослабевает, что связано с увеличением атомного радиуса. Аналогичные аномалии имеют и температуры кипения (плавления): Простое вещество Температура плавления, °C Температура кипения, °C F 2 − 220 − 188 Cl 2 -101 -34 Br 2 -7 58 I 2 113, 5 184, 885 At 2 244 309
 ХИМИЧЕСКИЕ СВОЙСТВА Галогены взаимодействуют почти со всеми простыми веществами. 1. Наиболее энергично протекает реакция с металлами. При нагревании фтор взаимодействует со всеми металлами (в том числе с золотом и платиной); на холоду реагирует с щелочными металлами, свинцом, железом. С медью, никелем реакция на холоду не протекает, поскольку на поверхности металла образуется защитный слой фторида, предохраняющий металл от дальнейшего окисления. Хлор энергично реагирует с щелочными металлами, а с медью, железом и оловом реакция протекает при нагревании. Аналогично ведут себя бром и иод. Взаимодействие галогенов с металлами является экзотермическим процессом и может быть выражена уравнением: 2 М+n. Ha. I 2=2 МНа. I H<0 2. Галогены с кислородом и азотом непосредственно не взаимодействуют. 3. Хорошо реагируют галогены с другими неметаллами, например: 2 Р+3 Сl 2=2 РСl 3 2 Р+5 Сl 2=2 РСl 5 Si+2 F 2=Si. F 4 4. Галогены (кроме фтора) не реагируют с инертными газами. Хе + F 2 = Xe. F 2 + 152 к. Дж.
ХИМИЧЕСКИЕ СВОЙСТВА Галогены взаимодействуют почти со всеми простыми веществами. 1. Наиболее энергично протекает реакция с металлами. При нагревании фтор взаимодействует со всеми металлами (в том числе с золотом и платиной); на холоду реагирует с щелочными металлами, свинцом, железом. С медью, никелем реакция на холоду не протекает, поскольку на поверхности металла образуется защитный слой фторида, предохраняющий металл от дальнейшего окисления. Хлор энергично реагирует с щелочными металлами, а с медью, железом и оловом реакция протекает при нагревании. Аналогично ведут себя бром и иод. Взаимодействие галогенов с металлами является экзотермическим процессом и может быть выражена уравнением: 2 М+n. Ha. I 2=2 МНа. I H<0 2. Галогены с кислородом и азотом непосредственно не взаимодействуют. 3. Хорошо реагируют галогены с другими неметаллами, например: 2 Р+3 Сl 2=2 РСl 3 2 Р+5 Сl 2=2 РСl 5 Si+2 F 2=Si. F 4 4. Галогены (кроме фтора) не реагируют с инертными газами. Хе + F 2 = Xe. F 2 + 152 к. Дж.
 5. При обычных условиях фтор реагирует с водородом в темноте со взрывом. Взаимодействие хлора с водородом протекает на ярком солнечном свету. Бром и водород взаимодействуют только при нагревании, а иод с водородом реагирует при сильном нагревании (до 350°С), но этот процесс обратимый. H 2+F 2=2 HF Н 2+Сl 2=2 НСl Н 2+Br 2=2 НBr Н 2+I 2 · 350° 2 HI Галоген в данной реакции является окислителем. Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму: Cl 2 + hν → 2 Cl, Cl + Н 2 → HCl + Н, Н + Cl 2 → HCl + Cl, Cl + Н 2 → HCl + Н и т. д. 6. Реакционная способность галогенов снижается в ряду F—Сl — Br — I. Поэтому предыдущий элемент вытесняет последующий из кислот типа НГ (Г — галоген) и их солей. В этом случае активность убывает: F 2>Сl 2>Br 2>I 2
5. При обычных условиях фтор реагирует с водородом в темноте со взрывом. Взаимодействие хлора с водородом протекает на ярком солнечном свету. Бром и водород взаимодействуют только при нагревании, а иод с водородом реагирует при сильном нагревании (до 350°С), но этот процесс обратимый. H 2+F 2=2 HF Н 2+Сl 2=2 НСl Н 2+Br 2=2 НBr Н 2+I 2 · 350° 2 HI Галоген в данной реакции является окислителем. Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму: Cl 2 + hν → 2 Cl, Cl + Н 2 → HCl + Н, Н + Cl 2 → HCl + Cl, Cl + Н 2 → HCl + Н и т. д. 6. Реакционная способность галогенов снижается в ряду F—Сl — Br — I. Поэтому предыдущий элемент вытесняет последующий из кислот типа НГ (Г — галоген) и их солей. В этом случае активность убывает: F 2>Сl 2>Br 2>I 2
 7. Реагируют с водой. Фтор реагирует с водой со взрывом с образованием атомарного кислорода: H 2 O+F 2=2 HF+O Остальные галогены реагируют с водой по следующей схеме: Гал 02+Н 2 О·НГал-1+НГал+1 О Эта реакция является реакцией диспропорционирования, когда галоген является одновременно и восстановителем, и окислителем, например: Сl 2+Н 2 OНСl+НСl. O Cl 2+H 2 OH++Cl-+HCl. O Сl°+1 e-Сl-Cl°-1 e-Сl+ 8. Галогены способны отнимать водород от других веществ, Скипидар +Сl 2 = НС 1+углерод Хлор замещает водород в предельных углеводородах: СН 4+Сl 2=СН 3 Сl+НСl
7. Реагируют с водой. Фтор реагирует с водой со взрывом с образованием атомарного кислорода: H 2 O+F 2=2 HF+O Остальные галогены реагируют с водой по следующей схеме: Гал 02+Н 2 О·НГал-1+НГал+1 О Эта реакция является реакцией диспропорционирования, когда галоген является одновременно и восстановителем, и окислителем, например: Сl 2+Н 2 OНСl+НСl. O Cl 2+H 2 OH++Cl-+HCl. O Сl°+1 e-Сl-Cl°-1 e-Сl+ 8. Галогены способны отнимать водород от других веществ, Скипидар +Сl 2 = НС 1+углерод Хлор замещает водород в предельных углеводородах: СН 4+Сl 2=СН 3 Сl+НСl
 Фтор • • • ПРИМЕНЕНИЕ ГАЛОГЕНОВ В ядерной промышленности(UF 6) В металлургии(Ca. F 2) В химическом синтезе(HF, Br. F 3) В холодильном деле(CF 2 Cl 2, …) Жидкий фтор - окислитель ракетных топлив. Хлор • • В органическом и полимерном синтезе(ПВХ, …) В химической промышленности(галогениды) В очистке воды и как отбеливатель(Cl 2) Для хлорирования руд с целью извлечения титана, ниобия, циркония и др. Бром • • В органическом синтезе(Br 2) В фотографии(Ag. Br) В фармацевтике Для повышения детонационной стойкости бензинов Йод • • В металлургии(I 2) Для деревообработки(KI, KI 3) В аналитике(иодометрия) В пищевых добавках(Na. I)
Фтор • • • ПРИМЕНЕНИЕ ГАЛОГЕНОВ В ядерной промышленности(UF 6) В металлургии(Ca. F 2) В химическом синтезе(HF, Br. F 3) В холодильном деле(CF 2 Cl 2, …) Жидкий фтор - окислитель ракетных топлив. Хлор • • В органическом и полимерном синтезе(ПВХ, …) В химической промышленности(галогениды) В очистке воды и как отбеливатель(Cl 2) Для хлорирования руд с целью извлечения титана, ниобия, циркония и др. Бром • • В органическом синтезе(Br 2) В фотографии(Ag. Br) В фармацевтике Для повышения детонационной стойкости бензинов Йод • • В металлургии(I 2) Для деревообработки(KI, KI 3) В аналитике(иодометрия) В пищевых добавках(Na. I)
 ПЕРСПЕКТИВЫ РАЗВИТИЯ • Широкое применение получили многочисленные соединения фтора фтористый водород, алюминия фторис, кремне-фториды, фторсульфоновая кислота (растворитель, катализатор, реагент для получения органических соединений, содержащих группу - SO 2 F), ВF 3 (катализатор), фторорганические соединения и др. • В промышленности применение иода пока незначительно по объему, но весьма перспективно. Так, на термическом разложении иодидов основано получение высокочистых металлов. • Широкое использование галогены находят в нефтехимической и нефтеперерабатывающей промышленности. Так на ОАО “НКНХ” получают галобутил каучуки. В процессе бромирования бутил каучука получают бромбутилкаучук (ББК), а при добавлении хлора-хлорбутилкаучук (ХБК). Эти виды каучуков получили большое применение в резинотехнической промышленности, и для изготовления изделий медицинского назначения.
ПЕРСПЕКТИВЫ РАЗВИТИЯ • Широкое применение получили многочисленные соединения фтора фтористый водород, алюминия фторис, кремне-фториды, фторсульфоновая кислота (растворитель, катализатор, реагент для получения органических соединений, содержащих группу - SO 2 F), ВF 3 (катализатор), фторорганические соединения и др. • В промышленности применение иода пока незначительно по объему, но весьма перспективно. Так, на термическом разложении иодидов основано получение высокочистых металлов. • Широкое использование галогены находят в нефтехимической и нефтеперерабатывающей промышленности. Так на ОАО “НКНХ” получают галобутил каучуки. В процессе бромирования бутил каучука получают бромбутилкаучук (ББК), а при добавлении хлора-хлорбутилкаучук (ХБК). Эти виды каучуков получили большое применение в резинотехнической промышленности, и для изготовления изделий медицинского назначения.


