3234_04h.ppt
- Количество слайдов: 23
 Презентація на тему: “Ернест Резерфорд” Виконав учень 10 -А класу Черняхівської гімназії Хробуст Петро
Презентація на тему: “Ернест Резерфорд” Виконав учень 10 -А класу Черняхівської гімназії Хробуст Петро
 Эрнест Резерфорд 30 августа 1871 г. – 19 октября 1937 г.
Эрнест Резерфорд 30 августа 1871 г. – 19 октября 1937 г.
 Наукова діяльність u Відкрив альфа-і бета-випромінювання, короткоживучий ізотоп радону (їх декілька, сам радон раніше відкрив німецький хімік) і безліч ізотопів. Пояснив на основі властивостей радону радіоактивність торію, відкрив і пояснив радіоактивне перетворення хімічних елементів, створив теорію радіоактивного розпаду, розщепив атом азоту, виявив протон. Довів, що альфа-частинки - ядро гелію. Поставивши досвід з розсіювання альфа-частинок на металевій фользі, вивів формулу Резерфорда. Виходячи з її аналізу, зробив висновок про існування в атомі масивного ядра. Створив планетарну теорію будови атомів. По ній, атом складається з ядра, що знаходиться в центрі, і електронів, що обертаються по орбітах навколо ядра. Першим відкрив утворення нових хімічних елементів при розпаді важких хімічних радіоактивних елементів. Уточнив на 30% відношення заряду до маси електрона. Написав і опублікував 3 томи робіт. Всі роботи його експериментальні. 12 учнів Резерфорда стали лауреатами Нобелівської премії з фізики та хімії. Один з найбільш талановитих учнів Генрі Мозлі, експериментально показав фізичний зміст періодичного закону, загинув в 1915 році на Галліполі в ході Дарданелльской операції. У Монреалі працював з Ф. Содді, О. Ханом; в Манчестері - з Г. Гейгером (зокрема, допоміг того розробити лічильник для автоматичного підрахунку числа іонізуючих частинок), в Кембриджі - з Н. Бором, П. Капіцею та багатьма іншими знаменитими в майбутньому вченими.
Наукова діяльність u Відкрив альфа-і бета-випромінювання, короткоживучий ізотоп радону (їх декілька, сам радон раніше відкрив німецький хімік) і безліч ізотопів. Пояснив на основі властивостей радону радіоактивність торію, відкрив і пояснив радіоактивне перетворення хімічних елементів, створив теорію радіоактивного розпаду, розщепив атом азоту, виявив протон. Довів, що альфа-частинки - ядро гелію. Поставивши досвід з розсіювання альфа-частинок на металевій фользі, вивів формулу Резерфорда. Виходячи з її аналізу, зробив висновок про існування в атомі масивного ядра. Створив планетарну теорію будови атомів. По ній, атом складається з ядра, що знаходиться в центрі, і електронів, що обертаються по орбітах навколо ядра. Першим відкрив утворення нових хімічних елементів при розпаді важких хімічних радіоактивних елементів. Уточнив на 30% відношення заряду до маси електрона. Написав і опублікував 3 томи робіт. Всі роботи його експериментальні. 12 учнів Резерфорда стали лауреатами Нобелівської премії з фізики та хімії. Один з найбільш талановитих учнів Генрі Мозлі, експериментально показав фізичний зміст періодичного закону, загинув в 1915 році на Галліполі в ході Дарданелльской операції. У Монреалі працював з Ф. Содді, О. Ханом; в Манчестері - з Г. Гейгером (зокрема, допоміг того розробити лічильник для автоматичного підрахунку числа іонізуючих частинок), в Кембриджі - з Н. Бором, П. Капіцею та багатьма іншими знаменитими в майбутньому вченими.
 Цікаві факти u u u За добру вдачу студенти прозвали Резерфорда «Крокодилом» . У 1931 році «Крокодил» виклопотав 15 000 фунтів стерлінгів на будівництво та обладнання спеціального будівлі лабораторії для Капіци. У лютому 1933 року в Кембриджі відбулося урочисте відкриття лабораторії. На торцевій стіні 2 - поверхового будинку був висічений з каменю величезний, на всю стіну крокодил. Його на замовлення Капіци зробив відомий скульптор Ерік Гілл. Резерфорд сам пояснив, що це він. Вхідні двері відкрили позолоченим ключем у формі крокодила. За відомостями Данила Даніна ("Резерфорд" з циклу ЖЗЛ): 25 жовтня 21 -го року. . . (Уривок з листа Капіци матері) Відносини З Резерфордом, Або, як я його називаю, Крокодилом, Поліпшуються. [По Словам Іва, Капіца Тан Пояснював Придумане Їм Прізвисько: «Це Тварина Ніколи Не Повертає Назад І Бо може символізувати Резерфордовского Проникливість І Його Стрімкий Просування Вперед» . Капіца додавав, що «В Росії На Крокодила Дивляться З Сумішшю Жаху І Захоплення» . ] Е. Резерфорд, який відкрив ядро атома, негативно відгукувався про перспективи ядерної енергетики: «Кожен, хто сподівається, що перетворення атомних ядер стануть джерелом енергії, сповідує дурниця» Коли Петро Капіца приїхав працювати в Кембридж до Резерфорду, то він йому сказав що штат лабораторії вже укомплектований. Тоді Капіца запитав: - Яку допустиму похибку ви допускаєте в експериментах? - Зазвичай близько 3% - А скільки людей працює в лабораторії? - 30 - Тоді 1 людина становить приблизно 3% від 30 Резерфорд розсміявся і прийняв Капицю в якості «допустимої помилки» . Отримавши в 1908 році звістка про присудження йому Нобелівської премії з хімії, Резерфорд заявив: «Вся наука - або фізика, або колекціонування марок» (All science is either physics or stamp collecting) Правнук Ернста Резерфорда - Майкл Резерфорд - відомий завдяки участі в прог-рок групі Genesis і своїй групі Mike & the Mechanics.
Цікаві факти u u u За добру вдачу студенти прозвали Резерфорда «Крокодилом» . У 1931 році «Крокодил» виклопотав 15 000 фунтів стерлінгів на будівництво та обладнання спеціального будівлі лабораторії для Капіци. У лютому 1933 року в Кембриджі відбулося урочисте відкриття лабораторії. На торцевій стіні 2 - поверхового будинку був висічений з каменю величезний, на всю стіну крокодил. Його на замовлення Капіци зробив відомий скульптор Ерік Гілл. Резерфорд сам пояснив, що це він. Вхідні двері відкрили позолоченим ключем у формі крокодила. За відомостями Данила Даніна ("Резерфорд" з циклу ЖЗЛ): 25 жовтня 21 -го року. . . (Уривок з листа Капіци матері) Відносини З Резерфордом, Або, як я його називаю, Крокодилом, Поліпшуються. [По Словам Іва, Капіца Тан Пояснював Придумане Їм Прізвисько: «Це Тварина Ніколи Не Повертає Назад І Бо може символізувати Резерфордовского Проникливість І Його Стрімкий Просування Вперед» . Капіца додавав, що «В Росії На Крокодила Дивляться З Сумішшю Жаху І Захоплення» . ] Е. Резерфорд, який відкрив ядро атома, негативно відгукувався про перспективи ядерної енергетики: «Кожен, хто сподівається, що перетворення атомних ядер стануть джерелом енергії, сповідує дурниця» Коли Петро Капіца приїхав працювати в Кембридж до Резерфорду, то він йому сказав що штат лабораторії вже укомплектований. Тоді Капіца запитав: - Яку допустиму похибку ви допускаєте в експериментах? - Зазвичай близько 3% - А скільки людей працює в лабораторії? - 30 - Тоді 1 людина становить приблизно 3% від 30 Резерфорд розсміявся і прийняв Капицю в якості «допустимої помилки» . Отримавши в 1908 році звістка про присудження йому Нобелівської премії з хімії, Резерфорд заявив: «Вся наука - або фізика, або колекціонування марок» (All science is either physics or stamp collecting) Правнук Ернста Резерфорда - Майкл Резерфорд - відомий завдяки участі в прог-рок групі Genesis і своїй групі Mike & the Mechanics.
 Эрнест Резерфорд считается величайшим физикомэкспериментатором двадцатого столетия. Он является центральной фигурой в наших познаниях в области радиоактивности, а также человеком, который положил начало ядерной физике. Помимо своего огромного теоретического значения его открытия получили широкий спектр применения, включая: ядерное оружие, атомные электростанции, радиоактивные исчисления и исследования радиации. Влияние трудов Резерфорда на мир огромно. Оно продолжает расти и, похоже, еще увеличится в будущем.
Эрнест Резерфорд считается величайшим физикомэкспериментатором двадцатого столетия. Он является центральной фигурой в наших познаниях в области радиоактивности, а также человеком, который положил начало ядерной физике. Помимо своего огромного теоретического значения его открытия получили широкий спектр применения, включая: ядерное оружие, атомные электростанции, радиоактивные исчисления и исследования радиации. Влияние трудов Резерфорда на мир огромно. Оно продолжает расти и, похоже, еще увеличится в будущем.
 Эрнест Резерфорд Родился в семье колесного мастера Джеймса Резерфорда и его жены учительницы Марты Томпсон. Кроме Эрнеста в семье было еще 6 сыновей и 5 дочерей.
Эрнест Резерфорд Родился в семье колесного мастера Джеймса Резерфорда и его жены учительницы Марты Томпсон. Кроме Эрнеста в семье было еще 6 сыновей и 5 дочерей.
 В Новой Зеландии в 1889 он поступил в Кентерберийский колледж и к двадцати трем годам получил три степени (бакалавра гуманитарных наук, бакалавра естественных наук, магистра гуманитарных наук). На следующий год ему присудили право на обучение в Кембриждском университете в Англии, где он провел три года как студентисследователь под руководством Дж. Томсона, одного из ведущих ученых того времени. В двадцать семь лет Резерфорд стал профессором физики в университете Макджил в Канаде. Там он работал девять лет и в 1907 году вернулся в Англию, чтобы возглавить физический факультет Манчестерского университета. В 1919 году Резерфорд вернулся в Кембридж, на этот раз как директор Кавендишской лаборатории, и оставался на этом посту до конца жизни.
В Новой Зеландии в 1889 он поступил в Кентерберийский колледж и к двадцати трем годам получил три степени (бакалавра гуманитарных наук, бакалавра естественных наук, магистра гуманитарных наук). На следующий год ему присудили право на обучение в Кембриждском университете в Англии, где он провел три года как студентисследователь под руководством Дж. Томсона, одного из ведущих ученых того времени. В двадцать семь лет Резерфорд стал профессором физики в университете Макджил в Канаде. Там он работал девять лет и в 1907 году вернулся в Англию, чтобы возглавить физический факультет Манчестерского университета. В 1919 году Резерфорд вернулся в Кембридж, на этот раз как директор Кавендишской лаборатории, и оставался на этом посту до конца жизни.
 Одно из первых открытий Резерфорда заключалось в том, что радиоактивное излучение урана состоит из двух различных компонентов, которые ученый назвал альфа- и бета-лучи. Позже он продемонстрировал природу каждого компонента (они состоят из быстродвижущихся частиц) и показал, что существует еще и третий компонент, который назвал гамма-лучами.
Одно из первых открытий Резерфорда заключалось в том, что радиоактивное излучение урана состоит из двух различных компонентов, которые ученый назвал альфа- и бета-лучи. Позже он продемонстрировал природу каждого компонента (они состоят из быстродвижущихся частиц) и показал, что существует еще и третий компонент, который назвал гамма-лучами.
 Но Резерфорд обнаружил, что некоторые альфа -частицы, проходя сквозь золотую фольгу, отклоняются очень сильно. Фактически некоторые вообще отлетают назад! Почувствовав, что за этим кроется нечто важное, ученый тщательно посчитал количество частиц, полетевших в каждом направлении. Затем путем сложного, но вполне убедительного математического анализа он показал единственный путь, которым можно было объяснить результаты экспериментов: атом золота состоял почти полностью из пустого пространства, а практически вся атомная масса была сконцентрирована в центре, в маленьком "ядре" атома!
Но Резерфорд обнаружил, что некоторые альфа -частицы, проходя сквозь золотую фольгу, отклоняются очень сильно. Фактически некоторые вообще отлетают назад! Почувствовав, что за этим кроется нечто важное, ученый тщательно посчитал количество частиц, полетевших в каждом направлении. Затем путем сложного, но вполне убедительного математического анализа он показал единственный путь, которым можно было объяснить результаты экспериментов: атом золота состоял почти полностью из пустого пространства, а практически вся атомная масса была сконцентрирована в центре, в маленьком "ядре" атома!
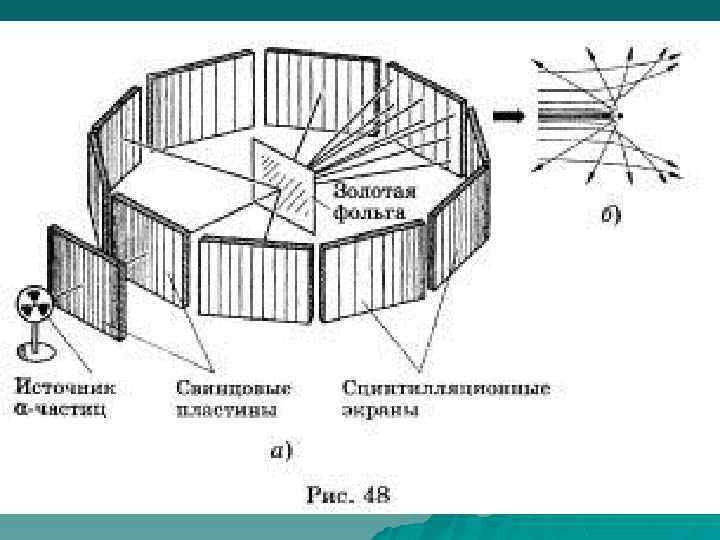
 Открытие Резерфорда также привело к появлению новой ветви науки: изучение атомного ядра. В 1919 году он добился успеха при трансформировании ядер азота в ядра кислорода, обстреливая первые быстродвижущимися альфа -частицами. Это было достижение, о котором мечтали древние алхимики.
Открытие Резерфорда также привело к появлению новой ветви науки: изучение атомного ядра. В 1919 году он добился успеха при трансформировании ядер азота в ядра кислорода, обстреливая первые быстродвижущимися альфа -частицами. Это было достижение, о котором мечтали древние алхимики.
 Личность Резерфорда постоянно поражала всех, кто с ним встречался. Он был крупным человеком с громким голосом, беспредельной энергией и заметным недостатком скромности. Когда коллеги отмечали сверхъестественную способность Резерфорда всегда находиться "на гребне волны" научных исследований, он сразу отвечал: "А почему бы и нет? Ведь это я вызвал волну, не так ли? " Немногие ученые стали бы возражать против этого утверждения.
Личность Резерфорда постоянно поражала всех, кто с ним встречался. Он был крупным человеком с громким голосом, беспредельной энергией и заметным недостатком скромности. Когда коллеги отмечали сверхъестественную способность Резерфорда всегда находиться "на гребне волны" научных исследований, он сразу отвечал: "А почему бы и нет? Ведь это я вызвал волну, не так ли? " Немногие ученые стали бы возражать против этого утверждения.
 Нобелівська премія u У 1908 році Резерфорду була присуджена Нобелівська премія з хімії «за проведені ним дослідження в області розпаду елементів в хімії радіоактивних речовин» . У своїй вступній промові від імені Шведської королівської академії наук К. Б. Хассельберг вказав на зв'язок між роботою, проведеною Резерфордом, і роботами Томсона, Анрі Беккереля, П'єра та Марі Кюрі. «Відкриття привели до приголомшливого висновку: хімічний елемент. . здатний перетворюватися в інші елементи » , - сказав Хассельберг. У своїй Нобелівській лекції Резерфорд відзначив: «Є всі підстави вважати, що альфа-частинки, які так вільно викидаються з більшості радіоактивних речовин, ідентичні за масою і складу і повинні складатися з ядер атомів гелію. Ми, отже, не можемо не прийти до висновку, що атоми основних радіоактивних елементів, таких як уран і торій, повинні будуватися, принаймні частково, з атомів гелію » . Після отримання Нобелівської премії Резерфорд зайнявся вивченням явища, яке спостерігалося при бомбардуванні пластинки тонкої золотої фольги альфа-частинками, випромінюваними таким радіоактивним елементом, як уран.
Нобелівська премія u У 1908 році Резерфорду була присуджена Нобелівська премія з хімії «за проведені ним дослідження в області розпаду елементів в хімії радіоактивних речовин» . У своїй вступній промові від імені Шведської королівської академії наук К. Б. Хассельберг вказав на зв'язок між роботою, проведеною Резерфордом, і роботами Томсона, Анрі Беккереля, П'єра та Марі Кюрі. «Відкриття привели до приголомшливого висновку: хімічний елемент. . здатний перетворюватися в інші елементи » , - сказав Хассельберг. У своїй Нобелівській лекції Резерфорд відзначив: «Є всі підстави вважати, що альфа-частинки, які так вільно викидаються з більшості радіоактивних речовин, ідентичні за масою і складу і повинні складатися з ядер атомів гелію. Ми, отже, не можемо не прийти до висновку, що атоми основних радіоактивних елементів, таких як уран і торій, повинні будуватися, принаймні частково, з атомів гелію » . Після отримання Нобелівської премії Резерфорд зайнявся вивченням явища, яке спостерігалося при бомбардуванні пластинки тонкої золотої фольги альфа-частинками, випромінюваними таким радіоактивним елементом, як уран.
 Модель атома Резерфорда
Модель атома Резерфорда
 Модель атома Резерфорда (Це цікаво) u При вивченні α-часток Резерфорд, виходячи з моделі Томсона, підрахував, що розсіювання αчасток не може давати великих кутів відхилень навіть при багатьох зіткненнях з частинкою. І тут Резерфорд звернувся до планетарної моделі. 7 березня 1911 року Резерфорд зробив у філософському товаристві в Манчестері доповідь “Розсіювання α і β-променів і будова атома”. У доповіді він, зокрема, говорив: “Розсіювання заряджених часток може бути пояснено, якщо припустити такий атом, що складається з центрального електричного заряду, зосередженого в точці й оточеного однорідним сферичним розподілом протилежної електрики рівної величини. При такому пристрої α і β-частки, коли вони проходять на близькій відстані від центра атома, отримують великі відхилення, хоча імовірність такого відхилення мала”. Бомбардування золотої фольги α-частинками проводили на такому пристрої. Важливим наслідком теорії Резерфорда була вказівка на заряд атомного центра, що Резерфорд поклав рівним ±Ne. Заряд виявився пропорційним атомній вазі. “Точне значення заряду центрального ядра не було визначено, - писав Резерфорд, - але для атома золота воно приблизно дорівнює 100 одиницям заряду”. З наступних досліджень і експериментів Гейгера і Мардсена, що почали перевірку формул Резерфорда, виникло уявлення про ядро, як стійку частину атома, що несе в собі майже всю масу атома й позитивним зарядом (Резерфорд вважав знак заряду невизначеним). При цьому число елементарних зарядів виявилося пропорційним атомній вазі. Заряд ядра виявився найважливішою характеристикою атома. У 1913 році було показано, що заряд ядра збігається з номером елемента в таблиці Менделєєва. Бор писав: ”Із самого початку було ясно, що завдяки великій масі ядра і його малої довжини в просторі порівняно з розмірами всього атома будова електронної системи повинне залежати майже винятково від повного електричного заряду ядра. Такі міркування відразу наводили на думку про те, що вся сукупність фізичних і хімічних властивостей кожного елемента може визначатися одним цілим числом.
Модель атома Резерфорда (Це цікаво) u При вивченні α-часток Резерфорд, виходячи з моделі Томсона, підрахував, що розсіювання αчасток не може давати великих кутів відхилень навіть при багатьох зіткненнях з частинкою. І тут Резерфорд звернувся до планетарної моделі. 7 березня 1911 року Резерфорд зробив у філософському товаристві в Манчестері доповідь “Розсіювання α і β-променів і будова атома”. У доповіді він, зокрема, говорив: “Розсіювання заряджених часток може бути пояснено, якщо припустити такий атом, що складається з центрального електричного заряду, зосередженого в точці й оточеного однорідним сферичним розподілом протилежної електрики рівної величини. При такому пристрої α і β-частки, коли вони проходять на близькій відстані від центра атома, отримують великі відхилення, хоча імовірність такого відхилення мала”. Бомбардування золотої фольги α-частинками проводили на такому пристрої. Важливим наслідком теорії Резерфорда була вказівка на заряд атомного центра, що Резерфорд поклав рівним ±Ne. Заряд виявився пропорційним атомній вазі. “Точне значення заряду центрального ядра не було визначено, - писав Резерфорд, - але для атома золота воно приблизно дорівнює 100 одиницям заряду”. З наступних досліджень і експериментів Гейгера і Мардсена, що почали перевірку формул Резерфорда, виникло уявлення про ядро, як стійку частину атома, що несе в собі майже всю масу атома й позитивним зарядом (Резерфорд вважав знак заряду невизначеним). При цьому число елементарних зарядів виявилося пропорційним атомній вазі. Заряд ядра виявився найважливішою характеристикою атома. У 1913 році було показано, що заряд ядра збігається з номером елемента в таблиці Менделєєва. Бор писав: ”Із самого початку було ясно, що завдяки великій масі ядра і його малої довжини в просторі порівняно з розмірами всього атома будова електронної системи повинне залежати майже винятково від повного електричного заряду ядра. Такі міркування відразу наводили на думку про те, що вся сукупність фізичних і хімічних властивостей кожного елемента може визначатися одним цілим числом.
 Модель атома Резерфорда (Це цікаво) u Ядерна модель атома Резерфорда одержала свій подальший розвиток завдяки роботам Нільса Бора, у яких вчення про будову атома нерозривно пов’язується з вченням про походження спектрів. Бор (Bohr) Нільс Хенрік Давид (1885 -1962) Лінійні спектри виходять при розкладанні світла що випускається розпеченими газами чи парами. Кожному елементу відповідає свій спектр, що відрізняється від спектрів інших елементів. Більшість металів дає дуже складні спектри, що містять величезне число ліній (у заліза до 5000), але зустрічаються і порівняно прості спектри. Після знайомства з Резерфордом Бор, відмовившись від вивчення електронної моделі, почав роботу в його групі. Звернувшись до планетарної моделі, Бор створив на її основі теорію атома Резерфорда-Бора. Резерфорд зрозумів революційний характер ідей Бора й обговорив з ним основи цієї теорії, висловив критичні зауваження, після чого статті Бора були опубліковані. Під час Першої Світової війни Бор продовжує працювати в лабораторії Резерфорда. У 1915 році він опублікував роботи “Про серійний спектр водню” і “Про квантову теорію випромінювання в структурі атома”. У 1916 році була опублікована стаття Зоммерфельда, де він розглянув рух електрона по еліптичних орбітах і узагальнив правила квантування Бора. Бор із захватом відгукнувся про цю статтю. Теорія атома після відкриттів Зоммерфельда стала називатися теорією Бора - Зоммерфельда. u У 1936 році Бор виступив зі статтею “Захоплення нейтрона і будова ядра”, у якій запропонував краплинну модель ядра і механізм захоплення нейтрона ядром. Дивно, але ні Бор, ні інші не могли відразу пророчити розподіл ядра, що підказується краплинною моделлю, поки на початку 1939 р. не був відкритий розподіл урану.
Модель атома Резерфорда (Це цікаво) u Ядерна модель атома Резерфорда одержала свій подальший розвиток завдяки роботам Нільса Бора, у яких вчення про будову атома нерозривно пов’язується з вченням про походження спектрів. Бор (Bohr) Нільс Хенрік Давид (1885 -1962) Лінійні спектри виходять при розкладанні світла що випускається розпеченими газами чи парами. Кожному елементу відповідає свій спектр, що відрізняється від спектрів інших елементів. Більшість металів дає дуже складні спектри, що містять величезне число ліній (у заліза до 5000), але зустрічаються і порівняно прості спектри. Після знайомства з Резерфордом Бор, відмовившись від вивчення електронної моделі, почав роботу в його групі. Звернувшись до планетарної моделі, Бор створив на її основі теорію атома Резерфорда-Бора. Резерфорд зрозумів революційний характер ідей Бора й обговорив з ним основи цієї теорії, висловив критичні зауваження, після чого статті Бора були опубліковані. Під час Першої Світової війни Бор продовжує працювати в лабораторії Резерфорда. У 1915 році він опублікував роботи “Про серійний спектр водню” і “Про квантову теорію випромінювання в структурі атома”. У 1916 році була опублікована стаття Зоммерфельда, де він розглянув рух електрона по еліптичних орбітах і узагальнив правила квантування Бора. Бор із захватом відгукнувся про цю статтю. Теорія атома після відкриттів Зоммерфельда стала називатися теорією Бора - Зоммерфельда. u У 1936 році Бор виступив зі статтею “Захоплення нейтрона і будова ядра”, у якій запропонував краплинну модель ядра і механізм захоплення нейтрона ядром. Дивно, але ні Бор, ні інші не могли відразу пророчити розподіл ядра, що підказується краплинною моделлю, поки на початку 1939 р. не був відкритий розподіл урану.
 Будова атома u Сусна теорія будови атомів базується на моделі Бора та дослідах Резерфорда, але тільки сучасні методи досліджень дозволяють пояснити будову атома більш докладно.
Будова атома u Сусна теорія будови атомів базується на моделі Бора та дослідах Резерфорда, але тільки сучасні методи досліджень дозволяють пояснити будову атома більш докладно.
 Сучасні уявлення про будову ядра u 1. Ядром називається центральна частина атома, у якій зосереджена практично вся маса атома і його позитивний електричний заряд. Всі атомні ядра складаються з елементарних часток: протонів і нейтронів, що вважаються двома зарядовими станами однієї частинки - нуклона. Протон має позитивний електричний заряд, що дорівнює по абсолютній величині заряду електрона. Нейтрон не має електричного заряду. 2. Зарядом ядра називається величина Zе, де е - величина заряду протона, Z - порядковий номер хімічного елемента в періодичній системі Менделєєва, дорівнює числу протонів у ядрі. В даний час відомі ядра з Z від Z = 1 до Z = 107. Для всіх ядер, крім і деяких інших нейтронодефіцітних ядер Nі, де N - число нейтронів у ядрі. Для легких ядер N/Z » 1; для ядер хімічних елементів, розташованих наприкінці періодичної системи, N/Z » 1, 6. 3. Число нуклонів у ядрі A=N+Z називається масовим числом. Нуклонам (протону і нейтрону) приписується масове число, рівне одиниці, електрону - нульове значення А. Ядра з однаковими Z, але різними А називаються ізотопами. Ядра, що при однаковому А мають різні Z, називаються ізобарами. Ядро хімічного елемента позначається X, де Х - символ хімічного елемента. Усього відомо близько 300 стійких ізотопів хімічних елементів і більш 2000 природних і штучно отриманих радіоактивних ізотопів. 4. Розмір ядра характеризується радіусом ядра, що має умовний зміст через розмитість границі ядра. Емпірична формула для радіуса ядра м, може бути пояснена як пропорційність об’єму ядра числу нуклонів у ньому. Густина ядерної речовини складає 1017 кг/м 3 і постійна для всіх ядер. Вона значно перевершує густину звичайних речовин. 5. Розподіл електричного заряду протонів по ядру в загальному випадку несиметрично. Мірою відхилення цього розподілу від сферично симетричного є квадрупольний електричний момент ядра Q. Якщо щільність заряду вважається скрізь однакової, то Q визначається тільки формою ядра.
Сучасні уявлення про будову ядра u 1. Ядром називається центральна частина атома, у якій зосереджена практично вся маса атома і його позитивний електричний заряд. Всі атомні ядра складаються з елементарних часток: протонів і нейтронів, що вважаються двома зарядовими станами однієї частинки - нуклона. Протон має позитивний електричний заряд, що дорівнює по абсолютній величині заряду електрона. Нейтрон не має електричного заряду. 2. Зарядом ядра називається величина Zе, де е - величина заряду протона, Z - порядковий номер хімічного елемента в періодичній системі Менделєєва, дорівнює числу протонів у ядрі. В даний час відомі ядра з Z від Z = 1 до Z = 107. Для всіх ядер, крім і деяких інших нейтронодефіцітних ядер Nі, де N - число нейтронів у ядрі. Для легких ядер N/Z » 1; для ядер хімічних елементів, розташованих наприкінці періодичної системи, N/Z » 1, 6. 3. Число нуклонів у ядрі A=N+Z називається масовим числом. Нуклонам (протону і нейтрону) приписується масове число, рівне одиниці, електрону - нульове значення А. Ядра з однаковими Z, але різними А називаються ізотопами. Ядра, що при однаковому А мають різні Z, називаються ізобарами. Ядро хімічного елемента позначається X, де Х - символ хімічного елемента. Усього відомо близько 300 стійких ізотопів хімічних елементів і більш 2000 природних і штучно отриманих радіоактивних ізотопів. 4. Розмір ядра характеризується радіусом ядра, що має умовний зміст через розмитість границі ядра. Емпірична формула для радіуса ядра м, може бути пояснена як пропорційність об’єму ядра числу нуклонів у ньому. Густина ядерної речовини складає 1017 кг/м 3 і постійна для всіх ядер. Вона значно перевершує густину звичайних речовин. 5. Розподіл електричного заряду протонів по ядру в загальному випадку несиметрично. Мірою відхилення цього розподілу від сферично симетричного є квадрупольний електричний момент ядра Q. Якщо щільність заряду вважається скрізь однакової, то Q визначається тільки формою ядра.



 Смерть Резерфорда
Смерть Резерфорда
 Смерть Резерфорда u Майже до кінця життя він відрізнявся міцним здоров'ям і вмер у Кембриджі 19 жовтня 1937 після нетривалої хвороби. У визнання видатних заслуг у розвитку науки вчений був похований у Вестмінстерському абатстві.
Смерть Резерфорда u Майже до кінця життя він відрізнявся міцним здоров'ям і вмер у Кембриджі 19 жовтня 1937 після нетривалої хвороби. У визнання видатних заслуг у розвитку науки вчений був похований у Вестмінстерському абатстві.


