Алканы.Ангел_Игорь.190-711..ppt
- Количество слайдов: 24
 Презентация на тему: Алканы Подготовил студент 1 -ого курса Ангел Игорь Факультет ГРТСИ группа 190 -01 б. ТП/16
Презентация на тему: Алканы Подготовил студент 1 -ого курса Ангел Игорь Факультет ГРТСИ группа 190 -01 б. ТП/16
 Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями (σ-) и имеют общую формулу: Cn. H 2 n+2
Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями (σ-) и имеют общую формулу: Cn. H 2 n+2
 Гомологический ряд Гомологи – это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СH 2. СН 4 С 2 H 6 C 3 H 8 C 4 H 10 C 5 H 12 метан этан пропан бутан пентан C 6 H 14 C 7 H 16 C 8 H 18 C 9 H 20 C 10 H 22 гексан гептан октан нонан декан
Гомологический ряд Гомологи – это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СH 2. СН 4 С 2 H 6 C 3 H 8 C 4 H 10 C 5 H 12 метан этан пропан бутан пентан C 6 H 14 C 7 H 16 C 8 H 18 C 9 H 20 C 10 H 22 гексан гептан октан нонан декан
 Изомерия алканов Структурная изомерия: CH 3 - CH 2 - CH 3 или CH 3 – CH - CH 2 - CH 3 │ CH 3
Изомерия алканов Структурная изомерия: CH 3 - CH 2 - CH 3 или CH 3 – CH - CH 2 - CH 3 │ CH 3
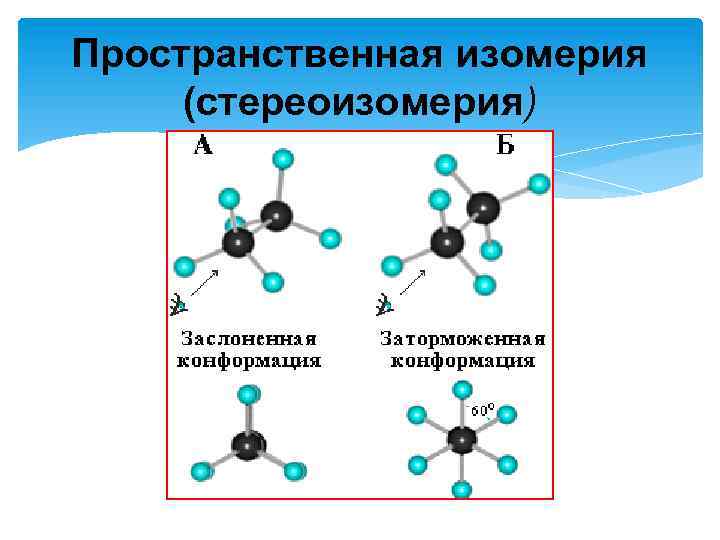 Пространственная изомерия (стереоизомерия)
Пространственная изомерия (стереоизомерия)
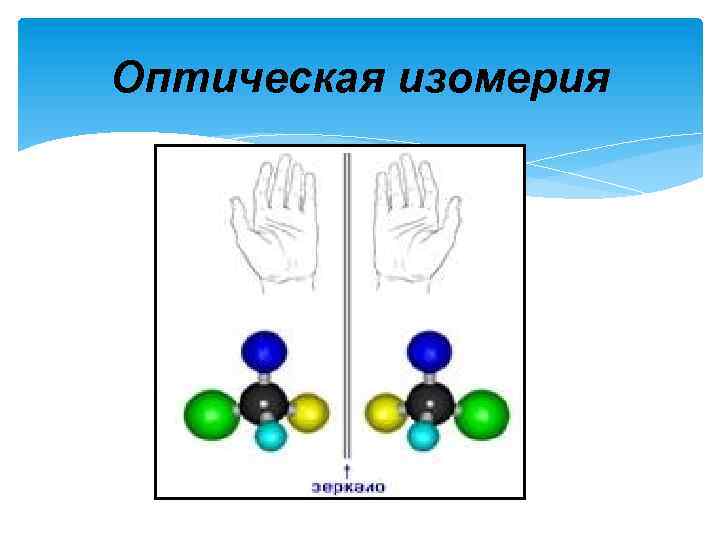 Оптическая изомерия
Оптическая изомерия
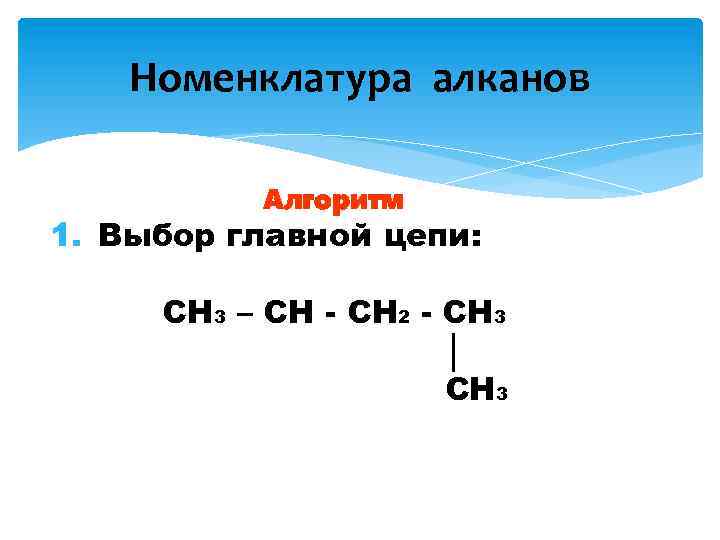 Номенклатура алканов Алгоритм 1. Выбор главной цепи: CH 3 – CH - CH 2 - CH 3 │ CH 3
Номенклатура алканов Алгоритм 1. Выбор главной цепи: CH 3 – CH - CH 2 - CH 3 │ CH 3
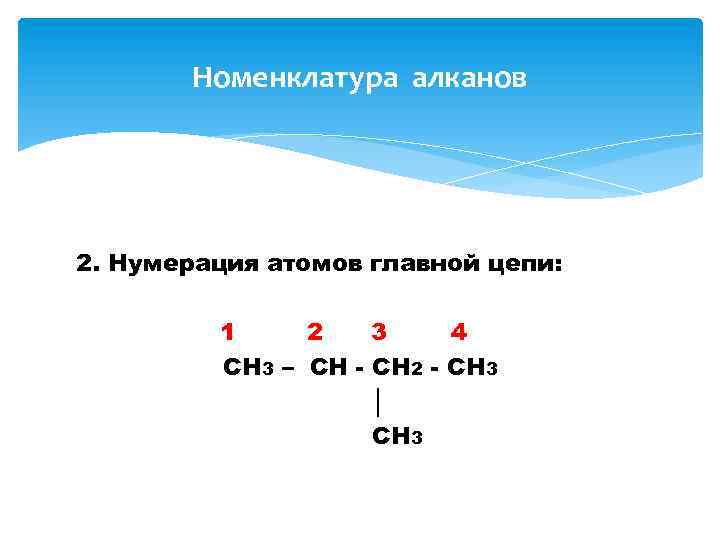 Номенклатура алканов 2. Нумерация атомов главной цепи: 1 2 3 4 CH 3 – CH - CH 2 - CH 3 │ CH 3
Номенклатура алканов 2. Нумерация атомов главной цепи: 1 2 3 4 CH 3 – CH - CH 2 - CH 3 │ CH 3
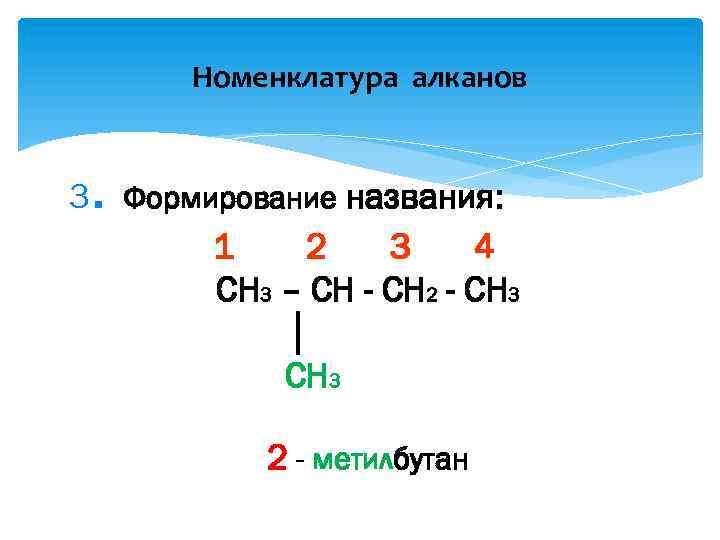 Номенклатура алканов . 3 Формирование названия: 1 2 3 4 CH 3 – CH - CH 2 - CH 3 │ CH 3 2 - метилбутан
Номенклатура алканов . 3 Формирование названия: 1 2 3 4 CH 3 – CH - CH 2 - CH 3 │ CH 3 2 - метилбутан
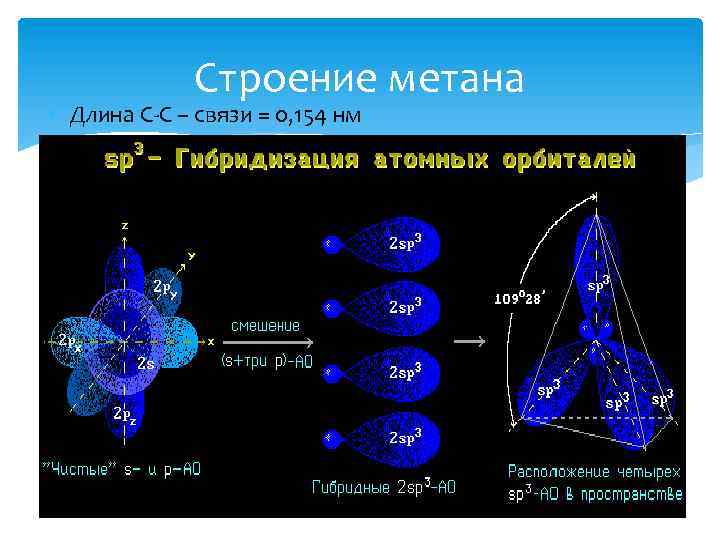 Строение метана • Длина С-С – связи = 0, 154 нм
Строение метана • Длина С-С – связи = 0, 154 нм
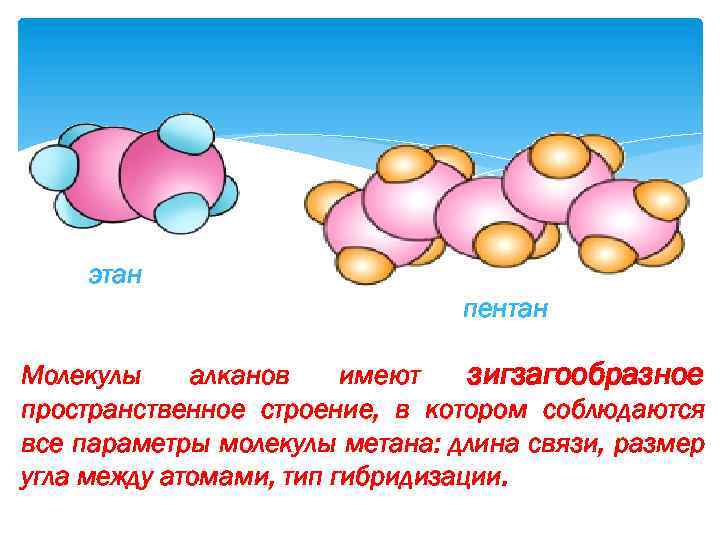 этан пентан Молекулы алканов имеют зигзагообразное пространственное строение, в котором соблюдаются все параметры молекулы метана: длина связи, размер угла между атомами, тип гибридизации.
этан пентан Молекулы алканов имеют зигзагообразное пространственное строение, в котором соблюдаются все параметры молекулы метана: длина связи, размер угла между атомами, тип гибридизации.
 Физические свойства СН 4…C 4 Н 10 – газы T кипения: -161, 6…-0, 5 °C T плавления: -182, 5…-138, 3 °C С 5 Н 12…C 15 Н 32 – жидкости T кипения: 36, 1… 270, 5 °C T плавления: -129, 8… 10 °C С 16 Н 34…и далее– твёрдые вещества T кипения: 287, 5 °C T плавления: 20 °C С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
Физические свойства СН 4…C 4 Н 10 – газы T кипения: -161, 6…-0, 5 °C T плавления: -182, 5…-138, 3 °C С 5 Н 12…C 15 Н 32 – жидкости T кипения: 36, 1… 270, 5 °C T плавления: -129, 8… 10 °C С 16 Н 34…и далее– твёрдые вещества T кипения: 287, 5 °C T плавления: 20 °C С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
 Получение алканов
Получение алканов
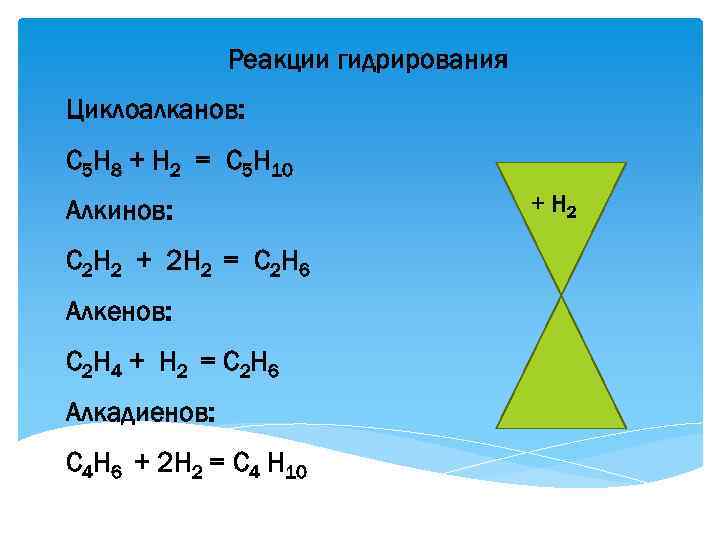 Реакции гидрирования Циклоалканов: С 5 Н 8 + Н 2 = С 5 Н 10 Алкинов: С 2 Н 2 + 2 Н 2 = С 2 Н 6 Алкенов: С 2 Н 4 + Н 2 = С 2 Н 6 Алкадиенов: С 4 Н 6 + 2 Н 2 = С 4 Н 10 + Н 2
Реакции гидрирования Циклоалканов: С 5 Н 8 + Н 2 = С 5 Н 10 Алкинов: С 2 Н 2 + 2 Н 2 = С 2 Н 6 Алкенов: С 2 Н 4 + Н 2 = С 2 Н 6 Алкадиенов: С 4 Н 6 + 2 Н 2 = С 4 Н 10 + Н 2
 Получение метана при сплавлении ацетата натрия со щелочью: t C CH 3 COONa + Na. OH CH 4 + Na 2 CO 3 ацетат натрия метан Свойства метана: 1) метан не вступает в реакцию окисления при действии раствора KMn. O 4; 2) метан не вступает в реакцию с раствором брома; 3) горение метана: CH 4 + 2 О 2 СО 2 + 2 Н 2 О + Q водного
Получение метана при сплавлении ацетата натрия со щелочью: t C CH 3 COONa + Na. OH CH 4 + Na 2 CO 3 ацетат натрия метан Свойства метана: 1) метан не вступает в реакцию окисления при действии раствора KMn. O 4; 2) метан не вступает в реакцию с раствором брома; 3) горение метана: CH 4 + 2 О 2 СО 2 + 2 Н 2 О + Q водного
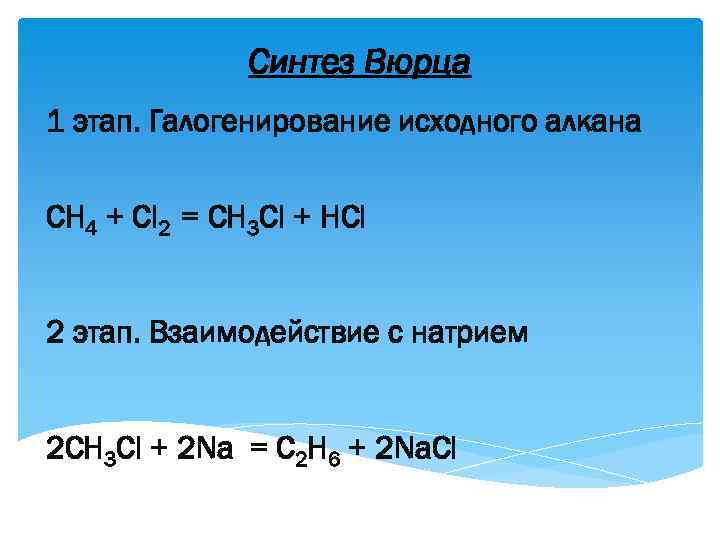 Синтез Вюрца 1 этап. Галогенирование исходного алкана СН 4 + Сl 2 = CH 3 Cl + HCl 2 этап. Взаимодействие с натрием 2 CH 3 Cl + 2 Na = C 2 H 6 + 2 Na. Cl
Синтез Вюрца 1 этап. Галогенирование исходного алкана СН 4 + Сl 2 = CH 3 Cl + HCl 2 этап. Взаимодействие с натрием 2 CH 3 Cl + 2 Na = C 2 H 6 + 2 Na. Cl
 Метан в лаборатории можно получить гидролизом карбида алюминия Al 4 C 3 + 12 H 2 O = 4 Al(OH)3 + 3 CH 4
Метан в лаборатории можно получить гидролизом карбида алюминия Al 4 C 3 + 12 H 2 O = 4 Al(OH)3 + 3 CH 4
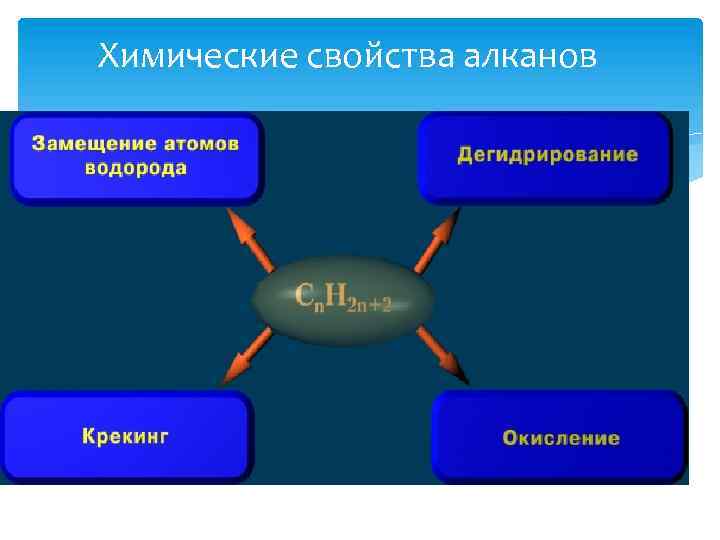 Химические свойства алканов
Химические свойства алканов
 Химические свойства: 1. Реакция замещения. Реакции протекают по радикальному механизму. 1) Сульфирование:
Химические свойства: 1. Реакция замещения. Реакции протекают по радикальному механизму. 1) Сульфирование:
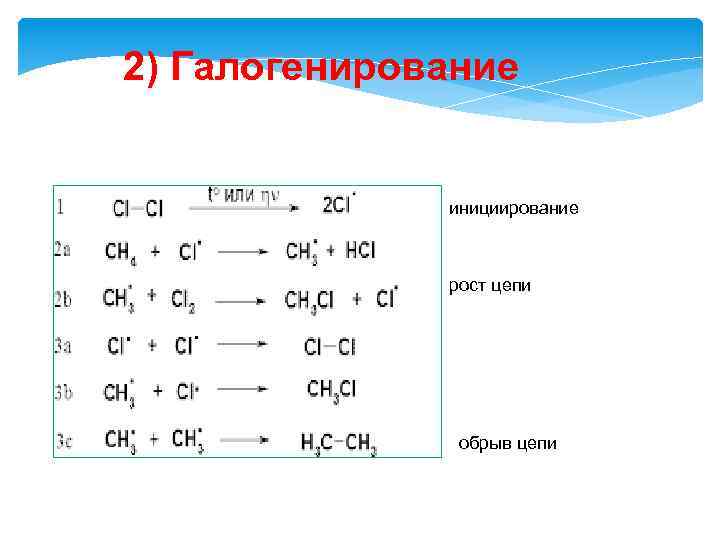 2) Галогенирование инициирование рост цепи обрыв цепи
2) Галогенирование инициирование рост цепи обрыв цепи
 3) Нитрование (р-я Коновалова)
3) Нитрование (р-я Коновалова)
 СН 3 СН 2 t, катализатор СН 3 СН СН 2 СН 3 СН 4 + Н 2 О 800°С 1500°С 2 СН 4 СН 3 СО + 3 Н 2 синтез-газ НС ≡ СН + 3 Н 2 + Q СН 3 Н 2 С=СН 2 + Q Предельные углеводороды горят (пламя не коптящее) С 3 Н 8 + 5 О 2 3 СО 2 + 4 Н 2 О + Q В присутствии катализаторов окисляются: СН 4 + О 2 500°С, катализатор 2 СН 3(СН 2)34 СН 3 + 5 О 2 Н 4 СН 3 С О Н + Н 2 О + Q (СН 2)16 СООН +2 Н 2 О + Q
СН 3 СН 2 t, катализатор СН 3 СН СН 2 СН 3 СН 4 + Н 2 О 800°С 1500°С 2 СН 4 СН 3 СО + 3 Н 2 синтез-газ НС ≡ СН + 3 Н 2 + Q СН 3 Н 2 С=СН 2 + Q Предельные углеводороды горят (пламя не коптящее) С 3 Н 8 + 5 О 2 3 СО 2 + 4 Н 2 О + Q В присутствии катализаторов окисляются: СН 4 + О 2 500°С, катализатор 2 СН 3(СН 2)34 СН 3 + 5 О 2 Н 4 СН 3 С О Н + Н 2 О + Q (СН 2)16 СООН +2 Н 2 О + Q
 6. Реакция горения: CH 4 + 2 O 2 → CO 2 + 2 H 2 O + Q
6. Реакция горения: CH 4 + 2 O 2 → CO 2 + 2 H 2 O + Q
 - Сырьё для синтезов спиртов, альдегидов, кислот. Получение растворителей Получение ацетилена Горючее для дизельных и турбореактивных двигателей В металлургии
- Сырьё для синтезов спиртов, альдегидов, кислот. Получение растворителей Получение ацетилена Горючее для дизельных и турбореактивных двигателей В металлургии


