Презентация lesson




















- Размер: 458.5 Кб
- Количество слайдов: 20
Описание презентации Презентация lesson по слайдам

 Хлорсутектің зертханада алу жолын, қасиеттерін меңгеру. Тұз қышқылының ортақ және өзіне тән қасиеттерін білу. Тұз қышқылы және хлоридтерді басқа заттардан ажырата білуге үйрету. Т о п т ы қ “ Іздесе – табасы ң ң Алысса – аласы ” ң ң М. уезов ӘХлорсутек сапалы реакция қ
Хлорсутектің зертханада алу жолын, қасиеттерін меңгеру. Тұз қышқылының ортақ және өзіне тән қасиеттерін білу. Тұз қышқылы және хлоридтерді басқа заттардан ажырата білуге үйрету. Т о п т ы қ “ Іздесе – табасы ң ң Алысса – аласы ” ң ң М. уезов ӘХлорсутек сапалы реакция қ
 І . Ұйымдастыру ІІ. “Галогендер”, “Хлор” тақырыптарын пысықтау ІІІ. Жаңа сабақ Хлорсутек ( проблемалық сұрақтар) Тұз қышқылы (эксперименттік зерттеу) Хлоридтер (тірек – сызба, мәтінмен жұмыс ) ІҮ. Деңгейлік тапсырма Ү. Бағалау ҮІ. Рефлексия ҮІІ. Үй тапсырмасы
І . Ұйымдастыру ІІ. “Галогендер”, “Хлор” тақырыптарын пысықтау ІІІ. Жаңа сабақ Хлорсутек ( проблемалық сұрақтар) Тұз қышқылы (эксперименттік зерттеу) Хлоридтер (тірек – сызба, мәтінмен жұмыс ) ІҮ. Деңгейлік тапсырма Ү. Бағалау ҮІ. Рефлексия ҮІІ. Үй тапсырмасы
 ІІ. “Галогендер”, “Хлор” тақырыптарына арналған пысықтау сұрақтары 1. Галогендер периодтық жүйеде қай топ , қай топшада орналасқан (ҮІІ А топ) 2. Қаншасы табиғатта кездеседі ( 4 – еуі, жасанды жолмен алынады) 3. Галоген, галогенсутек, галогенидтердің химиялық байланыс типін анықтаңдар осылыс т ріҚ ү Химиялы байланыс типіқ Hal 2 HHal Т здары ұ
ІІ. “Галогендер”, “Хлор” тақырыптарына арналған пысықтау сұрақтары 1. Галогендер периодтық жүйеде қай топ , қай топшада орналасқан (ҮІІ А топ) 2. Қаншасы табиғатта кездеседі ( 4 – еуі, жасанды жолмен алынады) 3. Галоген, галогенсутек, галогенидтердің химиялық байланыс типін анықтаңдар осылыс т ріҚ ү Химиялы байланыс типіқ Hal 2 HHal Т здары ұ
 HFHBr. HCl. HF№ 1 Проблемалы с ра қ ұ қ Хлор молекуласы ж не хлорсутек молекуласында ы ә ғ химиялы байланыс типі андай? қ қ № 2 Проблемалы с ра қ ұ қ Хлорсутекті химиялы байланыс типін біле ң қ отырып оны андай физикалы асиеттерін ң қ қ қ болжау а болады? ғ Cl. Cl Cl. H
HFHBr. HCl. HF№ 1 Проблемалы с ра қ ұ қ Хлор молекуласы ж не хлорсутек молекуласында ы ә ғ химиялы байланыс типі андай? қ қ № 2 Проблемалы с ра қ ұ қ Хлорсутекті химиялы байланыс типін біле ң қ отырып оны андай физикалы асиеттерін ң қ қ қ болжау а болады? ғ Cl. Cl Cl. H
 Хлорсутектің химиялық байланыс типін біле отырып, оның қандай физикалық қасиеттерін болжауға болады?
Хлорсутектің химиялық байланыс типін біле отырып, оның қандай физикалық қасиеттерін болжауға болады?
 HCl. Суда жа сы еридіқ 1 л HCl – 1, 64 г Т ссіз, ткір иісті ү ө тыныс алу жолдарын тітіркендіретін газ t б =-114, 2 0 САуадан 1, 26 есе ауыр t = қ -85 0 CЖанбайды, жануды олдамайды қ
HCl. Суда жа сы еридіқ 1 л HCl – 1, 64 г Т ссіз, ткір иісті ү ө тыныс алу жолдарын тітіркендіретін газ t б =-114, 2 0 САуадан 1, 26 есе ауыр t = қ -85 0 CЖанбайды, жануды олдамайды қ
 1. HCl ыш ылды асиет т н емесҚ қ қ қ ә 2. Сумен реакцияласады 1 V H 2 O – 500 V HCl (О о С) 1 V H 2 O – 450 V HCl (15 о С) 1 моль HCl – 17, 3 ккаль жылу
1. HCl ыш ылды асиет т н емесҚ қ қ қ ә 2. Сумен реакцияласады 1 V H 2 O – 500 V HCl (О о С) 1 V H 2 O – 450 V HCl (15 о С) 1 моль HCl – 17, 3 ккаль жылу
 2 Cl. Na 2 Cl. Fe OHСl 224. Та би атта хлор андай осылыстар ғ қ қ т рінде кездеседі. Неліктен бос к йінде ү ү кездеспейді? ( Na. Cl , KCl ; К Cl ·Na. Cl ; KCl·Na. Cl ; КС l·Mg 2 · 6 H 2 O )
2 Cl. Na 2 Cl. Fe OHСl 224. Та би атта хлор андай осылыстар ғ қ қ т рінде кездеседі. Неліктен бос к йінде ү ү кездеспейді? ( Na. Cl , KCl ; К Cl ·Na. Cl ; KCl·Na. Cl ; КС l·Mg 2 · 6 H 2 O )
 нерк сіптеӨ ә зертханада H 2 + Cl 2 2 HCl Na. Cl + H 2 SO 4 (конц) Na. HSO 4 + HCl ↑ 2 Na. Cl + H 2 SO 4 (конц) Na 2 SO 4 + 2 HCl ↑ № 3 Проблемалы с ра қ ұ қ Хлорсутекті алу шін неліктен концентрациялы к кірт ү ү ыш ылы алынады? қ қ
нерк сіптеӨ ә зертханада H 2 + Cl 2 2 HCl Na. Cl + H 2 SO 4 (конц) Na. HSO 4 + HCl ↑ 2 Na. Cl + H 2 SO 4 (конц) Na 2 SO 4 + 2 HCl ↑ № 3 Проблемалы с ра қ ұ қ Хлорсутекті алу шін неліктен концентрациялы к кірт ү ү ыш ылы алынады? қ қ
 ( “спиритус салями”)
( “спиритус салями”)
 Т з ұ ыш ылыны қ қ ң т рлері ү Концен- трациясы Ты ызды ы ғ ғ см 3 Т тіндегіш ү 37 – 38 1, 17 – 1, 19 Синтетикалы қ 31 – 32 1, 16 Техникалы қ 27, 5 1,
Т з ұ ыш ылыны қ қ ң т рлері ү Концен- трациясы Ты ызды ы ғ ғ см 3 Т тіндегіш ү 37 – 38 1, 17 – 1, 19 Синтетикалы қ 31 – 32 1, 16 Техникалы қ 27, 5 1,
 І топ. “Т з ыш ылыны индикаторлар а ұ қ қ ң ғ сері” ә ІІ топ. “Т з ыш ылыны негіздік ұ қ қ ң оксидтермен рекеттесуі” ә ІІІ топ. “Т з ыш ылыны негіздермен ұ қ қ ң рекеттесуі” ә
І топ. “Т з ыш ылыны индикаторлар а ұ қ қ ң ғ сері” ә ІІ топ. “Т з ыш ылыны негіздік ұ қ қ ң оксидтермен рекеттесуі” ә ІІІ топ. “Т з ыш ылыны негіздермен ұ қ қ ң рекеттесуі” ә
 Т з ыш ылыны орта ұ қ қ ң қ химиялы асиеттері қ қ Т з ыш ылыны зіне т н ұ қ қ ң ө ә химиялы асиеттері қ қ 1. Индикаторлар а сер етеді ғ ә Лакмус Фенолфтамин метилоранж 2. Негіздік оксидтермен а) OHCu. Cl. HCl. Сu. O 22 OHFe. Cl. HCl. Fe. O 22 2 )ә 1. Металдармен 22 HZn. Cl. HCl. Zn HCl. Cu 2. К міс (1)нитраты мен (сапалы ү қ реакция) 3 3 HNOAg. Cl Ag. NOHCl 3 3 Na. NOAg. Cl Ag. NONa. Cl 3. Негіздермен OHNa. Cl. HCl. Na. OH 2 а) 424)(2 SONa. OHCu. SO OHCu. Cl. HCl. OHCu 2222)( ) ә
Т з ыш ылыны орта ұ қ қ ң қ химиялы асиеттері қ қ Т з ыш ылыны зіне т н ұ қ қ ң ө ә химиялы асиеттері қ қ 1. Индикаторлар а сер етеді ғ ә Лакмус Фенолфтамин метилоранж 2. Негіздік оксидтермен а) OHCu. Cl. HCl. Сu. O 22 OHFe. Cl. HCl. Fe. O 22 2 )ә 1. Металдармен 22 HZn. Cl. HCl. Zn HCl. Cu 2. К міс (1)нитраты мен (сапалы ү қ реакция) 3 3 HNOAg. Cl Ag. NOHCl 3 3 Na. NOAg. Cl Ag. NONa. Cl 3. Негіздермен OHNa. Cl. HCl. Na. OH 2 а) 424)(2 SONa. OHCu. SO OHCu. Cl. HCl. OHCu 2222)( ) ә
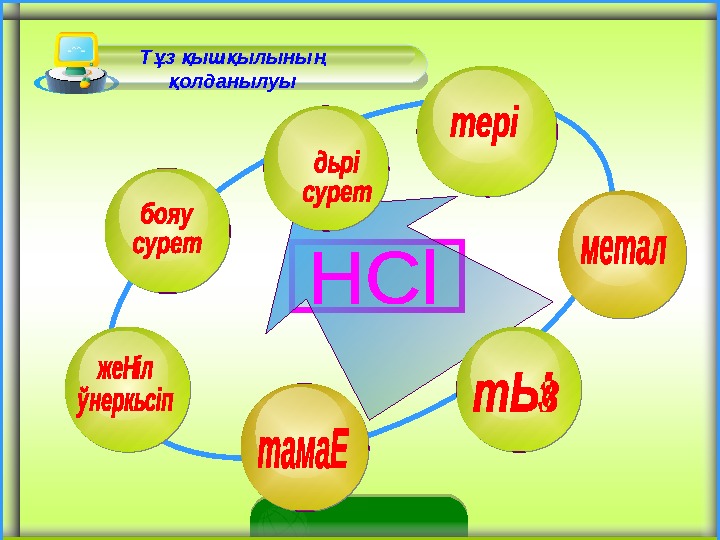
 Т з ыш ылыны ұ қ қ ң олданылуы қ
Т з ыш ылыны ұ қ қ ң олданылуы қ
 (м тінмен ж мыс)ә ұ 1. Неліктен ас т зы р ашан ал аш ы ұ ә қ ғ қ та ам ретінде абылданады? ғ қ 2. аза станда ас т зыны андай ке Қ қ ұ ң қ ң орындары бар? 3. “ Алмас” деп нені атайды?
(м тінмен ж мыс)ә ұ 1. Неліктен ас т зы р ашан ал аш ы ұ ә қ ғ қ та ам ретінде абылданады? ғ қ 2. аза станда ас т зыны андай ке Қ қ ұ ң қ ң орындары бар? 3. “ Алмас” деп нені атайды?
 1) б реакциясы эндотермиялы лде экзотермиялы қ ә қ 2) в реакциясы Mg химиялы байланыс типі қ 3) а реакциясы тоты сыздандыр ышты аны та қ ғ қ 4) г реакциясы НС l химиялы байланыс қ ІІІ де гей ( 5 пай) ң ұ Шыны ыдыс бірдей к лемде алын ан хлор ж не сутек ө ғ ә газдарымен толтырылды. Осы ыдысты аузын ты ындап к н с улесіне ой анда не ң ғ ү ә қ ғ бай алады? деген с ра а , ш о ушы былай деп жауап берді: қ ұ ққ ү қ Арман: — Сутек же іл сонды тан ол жо ары а к теріледі ң қ ғ ғ ө Н рлан: ұ — Газдар араласады, біра еште е бай алмайдық ң қ Аман: — рі т райы , опарылыс болады! Ә ұ қ қ ай о ушыны пікіріне осыласы ? Қ қ ң
1) б реакциясы эндотермиялы лде экзотермиялы қ ә қ 2) в реакциясы Mg химиялы байланыс типі қ 3) а реакциясы тоты сыздандыр ышты аны та қ ғ қ 4) г реакциясы НС l химиялы байланыс қ ІІІ де гей ( 5 пай) ң ұ Шыны ыдыс бірдей к лемде алын ан хлор ж не сутек ө ғ ә газдарымен толтырылды. Осы ыдысты аузын ты ындап к н с улесіне ой анда не ң ғ ү ә қ ғ бай алады? деген с ра а , ш о ушы былай деп жауап берді: қ ұ ққ ү қ Арман: — Сутек же іл сонды тан ол жо ары а к теріледі ң қ ғ ғ ө Н рлан: ұ — Газдар араласады, біра еште е бай алмайдық ң қ Аман: — рі т райы , опарылыс болады! Ә ұ қ қ ай о ушыны пікіріне осыласы ? Қ қ ң
 Сипаттама та ырыпқ барлы ын ғ т сіндік ү мені ң с ра тарым ұ қ бар т сінген ү жо пын қ рылысы Құ хлорсутек т з ұ ыш ылы қ қ асиеттері Қ хлорсутек т з ұ ыш ылы қ қ олданылуы Қ хлоридтер т з ұ ыш ылы қ қ
Сипаттама та ырыпқ барлы ын ғ т сіндік ү мені ң с ра тарым ұ қ бар т сінген ү жо пын қ рылысы Құ хлорсутек т з ұ ыш ылы қ қ асиеттері Қ хлорсутек т з ұ ыш ылы қ қ олданылуы Қ хлоридтер т з ұ ыш ылы қ қ
 ( Х а б а р л а м а )& 70 6, 7, 8 есептер (196 б)
( Х а б а р л а м а )& 70 6, 7, 8 есептер (196 б)
 арт ақ
арт ақ

