 Презентация Ипатовой А. Н. Лицей № 344
Презентация Ипатовой А. Н. Лицей № 344

 Это класс сложных веществ , состоящих из атомов 2 видов , один из которых кислород. Оксиды- бинарные соединения ( эти вещества состоят из 2 химических элементов. ) SO 2 - сернистый газ или сернистый ангидрид H 2 O- оксид водорода или вода
Это класс сложных веществ , состоящих из атомов 2 видов , один из которых кислород. Оксиды- бинарные соединения ( эти вещества состоят из 2 химических элементов. ) SO 2 - сернистый газ или сернистый ангидрид H 2 O- оксид водорода или вода
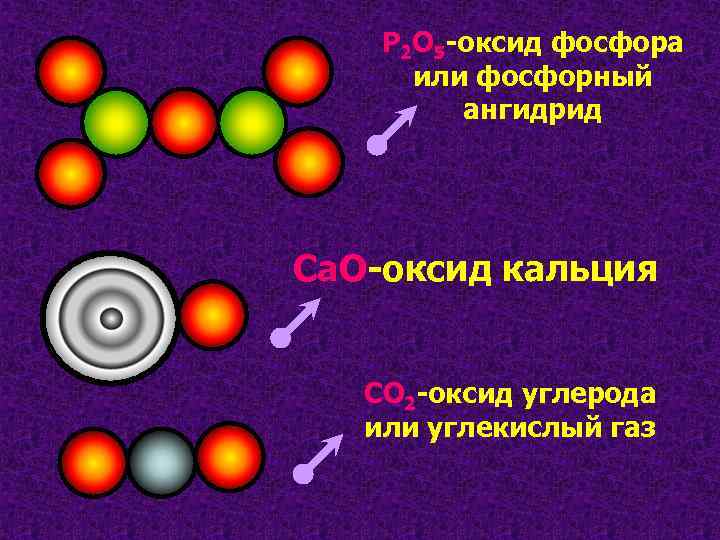 P 2 O 5 -оксид фосфора или фосфорный ангидрид Са. О-оксид кальция СО 2 -оксид углерода или углекислый газ
P 2 O 5 -оксид фосфора или фосфорный ангидрид Са. О-оксид кальция СО 2 -оксид углерода или углекислый газ
 Оксиды в лаборатории и в промышленности получают самыми разными способами. Один из них – получение оксидов из простых веществ. Нередко это химические реакции горения. Горение- это бурная химическая реакция , которая сопровождается выделением тепла и света. Рассмотрим горение в кислороде серы , угля , фосфора , железа. Какие признаки реакции горения наблюдаем?
Оксиды в лаборатории и в промышленности получают самыми разными способами. Один из них – получение оксидов из простых веществ. Нередко это химические реакции горения. Горение- это бурная химическая реакция , которая сопровождается выделением тепла и света. Рассмотрим горение в кислороде серы , угля , фосфора , железа. Какие признаки реакции горения наблюдаем?
 Химическое превращение можно записать с помощью слов: Сера+ кислород →сернистый газ Железо + кислород→железная окалина Химическое превращение можно записать с помощью химических формул: S+ O 2 →SO 2 Fe + O 2→Fe 3 O 4
Химическое превращение можно записать с помощью слов: Сера+ кислород →сернистый газ Железо + кислород→железная окалина Химическое превращение можно записать с помощью химических формул: S+ O 2 →SO 2 Fe + O 2→Fe 3 O 4
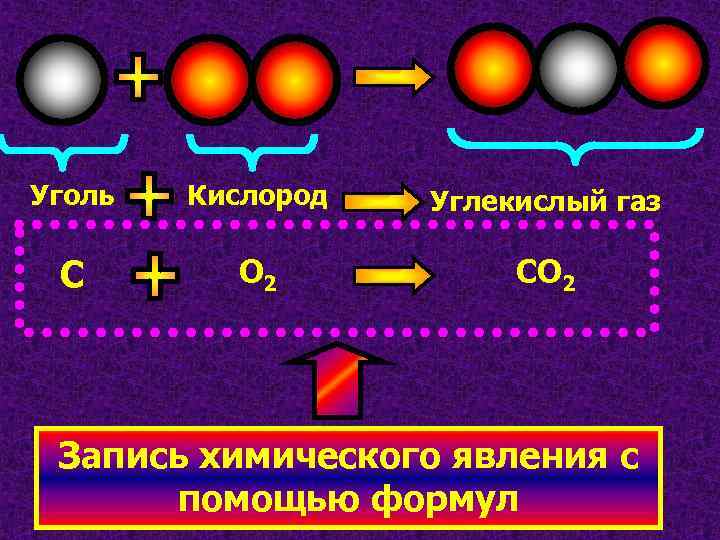 Уголь Кислород Углекислый газ С О 2 СО 2 Запись химического явления с помощью формул
Уголь Кислород Углекислый газ С О 2 СО 2 Запись химического явления с помощью формул
 Вещества , которые вступают в хим. реакцию , называются Вещества , которые получаются в хим. реакции , называются С О 2 Реагенты: уголь и кислород СО 2 Продукт: углекислый газ
Вещества , которые вступают в хим. реакцию , называются Вещества , которые получаются в хим. реакции , называются С О 2 Реагенты: уголь и кислород СО 2 Продукт: углекислый газ
 Вещество можно назвать несколькими способами : Это названия веществ с давних времен или те , которым ученые дали «свои» имена. Это названия веществ по особым правилам , принятым учеными всего мира. Оксиды называются так: слово « оксид» + название другого элемента по-русски в родительном падеже. Cu. O- оксид (чего? ) меди. СО 2 - оксид углерода.
Вещество можно назвать несколькими способами : Это названия веществ с давних времен или те , которым ученые дали «свои» имена. Это названия веществ по особым правилам , принятым учеными всего мира. Оксиды называются так: слово « оксид» + название другого элемента по-русски в родительном падеже. Cu. O- оксид (чего? ) меди. СО 2 - оксид углерода.
 Если элемент образует несколько оксидов , то после международного названия указывают в скобках римскими цифрами важную характеристику элемента в этом веществе – валентность. Если формула оксида имеет вид ЭО , то называют так Монооксид + название элемента по-русски в род. падеже Если формула оксида имеет вид ЭО 2 , то называют так диоксид + название элемента по-русски в род. падеже
Если элемент образует несколько оксидов , то после международного названия указывают в скобках римскими цифрами важную характеристику элемента в этом веществе – валентность. Если формула оксида имеет вид ЭО , то называют так Монооксид + название элемента по-русски в род. падеже Если формула оксида имеет вид ЭО 2 , то называют так диоксид + название элемента по-русски в род. падеже
 Если формула оксида имеет вид ЭО 3 , то называют триоксид + название элемента по-русски в род. падеже Если формула оксида имеет вид ЭО 4 , то называют тетраоксид + название элемента по-русски в род. падеже Сернистый газ Оксид серы (IV) Диоксид серы
Если формула оксида имеет вид ЭО 3 , то называют триоксид + название элемента по-русски в род. падеже Если формула оксида имеет вид ЭО 4 , то называют тетраоксид + название элемента по-русски в род. падеже Сернистый газ Оксид серы (IV) Диоксид серы
 NO 2 Оксид азота (IV) Cl 2 O Диоксид азота CO 2 Оксид хлора (I) Оксид углерода (IV) Диоксид углерода Углекислый газ
NO 2 Оксид азота (IV) Cl 2 O Диоксид азота CO 2 Оксид хлора (I) Оксид углерода (IV) Диоксид углерода Углекислый газ
 N 2 O 3 H 2 O Оксид азота (III) Оксид Азотистый ангидрид водорода вода Cl 2 O 7 Оксид хлора (VII) Хлорный ангидрид
N 2 O 3 H 2 O Оксид азота (III) Оксид Азотистый ангидрид водорода вода Cl 2 O 7 Оксид хлора (VII) Хлорный ангидрид
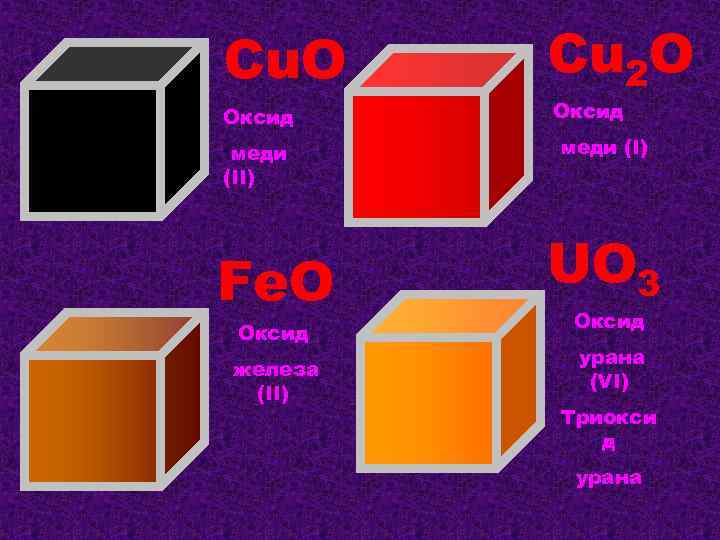 Cu. O Оксид меди (II) Fe. O Оксид железа (II) Cu 2 O Оксид меди (I) UO 3 Оксид урана (VI) Триокси д урана
Cu. O Оксид меди (II) Fe. O Оксид железа (II) Cu 2 O Оксид меди (I) UO 3 Оксид урана (VI) Триокси д урана

 Безразличные (индиффирентные) ( прямо Эти оксиды не взаимодействуют с водой или косвенно) им не соответствуют гидроксиды Примеры N : 2 O Оксид азота (I) NO Закись азота, веселящий газ Оксид азота (II) Монооксид азота Бесцветный газ со сладковаты м запахом Бесцветный газ без вкуса и запаха
Безразличные (индиффирентные) ( прямо Эти оксиды не взаимодействуют с водой или косвенно) им не соответствуют гидроксиды Примеры N : 2 O Оксид азота (I) NO Закись азота, веселящий газ Оксид азота (II) Монооксид азота Бесцветный газ со сладковаты м запахом Бесцветный газ без вкуса и запаха
 CO Оксид углерода (II) Монооксид углерода Угарный газ Бесцветный газ без вкуса и запаха, очень ядовит, так как выводит из строя молекулы гемоглобина. Основные Эти оксиды взаимодействуют с водой ( прямо или косвенно) им соответствуют гидроксиды. Непосредственно с водой реагируют оксиды металлов, которые главным подгруппам I и II групп ( оксиды основания щелочных и щелочноземельных металлов).
CO Оксид углерода (II) Монооксид углерода Угарный газ Бесцветный газ без вкуса и запаха, очень ядовит, так как выводит из строя молекулы гемоглобина. Основные Эти оксиды взаимодействуют с водой ( прямо или косвенно) им соответствуют гидроксиды. Непосредственно с водой реагируют оксиды металлов, которые главным подгруппам I и II групп ( оксиды основания щелочных и щелочноземельных металлов).
 Оксид щелочного (щелочноземельного ) металла + вода основание-щелочь Na 2 O + H 2 O = 2 Na. OH Ca. O + H 2 O = Ca(OH)2 Чтобы получить нерастворимое основание из соответствующего оксида, проводят 2 реакции: А) реакцию оксида с кислотой с образованием растворимой соли Б) реакцию этой соли со щелочью
Оксид щелочного (щелочноземельного ) металла + вода основание-щелочь Na 2 O + H 2 O = 2 Na. OH Ca. O + H 2 O = Ca(OH)2 Чтобы получить нерастворимое основание из соответствующего оксида, проводят 2 реакции: А) реакцию оксида с кислотой с образованием растворимой соли Б) реакцию этой соли со щелочью
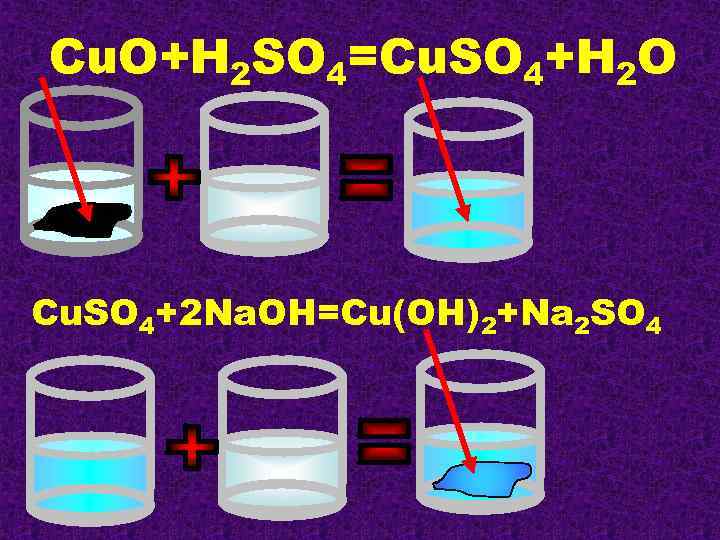 Cu. O+H 2 SO 4=Cu. SO 4+H 2 O Cu. SO 4+2 Na. OH=Cu(OH)2+Na 2 SO 4
Cu. O+H 2 SO 4=Cu. SO 4+H 2 O Cu. SO 4+2 Na. OH=Cu(OH)2+Na 2 SO 4
 Основный оксид при спекании с кислотным оксидом дает соль. При такой реакции соединения степени окисления элементов не меняются. Cu. O+SO 3=Cu. SO 4 Оксид меди (II) Оксид серы (VI)Сульфат меди (II) Ca. O+CO 2=Ca. CO 3 Оксид кальция Оксид Карбонат углерода(IV) кальция
Основный оксид при спекании с кислотным оксидом дает соль. При такой реакции соединения степени окисления элементов не меняются. Cu. O+SO 3=Cu. SO 4 Оксид меди (II) Оксид серы (VI)Сульфат меди (II) Ca. O+CO 2=Ca. CO 3 Оксид кальция Оксид Карбонат углерода(IV) кальция
 Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Pb. O+2 HNO 3=Pb(NO 3)2+H 2 O Оксид свинца Азотная кислота Нитрат свинца
Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Pb. O+2 HNO 3=Pb(NO 3)2+H 2 O Оксид свинца Азотная кислота Нитрат свинца
 Основные оксиды взаимодействуют с амфотерными оксидами также с образованием соли , при этом элемент в основном оксиде входит в состав катиона соли. Ca. O+Zn. O=Ca. Zn. O 2 Оксид кальция Оксид цинка Оксид натрия Оксид алюминия Цинкат кальция Na 2 O+Al 2 O 3=2 Na. Al. O 2 Метаалюмин ат натрия
Основные оксиды взаимодействуют с амфотерными оксидами также с образованием соли , при этом элемент в основном оксиде входит в состав катиона соли. Ca. O+Zn. O=Ca. Zn. O 2 Оксид кальция Оксид цинка Оксид натрия Оксид алюминия Цинкат кальция Na 2 O+Al 2 O 3=2 Na. Al. O 2 Метаалюмин ат натрия
 Кислотные Эти оксиды взаимодействуют с водой ( прямо или косвенно) им соответствуют гидроксидыкислоты Кислотные оксиды образуют неметаллы( элементы главных подгрупп), а также металлы(элементы побочных подгрупп) с максимальной степенью окисления (она = № группы).
Кислотные Эти оксиды взаимодействуют с водой ( прямо или косвенно) им соответствуют гидроксидыкислоты Кислотные оксиды образуют неметаллы( элементы главных подгрупп), а также металлы(элементы побочных подгрупп) с максимальной степенью окисления (она = № группы).
 Кислотный оксид + вода гидроксид-кислота SO 2 + H 2 O = H 2 SO 3 Оксид серы (IV) Сернистая кислота CO 2 + H 2 O = H 2 CO 3 Оксид углерода (IV) Угольная кислота
Кислотный оксид + вода гидроксид-кислота SO 2 + H 2 O = H 2 SO 3 Оксид серы (IV) Сернистая кислота CO 2 + H 2 O = H 2 CO 3 Оксид углерода (IV) Угольная кислота
 Иногда кислотные оксиды непосредственно не взаимодействуют с водой для получения кислоты проводят 2 реакции: 1) Спекание кислотного оксида с основным. 2) Взаимодействие этой соли с сильной кислотой. Si. O 2+Na 2 O=Na 2 Si. O 3 Оксид кремния Оксид натрия Силикат натрия Na 2 Si. O 3+2 HCl=2 Na. Cl+ H 2 Si. O 3 Соляная Кремниевая кислота
Иногда кислотные оксиды непосредственно не взаимодействуют с водой для получения кислоты проводят 2 реакции: 1) Спекание кислотного оксида с основным. 2) Взаимодействие этой соли с сильной кислотой. Si. O 2+Na 2 O=Na 2 Si. O 3 Оксид кремния Оксид натрия Силикат натрия Na 2 Si. O 3+2 HCl=2 Na. Cl+ H 2 Si. O 3 Соляная Кремниевая кислота
 Кислотный оксид при спекании с основным оксидом дает соль. При такой реакции соединения степени окисления элементов не меняются. N 2 O 5+2 Na 2 O=2 Na 2 NO 3 Оксид азота(V) Нитрат натрия Mn 2 O 7+K 2 O=2 KMn. O 4 Оксид марганца(VII) Перманганат калия
Кислотный оксид при спекании с основным оксидом дает соль. При такой реакции соединения степени окисления элементов не меняются. N 2 O 5+2 Na 2 O=2 Na 2 NO 3 Оксид азота(V) Нитрат натрия Mn 2 O 7+K 2 O=2 KMn. O 4 Оксид марганца(VII) Перманганат калия
 Кислотные оксиды взаимодействуют с основаниями-щелочами с образованием соли и воды. 2 Na. OH+SO 3=Na 2 SO 4+H 2 O Гидроксид натрия Оксид серы(VI) Сульфат натрия 6 Cs. OH+P 2 O 5=2 Cs 3 PO 4+3 H 2 O Гидроксид цезия Оксид Фосфат фосфора(V) цезия
Кислотные оксиды взаимодействуют с основаниями-щелочами с образованием соли и воды. 2 Na. OH+SO 3=Na 2 SO 4+H 2 O Гидроксид натрия Оксид серы(VI) Сульфат натрия 6 Cs. OH+P 2 O 5=2 Cs 3 PO 4+3 H 2 O Гидроксид цезия Оксид Фосфат фосфора(V) цезия
 Кислотные оксиды взаимодействуют с амфотерными оксидами также с образованием соли , при этом элемент в кислотном оксиде входит в состав аниона соли (кислотного остатка). SO 2+Zn. O=Zn. SO 3 Оксид серы(IV) Оксид цинка Сульфит цинка P 2 O 5+Al 2 O 3=2 Al. PO 4 Оксид фосфора(V) Фосфат алюминия
Кислотные оксиды взаимодействуют с амфотерными оксидами также с образованием соли , при этом элемент в кислотном оксиде входит в состав аниона соли (кислотного остатка). SO 2+Zn. O=Zn. SO 3 Оксид серы(IV) Оксид цинка Сульфит цинка P 2 O 5+Al 2 O 3=2 Al. PO 4 Оксид фосфора(V) Фосфат алюминия
 Амфотерные Эти оксиды являются нерастворимыми в воде, но в зависимости от других реагентов являются либо основными, либо кислотными. в зависимости от условий соответствующий гидроксид либо основание, либо кислота. SO 3+Zn. O=Zn. SO 4 Оксид серы(VI) Сульфат цинка H 2 SO 4+Zn. O=Zn. SO 4+H 2 O Серная кислота Оксид цинка
Амфотерные Эти оксиды являются нерастворимыми в воде, но в зависимости от других реагентов являются либо основными, либо кислотными. в зависимости от условий соответствующий гидроксид либо основание, либо кислота. SO 3+Zn. O=Zn. SO 4 Оксид серы(VI) Сульфат цинка H 2 SO 4+Zn. O=Zn. SO 4+H 2 O Серная кислота Оксид цинка
 Вывод: с кислотным оксидом и кислотой амфотерный оксид цинка ведет себя как основный оксид. Cu. O+Zn. O=Cu. Zn. O 2 Оксид меди (II) Цинкат меди (II) 2 Na. OH+Zn. O=Na 2 Zn. O 2+H 2 O Гидрокси д Цинкат натрия Вывод: с основным оксидом и щелочью амфотерный оксид цинка ведет себя как кислотный оксид. Подробнее смотри отдельную презентацию про амфотерные соединения.
Вывод: с кислотным оксидом и кислотой амфотерный оксид цинка ведет себя как основный оксид. Cu. O+Zn. O=Cu. Zn. O 2 Оксид меди (II) Цинкат меди (II) 2 Na. OH+Zn. O=Na 2 Zn. O 2+H 2 O Гидрокси д Цинкат натрия Вывод: с основным оксидом и щелочью амфотерный оксид цинка ведет себя как кислотный оксид. Подробнее смотри отдельную презентацию про амфотерные соединения.
 Здесь в качестве примеров будут приведены некоторые важные в промышленности реакции. Это 1 стадия производства серной кислоты из самородной серы. S+O 2=SO 2(сернистый S 0 -4ē S+4 2 O 0+4ē 2 O-2 газ) 4 1 Восстановитель, окисляет 4 1 Окислитель, восстанавливает
Здесь в качестве примеров будут приведены некоторые важные в промышленности реакции. Это 1 стадия производства серной кислоты из самородной серы. S+O 2=SO 2(сернистый S 0 -4ē S+4 2 O 0+4ē 2 O-2 газ) 4 1 Восстановитель, окисляет 4 1 Окислитель, восстанавливает
 2 Mg+O 2=2 Mg. O(оксид магния) Mg 0 -2ē Mg+2 2 O 0+4ē 2 O-2 4 2 Восстановитель, окисляется Окислитель, восстанавливаетс 2 1 Магний сгорает с яркой вспышкой, поэтому в старину эту реакцию использовали при фотографировании. N 2+O 2=2 NO(монооксид азота)
2 Mg+O 2=2 Mg. O(оксид магния) Mg 0 -2ē Mg+2 2 O 0+4ē 2 O-2 4 2 Восстановитель, окисляется Окислитель, восстанавливаетс 2 1 Магний сгорает с яркой вспышкой, поэтому в старину эту реакцию использовали при фотографировании. N 2+O 2=2 NO(монооксид азота)
 2 N 0 -4ē 2 N+2 2 O 0+4ē 2 O-2 4 1 Восстановитель, окисляется Окислитель, восстанавливается Эта реакция идет в природе в очень жестких условиях: в грозовом разряде. Таким образом азот из атмосферы переходит в почву с дождями и служит для питания растений ( круговорот азота в природе). В царское время эта реакция служила 1 стадией производства азотных удобрений и проводилась в электрической дуге. Но это было энергетически невыгодно. Некоторые значимые оксиды не получаются при непосредственном взаимодействии с кислородом, поэтому надо степень окисления нужного элемента взаимодействием с окислителем или наоборот, степень окисления нужного элемента взаимодействием с восстановителем.
2 N 0 -4ē 2 N+2 2 O 0+4ē 2 O-2 4 1 Восстановитель, окисляется Окислитель, восстанавливается Эта реакция идет в природе в очень жестких условиях: в грозовом разряде. Таким образом азот из атмосферы переходит в почву с дождями и служит для питания растений ( круговорот азота в природе). В царское время эта реакция служила 1 стадией производства азотных удобрений и проводилась в электрической дуге. Но это было энергетически невыгодно. Некоторые значимые оксиды не получаются при непосредственном взаимодействии с кислородом, поэтому надо степень окисления нужного элемента взаимодействием с окислителем или наоборот, степень окисления нужного элемента взаимодействием с восстановителем.
 2 SO 2+O 2=2 SO 3 (серный ангидрид) S+4 -2ē S+6 4 2 Восстановитель, окисляется 2 O 0+4ē 2 O-2 2 1 Окислитель, восстанавливается Эта реакция - 2 стадия производства «королевы кислот» -серной кислоты. Идет она в жестких условиях: температуре и давлении, а также при наличии особого вещества-катализатора. Это Pt, Fe, V 2 O 5. Катализатор не только скорость реакции, но и позволяет ей протекать ( это селективный катализатор).
2 SO 2+O 2=2 SO 3 (серный ангидрид) S+4 -2ē S+6 4 2 Восстановитель, окисляется 2 O 0+4ē 2 O-2 2 1 Окислитель, восстанавливается Эта реакция - 2 стадия производства «королевы кислот» -серной кислоты. Идет она в жестких условиях: температуре и давлении, а также при наличии особого вещества-катализатора. Это Pt, Fe, V 2 O 5. Катализатор не только скорость реакции, но и позволяет ей протекать ( это селективный катализатор).
 4 NH 3+5 O 2=4 NO+6 H 2 O N-3 -5ē N+2 2 O 0+4ē 2 O-2 4 5 Восстановитель, окисляется Окислитель, восстанавливается Эта реакция называется каталитическое окисление аммиака. Это современный способ получения NO для производства азотной кислоты и азотных удобрений (2 стадия этого производства). Этот способ > энергетически выгоден, но чтобы эта реакция осуществилась, необходим селективный катализатор –
4 NH 3+5 O 2=4 NO+6 H 2 O N-3 -5ē N+2 2 O 0+4ē 2 O-2 4 5 Восстановитель, окисляется Окислитель, восстанавливается Эта реакция называется каталитическое окисление аммиака. Это современный способ получения NO для производства азотной кислоты и азотных удобрений (2 стадия этого производства). Этот способ > энергетически выгоден, но чтобы эта реакция осуществилась, необходим селективный катализатор –
 2 NO+O 2=2 NO 2 N+2 -2ē N+4 2 O 0+4ē 2 O-2 4 2 2 1 (диоксид азота) Восстановитель, окисляется Окислитель, восстанавливается Это 3 стадия производства азотной кислоты. Эта реакция идет самопроизвольно, без подвода энергии. Мы рассмотрели реакции с окислителем ( в этих реакциях окислитель - кислород). Теперь рассмотрим реакции с восстановителями.
2 NO+O 2=2 NO 2 N+2 -2ē N+4 2 O 0+4ē 2 O-2 4 2 2 1 (диоксид азота) Восстановитель, окисляется Окислитель, восстанавливается Это 3 стадия производства азотной кислоты. Эта реакция идет самопроизвольно, без подвода энергии. Мы рассмотрели реакции с окислителем ( в этих реакциях окислитель - кислород). Теперь рассмотрим реакции с восстановителями.
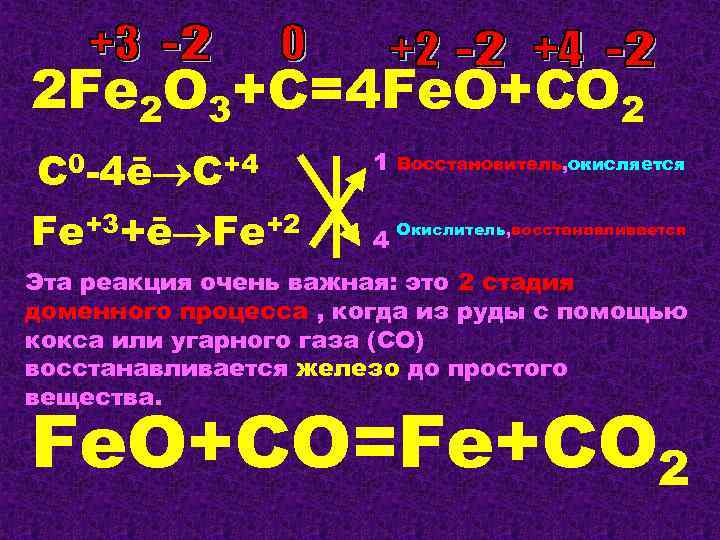 2 Fe 2 O 3+C=4 Fe. O+CO 2 C 0 -4ē C+4 Fe+3+ē Fe+2 1 Восстановитель, окисляется 4 Окислитель, восстанавливается Эта реакция очень важная: это 2 стадия доменного процесса , когда из руды с помощью кокса или угарного газа (СО) восстанавливается железо до простого вещества. Fe. O+CO=Fe+CO 2
2 Fe 2 O 3+C=4 Fe. O+CO 2 C 0 -4ē C+4 Fe+3+ē Fe+2 1 Восстановитель, окисляется 4 Окислитель, восстанавливается Эта реакция очень важная: это 2 стадия доменного процесса , когда из руды с помощью кокса или угарного газа (СО) восстанавливается железо до простого вещества. Fe. O+CO=Fe+CO 2
 Cr 2 O 3+Al=Al 2 O 3 +Cr Cr+3+3ē Cr 0 3 1 Окислитель, восстанавливается Al 0 -3ē Al+3 3 1 Восстановитель, окисляется Еще одна важная металлургическая реакция: металлотермия. Металлвосстановитель взаимодействует с оксидом тугоплавкого металла, при этом выделяется столько энергии в ходе реакции, что ценный тугоплавкий металл восстанавливается до простого вещества. Такая реакция называется алюмотермия.
Cr 2 O 3+Al=Al 2 O 3 +Cr Cr+3+3ē Cr 0 3 1 Окислитель, восстанавливается Al 0 -3ē Al+3 3 1 Восстановитель, окисляется Еще одна важная металлургическая реакция: металлотермия. Металлвосстановитель взаимодействует с оксидом тугоплавкого металла, при этом выделяется столько энергии в ходе реакции, что ценный тугоплавкий металл восстанавливается до простого вещества. Такая реакция называется алюмотермия.
 Эти реакции не имеют промышленного значения, но важны в лабораторной практике. Нерастворимые в воде основания самопроизвольно или при небольшом нагревании разлагаются на соответствующий оксид и воду Cu(OH)2=Cu. O+H 2 O 2 Fe(OH)3=Fe 2 O 3+3 H 2 O Внимание: степени окисления в таких веществах не меняются.
Эти реакции не имеют промышленного значения, но важны в лабораторной практике. Нерастворимые в воде основания самопроизвольно или при небольшом нагревании разлагаются на соответствующий оксид и воду Cu(OH)2=Cu. O+H 2 O 2 Fe(OH)3=Fe 2 O 3+3 H 2 O Внимание: степени окисления в таких веществах не меняются.
 Нестойкие кислоты самопроизвольно или при небольшом нагревании разлагаются на соответствующий оксид и воду. H 2 SO 3=SO 2 +H 2 O Сернистая кислота Диоксид серы Угольная кислота Углекислый газ H 2 CO 3=CO 2 +H 2 O 2 HCl. O=Cl 2 O +H 2 O Хлорноватиста я кислота Оксид хлора (I)
Нестойкие кислоты самопроизвольно или при небольшом нагревании разлагаются на соответствующий оксид и воду. H 2 SO 3=SO 2 +H 2 O Сернистая кислота Диоксид серы Угольная кислота Углекислый газ H 2 CO 3=CO 2 +H 2 O 2 HCl. O=Cl 2 O +H 2 O Хлорноватиста я кислота Оксид хлора (I)
 Это не окислительно-восстановительные реакции, приводящие к образованию 2 оксидов. Ca. CO 3=CO 2 +Ca. O Карбонат кальция Оксид кальция Это промышленная реакция прокаливания известняка. Продуктами являются углекислый газ и применяемая в строительстве негашеная известь или пушонка (оксид
Это не окислительно-восстановительные реакции, приводящие к образованию 2 оксидов. Ca. CO 3=CO 2 +Ca. O Карбонат кальция Оксид кальция Это промышленная реакция прокаливания известняка. Продуктами являются углекислый газ и применяемая в строительстве негашеная известь или пушонка (оксид
 2 HCl. O 4+P 2 O 5=2 HPO 3+Cl 2 O 7 Хлорная кислота Оксид Метафосфорная. Хлорный фосфора(V кислота ангидри ) Это не окислительно-восстановительнаяд реакция. А вот другое водоотнимающее средство- серная кислота-способна выступать как окислитель. 2 HBr+H 2 SO 4=Br 2+SO 2+2 H 2 O Бромоводород (Восстановител ь) бром Оксид серы (IV)
2 HCl. O 4+P 2 O 5=2 HPO 3+Cl 2 O 7 Хлорная кислота Оксид Метафосфорная. Хлорный фосфора(V кислота ангидри ) Это не окислительно-восстановительнаяд реакция. А вот другое водоотнимающее средство- серная кислота-способна выступать как окислитель. 2 HBr+H 2 SO 4=Br 2+SO 2+2 H 2 O Бромоводород (Восстановител ь) бром Оксид серы (IV)
 Полезные ископаемые Fe 2 O 3 Красный железняк 2 Fe 2 O 3*3 H 2 O Mn. O 2 Пиролюзит Браунит Mn 2 O 2 Бурый железняк Руды марганц а Руды желез а
Полезные ископаемые Fe 2 O 3 Красный железняк 2 Fe 2 O 3*3 H 2 O Mn. O 2 Пиролюзит Браунит Mn 2 O 2 Бурый железняк Руды марганц а Руды желез а
 Sn. O 2 Al 2 O 3 Bi 2 O 3 Оловянный камень(оловянная руда) Корунд (ископаемое алюминия) Висмутовая охра (ископаемое висмута и природная краска) Природные оксиды неметаллов, имеющие значение в промышленности. CO SO 2 Угарный газ ( восстановитель в металлургии) Сернистый газ из вулканов (производство серной кислоты).
Sn. O 2 Al 2 O 3 Bi 2 O 3 Оловянный камень(оловянная руда) Корунд (ископаемое алюминия) Висмутовая охра (ископаемое висмута и природная краска) Природные оксиды неметаллов, имеющие значение в промышленности. CO SO 2 Угарный газ ( восстановитель в металлургии) Сернистый газ из вулканов (производство серной кислоты).
 Si. O 2 Кварцевый песок (производство стекла, строительные работы, производство кремнийорганических соединений), кварц (производство особых стекол, пропускающих ультрафиолетовые лучи), горный хрусталь ( изготовление украшений и декоративной посуды). Природные «смеси» оксидов, имеющие значение в промышленности. Al 2 O 3*2 Si. O 2*2 H 2 O K 2 O*3 Al 2 O 3*6 Si. O 2*2 H 2 O Каолин ( производство фарфора, фаянса, алюминия). Слюда белая ( заслонки для промышленных печей).
Si. O 2 Кварцевый песок (производство стекла, строительные работы, производство кремнийорганических соединений), кварц (производство особых стекол, пропускающих ультрафиолетовые лучи), горный хрусталь ( изготовление украшений и декоративной посуды). Природные «смеси» оксидов, имеющие значение в промышленности. Al 2 O 3*2 Si. O 2*2 H 2 O K 2 O*3 Al 2 O 3*6 Si. O 2*2 H 2 O Каолин ( производство фарфора, фаянса, алюминия). Слюда белая ( заслонки для промышленных печей).
 Распорядилась так природа, Что окислитель-кислород Давным- давно и год за годом Легко оксиды создает. А что относится к оксидам? Обыкновенная вода. Оксидов очень много видов: Речной песок, слюда, руда. В оксидах разберись однажды В самом составе вещества: Есть кислород в оксиде каждом, А элементов только два.
Распорядилась так природа, Что окислитель-кислород Давным- давно и год за годом Легко оксиды создает. А что относится к оксидам? Обыкновенная вода. Оксидов очень много видов: Речной песок, слюда, руда. В оксидах разберись однажды В самом составе вещества: Есть кислород в оксиде каждом, А элементов только два.
 Подмигнув лиловым глазом, сера сразу стала газом. Газ такой бывает редко, он удушливый и едкий. Сера, сера «S» ! 32 атомный вес. Сера в воздухе горит, образует ангидрид. Ангидрид вонючий газ, слезы капают из глаз! SO 2
Подмигнув лиловым глазом, сера сразу стала газом. Газ такой бывает редко, он удушливый и едкий. Сера, сера «S» ! 32 атомный вес. Сера в воздухе горит, образует ангидрид. Ангидрид вонючий газ, слезы капают из глаз! SO 2
 Загорелся всем на диво Фосфор в колбочке красиво. Получаем, надо знать, Ангидрид Р 2 О 5.
Загорелся всем на диво Фосфор в колбочке красиво. Получаем, надо знать, Ангидрид Р 2 О 5.



