Презентация elektr rob zoshyt





































- Размер: 3.5 Mегабайта
- Количество слайдов: 58
Описание презентации Презентация elektr rob zoshyt по слайдам
 Електронний робочий зошит з хімії “Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості. ”
Електронний робочий зошит з хімії “Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості. ”
 Зміст: 1. Теоретичні відомості. 2. Картки контролю знань. 3. Самостійні роботи. 4. Задачі з практичним змістом.
Зміст: 1. Теоретичні відомості. 2. Картки контролю знань. 3. Самостійні роботи. 4. Задачі з практичним змістом.
 Теоретичні відомості
Теоретичні відомості
 Види сполучень атомів Карбону між собою 1. Сполучення простими ковалентними зв’язками: – С – С – Такі сполучення реалізуються навіть у простих речовинах Карбону: алмазі, графіті, карбіні, фулеренах. 2. Сполучення кратними (подвійними і потрійними) ковалентними зв’язками: – С = С – – С ≡ С – 3. Циклічне сполучення атомів Карбону: Алмази: Фулерени:
Види сполучень атомів Карбону між собою 1. Сполучення простими ковалентними зв’язками: – С – С – Такі сполучення реалізуються навіть у простих речовинах Карбону: алмазі, графіті, карбіні, фулеренах. 2. Сполучення кратними (подвійними і потрійними) ковалентними зв’язками: – С = С – – С ≡ С – 3. Циклічне сполучення атомів Карбону: Алмази: Фулерени:
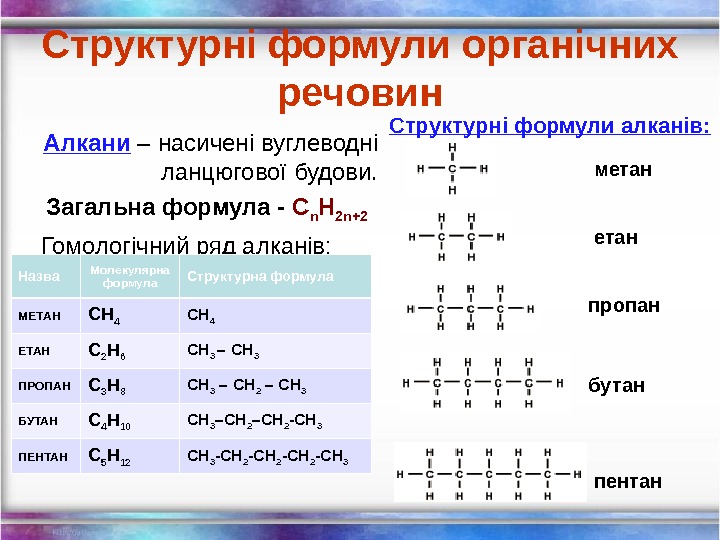
 Структурні формули органічних речовин Алкани – насичені вуглеводні ланцюгової будови. Загальна формула — С n H 2 n+2 Гомологічний ряд алканів: Назва Молекулярна формула Структурна формула МЕТАН СН 4 ЕТАН С 2 Н 6 СН 3 – СН 3 ПРОПАН С 3 Н 8 СН 3 – СН 2 – СН 3 БУТАН С 4 Н 10 СН 3 –СН 2 -СН 3 ПЕНТАН С 5 Н 12 СН 3 -СН 2 -СН 3 метан пропан бутан пентан. Структурні формули алканів:
Структурні формули органічних речовин Алкани – насичені вуглеводні ланцюгової будови. Загальна формула — С n H 2 n+2 Гомологічний ряд алканів: Назва Молекулярна формула Структурна формула МЕТАН СН 4 ЕТАН С 2 Н 6 СН 3 – СН 3 ПРОПАН С 3 Н 8 СН 3 – СН 2 – СН 3 БУТАН С 4 Н 10 СН 3 –СН 2 -СН 3 ПЕНТАН С 5 Н 12 СН 3 -СН 2 -СН 3 метан пропан бутан пентан. Структурні формули алканів:

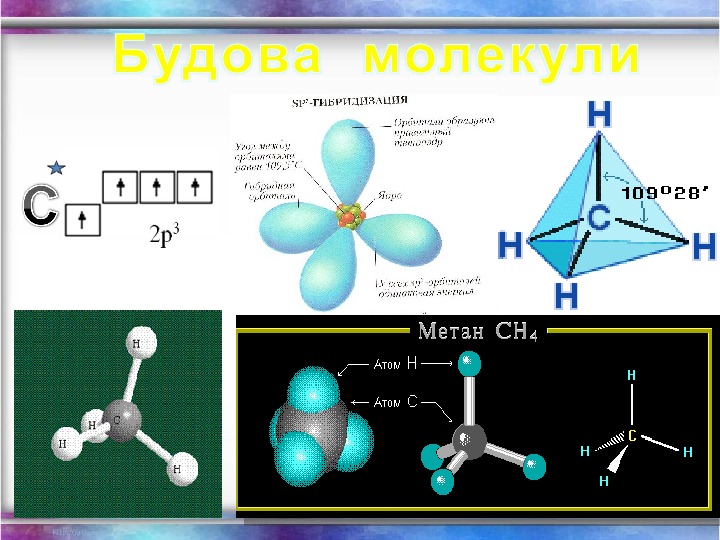
 Фізичні властивості метану: Метан (СН 4 ) — газ; без кольору; без запаху; майже не розчиняється у воді; t кипіння = — 161, 6 С; t плавлення = — 182, 5 С.
Фізичні властивості метану: Метан (СН 4 ) — газ; без кольору; без запаху; майже не розчиняється у воді; t кипіння = — 161, 6 С; t плавлення = — 182, 5 С.
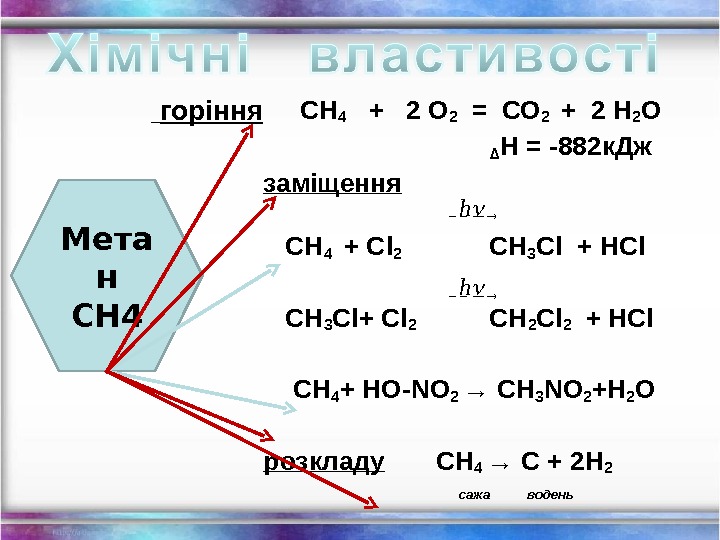
 СН 4 + 2 О 2 = СО 2 + 2 Н 2 О ∆ Н = -882 к. Дж заміщення СН 4 + Cl 2 СН 3 Cl + HCl СН 3 Cl+ Cl 2 СН 2 Cl 2 + HCl СН 4 + HO-NO 2 → СН 3 NO 2 +Н 2 О розкладу СН 4 → С + 2 Н 2 сажа водень. Мета н СН 4 горіння h h
СН 4 + 2 О 2 = СО 2 + 2 Н 2 О ∆ Н = -882 к. Дж заміщення СН 4 + Cl 2 СН 3 Cl + HCl СН 3 Cl+ Cl 2 СН 2 Cl 2 + HCl СН 4 + HO-NO 2 → СН 3 NO 2 +Н 2 О розкладу СН 4 → С + 2 Н 2 сажа водень. Мета н СН 4 горіння h h
 Застосування метану • як дешеве паливо у побуті, в автотранспорті та багатьох промислових процесах • як сировина для хімічної промисловості. З нього добувають: — сажу для виготовлення гуми, друкарських фарб; — водень – для синтезу аміаку; — дихлорометан, трихлорометан – розчинники; — хлороформ – знеболювальна речовина під час хірургічних операцій; — тетрахлорометан – засіб для гасіння вогню
Застосування метану • як дешеве паливо у побуті, в автотранспорті та багатьох промислових процесах • як сировина для хімічної промисловості. З нього добувають: — сажу для виготовлення гуми, друкарських фарб; — водень – для синтезу аміаку; — дихлорометан, трихлорометан – розчинники; — хлороформ – знеболювальна речовина під час хірургічних операцій; — тетрахлорометан – засіб для гасіння вогню
 Ненасичені вуглеводні – органічні сполуки, що мають кратні зв’язки між атомами Карбону (п одвійні – С = С – або потрійні – С Ξ С – ) Етиленові вуглеводні — органічні сполуки, що мають один подвійний зв’язок між атомами Карбону. Загальна формула С n H 2 n С 2 Н 4 — ет ен (етилен) С 3 Н 6 — проп ен С 4 Н 8 — бут ен Ацетиленові вуглеводні — органічні сполуки, що мають один потрійний зв’язок між атомами Карбону. Загальна формула — С n H 2 n — 2 С 2 Н 2 — ет ин (ацетилен) С 3 Н 4 — проп ін С 4 Н 6 — бут ин
Ненасичені вуглеводні – органічні сполуки, що мають кратні зв’язки між атомами Карбону (п одвійні – С = С – або потрійні – С Ξ С – ) Етиленові вуглеводні — органічні сполуки, що мають один подвійний зв’язок між атомами Карбону. Загальна формула С n H 2 n С 2 Н 4 — ет ен (етилен) С 3 Н 6 — проп ен С 4 Н 8 — бут ен Ацетиленові вуглеводні — органічні сполуки, що мають один потрійний зв’язок між атомами Карбону. Загальна формула — С n H 2 n — 2 С 2 Н 2 — ет ин (ацетилен) С 3 Н 4 — проп ін С 4 Н 6 — бут ин
 a) загальна формула b) кратні зв’язки c) тип гібридизації d) кут між напрямами зв’язку. Алкени Алкіни C n H 2 n-2 С СС С sp 2 sp 1 s + 2 p = 3 sp 2 1 s + 1 p = 2 sp < 120 ◦ < 1 8 0 ◦
a) загальна формула b) кратні зв’язки c) тип гібридизації d) кут між напрямами зв’язку. Алкени Алкіни C n H 2 n-2 С СС С sp 2 sp 1 s + 2 p = 3 sp 2 1 s + 1 p = 2 sp < 120 ◦ < 1 8 0 ◦
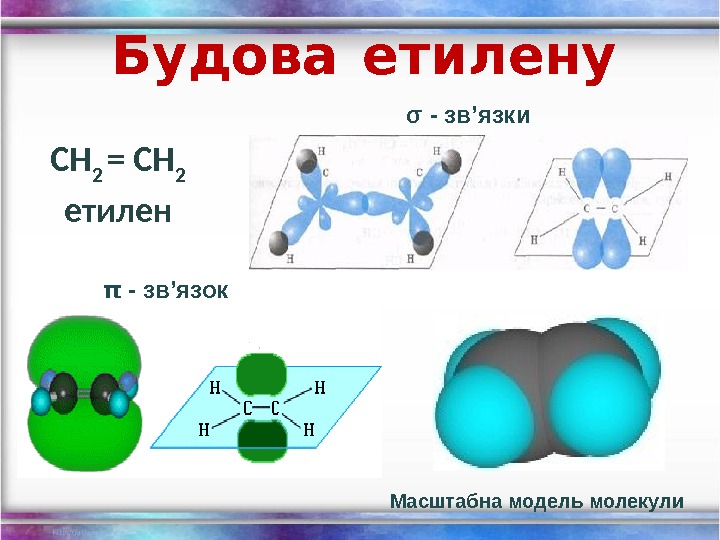
 Будова етилену СН 2 = СН 2 етилен σ — зв’язки π — зв’язок Масштабна модель молекули
Будова етилену СН 2 = СН 2 етилен σ — зв’язки π — зв’язок Масштабна модель молекули
 Фізичні властивості етилену С 2 Н 4 безбарвний газ; добре розчинний в органічних розчинниках; tплавл = — 169, 2 С; вибухонебезпечний
Фізичні властивості етилену С 2 Н 4 безбарвний газ; добре розчинний в органічних розчинниках; tплавл = — 169, 2 С; вибухонебезпечний
 Хімічні властивості етилену 1. Горіння (з виділенням великої кількості теплоти): С 2 Н 4 + 3 O 2 → 2 СО 2 +2 Н 2 О 2. Реакції приєднання по місцю розриву π — зв’язку: СН 2 = СН 2 а) гідрування — приєднання водню: С 2 Н 4 + Н 2 → С 2 Н 6 б) галогенування — приєднання галогенів: С 2 Н 4 + Br 2 →С 2 Н 4 Br 2 Якісне визначення ненасичених вуглеводнів — знебарвлення розчину калій перманганату і бромної води
Хімічні властивості етилену 1. Горіння (з виділенням великої кількості теплоти): С 2 Н 4 + 3 O 2 → 2 СО 2 +2 Н 2 О 2. Реакції приєднання по місцю розриву π — зв’язку: СН 2 = СН 2 а) гідрування — приєднання водню: С 2 Н 4 + Н 2 → С 2 Н 6 б) галогенування — приєднання галогенів: С 2 Н 4 + Br 2 →С 2 Н 4 Br 2 Якісне визначення ненасичених вуглеводнів — знебарвлення розчину калій перманганату і бромної води
 Хімічні властивості етилену Вид реакції Гідрування Галогенування (бромування) Гідрогалогенування Гідратація Полімеризаціякаталізатор
Хімічні властивості етилену Вид реакції Гідрування Галогенування (бромування) Гідрогалогенування Гідратація Полімеризаціякаталізатор
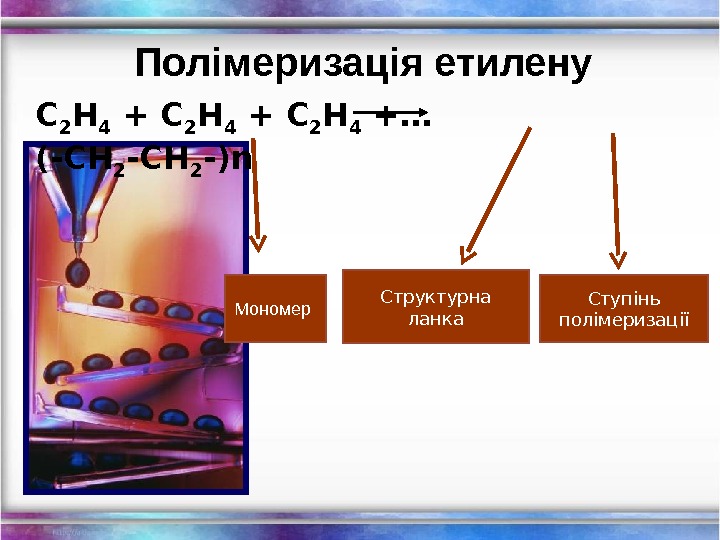
 Полімеризація етилену С 2 Н 4 +… (-СН 2 -) n Структурна ланка Ступінь полімеризаціїМономер
Полімеризація етилену С 2 Н 4 +… (-СН 2 -) n Структурна ланка Ступінь полімеризаціїМономер
 Застосування етилену прискорює достигання плодів для виробництва поліетилену для добування етилового спирту для отримання анестезійної речовини — хлоретану для добування пестициду – 1, 2 — дихлоретану
Застосування етилену прискорює достигання плодів для виробництва поліетилену для добування етилового спирту для отримання анестезійної речовини — хлоретану для добування пестициду – 1, 2 — дихлоретану

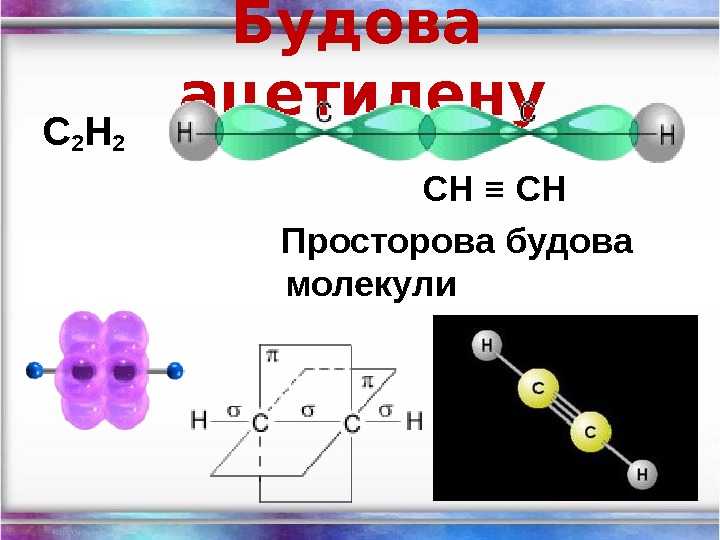
 Будова ацетилену С 2 Н 2 СН ≡ СН Просторова будова молекули
Будова ацетилену С 2 Н 2 СН ≡ СН Просторова будова молекули
 Фізичні властивості С 2 Н 2 безбарвний газ; майже без запаху; малорозчинний у воді, але під тиском добре розчиняється у ацетоні; tкип = — 84 С; легший за повітря; вибухонебезпечний
Фізичні властивості С 2 Н 2 безбарвний газ; майже без запаху; малорозчинний у воді, але під тиском добре розчиняється у ацетоні; tкип = — 84 С; легший за повітря; вибухонебезпечний
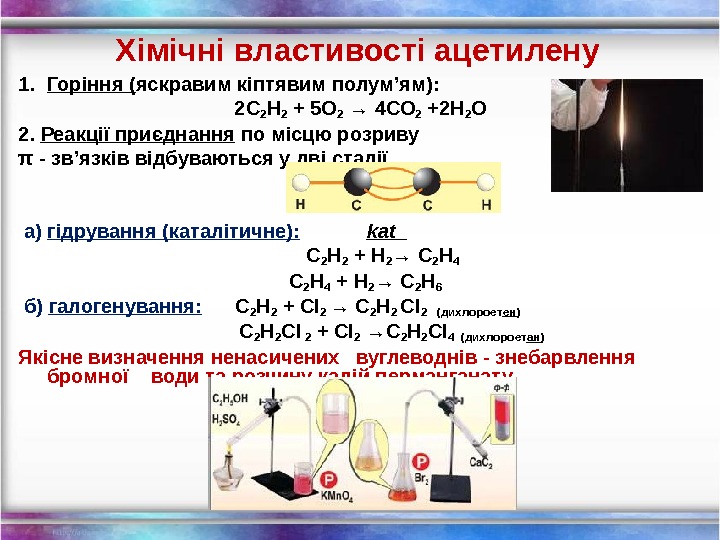
 Хімічні властивості ацетилену 1. Горіння ( яскравим кіптявим полум’ям): 2 С 2 Н 2 + 5 O 2 → 4 СО 2 +2 Н 2 О 2. Реакції приєднання по місцю розриву π — зв’язків відбуваються у дві стадії а) гідрування (каталітичне): kat С 2 Н 2 + Н 2 → С 2 Н 4 С 2 Н 4 + Н 2 → С 2 Н 6 б) галогенування: С 2 Н 2 + Cl 2 → С 2 Н 2 Cl 2 ( дихлороет ен ) С 2 Н 2 Cl 2 + Cl 2 →С 2 Н 2 Cl 4 (дихлороет ан ) Якісне визначення ненасичених вуглеводнів — знебарвлення бромної води та розчину калій перманганату.
Хімічні властивості ацетилену 1. Горіння ( яскравим кіптявим полум’ям): 2 С 2 Н 2 + 5 O 2 → 4 СО 2 +2 Н 2 О 2. Реакції приєднання по місцю розриву π — зв’язків відбуваються у дві стадії а) гідрування (каталітичне): kat С 2 Н 2 + Н 2 → С 2 Н 4 С 2 Н 4 + Н 2 → С 2 Н 6 б) галогенування: С 2 Н 2 + Cl 2 → С 2 Н 2 Cl 2 ( дихлороет ен ) С 2 Н 2 Cl 2 + Cl 2 →С 2 Н 2 Cl 4 (дихлороет ан ) Якісне визначення ненасичених вуглеводнів — знебарвлення бромної води та розчину калій перманганату.
 Застосування ацетилену • для газового різання і зварювання металів • для синтезу оцтової кислоти • для виготовлення пластмас і синтетичних каучуків
Застосування ацетилену • для газового різання і зварювання металів • для синтезу оцтової кислоти • для виготовлення пластмас і синтетичних каучуків
 Порівняльна таблиця № п/п Назва Клас вуглеводню Загальна формула Будова Хімічні властивості Якісне визначення СН 4 м е т а н Насичені, алкани С n H 2 n +2 тетраедр одинарні зв’язки Реакції заміщення: СН 4 + Cl 2 → СН 3 Cl +Н Cl Стійкі до дії розчинів бромної води та калій перманганату С 2 Н 4 е т е н Етиленові, алкени С n H 2 n С=С подвійний зв’язок Реакції приєднання, полімеризації : С 2 Н 4 + Br 2 → С 2 Н 4 Br 2 n С 2 Н 4 → (- С 2 Н 4 -) n Знебарвлення розчину бромної води і калій перманганату С 2 Н 2 е т и н Ацетиленові, алкіни С n H 2 n -2 С ≡ С потрійний зв’язок Реакції приєднання (дві стадії): С 2 Н 2 + Н 2 → С 2 Н 4 + Н 2 → С 2 Н 6 Знебарвлення розчину бромної води і калій перманганату
Порівняльна таблиця № п/п Назва Клас вуглеводню Загальна формула Будова Хімічні властивості Якісне визначення СН 4 м е т а н Насичені, алкани С n H 2 n +2 тетраедр одинарні зв’язки Реакції заміщення: СН 4 + Cl 2 → СН 3 Cl +Н Cl Стійкі до дії розчинів бромної води та калій перманганату С 2 Н 4 е т е н Етиленові, алкени С n H 2 n С=С подвійний зв’язок Реакції приєднання, полімеризації : С 2 Н 4 + Br 2 → С 2 Н 4 Br 2 n С 2 Н 4 → (- С 2 Н 4 -) n Знебарвлення розчину бромної води і калій перманганату С 2 Н 2 е т и н Ацетиленові, алкіни С n H 2 n -2 С ≡ С потрійний зв’язок Реакції приєднання (дві стадії): С 2 Н 2 + Н 2 → С 2 Н 4 + Н 2 → С 2 Н 6 Знебарвлення розчину бромної води і калій перманганату
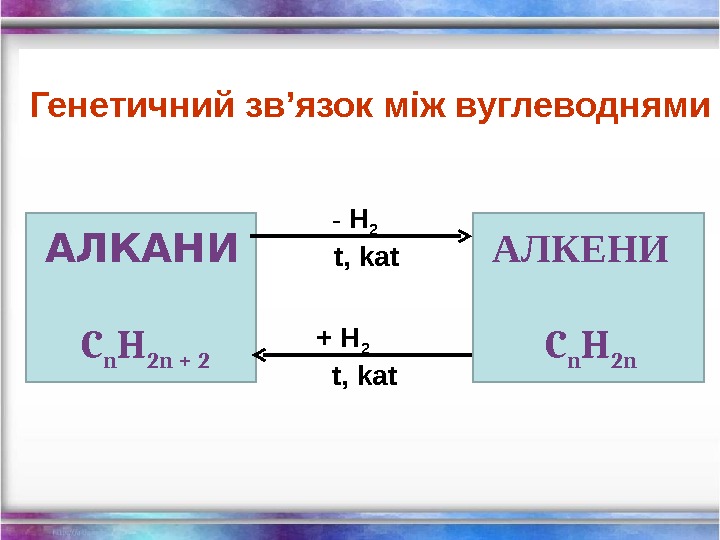
 АЛКАНИ C n H 2 n + 2 — H 2 t, kat + H 2 t, kat АЛКЕНИ C n H 2 n Генетичний зв ’ язок між вуглеводнями
АЛКАНИ C n H 2 n + 2 — H 2 t, kat + H 2 t, kat АЛКЕНИ C n H 2 n Генетичний зв ’ язок між вуглеводнями
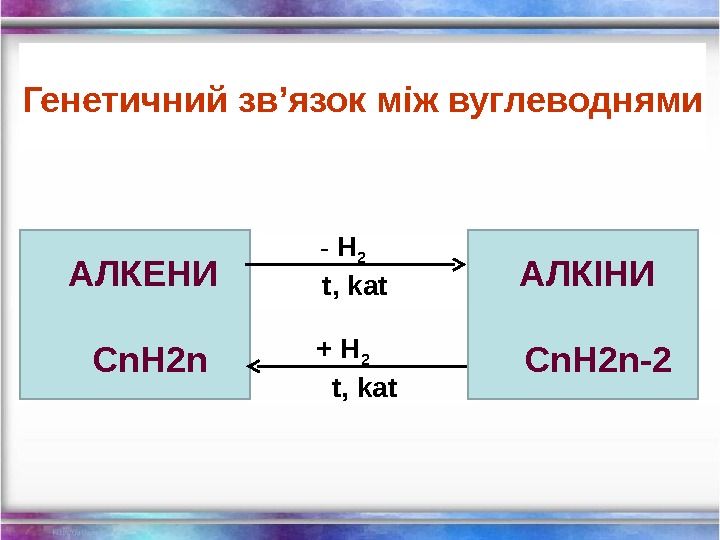
 АЛКЕНИ С n. H 2 n — H 2 t, kat + H 2 t, kat АЛКІНИ С n. H 2 n — 2 Генетичний зв ’ язок між вуглеводнями
АЛКЕНИ С n. H 2 n — H 2 t, kat + H 2 t, kat АЛКІНИ С n. H 2 n — 2 Генетичний зв ’ язок між вуглеводнями
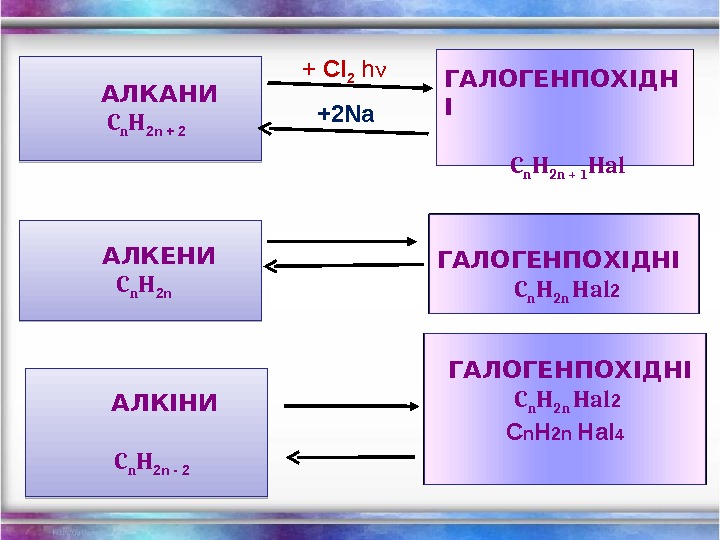
 АЛКАНИ C n H 2 n + 2 ГАЛОГЕНПОХІДН І C n H 2 n + 1 Hal+ Cl 2 h ν +2 Na АЛКЕНИ C n H 2 n ГАЛОГЕНПОХІДНІ C n H 2 n Hal 2 АЛКІНИ C n H 2 n — 2 ГАЛОГЕНПОХІДНІ C n H 2 n Hal 2 C n H 2 n Hal
АЛКАНИ C n H 2 n + 2 ГАЛОГЕНПОХІДН І C n H 2 n + 1 Hal+ Cl 2 h ν +2 Na АЛКЕНИ C n H 2 n ГАЛОГЕНПОХІДНІ C n H 2 n Hal 2 АЛКІНИ C n H 2 n — 2 ГАЛОГЕНПОХІДНІ C n H 2 n Hal 2 C n H 2 n Hal
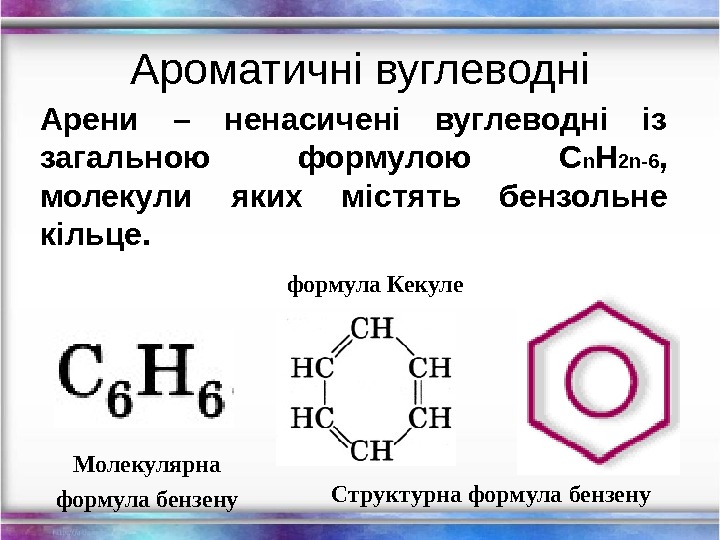
 Структурна формула бензену. Арени – ненасичені вуглеводні із загальною формулою C n H 2 n-6 , молекули яких містять бензольне кільце. Молекулярна формула бензену формула Кекуле. Ароматичні вуглеводні
Структурна формула бензену. Арени – ненасичені вуглеводні із загальною формулою C n H 2 n-6 , молекули яких містять бензольне кільце. Молекулярна формула бензену формула Кекуле. Ароматичні вуглеводні
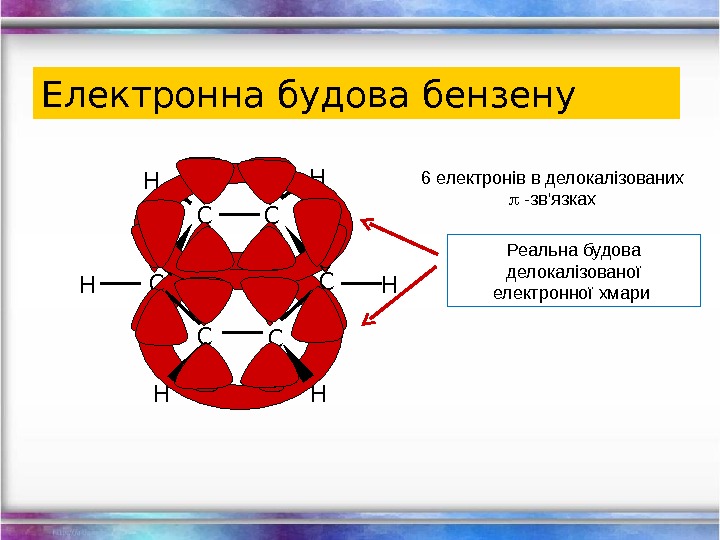
 Електронна будова бензену C CC C HH H H 6 електронів в делокалізованих -зв’язках Реальна будова делокалізовано ї електронної хмари
Електронна будова бензену C CC C HH H H 6 електронів в делокалізованих -зв’язках Реальна будова делокалізовано ї електронної хмари
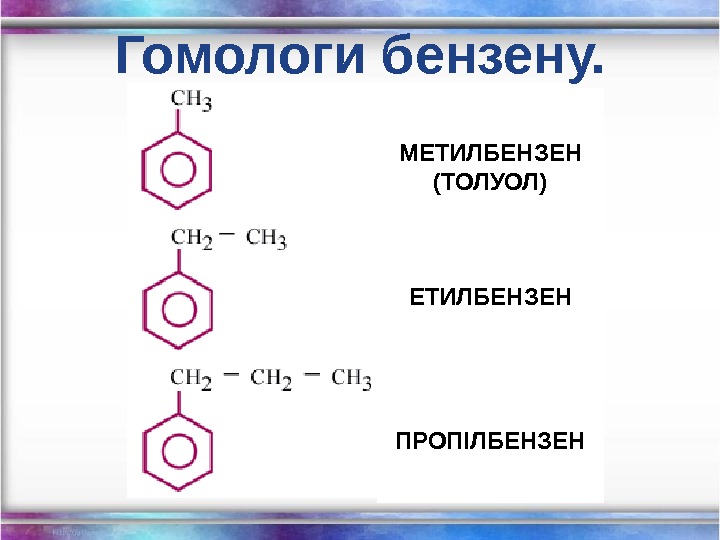
 Гомологи бензену. МЕТИЛБЕНЗЕН (ТОЛУОЛ) ЕТИЛБЕНЗЕН ПРОПІЛБЕНЗЕН
Гомологи бензену. МЕТИЛБЕНЗЕН (ТОЛУОЛ) ЕТИЛБЕНЗЕН ПРОПІЛБЕНЗЕН
 Отримання бензену. Бензен є першим представником аренів. Його можна отримати тримеризацією ацетилену. Бензол отримують при переробці кам’яного вугілля, а також при риформінгу бензинів з низьким октановим числом. активоване вугілля,
Отримання бензену. Бензен є першим представником аренів. Його можна отримати тримеризацією ацетилену. Бензол отримують при переробці кам’яного вугілля, а також при риформінгу бензинів з низьким октановим числом. активоване вугілля,
 Фізичні властивості бензену. Бензен: • безбарвна рідина, • з різким характерним запахом, • легший води, • розчиняється у воді, • розчинний в органічних розчинниках. Увага! Бензен токсичний, тому робота з ним в умовах школи недопустима.
Фізичні властивості бензену. Бензен: • безбарвна рідина, • з різким характерним запахом, • легший води, • розчиняється у воді, • розчинний в органічних розчинниках. Увага! Бензен токсичний, тому робота з ним в умовах школи недопустима.
 1. Бензен горить. Полум’я бензену кіптяве через високий вміст Карбону в молекулі. Хімічні властивості бензену. Через особливу будову молекули, бензен займає проміжне положення між алканами і алкенами , тобто може вступати в реакції приєднання і в реакції заміщення.
1. Бензен горить. Полум’я бензену кіптяве через високий вміст Карбону в молекулі. Хімічні властивості бензену. Через особливу будову молекули, бензен займає проміжне положення між алканами і алкенами , тобто може вступати в реакції приєднання і в реакції заміщення.
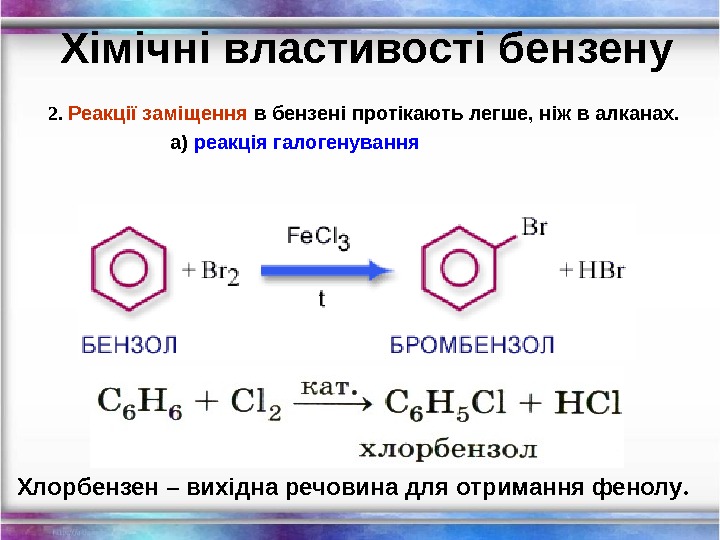
 Хімічні властивості бензену 2. Реакції заміщення в бензені протікають легше, ніж в алканах. а) реакція галогенування Хлорбензен – вихідна речовина для отримання фенолу.
Хімічні властивості бензену 2. Реакції заміщення в бензені протікають легше, ніж в алканах. а) реакція галогенування Хлорбензен – вихідна речовина для отримання фенолу.
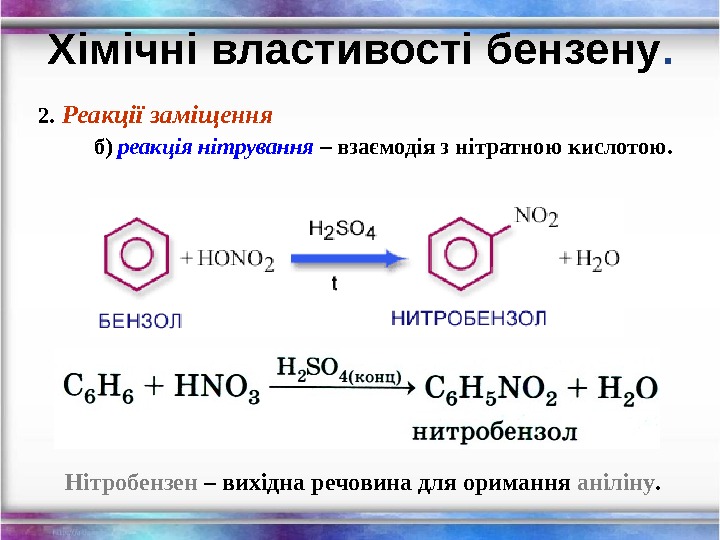
 2. Реакції заміщення б) реакція нітрування – взаємодія з нітратною кислотою. Хімічні властивості бензену. Нітробензен – вихідна речовина для оримання аніліну.
2. Реакції заміщення б) реакція нітрування – взаємодія з нітратною кислотою. Хімічні властивості бензену. Нітробензен – вихідна речовина для оримання аніліну.
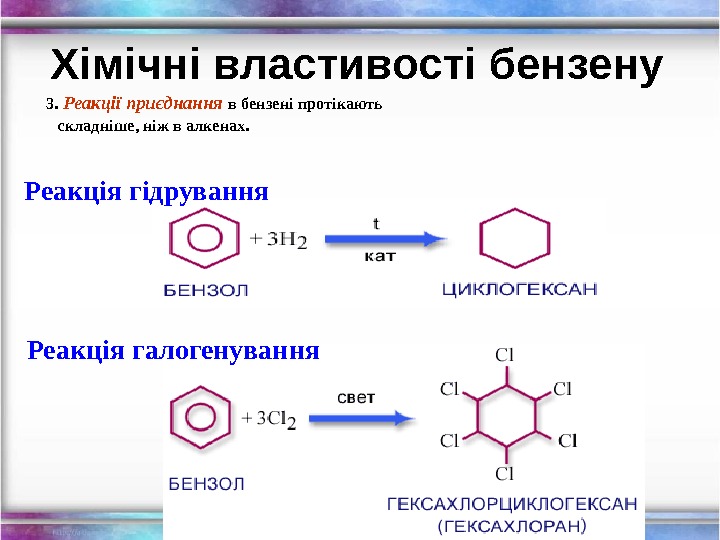
 Хімічні властивості бензену 3. Реакції приєднання в бензені протікають складніше, ніж в алкенах. Реакція гідрування Реакція галогенування
Хімічні властивості бензену 3. Реакції приєднання в бензені протікають складніше, ніж в алкенах. Реакція гідрування Реакція галогенування
 Хімічні властивості бензену • Незважаючи на високу ненасиченість молекули бензену (за складом), він не дає характерних, якісних реакцій для ненасичених вуглеводнів: не знебарвлює бромну воду і розчин перманганату калію. • Це пов’язано з особливою будовою молекули бензолу.
Хімічні властивості бензену • Незважаючи на високу ненасиченість молекули бензену (за складом), він не дає характерних, якісних реакцій для ненасичених вуглеводнів: не знебарвлює бромну воду і розчин перманганату калію. • Це пов’язано з особливою будовою молекули бензолу.
 Застосування бензену 1 -добавка до бензину; виробництво 2 -розчинників; 3 -ацетону; 4 -аніліну; 5 -фенолу; 6 -пестицидів; 7 -ліків; 8 -фенолформальдегідних пластмас.
Застосування бензену 1 -добавка до бензину; виробництво 2 -розчинників; 3 -ацетону; 4 -аніліну; 5 -фенолу; 6 -пестицидів; 7 -ліків; 8 -фенолформальдегідних пластмас.
 Картки контролю знань
Картки контролю знань
 Картка № 1 1. Гомологічний ряд насичених вуглеводнів називається: а) арени; б) алкени; в) алкани; г) алкіни 2. У будові етиленових вуглеводнів між атомами Карбону розміщений: а) один подвійний зв ’ язок; б) два подвійних зв ’ язки; в) один потрійний зв ’ язок 3. Для ацетиленових вуглеводнів характерний тип гібридизації атомних орбіталей Карбону: а) sp – гібридизація; б) sp – гібридизація; в) sp – гібридизація;
Картка № 1 1. Гомологічний ряд насичених вуглеводнів називається: а) арени; б) алкени; в) алкани; г) алкіни 2. У будові етиленових вуглеводнів між атомами Карбону розміщений: а) один подвійний зв ’ язок; б) два подвійних зв ’ язки; в) один потрійний зв ’ язок 3. Для ацетиленових вуглеводнів характерний тип гібридизації атомних орбіталей Карбону: а) sp – гібридизація; б) sp – гібридизація; в) sp – гібридизація;
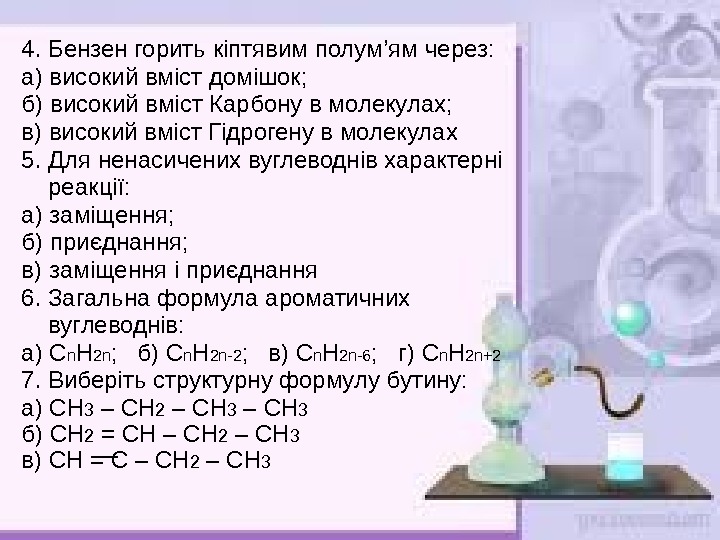
 4. Бензен горить кіптявим полум ’ ям через: а) високий вміст домішок; б) високий вміст Карбону в молекулах; в) високий вміст Гідрогену в молекулах 5. Для ненасичених вуглеводнів характерні реакції: а) заміщення; б) приєднання; в) заміщення і приєднання 6. Загальна формула ароматичних вуглеводнів: а) С n H 2 n ; б) С n H 2 n -2 ; в) С n H 2 n -6 ; г) С n H 2 n +2 7. Виберіть структурну формулу бутину: а) СН 3 – СН 2 – СН 3 б) СН 2 = СН – СН 2 – СН 3 в) СН = С – СН 2 – СН
4. Бензен горить кіптявим полум ’ ям через: а) високий вміст домішок; б) високий вміст Карбону в молекулах; в) високий вміст Гідрогену в молекулах 5. Для ненасичених вуглеводнів характерні реакції: а) заміщення; б) приєднання; в) заміщення і приєднання 6. Загальна формула ароматичних вуглеводнів: а) С n H 2 n ; б) С n H 2 n -2 ; в) С n H 2 n -6 ; г) С n H 2 n +2 7. Виберіть структурну формулу бутину: а) СН 3 – СН 2 – СН 3 б) СН 2 = СН – СН 2 – СН 3 в) СН = С – СН 2 – СН
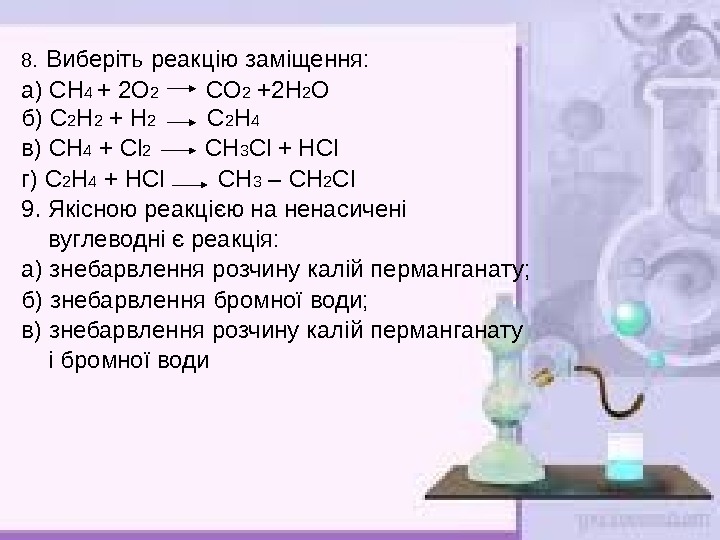
 8. Виберіть реакцію заміщення: а) СН 4 + 2 О 2 СО 2 +2 Н 2 О б) С 2 Н 2 + Н 2 С 2 Н 4 в) СН 4 + Cl 2 СН 3 Cl + Н Cl г) С 2 Н 4 + Н Cl СН 3 – СН 2 Cl 9. Якісною реакцією на ненасичені вуглеводні є реакція: а) знебарвлення розчину калій перманганату; б) знебарвлення бромної води; в) знебарвлення розчину калій перманганату і бромної води
8. Виберіть реакцію заміщення: а) СН 4 + 2 О 2 СО 2 +2 Н 2 О б) С 2 Н 2 + Н 2 С 2 Н 4 в) СН 4 + Cl 2 СН 3 Cl + Н Cl г) С 2 Н 4 + Н Cl СН 3 – СН 2 Cl 9. Якісною реакцією на ненасичені вуглеводні є реакція: а) знебарвлення розчину калій перманганату; б) знебарвлення бромної води; в) знебарвлення розчину калій перманганату і бромної води
 Картка № 2 1. Органічні речовини, що складаються тільки з двох елементів — Карбону і Гідрогену називаються: а) вуглеводи; б) вуглеводні; в) аміни 2. Хімічна формула метану: а) СН 4 ; б) С 2 Н 4 ; в) С 2 Н 2 ; г) С 6 Н 6 3. У складі алкінів наявні: а) 2 П – зв ’ язки; б) 1 П – зв ’ язок; в) бензольне кільце 4. Як якісно відрізнити ацетилен від пропану: а) за здатністю горіти безбарвним полум ’ ям; б) за здатністю утворювати вибухонебезпечні суміші з повітрям; в) за здатністю знебарвлювати розчин перманганату калію
Картка № 2 1. Органічні речовини, що складаються тільки з двох елементів — Карбону і Гідрогену називаються: а) вуглеводи; б) вуглеводні; в) аміни 2. Хімічна формула метану: а) СН 4 ; б) С 2 Н 4 ; в) С 2 Н 2 ; г) С 6 Н 6 3. У складі алкінів наявні: а) 2 П – зв ’ язки; б) 1 П – зв ’ язок; в) бензольне кільце 4. Як якісно відрізнити ацетилен від пропану: а) за здатністю горіти безбарвним полум ’ ям; б) за здатністю утворювати вибухонебезпечні суміші з повітрям; в) за здатністю знебарвлювати розчин перманганату калію
 5. Для бензену характерні типи реакцій: а) реакції приєднання; б) реакції заміщення; в) реакції приєднання і заміщення 6. Виберіть формули алкенів: а) С 2 Н 4 б) С 4 Н 10 в) С 2 Н 2 г) С 3 Н 6 д) С 5 Н 12 7. Отримати із алкенів насичені вуглеводні можна реакцією: а) гідрування; б) дегідрування; в) гідратації 8. Загальна формула насичених вуглеводнів: а) С n Н 2 n б) С n Н 2 n +2 в) С n Н 2 n -2 г) С n Н 2 n —
5. Для бензену характерні типи реакцій: а) реакції приєднання; б) реакції заміщення; в) реакції приєднання і заміщення 6. Виберіть формули алкенів: а) С 2 Н 4 б) С 4 Н 10 в) С 2 Н 2 г) С 3 Н 6 д) С 5 Н 12 7. Отримати із алкенів насичені вуглеводні можна реакцією: а) гідрування; б) дегідрування; в) гідратації 8. Загальна формула насичених вуглеводнів: а) С n Н 2 n б) С n Н 2 n +2 в) С n Н 2 n -2 г) С n Н 2 n —
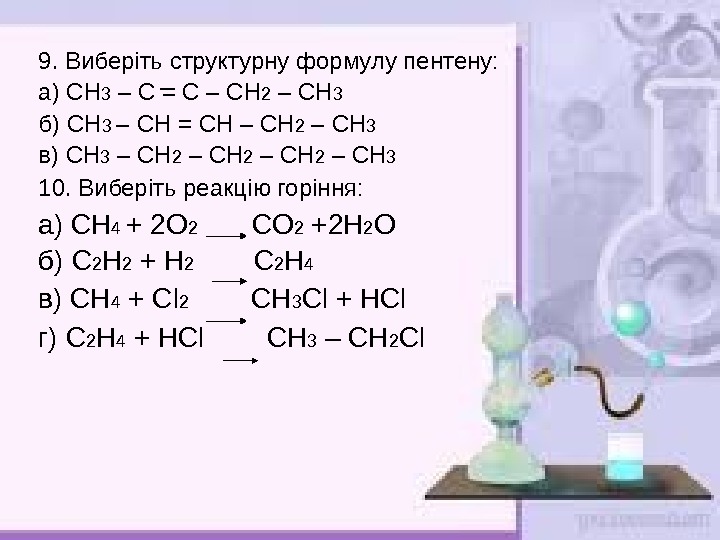
 9. Виберіть структурну формулу пентену: а) СН 3 – С = С – СН 2 – СН 3 б) СН 3 – СН = СН – СН 2 – СН 3 в) СН 3 – СН 2 – СН 3 10. Виберіть реакцію горіння: а) СН 4 + 2 О 2 СО 2 +2 Н 2 О б) С 2 Н 2 + Н 2 С 2 Н 4 в) СН 4 + Cl 2 СН 3 Cl + Н Cl г) С 2 Н 4 + Н Cl СН 3 – СН 2 Cl
9. Виберіть структурну формулу пентену: а) СН 3 – С = С – СН 2 – СН 3 б) СН 3 – СН = СН – СН 2 – СН 3 в) СН 3 – СН 2 – СН 3 10. Виберіть реакцію горіння: а) СН 4 + 2 О 2 СО 2 +2 Н 2 О б) С 2 Н 2 + Н 2 С 2 Н 4 в) СН 4 + Cl 2 СН 3 Cl + Н Cl г) С 2 Н 4 + Н Cl СН 3 – СН 2 Cl
 Картка № 3 1. Валентність Карбону в органічних сполуках: а) IV б ) II в ) III г ) II або IV 2. Один з рядів вуглеводнів, що має загальну формулу С n Н 2 n , називається: а) насичені вуглеводні; б) етиленові вуглеводні; в) ацетиленові вуглеводні; г) ароматичні вуглеводні 3. Для насичених вуглеводнів характерний тип гібридизації атомних орбіталей Карбону: а) sp – гібридизація; б) sp – гібридизація; в) sp – гібридизація;
Картка № 3 1. Валентність Карбону в органічних сполуках: а) IV б ) II в ) III г ) II або IV 2. Один з рядів вуглеводнів, що має загальну формулу С n Н 2 n , називається: а) насичені вуглеводні; б) етиленові вуглеводні; в) ацетиленові вуглеводні; г) ароматичні вуглеводні 3. Для насичених вуглеводнів характерний тип гібридизації атомних орбіталей Карбону: а) sp – гібридизація; б) sp – гібридизація; в) sp – гібридизація;
 4. У складі аренів наявні: а) 2 П – зв ’ язки; б) 1 П – зв ’ язок; в) бензольне кільце 5. Назвіть продукти горіння метану: а) чадний газ і водень; б) вуглекислий газ і вода; в) вуглекислий газ і водень 6. Які реакції у аренів відбуваються легше, ніж у інших вуглеводнів: а) заміщення; б) приєднання; в) приєднання і заміщення 7. Виберіть формули алканів: а) С 4 Н 8 б) СН 4 в) С 3 Н 8 г) С 3 Н 4 д) С 4 Н
4. У складі аренів наявні: а) 2 П – зв ’ язки; б) 1 П – зв ’ язок; в) бензольне кільце 5. Назвіть продукти горіння метану: а) чадний газ і водень; б) вуглекислий газ і вода; в) вуглекислий газ і водень 6. Які реакції у аренів відбуваються легше, ніж у інших вуглеводнів: а) заміщення; б) приєднання; в) приєднання і заміщення 7. Виберіть формули алканів: а) С 4 Н 8 б) СН 4 в) С 3 Н 8 г) С 3 Н 4 д) С 4 Н
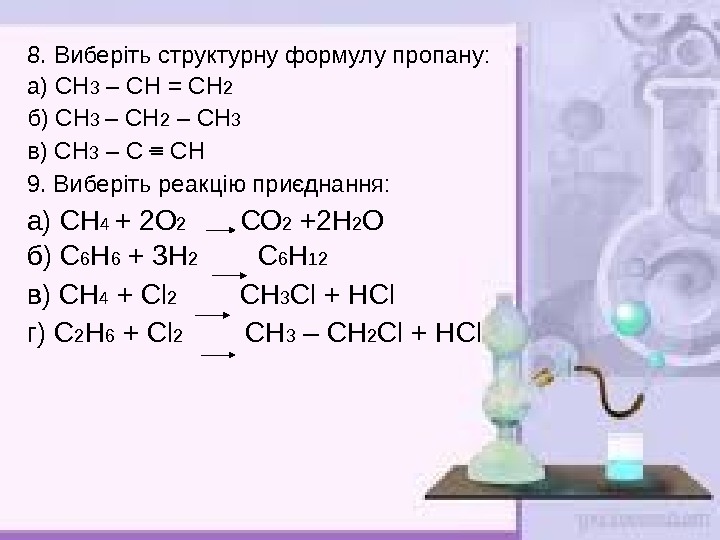
 8. Виберіть структурну формулу пропану: а) СН 3 – СН = СН 2 б) СН 3 – СН 2 – СН 3 в) СН 3 – С = СН 9. Виберіть реакцію приєднання: а) СН 4 + 2 О 2 СО 2 +2 Н 2 О б) С 6 Н 6 + 3 Н 2 С 6 Н 12 в) СН 4 + Cl 2 СН 3 Cl + Н Cl г) С 2 Н 6 + Cl 2 СН 3 – СН 2 Cl + Н Cl
8. Виберіть структурну формулу пропану: а) СН 3 – СН = СН 2 б) СН 3 – СН 2 – СН 3 в) СН 3 – С = СН 9. Виберіть реакцію приєднання: а) СН 4 + 2 О 2 СО 2 +2 Н 2 О б) С 6 Н 6 + 3 Н 2 С 6 Н 12 в) СН 4 + Cl 2 СН 3 Cl + Н Cl г) С 2 Н 6 + Cl 2 СН 3 – СН 2 Cl + Н Cl
 Ключ до тест ів: Картка № 1 1) в 2) а 3) в 4) б 5) б 6) в 7) в 8) в 9) в Картка № 2 1) б 2) а 3) а 4) в 5) в 6) а, г 7) а 8) б 9) б 10) а Картка № 3 1) а 2) б 3) б 4) в 5) б 6) а 7) б, в 8) б 9) б
Ключ до тест ів: Картка № 1 1) в 2) а 3) в 4) б 5) б 6) в 7) в 8) в 9) в Картка № 2 1) б 2) а 3) а 4) в 5) в 6) а, г 7) а 8) б 9) б 10) а Картка № 3 1) а 2) б 3) б 4) в 5) б 6) а 7) б, в 8) б 9) б
 Самостійні роботи
Самостійні роботи
 ЗАВДАННЯ (І РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) С 2 Н 2 ; б) С 3 Н 8 ; в) С 6 Н 12 ; г) СН 4 ; д) С 4 Н 6 2. Встановіть відповідність між структурною формулою і назвою сполуки: 1) СН 3 –СН = СН — СН 2 — СН 3 ; а) пентан; 2) СН 3 — СН 2 – СН 2 — СН 3 ; б) бутин; 3) СН ≡ С – СН 2 — СН 3 ; в) бутан; г) пентен 3. Допишіть рівняння реакцій: а) СН 4 + Br 2 → б) С 3 Н 8 + O 2 → в) С 2 Н 4 + Cl 2 → г) С 2 Н 2 + Н 2 →
ЗАВДАННЯ (І РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) С 2 Н 2 ; б) С 3 Н 8 ; в) С 6 Н 12 ; г) СН 4 ; д) С 4 Н 6 2. Встановіть відповідність між структурною формулою і назвою сполуки: 1) СН 3 –СН = СН — СН 2 — СН 3 ; а) пентан; 2) СН 3 — СН 2 – СН 2 — СН 3 ; б) бутин; 3) СН ≡ С – СН 2 — СН 3 ; в) бутан; г) пентен 3. Допишіть рівняння реакцій: а) СН 4 + Br 2 → б) С 3 Н 8 + O 2 → в) С 2 Н 4 + Cl 2 → г) С 2 Н 2 + Н 2 →
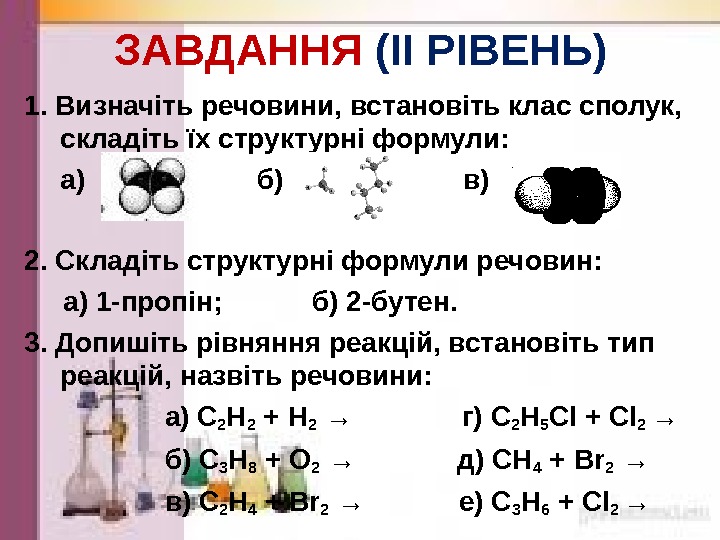
 ЗАВДАННЯ (І I РІВЕНЬ) 1. Визначіть речовини, встановіть клас сполук, складіть їх структурні формули: а) б) в) 2. Складіть структурні формули речовин: а) 1 -пропін; б) 2 -бутен. 3. Допишіть рівняння реакцій, встановіть тип реакцій, назвіть речовини: а) С 2 Н 2 + Н 2 → г) С 2 Н 5 Cl + Cl 2 → б) С 3 Н 8 + O 2 → д) СН 4 + Br 2 → в) С 2 Н 4 + Br 2 → е) С 3 Н 6 + Cl 2 →
ЗАВДАННЯ (І I РІВЕНЬ) 1. Визначіть речовини, встановіть клас сполук, складіть їх структурні формули: а) б) в) 2. Складіть структурні формули речовин: а) 1 -пропін; б) 2 -бутен. 3. Допишіть рівняння реакцій, встановіть тип реакцій, назвіть речовини: а) С 2 Н 2 + Н 2 → г) С 2 Н 5 Cl + Cl 2 → б) С 3 Н 8 + O 2 → д) СН 4 + Br 2 → в) С 2 Н 4 + Br 2 → е) С 3 Н 6 + Cl 2 →
 ЗАВДАННЯ (І II РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) б) С 3 Н 8 ; в) г) С 3 Н 4 ; д) С 4 Н 6 ; е) 2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції: 1) заміщення з бромом; а) пропін; 2) приєднання хлору; б) бутан; 3) полімеризація; в) бензен; г) етен 3. Здійсніть перетворення, вкажіть тип реакцій, назвіть речовини: а) C 2 H 6 → C 2 H 4 → C О 2 б) C H 4 → C 2 H 2 СІ 2 → C 2 H 4 Cl 2 ↓ C 2 H 5 Br
ЗАВДАННЯ (І II РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) б) С 3 Н 8 ; в) г) С 3 Н 4 ; д) С 4 Н 6 ; е) 2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції: 1) заміщення з бромом; а) пропін; 2) приєднання хлору; б) бутан; 3) полімеризація; в) бензен; г) етен 3. Здійсніть перетворення, вкажіть тип реакцій, назвіть речовини: а) C 2 H 6 → C 2 H 4 → C О 2 б) C H 4 → C 2 H 2 СІ 2 → C 2 H 4 Cl 2 ↓ C 2 H 5 Br
 ЗАВДАННЯ (І V РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) С 3 Н 8 б) С 3 Н 4 в) г) д) С 4 Н 6 е) 2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції: 1) полімеризація; а) ацетилен; 2) заміщення з хлором; б) пропан; 3) приєднання брому; в) етилен; г) бензен 3. Встановіть послідовність типів реакцій для здійснення перетворення Алкан → галогенпохідне алкану → алкен → алкін → вуглекислий газ: а) гідрогалогенування; б) дегідрування; в) горіння; г) дегідрогалогенування; д) галогенування. 4. Здійсніть перетворення, назвіть речовини: + Cl 2 — НСІ — Н 2 + СІ 2 C 2 H 6 → Х 1 → Х 2 → Х 3 → Х
ЗАВДАННЯ (І V РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) С 3 Н 8 б) С 3 Н 4 в) г) д) С 4 Н 6 е) 2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції: 1) полімеризація; а) ацетилен; 2) заміщення з хлором; б) пропан; 3) приєднання брому; в) етилен; г) бензен 3. Встановіть послідовність типів реакцій для здійснення перетворення Алкан → галогенпохідне алкану → алкен → алкін → вуглекислий газ: а) гідрогалогенування; б) дегідрування; в) горіння; г) дегідрогалогенування; д) галогенування. 4. Здійсніть перетворення, назвіть речовини: + Cl 2 — НСІ — Н 2 + СІ 2 C 2 H 6 → Х 1 → Х 2 → Х 3 → Х
 Задачі з практичним змістом
Задачі з практичним змістом
 Задача № 1 (І РІВЕНЬ) Сажу, добуту із метану, застосовують для виготовлення гуми, друкарських фарб. Визначте, яку масу сажі можна добути із 448 л метану.
Задача № 1 (І РІВЕНЬ) Сажу, добуту із метану, застосовують для виготовлення гуми, друкарських фарб. Визначте, яку масу сажі можна добути із 448 л метану.
 Задача № 2 (ІІ РІВЕНЬ) Ацетилен, що використовується для зварювальних робіт, добувають часто на місці в результаті взаємодії карбіду кальцію Са. С 2 з водою. Який об ’ єм ацетилену можна добути із 71 кг карбіду кальцію з масовою часткою домішок 10%?
Задача № 2 (ІІ РІВЕНЬ) Ацетилен, що використовується для зварювальних робіт, добувають часто на місці в результаті взаємодії карбіду кальцію Са. С 2 з водою. Який об ’ єм ацетилену можна добути із 71 кг карбіду кальцію з масовою часткою домішок 10%?
 Задача № 3 (ІІІ РІВЕНЬ) Для знезаражування зерносховищ та проти філоксери винограду використовується 1, 2 – дихлоретан. Який об ’ єм 1, 2 -дихлоретану утвориться при взаємодії 50 л етилену із 44, 8 л хлору?
Задача № 3 (ІІІ РІВЕНЬ) Для знезаражування зерносховищ та проти філоксери винограду використовується 1, 2 – дихлоретан. Який об ’ єм 1, 2 -дихлоретану утвориться при взаємодії 50 л етилену із 44, 8 л хлору?
 Задача № 4 (І V РІВЕНЬ) Ароматичні властивості бензолу допомагають у виробництві різної парфумерії. Яку масу бензолу можна отримати із ацетилену, добутого із 100 л природного газу Шебелинського газового родовища (вміст метану 98%), якщо вихід продукту становить 80%?
Задача № 4 (І V РІВЕНЬ) Ароматичні властивості бензолу допомагають у виробництві різної парфумерії. Яку масу бензолу можна отримати із ацетилену, добутого із 100 л природного газу Шебелинського газового родовища (вміст метану 98%), якщо вихід продукту становить 80%?

