Алканы.ppt
- Количество слайдов: 46
 Предмет органической химии Органическая химия — химия соединений углерода. Причины выделения органической химии в отдельную науку – многообразие органических соединений
Предмет органической химии Органическая химия — химия соединений углерода. Причины выделения органической химии в отдельную науку – многообразие органических соединений
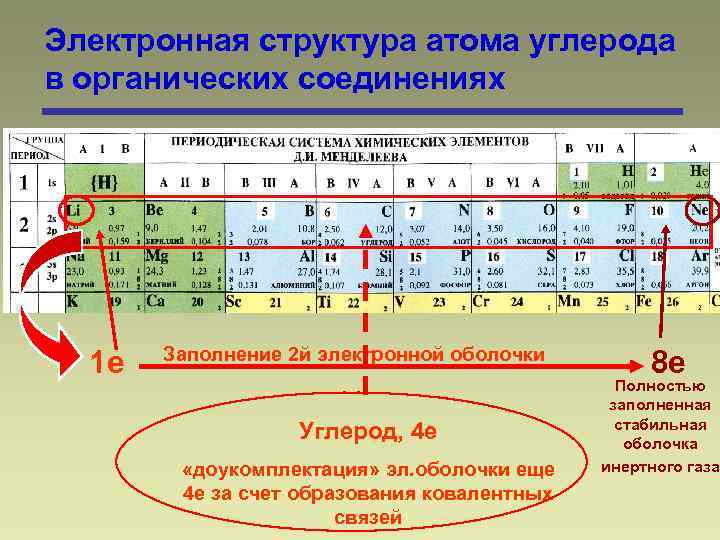 Электронная структура атома углерода в органических соединениях 1 е Заполнение 2 й электронной оболочки Углерод, 4 е «доукомплектация» эл. оболочки еще 4 е за счет образования ковалентных связей 8 е Полностью заполненная стабильная оболочка инертного газа
Электронная структура атома углерода в органических соединениях 1 е Заполнение 2 й электронной оболочки Углерод, 4 е «доукомплектация» эл. оболочки еще 4 е за счет образования ковалентных связей 8 е Полностью заполненная стабильная оболочка инертного газа
 Типы химической связи метан этилен ацетилен
Типы химической связи метан этилен ацетилен
 Направленность ковалентной связи
Направленность ковалентной связи
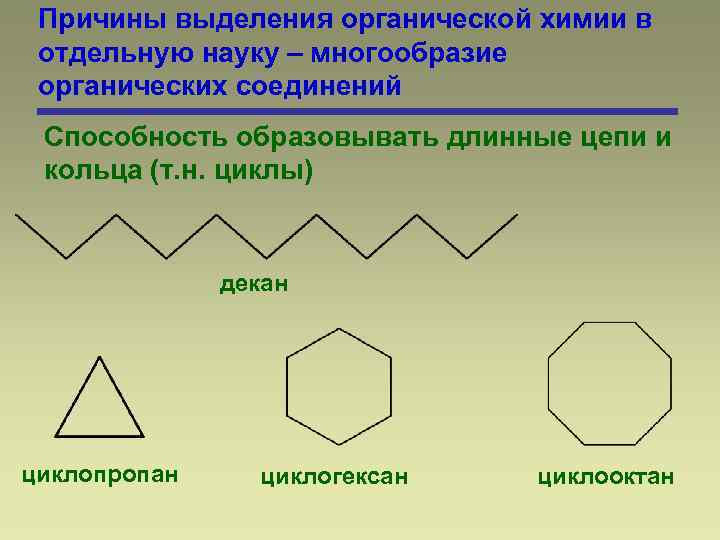 Причины выделения органической химии в отдельную науку – многообразие органических соединений Способность образовывать длинные цепи и кольца (т. н. циклы) декан циклопропан циклогексан циклооктан
Причины выделения органической химии в отдельную науку – многообразие органических соединений Способность образовывать длинные цепи и кольца (т. н. циклы) декан циклопропан циклогексан циклооктан
 Причины выделения органической химии в отдельную науку Способность образовывать длинные цепи и кольца (т. н. циклы) бензол кубан адамантан
Причины выделения органической химии в отдельную науку Способность образовывать длинные цепи и кольца (т. н. циклы) бензол кубан адамантан
 Многочисленность органических соединений Палитоксин 10 -7 г
Многочисленность органических соединений Палитоксин 10 -7 г
 Многочисленность органических соединений Палитоксин 10 -7 г
Многочисленность органических соединений Палитоксин 10 -7 г
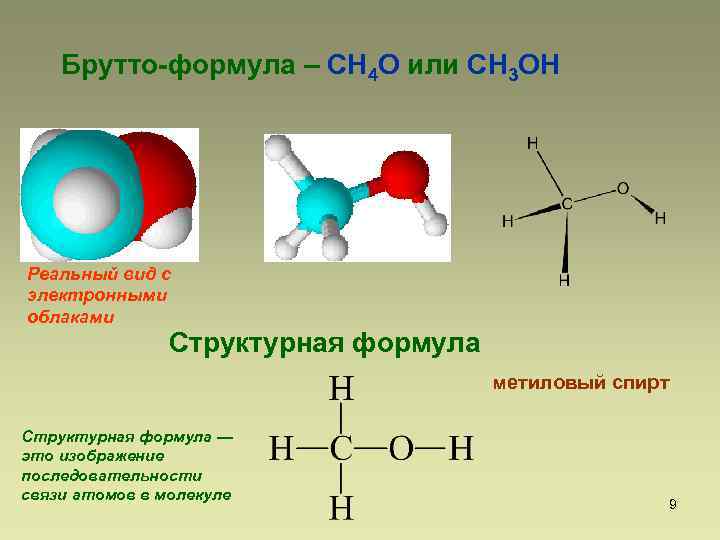 Брутто-формула – СН 4 О или CH 3 OH Реальный вид с электронными облаками Структурная формула метиловый спирт Структурная формула — это изображение последовательности связи атомов в молекуле 9
Брутто-формула – СН 4 О или CH 3 OH Реальный вид с электронными облаками Структурная формула метиловый спирт Структурная формула — это изображение последовательности связи атомов в молекуле 9
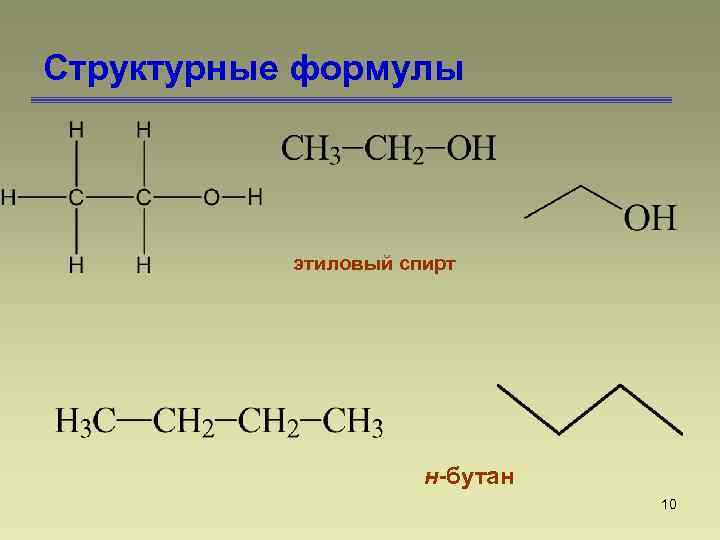 Структурные формулы этиловый спирт н-бутан 10
Структурные формулы этиловый спирт н-бутан 10
 Электроотрицательность F > O > Сl > N > Вг > С ~ Н
Электроотрицательность F > O > Сl > N > Вг > С ~ Н
 Перераспределение электронной плотности – ключ к пониманию химических превращений δ- Уксусный альдегид δ+ ОН- 12
Перераспределение электронной плотности – ключ к пониманию химических превращений δ- Уксусный альдегид δ+ ОН- 12
 АЛКАНЫ (насыщенные углеводороды, парафины)
АЛКАНЫ (насыщенные углеводороды, парафины)
 Алифатические углеводороды Ароматические
Алифатические углеводороды Ароматические
 Алканы Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой только -связями.
Алканы Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой только -связями.
 Строение метан
Строение метан
 Пространственное строение
Пространственное строение
 Гомология Гомологический ряд метана и т. д. Гомологический ряд изобутана Сn. Н 2 n+2
Гомология Гомологический ряд метана и т. д. Гомологический ряд изобутана Сn. Н 2 n+2
 Алканы. Номенклатура. Названия нормальных алканов по заместительной номенклатуре Углеводород (алкан) Формула Название Радикал (алкил) Формула Название CH 4 метан CH 3— метил CH 3 этан CH 3 CH 2— этил CH 3 CH 2 CH 3 пропан CH 3 CH 2— пропил CH 3(CH 2)2 CH 3 бутан CH 3(CH 2)2 CH 2— бутил CH 3(CH 2)3 CH 3 пентан CH 3(CH 2)3 CH 2— пентил CH 3(CH 2)4 CH 3 гексан CH 3(CH 2)4 CH 2— гексил CH 3(CH 2)5 CH 3 гептан CH 3(CH 2)5 CH 2— гептил CH 3(CH 2)6 CH 3 октан CH 3(CH 2)6 CH 2— октил CH 3(CH 2)7 CH 3 нонан CH 3(CH 2)7 CH 2— нонил CH 3(CH 2)8 CH 3 декан CH 3(CH 2)8 CH 2— децил (декин)
Алканы. Номенклатура. Названия нормальных алканов по заместительной номенклатуре Углеводород (алкан) Формула Название Радикал (алкил) Формула Название CH 4 метан CH 3— метил CH 3 этан CH 3 CH 2— этил CH 3 CH 2 CH 3 пропан CH 3 CH 2— пропил CH 3(CH 2)2 CH 3 бутан CH 3(CH 2)2 CH 2— бутил CH 3(CH 2)3 CH 3 пентан CH 3(CH 2)3 CH 2— пентил CH 3(CH 2)4 CH 3 гексан CH 3(CH 2)4 CH 2— гексил CH 3(CH 2)5 CH 3 гептан CH 3(CH 2)5 CH 2— гептил CH 3(CH 2)6 CH 3 октан CH 3(CH 2)6 CH 2— октил CH 3(CH 2)7 CH 3 нонан CH 3(CH 2)7 CH 2— нонил CH 3(CH 2)8 CH 3 декан CH 3(CH 2)8 CH 2— децил (декин)
 Алканы. Номенклатура Первичный Вторичный Третичный Четвертичный 2, 2, 4 -триметилпентан
Алканы. Номенклатура Первичный Вторичный Третичный Четвертичный 2, 2, 4 -триметилпентан
 Алканы. Структурная изомерия С 4 Н 10 н-бутан Ткип= -0, 5 С изобутан Ткип= -11, 7 С
Алканы. Структурная изомерия С 4 Н 10 н-бутан Ткип= -0, 5 С изобутан Ткип= -11, 7 С
 Алканы. Физические свойства Отдельные представители Название Структурная формула Физические свойства Tпл, С Tкип, С Метан CH 4 – 183 – 161, 5 Этан CH 3 – 172 – 89 Пропан CH 3 CH 2 CH 3 – 188 – 42 Бутан CH 3(CH 2)2 CH 3 – 138 – 0, 5 Пентан CH 3(CH 2)3 CH 3 – 130 36 2 -Метилбутан (изопентан) – 160 28 2, 2 -Диметилпропан, (неопентан) – 20 9, 5 Гексан CH 3(CH 2)4 CH 3 – 95 69 Гептан CH 3(CH 2)5 CH 3 – 91 98 Октан CH 3(CH 2)6 CH 3 – 57 126 Нонан CH 3(CH 2)7 CH 3 – 54 151 Декан CH 3(CH 2)8 CH 3 – 30 174 Пентадекан CH 3(CH 2)13 CH 3 10 270, 5 Эйкозан CH 3(CH 2)18 CH 3 37 343
Алканы. Физические свойства Отдельные представители Название Структурная формула Физические свойства Tпл, С Tкип, С Метан CH 4 – 183 – 161, 5 Этан CH 3 – 172 – 89 Пропан CH 3 CH 2 CH 3 – 188 – 42 Бутан CH 3(CH 2)2 CH 3 – 138 – 0, 5 Пентан CH 3(CH 2)3 CH 3 – 130 36 2 -Метилбутан (изопентан) – 160 28 2, 2 -Диметилпропан, (неопентан) – 20 9, 5 Гексан CH 3(CH 2)4 CH 3 – 95 69 Гептан CH 3(CH 2)5 CH 3 – 91 98 Октан CH 3(CH 2)6 CH 3 – 57 126 Нонан CH 3(CH 2)7 CH 3 – 54 151 Декан CH 3(CH 2)8 CH 3 – 30 174 Пентадекан CH 3(CH 2)13 CH 3 10 270, 5 Эйкозан CH 3(CH 2)18 CH 3 37 343
 Алканы. Физические свойства Зависимость температуры кипения от числа атомов углерода в молекуле алкана
Алканы. Физические свойства Зависимость температуры кипения от числа атомов углерода в молекуле алкана
 Алканы. Физические свойства Зависимость температуры плавления от числа атомов углерода в молекуле алкана
Алканы. Физические свойства Зависимость температуры плавления от числа атомов углерода в молекуле алкана
 Алканы. Физические свойства Изменение температуры кипения в изомерах гексана
Алканы. Физические свойства Изменение температуры кипения в изомерах гексана
 Алканы. Природные источники
Алканы. Природные источники
 Алканы. Получение Перегонка нефти
Алканы. Получение Перегонка нефти
 Алканы. Способы получения Газофикация угля (Бертло, 1869) Сжижение угля Метод Фишера-Тропша Синтетический бензин — «синтин»
Алканы. Способы получения Газофикация угля (Бертло, 1869) Сжижение угля Метод Фишера-Тропша Синтетический бензин — «синтин»
 Алканы. Способы получения Получение из ненасыщенных углеводородов Получение из галогенопроизводных
Алканы. Способы получения Получение из ненасыщенных углеводородов Получение из галогенопроизводных
 Алканы. Способы получения Реакция Ш. А. Вюрца (1854)
Алканы. Способы получения Реакция Ш. А. Вюрца (1854)
 Алканы. Способы получения Восстановление галогеналканов
Алканы. Способы получения Восстановление галогеналканов
 Алканы. Способы получения Получение из солей карбоновых кислот Электролиз солей щелочных металлов и карбоновых кислот (реакция Кольбе)
Алканы. Способы получения Получение из солей карбоновых кислот Электролиз солей щелочных металлов и карбоновых кислот (реакция Кольбе)
 Алканы. Способы получения Получение алканов из альдегидов и кетонов
Алканы. Способы получения Получение алканов из альдегидов и кетонов
 Алканы. Химические свойства Галогенирование
Алканы. Химические свойства Галогенирование
 Алканы. Химические свойства Галогенирование (Механизм реакции) Инициирование Рост цепи
Алканы. Химические свойства Галогенирование (Механизм реакции) Инициирование Рост цепи
 Алканы. Химические свойства Галогенирование (Механизм реакции) Обрыв цепи
Алканы. Химические свойства Галогенирование (Механизм реакции) Обрыв цепи
 Алканы. Химические свойства Галогенирование (Механизм реакции) 4. Реакционная способность водорода у третичного атома углерода выше, чем у вторичного, а вторичного выше, чем у первичного. 376 к. Дж/моль 390 к. Дж/моль 415 к. Дж/моль
Алканы. Химические свойства Галогенирование (Механизм реакции) 4. Реакционная способность водорода у третичного атома углерода выше, чем у вторичного, а вторичного выше, чем у первичного. 376 к. Дж/моль 390 к. Дж/моль 415 к. Дж/моль
 Алканы. Химические свойства Галогенирование (Механизм реакции)
Алканы. Химические свойства Галогенирование (Механизм реакции)
 Алканы. Химические свойства Сульфохлорирование С 10 H 22 + SO 2 + Cl 2 C 10 H 21 SO 2 Cl + HCl декан сульфохлорид декана C 10 H 21 SO 2 Cl + 2 Na. OH C 10 H 21 SO 3 Na + Na. Cl + H 2 O алкилсульфонат
Алканы. Химические свойства Сульфохлорирование С 10 H 22 + SO 2 + Cl 2 C 10 H 21 SO 2 Cl + HCl декан сульфохлорид декана C 10 H 21 SO 2 Cl + 2 Na. OH C 10 H 21 SO 3 Na + Na. Cl + H 2 O алкилсульфонат
 Алканы. Химические свойства Нитрование Реакция М. И. Коновалова
Алканы. Химические свойства Нитрование Реакция М. И. Коновалова
 Алканы. Химические свойства Окисление Сильные окислители (KMn. O 4, K 2 Cr 2 O 7 и др. )
Алканы. Химические свойства Окисление Сильные окислители (KMn. O 4, K 2 Cr 2 O 7 и др. )
 Алканы. Химические свойства Окисление CH 4 + H 2 O CO + 3 H 2 CH 4 + ½O 2 CO + H 2 CH 4 + CO 2 2 CO + 2 H 2 CH 4 + 2 O 2 CO 2 + H 2 O + 890 к. Дж/моль
Алканы. Химические свойства Окисление CH 4 + H 2 O CO + 3 H 2 CH 4 + ½O 2 CO + H 2 CH 4 + CO 2 2 CO + 2 H 2 CH 4 + 2 O 2 CO 2 + H 2 O + 890 к. Дж/моль
 Алканы. Химические свойства Изомеризация
Алканы. Химические свойства Изомеризация
 Алканы. Химические свойства Термическое разложение (Крекинг) Температура – 470— 650°С; Давление – 7 МПа Каталитический крекинг Катализаторы – Аl. Сl 3, Сr 2 О 3, алюмосиликаты; Температура – 470— 500°С; Давление 0, 01— 0, 1 МПа
Алканы. Химические свойства Термическое разложение (Крекинг) Температура – 470— 650°С; Давление – 7 МПа Каталитический крекинг Катализаторы – Аl. Сl 3, Сr 2 О 3, алюмосиликаты; Температура – 470— 500°С; Давление 0, 01— 0, 1 МПа
 Алканы. Химические свойства Риформинг – получение разветвленных, ненасыщенных и ароматических углеводородов Катализаторы – Pt, Rh, Ir, Ga, Ge, Sn на Аl 2 О 3; Температура – 500— 550°С; Давление 1— 5 МПа 45
Алканы. Химические свойства Риформинг – получение разветвленных, ненасыщенных и ароматических углеводородов Катализаторы – Pt, Rh, Ir, Ga, Ge, Sn на Аl 2 О 3; Температура – 500— 550°С; Давление 1— 5 МПа 45



