леч. фак. Лекция 1. Предмет и задачи клинической иммунологи.pptx
- Количество слайдов: 43

Предмет и задачи клинической иммунологии. Основы общей иммунологии.

Основные задачи клинической иммунологии: • диагностика иммунопатологических состояний при разных заболеваниях; • своевременное выявление лиц с иммунодефицитом, установление у них уровня иммунного дефекта; • разработка методов диагностики и оценки иммунного статуса; • разработка способов коррекции (иммунотерапии) различных форм нарушения иммунитета; • прогнозирование эффективности лечения и исхода различных иммунопатологических состояний.

• Клиническая иммунология –это клиническая и лабораторная дисциплина, которая занимается обследованием, диагностикой и лечением больных с заболеваниями или патологическими процессами, развивающимися в результате нарушения иммунных механизмов , а также теми случаями, когда иммунологические манипуляции являются важной частью терапии и/или профилактики (коммюнике экспертов ВОЗ, МСИО МААКИ, 1993) С 1995 г специалист , занимающийся лечением больных с аллергическими заболеваниями, именуется как врач аллерголог-иммунолог ПРИКАЗ от 7 ноября 2012 года N 606 н Об утверждении Порядка оказания медицинской помощи населению по профилю «аллергология и иммунология» Врач аллерголог-иммунолог осуществляет: • Лечение, диагностику и профилактику аллергическим и иммунопатологических заболеваний • Взаимодействие с врачами ПМСП и врачами специалистами ( дерматолог, отоларинголог, инфекционист, эндокринолог, гинеколог, стоматолог и тд) • Обеспечивает преемственность в работе со стационаром • Своевременное направление больного на МСЭ для решения вопроса о наличии вопроса для установления инвалидности • Обеспечивает диспансерное наблюдение пациентов с атопическими заболеваниями • Проведение АСИТ • Обучение пациентов и членов их семей в Астма- школах

Этапы становления и развития иммунологии 1 этап : Эмпирическая иммунизация 18 век- вариоляция с целью профилактики оспы 1778 г. - прививка против натуральной оспы (Э. Дженнер) 2 этап : Экспериментальная иммунология – создание вакцины против бешенства (Л. Пастер), а также вакцин для профилактики холеры и сибирской язвы у животных. Разработан общий принцип стимуляции иммунитета с помощью вакцин. 3 этап : Создание научного фундамента иммунологии (начало ХХ века) – создание теории клеточного (И. И. Мечников) гуморального (П. Эрлих) иммунитета 4 этап : Возникновение неинфекционной иммунологии 1900 г. – К. Ландштейнер открыл антигены А и В на поверхности эритроцитов 1906 г. – аллергия (П. Рише, К. Пирке) 1958 г. – иммунологическая толерантность (П. Медавара), модель молекулы иммуноглобулина (Р. Портер, Д. Эдельман) 1959 г. – описана система антигенов гистосовместимости (Ж. Доссе)

Эдвард Дженнер (1749 -1823) Вакцинации (от лат. vacca - корова), разработанный в конце XVIIIв. английским врачом Э. Дженнером (E. Jenner). Он обратил внимание на тот факт, что молочницы, ухаживавшие за больными животными, иногда заболевали в крайне слабой форме оспой коров, но при этом никогда не болели натуральной оспой. Подобное наблюдение давало в руки исследователя реальную возможность борьбы с болезнью людей. В 1796 г. , через 30 лет после начала своих изысканий, Э. Дженнер решился апробировать метод вакцинации коровьей оспой. Эксперимент прошел успешно, и с тех пор способ вакцинации по Э. Дженнеру нашел широкое применение во всем мире.

Рождение инфекционной иммунологии связывают с именем выдающегося французского ученого Луи Пастера (Louis Paster). Первый шаг к целенаправленному поиску вакцинных препаратов, создающих устойчивый иммунитет к инфекции, был сделан после хорошо известного наблюдения Пастера над патогенностью возбудителя куриной холеры. Было показано, что заражение кур ослабленной (аттенуированной) культурой возбудителя создает невосприимчивость к патогенному микробу (1880 г). В 1881 г. Пастер продемонстрировал эффективный подход к иммунизации коров против сибирской язвы, а в 1885 г. ему удалось показать возможность защиты людей от бешенства ) Луи Пастер (1822 -1895)

• Эмиль фон Беринг (1854 -1917) К 40 -50 -м годам нашего столетия принципы вакцинации, заложенные Пастером, нашли свое проявление в создании целого арсенала вакцин против самого широкого набора инфекционных заболеваний. Хотя Пастер считается основателем инфекционной иммунологии, он ничего не знал о факторах, включенных в процесс защиты от инфекции. Первыми, кто пролил свет на один из механизмов невосприимчивости к инфекции, были Беринг (Behring) и Китазато (Kitasato). Они продемонстрировали, что сыворотка от мышей, предварительно иммунизированных столбнячным токсином, введенная интактным животным, защищает последних от смертельной дозы токсина. Образовавшийся в результате иммунизации сывороточный фактор - антитоксин - представлял собой первое обнаруженное специфическое антитело. Работы этих ученых положили начало изучению механизмов гуморального иммунитета. Сибасабуро Китасато (1853 -1931)

У истоков познания вопросов клеточного иммунитета стоял русский биолог-эволюционист Илья Мечников. Илья Ильич Мечников (1845 -1916) В 1883 году он сделал первое сообщение по фагоцитарной (клеточной) теории иммунитета на съезде врачей и ествоиспытателей в Одессе. Мечников утверждал тогда, что способность подвижных клеток беспозвоночных животных поглощать пищевые частицы, т. е. участвовать в пищеварении, есть фактически их способность поглощать вообще все "чужое", не свойственное организму: различных микробов, инертных частиц, отмирающих частей тела. У человека также есть амебоидные подвижные клетки - макрофаги и нейтрофилы. Но "едят" они пищу особого рода - патогенных микробов. Эволюция сохранила поглотительную способность амебоидных клеток от одноклеточных животных до высших позвоночных, включая человека. Однако функция этих клеток у высокоорганизованных многоклеточных стала иной - это борьба с микробной агрессией.

Пауль Эрлих (1854 -1915) Параллельно с Мечниковым разрабатывал свою теорию иммунной защиты от инфекции немецкий фармаколог Пауль Эрлих. Он знал о том факте, что в сыворотке крови животных, зараженных бактериями, появляются белковые вещества, способные убивать патогенные микроорганизмы. Эти вещества впоследствии были названы им " антителами ". Самое характерное свойство антител - это их ярко выраженная специфичность. Образовавшись как защитное средство против одного микроорганизма, они нейтрализуют и разрушают только его, оставаясь безразличными к другим. Пытаясь понять это явление специфичности, Эрлих выдвинул теорию "боковых цепей", по которой антитела в виде рецепторов предсуществуют на поверхности клеток. При этом антиген микроорганизмов выступает в качестве селективного фактора. Вступив в контакт со специфическим рецептором, он обеспечивает усиленную продукцию и выход в циркуляцию только этого конкретного рецептора (антитела). Две теории - клеточная (фагоцитарная) и гуморальная - в период своего возникновения стояли на антагонистических позициях. Школы Мечникова и Эрлиха боролись за научную истину, не подозревая, что каждый удар и каждое его парирование сближало противников. В 1908 г. обоим ученым одновременно была присуждена Нобелевская премия.

Новый этап развития иммунологии связан в первую очередь с именем выдающегося австралийского ученого М. Бернета (Macfarlane Burnet; 1899 -1985). Именно он в значительной степени определил лицо современной иммунологии. Рассматривая иммунитет как реакцию, направленную на дифференциацию всего "своего" от всего "чужого", он поднял вопрос о значении иммунных механизмов в поддержании генетической целостности организма в период индивидуального (онтогенетического) развития. Именно Бернет обратил внимание на лимфоцит, как на основного участника специфического иммунного реагирования, дав ему название " иммуноцит ". Именно Бернет предсказал, а англичанин Питер Медавар и чех Милан Гашек экспериментально подтвердили состояние, противоположное иммунной реактивности - толерантности. Именно Бернет указал на особую роль тимуса в формировании иммунного ответа. И наконец, Бернет остался в истории иммунологии как создатель клональноселекционной теории иммунитета. Формула такой теории проста: один клон лимфоцитов способен реагировать только на одну конкретную антигенную специфическую детерминанту.

Питер Медавар (Medawar) (1915 -1987) После доказательств Питером Медаваром иммунной природы отторжения чужеродного трансплантата и накопления фактов по иммунологии злокачественных новообразований стало очевидным, что иммунная реакция развивается не только на микробные антигены, но и тогда, когда имеются любые, пусть незначительные антигенные различия между организмом и тем биологическим материалом (трансплантатом, злокачественной опухолью), с которым встречается организм.

Открытие групп крови AB 0 – 1900 Открытие группы крови Rhesus (совм. С А. Винером) – 1940 Экспериментальная система: гаптены и белки-носители Наиболее важная работа для иммунологов: «Специфичность серологических реакций» (1936). Карл Ландштайнер (Landsteiner) (1868 -1943)

Роберт Кох (1843 -1910) Большой вклад в становление современной иммунологии внесли также Роберт Кох (Robert Koch; 1843 -1910), открывший возбудитель туберкулеза и описавший кожную туберкулиновую реакцию; Жюль Борде (Jules Bordet; 1870 -1961), сделавший важный вклад в понимание комплемент зависимого лизиса бактерий; Карл Ландштейнер (Karl Landsteiner; 1868 -1943), получивший Нобелевскую премию за открытие групп крови и разработавший подходы к изучению тонкой специфичности антител с помощью гаптенов; Родни Портер (Rodney Porter; 1917 -1985) и Джеральд Эдельман (Gerald Edelman; 1929), изучившие структуру антител; Джордж Снелл (George Snell), Барух Венацерраф (Baruj Benacerraf) и Жан Доссе (Jean Dausset), описавшие главный комплекс гистосовместимости у животных и человека и открывшие гены иммунного ответа.

Нобелевская премия 1980 г. Джордж Снелл (Snell) (1903 -1996) Открытие главного комплекса гистосовместимости (Н-2 мышей) (совместно с Б. Бенацерафом) Жан Доссе (Dausset) (1916 -2009) Обоснование и описание системы МНС человека – HLA. Установление роли HLA в практике трансплантаций и заболеваний

Нобелевская премия 1987 г. Сузуму Тонегава (Tonegawa), р. 1939 г. установил механизмы формирования многообразия антител за счет перестроек генов иммуноглобулинов

Нобелевская премия 1996 г. Питер Догерти (Doherty) р. 1940 г Рольф Цинкернагель (Zinkernagel), р. 1944 За работы по механизму распознавания вирусов Т лимфоцитами клетками и установление роли молекул МНС в Т-клеточном распознавании ( «чужое в контексте своего» ).

Основные достижения иммунологии • Созданы вакцины для профилактики инфекционных заболеваний • Решена проблема переливания крови • Решена проблема резус - конфликта плода и матери • Решены многие проблемы в трансплантологии • Разработаны иммунологические методы диагностики, профилактики и лечения различных заболеваний • Получены лечебные сывороточные препараты

Иммунопатология – раздел иммунологии, изучающий заболевания, которые возникают в результате избытка, недостатка или отсутствия иммунных реакций. Виды иммунопатологических состояний: 1. Иммунодефицитные состояния (ИДС). 2. Аллергиеские реакции. 3. Аутоиммунные процессы.

Иммунодефицит – нарушение иммунологической реактивности, обусловленное выпадением одного или нескольких компонентов иммунного аппарата или тесно взаимодействующих с ним неспецифических факторов, и как следствие нарушение способности к нормальному иммунному ответу на разные антигены. Классификация иммунодефицитных состояний Первичные (врождённые) ИДС связаны с генетическим блоком развития иммунной системы в онтогенезе, с предетерминированным нарушением процессов пролиферации и дифференциации иммунокомпетентных клеток. Вторичные (приобретённые) ИДС формируются под действием экзогенных факторов на уровне фенотипа. Возникают вследствие нарушений иммунорегуляции, связанных с перенесёнными инфекциями, травмами, лечебными воздействиями и т. д.

Аллергия (греч. аllos – другой, ergon – действие) (гиперчувствительность) – это состояние повышенной чувствительности организма к определенным антигенам, возникающее при изменении его реактивности. Аллергия – это феномен, обладающий основным свойством всех иммунологических реакций – специфичностью (возникает на строго определенные факторы), которая развивается при повторном контакте с аллергеном.

Аутоиммунные процессы – это состояния, при которых происходит выработка аутоантител или накопление клона сенсибилизированных лимфоцитов к антигенам собственных тканей организма. Аутоиммунные реакции развиваются в норме у здоровых лиц и при патологических процессах. Они протекают непрерывно, их действие сводится к устранению отмирающих, стареющих клеток. Аутоиммунные болезни (аутоаллергия) – это аутоиммунные реакции с забарьерными антигенами, когда они играют главную роль в патогенезе болезни. «Забарьерные» органы – это органы, антигены которых в силу анатомических обстоятельств не контактируют с клетками иммунной системы, либо образуются в такой период онтогенеза, когда формирование естественной толерантности уже закончилось (головной мозг, передняя камера глаза, роговица, хрусталик, сетчатка, стекловидное тело, семенные канальца яичек, фолликулы щитовидной железы, подкожная жировая клетчатка, волосяные луковицы, рубцовая ткань). Эти антигены называют секвестрированными.

Современные методы иммунодиагностики. Группы лабораторных методов иммунодиагностики. Иммунодиагностика – важнейшая часть современной клинической иммунологии Её основными задачами являются • Выявление нарушенного звена в стройной системе функционирования иммунной системы • Анализ этиологии , патогенеза, прогноз возможного обострения, выбор средств иммунокоррекции • Оценка эффективности проводимой терапии

Оценка иммунного статуса I этап – клиническая долабораторная диагностика иммунодефицитных и других иммунопатологических состояний: • иммунологический анамнез (частота инфекционных заболеваний, характер их течения, выраженность температурной реакции, наличие очагов хронической инфекции) • клинический анализ крови (содержание лейкоцитов, в т. ч. лимфоцитов, моноцитов, сегментоядерных) • результаты бактериологического (вирусологического) и серологического исследований на бактерио- (вирусо-) носительство

II этап предусматривает применение тестов 2 -х уровней. Тесты первого уровня позволяют выявить грубые нарушения функций иммунной системы: • процентное содержание и абсолютное количество Т - и Влимфоцитов; • уровень иммуноглобулинов сыворотки крови классов М, G, А, Е; • титр комплемента; • фагоцитарная активность нейтрофилов.

Тесты второго уровня проводятся при выявлении грубых нарушений функции иммунной системы и включают углубленное иммунологическое обследование для установления регуляторных нарушений и дисфункций иммунитета: • субпопуляции Т-лимфоцитов (CD 4+, CD 8+), их соотношение; • функциональная активность Т- и Влимфоцитов в РБТ и РТМЛ; • цитотоксическая активность лейкоцитов; • кожные тесты.

Диагностические мероприятия при аллергических заболевания аллергологический анамнез (наличие аллергических реакций на антибиотики, пищевые продукты, пыльцу растений и т. д. ); данные клинико-лабораторных исследований (лейкоцитоз, эозинофилия); при аллергических реакциях I – содержание сывороточных Jg. E; при аллергических реакциях II типа – выявление в сыворотке крови антиэритроцитарных, антилейкоцитарных, антитромбоцитарных антител, оказывающих цитолитическое действие в присутствии комплемента на клетки- «мишени» ; при аллергических реакциях III типа – иммунные комплексы, циркулирующие в крови или фиксированные на тканях органа- «мишени» ; для изучения клеточно-опосредованной сенсибилизации при аллергии IV типа проводят РБТ и РТМЛ; при реакциях I и IV типов проводят кожноаллергические пробы.

Метод кожных проб основан на том, что Ig Е находится не только в шоковом органе, но и в коже. В месте введения аллергена происходит аллергическая реакция АГ-АТ с высвобождением гистамина (через 20 -30 минут – покраснение, волдырь). Выраженность кожной реакции зависит от степени сенсибилизации организма.
Иммунопрофилактика и иммунотерапия являются разделами иммунологии, которые изучают и разрабатывают способы и методы специфической профилактики и лечения инфекционных и неинфекционных болезней с помощью иммунобиологических препаратов, действующих на основе иммунологических принципов и/ или влияющих на иммунную систему. Иммунопрофилактика - направлена на создание иммунитета к возбудителю инфекционного заболевания или его антигенам, а также патогену для предупреждения возможного заболевания путем формирования невосприимчивости к ним организма. Иммунотерапия –направлена на лечение уже развившегося заболевания, в основе которого лежат нарушения функций иммунной системы, или же иммунной системе принадлежит ведущая роль в восстановлении здоровья.

Только благодаря вакцинопрофилактике на земном шаре удалось ликвидировать натуральную оспу, полиомиелит на большинстве континентов, резко снизить заболеваемость корью, эпидемическим Arial паротитом, краснухой. В лечении целого ряда токсинемических инфекций (ботулизм, столбняк и др. ) ведущее значение имеет серотерапия, т. е. применение антитоксических сывороток и иммуноглобулинов.

Основные принципы иммунотерапии: 1. 2. 3. 4. 5. 6. 7. Применение иммуномодуляторов только при наличии характерных клинических признаков и изменений показателей иммунного статуса. Определение иммунного статуса до начала иммунотерапии. Определение уровня и степени дефекта иммунной системы. В зависимости от дефекта применение либо угенетающего, либо стимулирующего средства. Контроль динамики иммунного статуса в процессе иммунотерапии. Строгое соблюдение схем и дозировок. Назначение иммуномодуляторов в профилактических целях для поддержания иммунного статуса (онкология, оперативные вмешательства, стресс, экологические, профессиональные и другие воздействия).

Методы иммунокоррекции Принцип иммунопрофилактики и иммунотерапии сводится к тому или иному воздействию на иммунную систему: • активации, супрессии или нормализации ее работы. Это воздействие может быть • активным или пассивным, • специфическим или неспецифическим. Для такого избирательного и дифференцированного действия на иммунную систему разработано множество препаратов, объединенных в группу иммунобиологических препаратов (ИБП).

Общая характеристика и классификация ИБП В настоящее время выделяют 5 основных групп ИБП (А. А. Воробьев). 1. получаемые из живых или убитых микробов (бактерии, вирусы, грибы) или микробных продуктов и используемые для специфической профилактики и лечения. К этой группе относятся живые и инактивированные вакцины, субъединичные вакцины, анатоксины, бактериофаги, пробиотики. 2. на основе антител. К этой группе относятся иммуноглобулины, иммунные сыворотки, иммунотоксины, антитела-ферменты, рецепторные антитела, мини-антитела. 3. иммуномодуляторы для иммунокоррекции, лечения и профилактики инфекционных, неинфекционных болезней, иммунодефицитов. К этой группе относятся экзогенные и эндогенные иммуномодуляторы. 4. адаптогены - сложные химические вещества растительного происхождения, обладающие широким спектром биологической активности, действующие на иммунную систему. 5. диагностические препараты и системы для специфической диагностики инфекционных и неинфекционных заболеваний, с помощью которых можно идентифицировать антигены, антитела, ферменты, продукты метаболизма, биологически активные вещества, чужеродные клетки.

. Вакцины Живые вакцины представляют собой препараты, в которых действующим началом являются ослабленные тем или иным способом, потерявшие вирулентность, но сохранившие специфическую антигенную активность штаммы патогенных микроорганизмов (бактерий, вирусов). Такие штаммы получили название аттенуированных штаммов. Аттенуация (ослабление) достигается путем длительного воздействия на штамм химических (мутагены), физических (температура, радиация) факторов или же длительного пассирования через организм невосприимчивых к инфекции животных или других биообъектов (эмбрионы птиц, культуры клеток). В результате такой обработки селектируются штаммы со сниженной вирулентностью, но способные при введении в организм человека вызывать специфический иммунный ответ, не вызывая инфекционного заболевания. Примером : вакцины против кори, эпидемического паротита, краснухи, полиомиелита. Кроме того, в качестве живых вакцин иногда используют так называемые дивергентные штаммы, т. е. непатогенные для человека микроорганизмы, имеющие общие протективные антигены с возбудителем инфекции. Примерами : вакцина против натуральной оспы, в которой используется живой вирус оспы коров, и БЦЖ-вакцина, в состав которой включены родственные в антигенном отношении микобактерии бычьего типа.

Инактивированные (убитые) вакцины В качестве действующего начала включают убитые тем или иным способом микроорганизмы (бактерии, вирусы). Для инактивации микроорганизмов обычно используют формальдегид, спирты, фенол, температурное и УФвоздействие, ионизирующую радиацию и другие физические или химические методы. Получают инактивированные вакцины путем выращивания микроорганизмов на искусственных питательных средах (бактерии) или культурах клеток. После инактивации тем или иным методом проводят выделение и очистку антигенных комплексов, при необходимости лиофилизацию. В препарат добавляют консервант, иногда адъюванты. Применяются такие вакцины, как правило, в виде нескольких инъекций на курс вакцинации. Примером инактивированных вакцин являются вакцины против гриппа, неживая вакцина против полиомиелита, вакцина против бешенства и некоторые другие вакцины против особо опасных инфекций.

Молекулярные вакцины антиген находится в молекулярной форме или в виде фрагментов его молекулы (эпитопов). Такие антигены можно получить либо биологическим синтезом в процессе культивирования микроорганизмов, либо при культивировании рекомбинантных бактерий или грибов, содержащих ген нужного антигена, либо химическим синтезом антигенных детерминант. К сожалению, рекомбинантные технологии получения молекулярных вакцин не нашли широкого распространения прежде всего из-за низкой иммуногенности антигенов. Пример: рекомбинантная вакцина против гепатита В, полученная из антигена вируса, продуцируемого рекомбинантным штаммом дрожжей. При вакцинации этой вакциной препарат необходимо вводить трижды с короткими (месяц) промежутками для получения полноценного иммунного ответа Анатоксины (токсоиды) Принцип получения анатоксинов состоит в том, что образующийся при культивировании бактерий токсин в молекулярном виде превращают в нетоксическую, но сохраняющую иммуногенность форму - анатоксин. Для этого токсин подвергают нагреванию до 37 °С и обработке 0, 4% формалином в течении 3 -4 нед, после чего обязательно проверяют препарат на токсичность, очищают от клеточных компонентов, продуктов бактерий и питательной среды и концентрируют. Для повышения иммуногенности добавляют адъюванты. Пример: дифтерийный, столбнячный, ботулинический, стафилококковый, холерный и гангренозный анатоксины.

Синтетические вакцины Молекулы антигенов и их эпитопы сами по себе малоиммуногенны. Это связано с их быстрым распадом в организме, а также недостаточно активным процессом адгезии их иммунокомпетентными клетками из-за небольшой молекулярной массы. Для повышения иммуногенности их сшивают с полимерными крупномолекулярными безвредными для организма соединениями, которые играют роль шлеппера и адъюванта. Такой искусственно созданный комплекс долго сохраняется в организме и легко адгезируется иммунокомпетентными клетками. Пример: отечественная вакцина против гриппа Гриппол. Ассоциированные вакцины, в состав которых входит несколько разнородных антигенов, что позволяет проводить вакцинопрофилактику сразу нескольких инфекций. Разработкой таких вакцин занимаются для того, чтобы уменьшить число вакцин и инъекций при проведении массовой вакцинации. Создание таких вакцин обоснованно, так как показано, что иммунная система способна отвечать сразу на десятки различных антигенов. Основная задача при создании ассоциированных вакцин заключается в том, чтобы сбалансировать состав входящих в нее антигенов и недопустить их взаимную конкуренцию и поствакцинальные осложнения. В состав таких вакцин могут входить как живые, так и убитые вакцины. Если в состав препарата входят однородные компоненты - поливакциная, Пример: живая полиомиелитная вакцина, в состав которой входят аттенуированные штаммы вируса полиомиелита I, II и III типа. Состоит из разнородных компонентов, его называют комбинированной вакциной. Пример: живая ассоциированная вакцина против кори, эпидемического паротита и краснухи и АКДС-вакцина (коклюш, дифтерия, столбняк).

Адъюванты Иногда для усиления иммуногенности вакцинных препаратов прибегают к помощи адъювантов (от лат. adjuvant - помощник). В качестве адъювантов используют минеральные сорбенты (гели гидрата окиси и фосфата алюминия), полимеры, сложные химические соединения (ЛПС, мурамилдипептид и др. ), бактериальные клетки и их компоненты (БЦЖ, коклюшные бактерии), липиды и эмульгаторы (ланолин, арлацел), вещества, вызывающие воспаление (сапонин, скипидар). Эти различные по происхождению и химической структуре вещества имеют одно общее свойство - способность усиливать иммуногенность различных антигенов. Механизм действия адъювантов очень сложный. Они действуют не только на антиген, но и на организм. В результате антиген лучше захватывается и представляется иммунокомпетентным клеткам, т. е. превращается из тимусзависимого в тимуснезависимый антиген. Адъюванты в месте введения вызывают воспалительную реакцию с образованием фиброзной капсулы, в результате чего антиген долгое время сохраняется (депонируется) в месте инъекции и действует длительное время (эффект ревакцинации). В связи с этим адъювантные вакцины еще называют депонированными.

Иммуномодуляция – временное повышение или снижение факторов иммунологической реактивности. Иммуностимулирующая терапия Классификация иммуностимуляторов по происхождению: • Тимические: тималин, тимостимулин, тимоген, Т-активин, имунофан. • Костномозговые: миелопид, серамил, бивален. • Цитокины: беталейкин (ИЛ-1), ронколейкин (ИЛ-2), лейкинферон (αинтерферон, ИЛ-1, 6), интерферон человеческий лейкоцитарный, реаферон, виферон, гриппферон, кипферон. • Микробные: рибомунил, бронхомунал, ИРС-19. • Растительные: иммунал, элеутерококк, настойка китайского лиммоника.

Классификация иммуностимуляторов по уровню воздействия Стимуляторы Т-лимфоцитов: препараты тимуса (Т-активин, тималин, тимоген, имунофан); левамизол (декарис). Стимуляторы В-лимфоцитов: миелопид; продигиозан; пирогенал. Стимуляторы фагоцитоза: ликопид; метилурацил. Стимуляторы эндогенного интерферона: дибазол; препараты интерферона (роферон, виферон, кипферон). Комбинированные препараты: полиоксидоний – стимуляция активности макрофагов, Т- и Влимфоцитов.

Иммуносупрессивная (иммунодепрессивная) терапия - применение препаратов, подавляющих размножение ИКК в костном мозге путем блокады или деструкции ядерной ДНК • глюкокортикоиды; • антиметаболиты (азатиоприн, метотрексат); • алкилирующие соединения (циклофосфамид, хлоранбуцил); • антибиотики (циклоспорин, актиномицин D). Практическое применение: • в онкологической практике; • для лечения больных аутоиммунными заболеваниями.
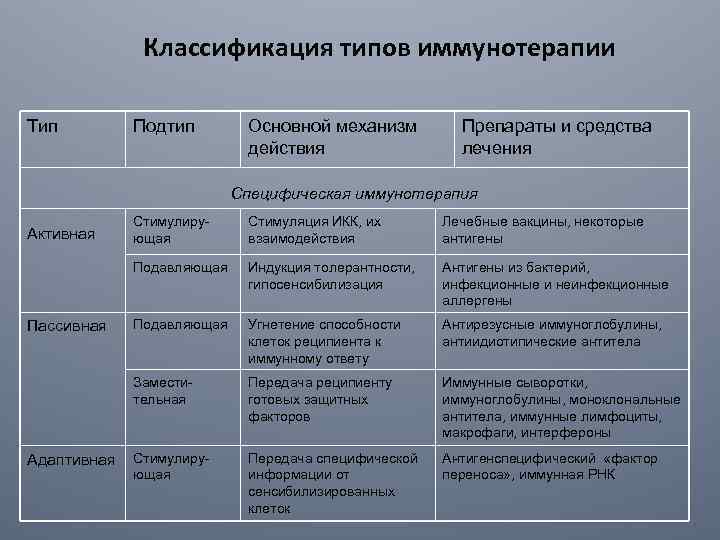
Классификация типов иммунотерапии Тип Подтип Основной механизм действия Препараты и средства лечения Специфическая иммунотерапия Пассивная Адаптивная Стимуляция ИКК, их взаимодействия Лечебные вакцины, некоторые антигены Индукция толерантности, гипосенсибилизация Антигены из бактерий, инфекционные и неинфекционные аллергены Подавляющая Угнетение способности клеток реципиента к иммунному ответу Антирезусные иммуноглобулины, антиидиотипические антитела Заместительная Стимулирующая Подавляющая Активная Передача реципиенту готовых защитных факторов Иммунные сыворотки, иммуноглобулины, моноклональные антитела, иммунные лимфоциты, макрофаги, интерфероны Стимулирующая Передача специфической информации от сенсибилизированных клеток Антигенспецифический «фактор переноса» , иммунная РНК
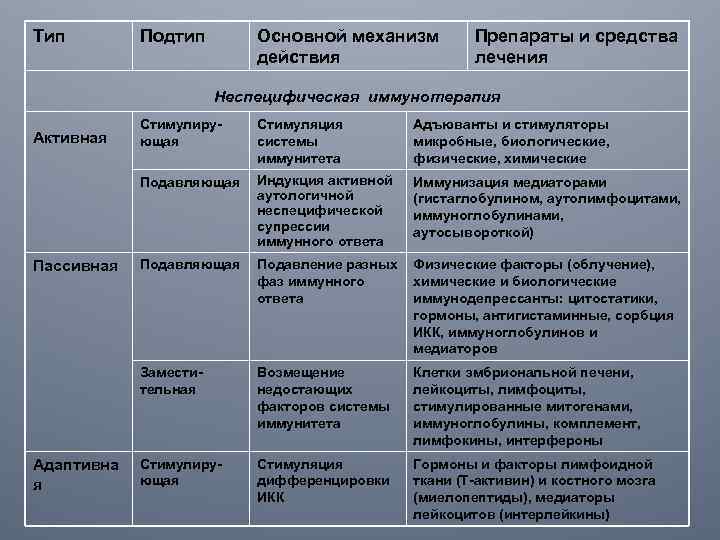
Тип Подтип Основной механизм действия Препараты и средства лечения Неспецифическая иммунотерапия Пассивная Адаптивна я Стимуляция системы иммунитета Адъюванты и стимуляторы микробные, биологические, физические, химические Индукция активной аутологичной неспецифической супрессии иммунного ответа Иммунизация медиаторами (гистаглобулином, аутолимфоцитами, иммуноглобулинами, аутосывороткой) Подавляющая Подавление разных Физические факторы (облучение), фаз иммунного химические и биологические ответа иммунодепрессанты: цитостатики, гормоны, антигистаминные, сорбция ИКК, иммуноглобулинов и медиаторов Заместительная Стимулирующая Подавляющая Активная Возмещение недостающих факторов системы иммунитета Клетки эмбриональной печени, лейкоциты, лимфоциты, стимулированные митогенами, иммуноглобулины, комплемент, лимфокины, интерфероны Стимулирующая Стимуляция дифференцировки ИКК Гормоны и факторы лимфоидной ткани (Т-активин) и костного мозга (миелопептиды), медиаторы лейкоцитов (интерлейкины)

Контрольные вопросы к лекции: • Каковы основные аллергологии? задачи службы клинической иммунологии и • Какие основные иммунопатологические состояния являются предметом рассмотрения клиническим аллергологом-иммунологом? • Какие основные методы иммунодиагностики используют для диагностики и дифференциальной диагностики иммунопатологических состояний? • Какие основные лабораторные методы иммунодиагностики используют для диагностики и дифференциальной диагностики иммунопатологических состояний? • Какие принципы лежат в основе иммунотерапии? • Какие принципы лежат в основе иммунопрофилактики?
леч. фак. Лекция 1. Предмет и задачи клинической иммунологи.pptx