Первая лечебники.ppt
- Количество слайдов: 53

Предмет биоорганической химии. Классификация, строение, реакционная способность органических соединений ЖЕРАР, Герхардт Шарль Фредерик БУТЛЕРОВ Александр Михайлович Эрвин Чаргафф Джеймс Дьюи Уотсон Лектор: профессор Коваленко С. И. 1

План 1. Предмет и значение биоорганической химии 2. Классификация и номенклатура органических соединений 3. Способы изображения органических молекул 4. Химическая связь в биоорганических молекулах 5. Электронные эффекты. Взаимное влияние атомов в молекуле 6. Классификация химических реакций и реагентов 7. Понятие о механизмах химических реакций 2

Предмет биоорганической химии Биоорганическая имия — самостоятельный х раздел химической науки, что изучает строение, свойства и биологические функции химических соединений органического происхождения, оторые принимают участие в к обмене веществ живых организмов. 3

Классификация биоорганических соединений • Обектами изучения биоорганической химии являются низкомолекулярные биомолекулы и биополимеры (белки, нуклеиновые кислоты и полисахариды), биоре-гуляторы (ферменты, гормоны, витамины и другие), природные и синтетические физиологически активные соединения, в том числе лекарственные средства и вещества с токсичным действием. • Биомолекулы - биоорганические соединения, которые входят в состав живых организмов и специализированные для образования клеточных структур и участия в биохимических реакциях, составляют основу обмена веществ (метаболизм) и физиологических функций живых клеток и многоклеточных организмов в целом. 4

• Обмен веществ - совокупность химических реакций, которые протекают в организме (in vivo). Обмен веществ называют также метаболизмом. Метаболизм может происходить в двух направлениях – анаболизм и катаболизм. • Анаболизм - это синтез в организме сложных веществ из сравнительно простых. Он протекает с затратой энергии (эндотермический процесс). • Катаболизм - напротив, распад сложных органических соединений на более простые. Проходит он с выделением энергии (экзотермический процесс). • Метаболитические процессы проходят при участии ферментов. • Ф е р м е н т ы исполняют в организме роль биокатализаторов. Без ферментов биохимические процессы или совсем не протекали бы, или протекали бы очень медленно и организм не смог бы поддерживать жизнь. 5

• Биоэлементы. В состав биоорганических соединений, кроме атомов углерода (С), которые составляют основу любой органической молекулы, входят также водород (Н), кислород (О), азот (N), фосфор (Р) и сера (S). Эти биоэлементы (“органогены”) сконцентрированы в живых организмах в количестве, что свыше 200 раз превышает их содержание в объектах неживой природы. Отмеченные элементы составляют свыше 99% элементного состава биомолекул. 6

Органическая химия — химия соединений углерода. Органическая химия— химия углеводородов и их производных. 7

Биоорганическая имия возникла из недр органической имии и х х базируется на ее идеях и методах. В истории развития для органической химии отведены такие этапы: эмпирический, аналитический , структурный и современный. Период от первого знакомства человека с органическими веществами до конца XVІІІ века считается эмпирическим. сновной О итог этого периода – люди осознали значение элементного анализа и установление томных молекулярных а и масс. “Теория итализма” в “жизненной силы” (Берцелиус). До 60 -х годов XІX века продолжался налитический период. Он а ознаменовался тем, что с конца первой четверти XІX века были сделаны ряд перспективных открытий, которые нанесли сокрушительн удар по виталистической еории. Первым в этом ый т ряду был ченик ерцелиуса, немецкий химик елер. Он осуществил у Б В ряд открытиий в 1824 г. – синтез щавелевой кислоты из дициана : (CN)2 НООС – СООН. 1828 р. – синтез мочевины из аммония цианата: NH 4 CNO NH 2 – C – NH 2 О 8

В 1853 Ш. Жерар разработал «теорию типов» и ипользовал её для классификации органических соединений. Согласно Жерару, более сложные органические соединения могут быть произведены от следующих основных четырёх типов веществ: Н Н тип ВОДОРОДА Н Н O тип ВОДЫ Н Cl тип ХЛОРИСТОГО ВОДОРОДА Н Н H N тип АММИАКА С 1857 по предложению Ф. А. Кекуле углеводороды стали относить к типу метана Н Н H Н С 9

Основные положения теории строения органических соединений (1861) 1) атомы в молекулах соединены друг с другом химическими связями в соответствии с их валентностью; 2) атомы в молекулах органических веществ соединяются между собой в определенной последовательности, что обусловливает химическое строение (структуру) молекулы; 3) свойства органических соединений зависят не только от числа и природы входящих в их состав атомов, но и от химического строения молекул; 4) в органических молекулах существует взаимодействие между атомами, как связанными друг с другом, так и несвязанными; 5) химическое строение вещества можно определить в результате изучения его химических превращений и, наоборот, по строению вещества можно характеризовать его 10 свойства.

Основные положения теории строения органических соединений (1861) Молекулярная формула - формула органического соединения, которая указывает на количество атомов каждого элемента в молекуле. Например: С 5 Н 12 – пентан, С 6 Н 6 – бензен и т. д. Структурная формула — это изображение последовательности связи атомов в молекуле. Брутто-формула – СН 4 О или CH 3 OH Структурная формула Упрощенные формулы строения иногда называют рациональными 11
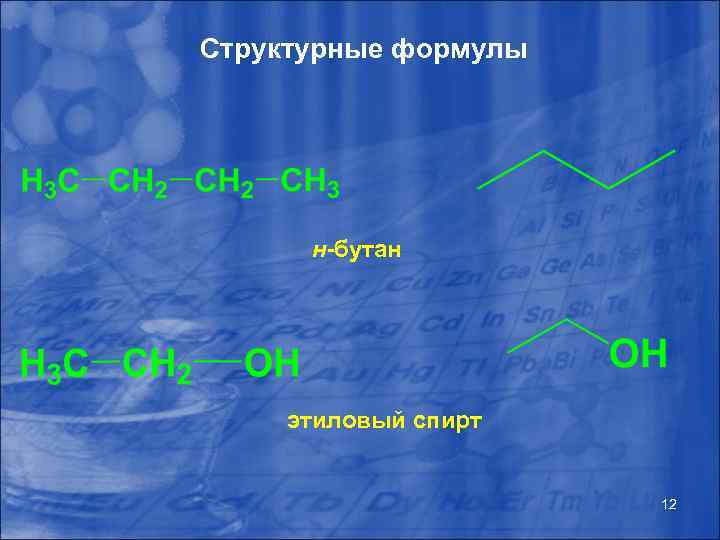
Структурные формулы н-бутан этиловый спирт 12
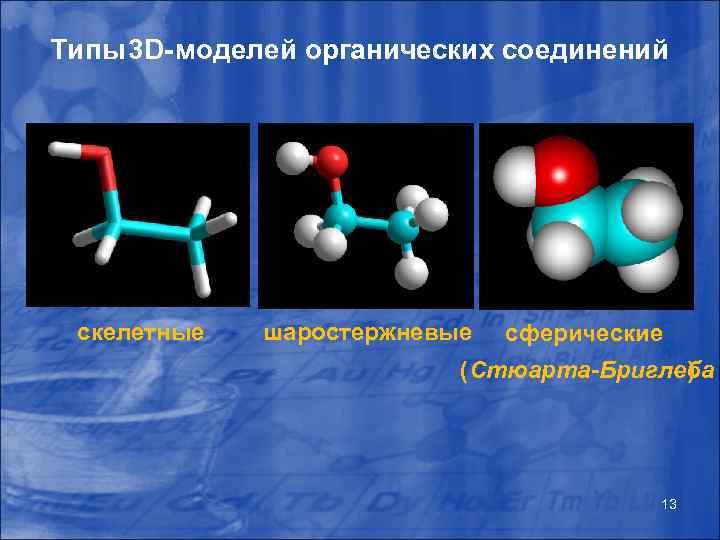
Типы 3 D-моделей органических соединений скелетные шаростержневые сферические (Стюарта-Бриглеба ) 13

Етапы развития биоорганической химии Как отдельная область знаний, которая совмещает концептуальные ринципы и методологию органической химии с п одной стороны и молекулярной биохимии и молекулярной фармакологии с другой стороны, биоорганическая химия сформировалась в 60 -90 годах ХХ столетия на основании разработок химии природных веществ и биополимеров. Фундаментальное значение современная биоорганическая химия приобрела благодаря работам В. Стейна, С. Мура, Ф. Сенгера (анализ аминокислотного состава и определение первичной труктуры ептидов белков), Л. Полинга и Х. Астбери с п и (выяснение строения -спирали и -структуры и их значение в реализации биологических функций белковых молекул), Е. Чаргаффа (расшифровывание особенностей нуклеотидного состава нуклеиновых кислот), Дж. Уотсона, Фр. Крика, М. Уилкинса, Р. Франклина (установление закономерностей пространственной структуры молекулы ДНК), Г. Корани (химический синтез ген а) и т. д. 14

Классификация органических соединений по строению углеродного скелета и природе функциональной группы Огромное число органических соединений побудило химиков провести их классификацию. основу классификации рганических В о соединений положены два классификационных признака: 1. Строение карбонового скелета 2. Природа функциональных групп Классификация по способу строения карбонового скелета : 1. Ациклические (алканы, алкены, алкины, алкадиены); 2. Циклические 2. 1. Карбоциклические (алициклические и ароматические) 2. 2. Гетероциклические Ациклическиесоединения называют ще алифатическими. е К ним принадлежат вещества с незамкнутой углеродной цепью. Ациклические соединения делят на насыщенные (или предельные) Сn. H 2 n+2 (алканы, парафины) и ненасыщенные (непредельные). К последним относят алкены Сn. H 2 n , алкины Сn. H 2 n -2, алкадиены Сn. H 2 n -2. 15
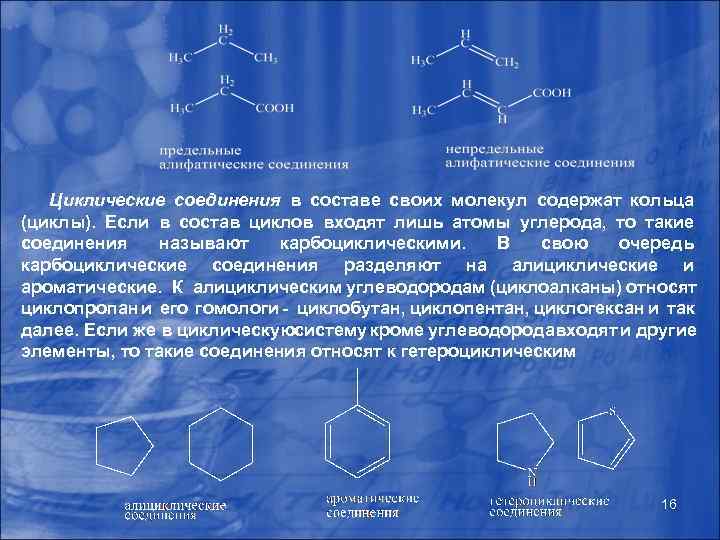
Циклические соединения в составе своих молекул содержат кольца (циклы). Если в состав циклов входят лишь атомы углерода, то такие соединения называют карбоциклическими. В свою очередь карбоциклические соединения разделяют на алициклические и ароматические. К алициклическим углеводородам (циклоалканы) относят циклопропан и его гомологи - циклобутан, циклопентан, циклогексан и так далее. Если же в циклическую истему кроме углеводорода ходят и другие с в элементы, то такие соединения относят к гетероциклическим. 16

Классификация по природе функциональной группы Функциональная группа – это атом или группа определенным образом связанных атомов, наличие которых в молекуле органического вещества определяет характерные свойства и его принадлежность к тому или другому классу соединений. По количеству и однородности функцональных групп органические соединения делят на моно-, поли- и гетерофункциональные. Вещества с одной функциональной группой называют монофунк-циональными , с несколькими одинаковыми функциональными группами полифункциональными. Соединения, содержащие несколько различных функциональных групп гетерофункциональными. Важно, что соединения одного класса объединены в гомологические яды. Гомологический р ряд это ряд органических соединений с одинаковыми функциональными группами и однотипным строением, каждый представитель гомологического ряда отличается от предыдущего а постоянную диницу ( СН 2 ), н е которую называют гомологической разностью. Члены гомологического ряда называют гомологами. 17

Номенклатурные системы в органической химии – тривиальная, рациональная и международная ( IUPAC) • Химическая номенклатура совокупность названий индивидуальных химических веществ, их групп и классов, а также правила составления их названий. • Тривиальная (историческая) номенклатура связана с процессом получения веществ (пирогаллол – продукт пирролиза галловой кислоты), источника происхождения, из которого получали (муравьиная кислота) и т. д. Тривиальные названия соединений широко применяют в химии природных и гетероциклических соединений (цитраль, гераниол, тиофен, пиррол, хинолин, и др. ). • В основе рациональной номенклатуры используется принцип деления органических соединений на гомологические ряды. Все вещества в определенном гомологическом ряду рассматриваются как производные самого простого представителя данного ряда – первого или иногда второго. В частности, у алканов – метана, у алкенов – этилена и т. д. 18

Международная номенклатура (IUPAC). Правила современной номенклатуры были разработаны в 1957 году на ХІХ конгрессе Международного союза теоретической и прикладной имии (International nion of Pure and Applied Chemistry – х U IUPAC). Радикально-функциональная номенклатура В основе этих . названий лежит название функционального класса (спирт, эфир, кетон и др. ), которому предшествуют названия углеводородных радикалов, апример: лилхлорид, иэтиловый н а д эфир, диметилкетон, пропиловый спирт и т. д. Заместительная номенклатура. Правила номенклатуры. Родоначальная структура - структурный фрагмент молекулы (молекулярный остов), лежащий в основе названия соединения, главная углеродная цепь атомов для алициклических оединений, с для карбоциклических – цикл. 19

Химическая связь в органических молекулах Химическая связь – явление взаимодействия внешних электронных оболочек (валентных электронов атомов) и ядер атомов, обуславливающее существование молекулы или кристалла как целого. Как правило атом, принимая, отдавая электрон или образуя общую электронную пару, стремится приобрести конфигурацию внешней электронной оболочки аналогичную инертным газам. Для органических соединений характерны следующие типы химических связей: - ионная связь - ковалентная связь - донорно - акцепторная связь - водородная связь Также существуют некоторые другие типы химической связи (металлическая, одноэлектронная, двухэлектронная трехцентровая), однако в органических соединениях они 20 практически не встречаются.
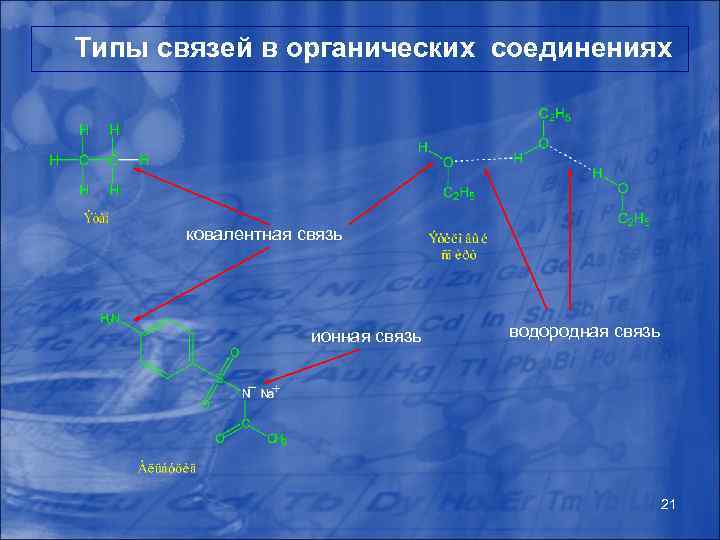
Типы связей в органических соединениях ковалентная связь ионная связь водородная связь 21

Ковалентная связь в молекулах органических соединений : Ø Неполярная Ø Полярная Ø Одинарная (σ-связь) Ø Кратная (σ-связь и π-связь) Водородная связь в молекулах органических соединений : Ø Внутримолекулярная Ø Межмолекулярная 22

Типы связей в органических соединениях Наиболее характерной для органических соединений является ковалентная связь Ковалентная связь - это взаимодействие . атомов, которое реализуется посредством образования общей электронной пары. Данный тип связи образуется между атомами, которые имеют сравнимые значения электроотрицательности. Электроотрицательность - свойство атома, показывающее способность оттягивать к себе электроны от других атомов. Ковалентная связь может быть полярной или неполярной. Неполярная ковалентная связь возникает между атомами с одинаковым значением электроотрицательности. 2. 55 23

Типы связей в органических соединениях Ковалентная полярная связь образуется между атомами, которые имеют различные значения электроотрицательности. В данном случае связанные атомы приобретают частичные заряды. δ+ δ 2. 55 2. 96 Особым подтипом ковалентной связи является донорноакцепторная связь. Как и в предыдущих примерах данный тип взаимодействия обусловлен наличием общей электронной пары, однако последняя предоставляется одним из атомов образующих связь (донором) и принимается другим атомом (акцептором) 24

Типы связей в органических соединениях Ионная связь образуется между атомами, которые сильно отличаются по значениям электроотрицательности. В данном случае электрон менее электроотрицательного элемента (зачастую это металл) полностью ереходит к более электроотрицательному п элементу. Данный переход электрона обуславливает появление положительного заряда у менее электроотрицательного тома и а отрицательного у более электроотрицательного. Таким образом, образуется два иона с противоположным зарядом, между которыми существует электровалентное взаимодействие. 25
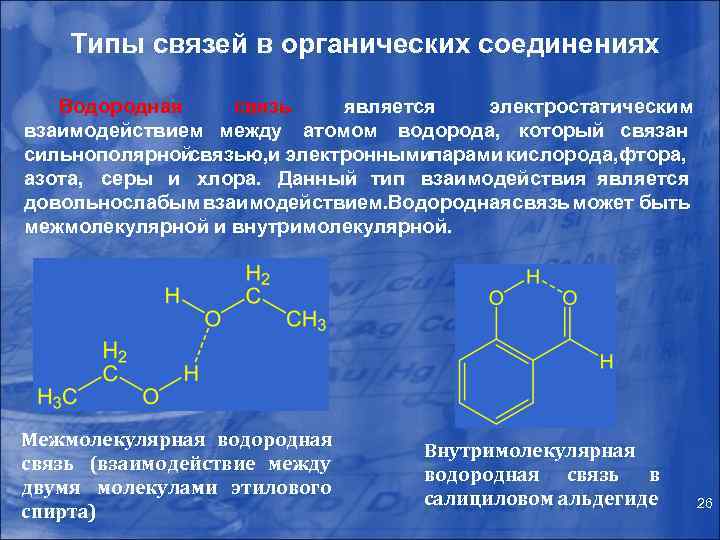
Типы связей в органических соединениях Водородная связь является электростатическим взаимодействием между атомом водорода, который связан сильнополярной связью, электронными и парами кислорода, тора, ф азота, серы и хлора. Данный тип взаимодействия является довольно лабым взаимодействием. одородная вязь может быть с В с межмолекулярной и внутримолекулярной. Межмолекулярная водородная связь (взаимодействие между двумя молекулами этилового спирта) Внутримолекулярная водородная связь в салициловом альдегиде 26

Химическая связь в органических молекулах Современная теория химической связи основывается на квантово-механической модели молекулы ак системы, состоящей к из электронов и атомных ядер. Краеугольным онятием квантовоп механической теории является атомная орбиталь. Атомная орбиталь – часть пространства, котором ероятность в в нахождения электронов является максимальной. Связь, таким образом, может быть рассмотрена как взаимодействие ( «перекрывание» ) рбиталей, которые есут по одному лектрону о н э с противоположными спинами. 27

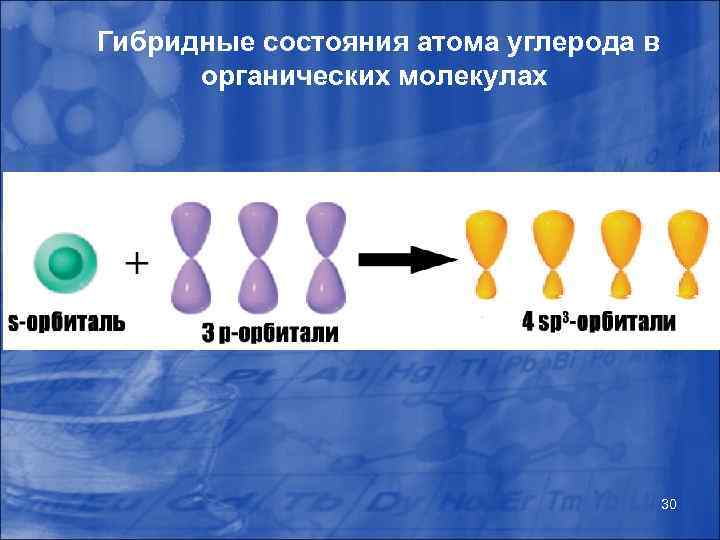
Гибридизация атомных орбиталей Согласно квантово-механической теории, количество образованных атомом ковалентных связей определяется количеством одноэлектронных томных орбиталей (количеством а неспаренных лектронов). атома углерода в основном остоянии э У с всего два неспаренных электрона, однако возможный переход электрона с 2 s на 2 рz обуславливает возможность образования четырех ковалентных связей. Состояние атома углерода, при котором он имеет четыре неспаренных электрона называется «возбужденным» . Несмотря на то, что орбитали углерода являются неравноценными, известно, что возможно образование четырех эквивалентных связей вследствие гибридизации атомных орбиталей. Гибридизация – явление, при котором из нескольких азных по р форме и близких по энергии орбиталей образуется такое же количество одинаковых по форме и количеству орбиталей. 28
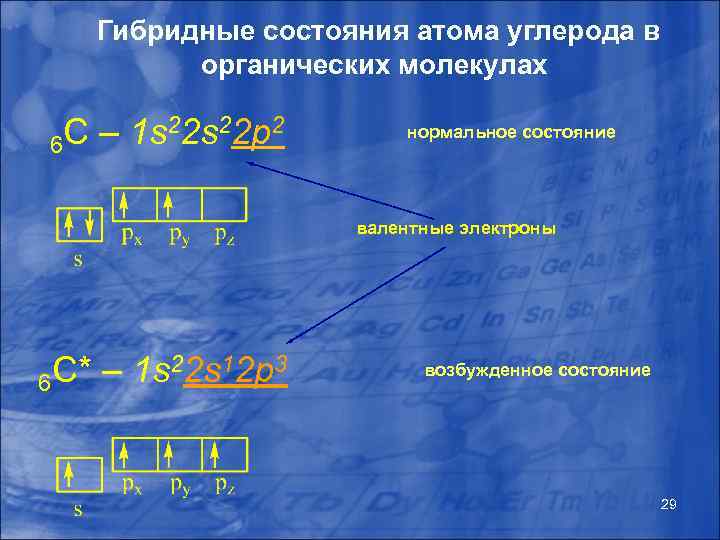
Гибридные состояния атома углерода в органических молекулах C – 1 s 22 p 2 6 нормальное состояние валентные электроны C* – 1 s 22 s 12 p 3 6 возбужденное состояние 29
Гибридные состояния атома углерода в органических молекулах 30
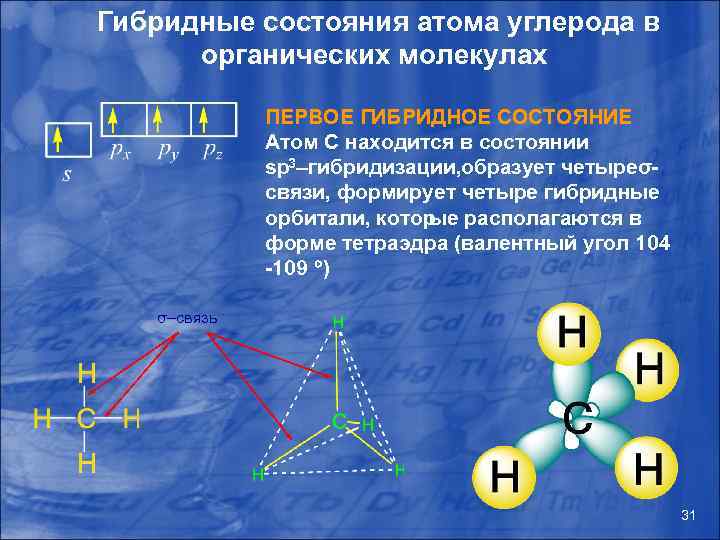
Гибридные состояния атома углерода в органических молекулах ПЕРВОЕ ГИБРИДНОЕ СОСТОЯНИЕ Атом С находится в состоянии sp 3–гибридизации, бразует четыре о σ связи, формирует четыре гибридные орбитали, котор ые располагаются в форме тетраэдра (валентный угол 104 -109 ) σ–связь 31
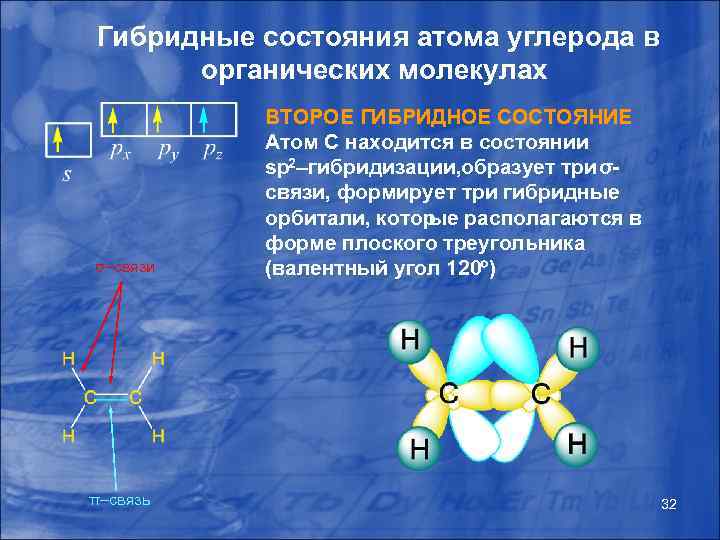
Гибридные состояния атома углерода в органических молекулах σ–связи π–связь ВТОРОЕ ГИБРИДНОЕ СОСТОЯНИЕ Атом С находится в состоянии sp 2–гибридизации, бразует три σо связи, формирует три гибридные орбитали, котор ые располагаются в форме плоского треугольника (валентный угол 120 ) 32
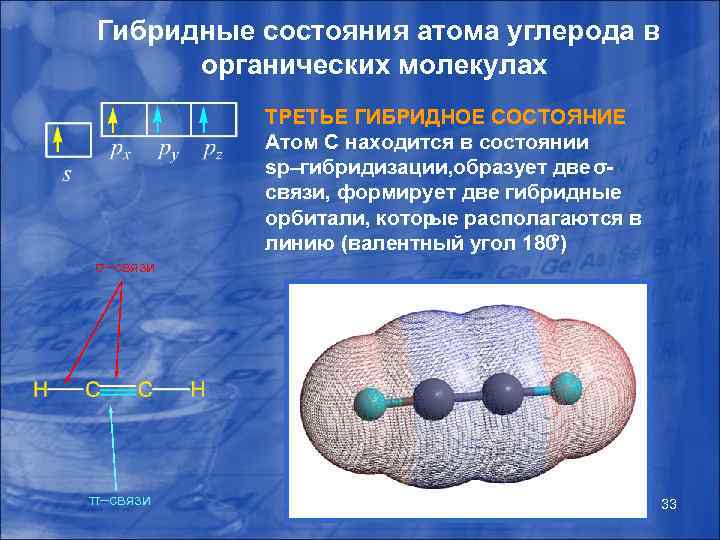
Гибридные состояния атома углерода в органических молекулах ТРЕТЬЕ ГИБРИДНОЕ СОСТОЯНИЕ Атом С находится в состоянии sp–гибридизации, бразует две σо связи, формирует две гибридные орбитали, котор ые располагаются в линию (валентный угол 180 ) σ–связи π–связи 33

Характеристики химических связей • Кратность • Длина. • Энергия. • Полярность. • Поляризуемость. • С – С - одинарная • С=С - двойная • С С - тройная 34

Характеристики химических связей Длина связи - растояние между соседними атомами. При увеличении кратности связи, длина уменьшается. 35

Характеристики химических связей Энергия связи – енергия, которая необходима для гомолитического разрыва химической связи. Энергия связи выражается в килоджоулях (к. Дж/моль) или килокалориях (ккал/моль) и характеризует прочность химической связи. 36

Характеристики химических связей Полярность связи - неравномерное распределение электронной плотности между двома соседними атомами, которые отличаются своею электроотрицательностью. Шкала ПОЛИНГА: F-4, 0; O – 3, 5; Cl – 3, 0; N – 3, 0; Br – 2, 8; S – 2, 5; C-2, 5; H-2, 1. разница 1, 7< электроотрицательности <1, 7 йонная ковалентная 37

Характеристики химических связей Поляризуемость связи - смещение электронной плотности под действием внешних факторов. Поляризуемость связи - степень подвижности электронов. С увеличением атомного радиуса возростает поляризуемость электронов. Поэтому поляризуемость связи Карбон - галоген увеличивается следующим образом: C-F<C-Cl<C-Br<C-I. В то же время полярность увеличивается в противоположном направлении. Поляризуемость электронов значительно влияет на реакционную способность соединений. 38

Электронные эффекты. Взаимное влияние атомов в молекуле По современным теоретическим представлениям, реакционная способность органических молекул предопределена смещением и подвижностью электронных облаков, которые образуют ковалентную связь. В органической химии различают два типа смещений электронов: а) электронные смещения , происходящие в системе -связей, б) электронные смещения, передающиеся системой -связей. В первом случае имеет место так называемый индуктивный эффект, во втором - мезомерный. Индуктивный эффект - перераспределение электронной плотности (поляризация), возникающее в результате разницы электроотрицательности между атомами молекулы в системе -связей. Через незначительную поляризуемость -связей индуктивний эффект быстро угасает и через 3 -4 связи он почти не проявляется. 39

Электронные эффекты. Взаимное влияние атомов в молекуле Понятие об индуктивном эффекте было введено К. Ингольдом, им же были введены обозначения: Ø–I-эффект в случае понижения заместителем электронной плотности Ø+I-эффект в случае повышения заместителем электронной плотности Положительный индуктивний эффект проявляют алкильные радикалы (СН 3, С 2 Н 5 - и т. д. ). Все другие заместители, связанные с атомом углерода, проявляют отрицательный индуктивный эффект. 40

Электронные эффекты. Взаимное влияние атомов в молекуле Мезомерным эффектом называют перераспределение электронной плотности вдоль сопряженной системы. К сопряженным системам принадлежат молекулы органических соединений, в которых чередуются двойные и одинарные связи или когда рядом с двойной связью размещен атом, имеющий на р-орбитали неподеленную пару электронов. В первом случае имеет место , - сопряжение, а во втором – р, -сопряжение. Сопряженные системы бывают с открытой и замкнутой цепью сопряжения. Примером таких соединений является 1, 3 -бутадиен и бензен. В молекулах этих соединений атомы углерода находятся в состоянии sp 2 -гибридизации и за счет негибридных p-орбиталей образуют -связи, которые взаимно перекрываются между собой и формируют единственное электронное облако, то есть имеет место сопряжение. 41

Электронные эффекты. Взаимное влияние атомов в молекуле Существует два вида мезомерного эффекта – положительный мезомерный эффект (+М) и отрицательный мезомерный эффект ( -М). Положительный мезомерный эффект проявляют заместители, предоставляющие p-электроны в сопряженную систему. К таковым относят: -O, -S -NН 2, -ОН, -OR, Hal (галогены) и другие заместители, которые имеют отрицательный заряд или неподеленную пару электронов. Отрицательный мезомерный эффект характерен для заместителей оттягивающих на себя -электронную плотность из сопряженной системы. К таковым относят заместители, имеющие кратные связи между атомами с разной электроотрицательностью: -N 02; -SO 3 Н; >С=О; -СООН и другие. Мезомерный эффект графически отражается согнутой стрелкой, которая показывает направление смещения электронов В отличие от индукционного эффекта, мезомерный эффект не погасает. Он передается полностью по системе, независимо от длины цепи сопряжения. 42

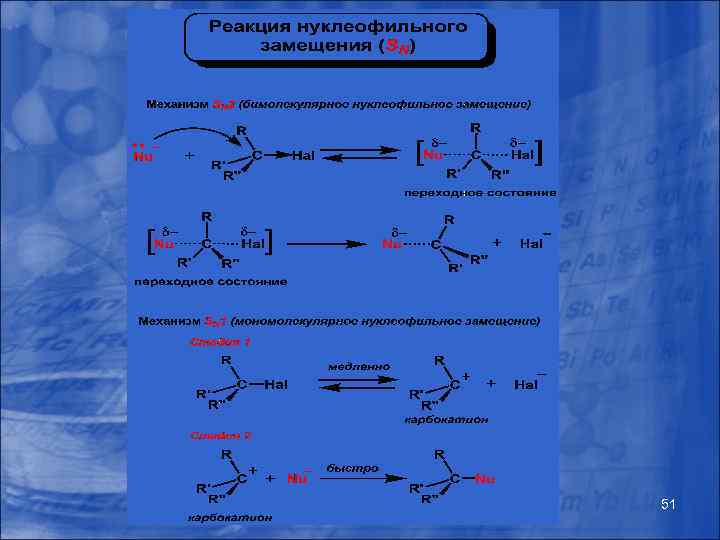
Типы химических реакций Химическую реакцию можно рассматривать как взаимодействие реагента и субстрата. В зависимости от способа разрыва и образования химической связи в молекулах, органические реакции делят на: а) гомолитические б) гетеролитические в) молекулярные Гомолитические или свободно-радикальные реакции обусловлены гомолитическим разрывом связи, когда у каждого атома остается по одному электрону, то есть образуются радикалы. Гомолитический разрыв происходит при высоких температурах, действии кванта света или катализе. 43

Типы химических реакций Гетеролитические или ионные реакции протекают таким образом, что пара связующих электронов остается около одного из атомов и образуются ионы. Частица с электронной парой называется нуклеофильной и имеет отрицательный заряд (-). Частица без электронной пары называется электрофильной и имеет положительный заряд (+). 44

Механизм химической реакции Механизмом реакции называют совокупность элементарных (простых) стадий, из которых состоит данная реакция. Механизм реакции чаще всего включает такие стадии: активация реагента с образованием электрофила, нуклеофила или свободного радикала. Для активации реагента нужен, как правило, катализатор. Во второй стадии происходит взаимодействие активированного реагента с субстратом. При этом образуются промежуточные частицы (интермедиаты). К последним принадлежат -комплексы, -комплексы (карбокатионы), карбанионы, новые свободные радикалы. На конечной стадии проходит присоединение или отщепление к (от) образованному во второй стадии интермедиату какой-то частицы с формированием конечного продукта реакции. Если реагент при активации генерирует нуклеофил, то это - нуклеофильные реакции. Их помечают буквой N-(в индексе). В случае, когда реагент генерирует электрофил, реакции принадлежат к электрофильным (Е). Аналогично можно сказать и о свободнорадикальных реакциях (R). 45

Нуклеофилы – реагенты, имеющие отрицательный заряд или обогащенный электронной плотностью атом: 1) анионы: OH-, CN-, RO-, RS-, Hal- и другие анионы; 2) нейтральные молекулы с неподеленными парами электронов: NH 3, NH 2 R, H 2 O, ROH и другие; 3) молекулы с избыточной электронной плотностью (имеющие связи). Электрофилы – реагенты, имеющие положительный заряд или обедненный электронной плотностью атом: 1) катионы: Н+ (протон), НSO 3+ (ион гидрогенсульфония), NO 2+ (ион нитрония), NO (ион нитрозония) и другие катионы; 2) нейтральные молекулы, имеющие вакантную орбиталь : Al. Cl 3, Fe. Br 3, Sn. Cl 4, BF 4 (кислоты Льюиса), SO 3; 3) молекулы с обедненной электронной плотностью на атоме. 46

Классификация химических реакций • • Реакции замещения Реакции присоединения Реакции отщепления (элеминирования) Реакции изомеризации (перегруппирования) 47

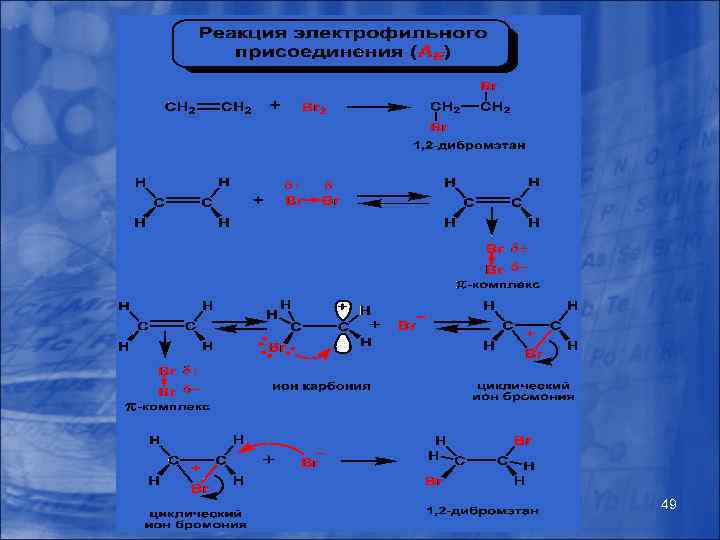
Наиболее распространенные реакции в органической химии SR – замещение радикальное; SN – замещение нуклеофильное; SE – замещение электрофильное; AE – присоединение электрофильное; AN – присоединение нуклеофильное 48
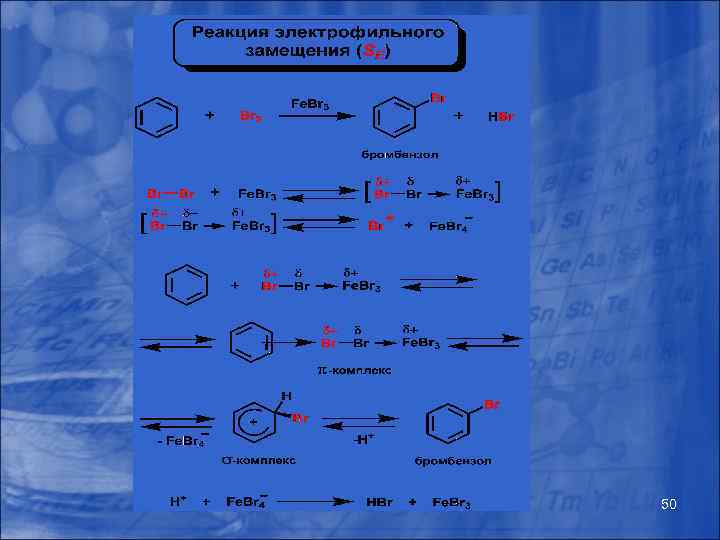
49
50
51

52

БЛАГОДАРЮ ЗА ВНИМАНИЕ! 53
Первая лечебники.ppt