02.Алканы.pptx
- Количество слайдов: 26
 Предельные углеводороды Насыщенные алифатические углеводороды Алканы или Парафины
Предельные углеводороды Насыщенные алифатические углеводороды Алканы или Парафины
 Углеводороды это органические соединения, молекулы которых состоят только из углерода C и водорода H. Алканы это ациклические углеводороды линейного или разветвлённого строения, содержащие только простые σ-связи и образующие гомологический ряд с общей формулой Cn. H 2 n+2
Углеводороды это органические соединения, молекулы которых состоят только из углерода C и водорода H. Алканы это ациклические углеводороды линейного или разветвлённого строения, содержащие только простые σ-связи и образующие гомологический ряд с общей формулой Cn. H 2 n+2
 Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp 3 -гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109° 28'. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0, 154 нм, длина связи C—H — 0, 1087 нм. Простейшим представителем класса является метан (CH 4).
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp 3 -гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109° 28'. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0, 154 нм, длина связи C—H — 0, 1087 нм. Простейшим представителем класса является метан (CH 4).
 Номенклатура Рациональная Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название «алкил 1 алкил 2 алкил 3 алкил 4 метан» , например: а: н-бутил-втор-бутилизобутилметан б: триизопропилметан в: триэтилпропилметан
Номенклатура Рациональная Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название «алкил 1 алкил 2 алкил 3 алкил 4 метан» , например: а: н-бутил-втор-бутилизобутилметан б: триизопропилметан в: триэтилпропилметан
 Систематическая ИЮПАК По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Систематическая ИЮПАК По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
 ИЗОМЕРИЯ Первые три члена гомологического ряда алканов (метан, этан, пропан) изомеров не имеют. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C 7 H 16 — также оптической изомерией.
ИЗОМЕРИЯ Первые три члена гомологического ряда алканов (метан, этан, пропан) изомеров не имеют. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C 7 H 16 — также оптической изомерией.
 Физические свойства. Алканы – бесцветные вещества, легче воды, плохо растворяются в воде, но растворяются в органических растворителях (бензол, тетрахлорметан). Газообразные и жидкие алканы образуют взрывоопасные смеси с воздухом.
Физические свойства. Алканы – бесцветные вещества, легче воды, плохо растворяются в воде, но растворяются в органических растворителях (бензол, тетрахлорметан). Газообразные и жидкие алканы образуют взрывоопасные смеси с воздухом.
 Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях неразветвлённые алканы с CH 4 до C 4 H 10 и неопентан — газы; с C 5 H 12 до C 13 H 28 — жидкости; начиная с C 14 H 30 и далее — твёрдые вещества. Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ. Газообразные алканы горят бесцветным или бледноголубым пламенем с выделением большого количества тепла.
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях неразветвлённые алканы с CH 4 до C 4 H 10 и неопентан — газы; с C 5 H 12 до C 13 H 28 — жидкости; начиная с C 14 H 30 и далее — твёрдые вещества. Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ. Газообразные алканы горят бесцветным или бледноголубым пламенем с выделением большого количества тепла.
 Химические свойства. Алканы химически мало активны. Для алканов наиболее характерны реакции замещения. В этих реакциях происходит гомолитический разрыв ковалентных связей, они осуществляются по свободнорадикальному (цепному) механизму.
Химические свойства. Алканы химически мало активны. Для алканов наиболее характерны реакции замещения. В этих реакциях происходит гомолитический разрыв ковалентных связей, они осуществляются по свободнорадикальному (цепному) механизму.
 1. Галогенирование (замещение атома водорода атомом галогена - F, Cl, Br с образованием галогеналкана RHal). Алканы очень активно реагируют со фтором. Хлорирование протекает под действием света и является фотохимической цепной реакцией. СН 4 + Cl 2 → CH 3 Cl + HCl CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl CHCl 3 + Cl 2 → CCl 4 + HCl При галогенировании алканов более сложного строения на атом галогена легче всего замещаются атомы водорода при третичном углеродном атоме, затем – при вторичном и, наконец, при первичном.
1. Галогенирование (замещение атома водорода атомом галогена - F, Cl, Br с образованием галогеналкана RHal). Алканы очень активно реагируют со фтором. Хлорирование протекает под действием света и является фотохимической цепной реакцией. СН 4 + Cl 2 → CH 3 Cl + HCl CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl CHCl 3 + Cl 2 → CCl 4 + HCl При галогенировании алканов более сложного строения на атом галогена легче всего замещаются атомы водорода при третичном углеродном атоме, затем – при вторичном и, наконец, при первичном.

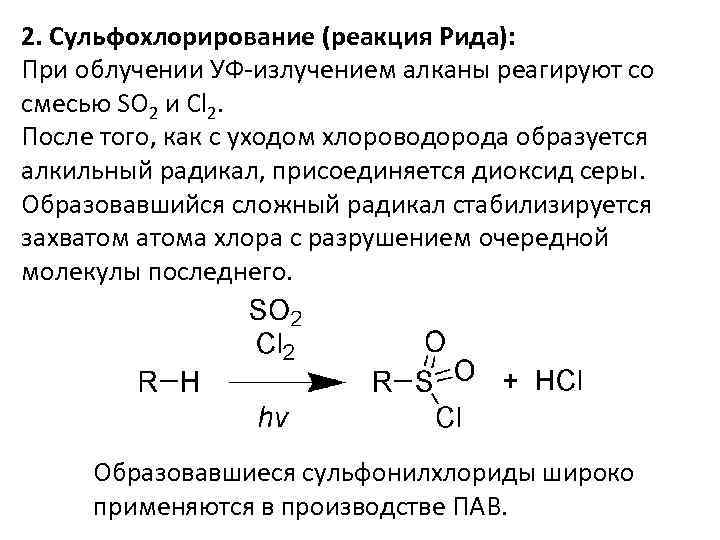 2. Сульфохлорирование (реакция Рида): При облучении УФ-излучением алканы реагируют со смесью SO 2 и Cl 2. После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватома хлора с разрушением очередной молекулы последнего. Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
2. Сульфохлорирование (реакция Рида): При облучении УФ-излучением алканы реагируют со смесью SO 2 и Cl 2. После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватома хлора с разрушением очередной молекулы последнего. Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
 3. Нитрование - замещение атома водорода нитрогруппой -NO 2 c образованием нитроалканов Cn H 2 n+1 NO 2 Реакция Коновалова Cn. H 2 n+2 + HNO 3 → Cn. H 2 n+1 NO 2 + H 2 O Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO 2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных. Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
3. Нитрование - замещение атома водорода нитрогруппой -NO 2 c образованием нитроалканов Cn H 2 n+1 NO 2 Реакция Коновалова Cn. H 2 n+2 + HNO 3 → Cn. H 2 n+1 NO 2 + H 2 O Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO 2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных. Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
 Реакции окисления. При обычных условиях алканы устойчивы к действию окислителей (KMn. O 4, K 2 Cr 2 O 7). 1. Окисление кислородом воздуха при высоких температурах (горение) А) полное окисление (избыток О 2) с образованием углекислого газа и воды: СН 4 + 2 О 2 → СО 2 + 2 Н 2 О Б) неполное окисление (недостаток О 2) 2 СН 4 + 3 О 2 → 2 СО + 4 Н 2 О СН 4 + О 2 → С + 2 Н 2 О В) каталитическое окисление (катализаторы – соединения Mn) СН 3 - СН 2 - СН 3 → 2 СН 3 СООН + Н 2 О
Реакции окисления. При обычных условиях алканы устойчивы к действию окислителей (KMn. O 4, K 2 Cr 2 O 7). 1. Окисление кислородом воздуха при высоких температурах (горение) А) полное окисление (избыток О 2) с образованием углекислого газа и воды: СН 4 + 2 О 2 → СО 2 + 2 Н 2 О Б) неполное окисление (недостаток О 2) 2 СН 4 + 3 О 2 → 2 СО + 4 Н 2 О СН 4 + О 2 → С + 2 Н 2 О В) каталитическое окисление (катализаторы – соединения Mn) СН 3 - СН 2 - СН 3 → 2 СН 3 СООН + Н 2 О
 При каталитическом окислении парафинов могут образовываться спирты, альдегиды, карбоновые кислоты. При мягком окислении СН 4 в присутствии катализатора кислородом при 200 °C могут образоваться: метанол: 2 СН 4 + О 2 → 2 СН 3 ОН; формальдегид: СН 4 + О 2 → СН 2 О + Н 2 O; муравьиная кислота: 2 СН 4 + 3 О 2 → 2 НСООН + 2 Н 2 O.
При каталитическом окислении парафинов могут образовываться спирты, альдегиды, карбоновые кислоты. При мягком окислении СН 4 в присутствии катализатора кислородом при 200 °C могут образоваться: метанол: 2 СН 4 + О 2 → 2 СН 3 ОН; формальдегид: СН 4 + О 2 → СН 2 О + Н 2 O; муравьиная кислота: 2 СН 4 + 3 О 2 → 2 НСООН + 2 Н 2 O.
 Термические превращения алканов: Разложение Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов. CH 4 → C + 2 H 2 (t > 1000 °C) C 2 H 6 → 2 C + 3 H 2.
Термические превращения алканов: Разложение Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов. CH 4 → C + 2 H 2 (t > 1000 °C) C 2 H 6 → 2 C + 3 H 2.
 Крекинг - термический крекинг и каталитический крекинг на алюмосиликатном катализаторе. При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. Расщепление н-бутана на этан и этилен: С 4 Н 10 → С 2 Н 6 + С 2 Н 4 Расщепление н-гексадекана на н-октан и октен: C 16 H 34 → C 8 H 18 + C 8 H 16
Крекинг - термический крекинг и каталитический крекинг на алюмосиликатном катализаторе. При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. Расщепление н-бутана на этан и этилен: С 4 Н 10 → С 2 Н 6 + С 2 Н 4 Расщепление н-гексадекана на н-октан и октен: C 16 H 34 → C 8 H 18 + C 8 H 16
 Дегидрирование Образование: 1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода: а) CH 3 -CH 3 → CH 2=CH 2 + H 2 (этан → этен); б) CH 3 -CH 2 -CH 3 → CH 2=CH-CH 3 + H 2 (пропан → пропен). Условия протекания: 400— 600 °C, катализаторы — Pt, Ni, Al 2 O 3, Cr 2 O 3. 2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2 -метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода.
Дегидрирование Образование: 1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода: а) CH 3 -CH 3 → CH 2=CH 2 + H 2 (этан → этен); б) CH 3 -CH 2 -CH 3 → CH 2=CH-CH 3 + H 2 (пропан → пропен). Условия протекания: 400— 600 °C, катализаторы — Pt, Ni, Al 2 O 3, Cr 2 O 3. 2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2 -метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода.
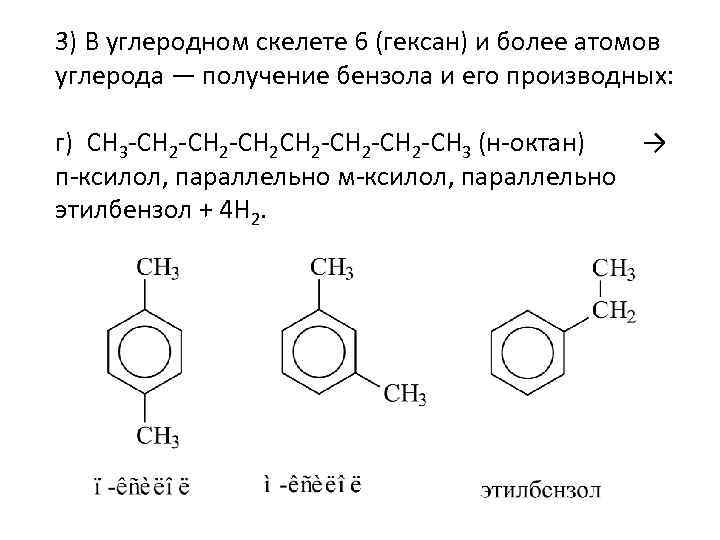 3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных: г) CH 3 -CH 2 -CH 2 -CH 3 (н-октан) → п-ксилол, параллельно м-ксилол, параллельно этилбензол + 4 H 2.
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных: г) CH 3 -CH 2 -CH 2 -CH 3 (н-октан) → п-ксилол, параллельно м-ксилол, параллельно этилбензол + 4 H 2.
 Конверсия метана В присутствии никелевого катализатора протекает реакция: CH 4 + H 2 O → CO + 3 H 2. Продукт этой реакции (смесь CO и H 2) называется «синтез-газом» . Синтез Фишера — Тропша n. CO + (2 n+1)H 2 → Cn. H 2 n+2 + n. H 2 O
Конверсия метана В присутствии никелевого катализатора протекает реакция: CH 4 + H 2 O → CO + 3 H 2. Продукт этой реакции (смесь CO и H 2) называется «синтез-газом» . Синтез Фишера — Тропша n. CO + (2 n+1)H 2 → Cn. H 2 n+2 + n. H 2 O
 Реакции электрофильного замещения Изомеризация: Под действием катализатора (например, Al. Cl 3) происходит изомеризация алкана: например, бутан (C 4 H 10), взаимодействуя с хлоридом алюминия (Al. Cl 3), превращается из н-бутана в 2 -метилпропан (изобутан).
Реакции электрофильного замещения Изомеризация: Под действием катализатора (например, Al. Cl 3) происходит изомеризация алкана: например, бутан (C 4 H 10), взаимодействуя с хлоридом алюминия (Al. Cl 3), превращается из н-бутана в 2 -метилпропан (изобутан).
 Получение Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно. Восстановление галогенпроизводных алканов, спиртов, карбонильных соединений. Гидрирование непредельных углеводородов: Cn. H 2 n + H 2 → Cn. H 2 n+2 Cn. H 2 n-2 + 2 H 2 → Cn. H 2 n+2 Катализатором реакции являются соединения никеля, платины или палладия.
Получение Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно. Восстановление галогенпроизводных алканов, спиртов, карбонильных соединений. Гидрирование непредельных углеводородов: Cn. H 2 n + H 2 → Cn. H 2 n+2 Cn. H 2 n-2 + 2 H 2 → Cn. H 2 n+2 Катализатором реакции являются соединения никеля, платины или палладия.
 Газификация твердого топлива (Процессы Бертло, Шрёдера, Бергиуса) Проходит при повышенной температуре и давлении. Катализатор — Ni (для Бертло), Mo (для Шрёдера) или без катализатора (для Бергиуса): C + 2 H 2 → CH 4
Газификация твердого топлива (Процессы Бертло, Шрёдера, Бергиуса) Проходит при повышенной температуре и давлении. Катализатор — Ni (для Бертло), Mo (для Шрёдера) или без катализатора (для Бергиуса): C + 2 H 2 → CH 4
 Из солей карбоновых кислот при повышенной температуре (реакция Дюма, пиролиз). Пиролизом называют термическое разложение веществ без доступа воздуха. При нагревании твердых солей карбоновых кислот с щелочами образуется предельный углеводород, содержащий на один атом углерода меньше, чем в кислоте, образующей исходную соль. CH 3 COONa(тв. ) + Na. OH/Ca(OH)2(тв. ) → Na 2 CO 3 + CH 4↑
Из солей карбоновых кислот при повышенной температуре (реакция Дюма, пиролиз). Пиролизом называют термическое разложение веществ без доступа воздуха. При нагревании твердых солей карбоновых кислот с щелочами образуется предельный углеводород, содержащий на один атом углерода меньше, чем в кислоте, образующей исходную соль. CH 3 COONa(тв. ) + Na. OH/Ca(OH)2(тв. ) → Na 2 CO 3 + CH 4↑
 Из галогеналканов: А) синтез Вюрца: СН 3 – Cl + 2 Na + Cl – CH 3 → СН 3 – СН 3 + 2 Na. Cl Практическое значение этот способ имеет только для получения симметричных алканов с четным числом атомов углерода. Б) синтез Вюрца – Гриньяра: СН 3 – Cl + Mg →CH 3 – Mg – Cl (реактив Гриньяра) CH 3 – Mg – Cl + Cl – CH 2 – CH 3 + Mg. Cl 2 Вместо натрия в этой реакции могут быть использованы и другие металлы, например литий, магний, цинк.
Из галогеналканов: А) синтез Вюрца: СН 3 – Cl + 2 Na + Cl – CH 3 → СН 3 – СН 3 + 2 Na. Cl Практическое значение этот способ имеет только для получения симметричных алканов с четным числом атомов углерода. Б) синтез Вюрца – Гриньяра: СН 3 – Cl + Mg →CH 3 – Mg – Cl (реактив Гриньяра) CH 3 – Mg – Cl + Cl – CH 2 – CH 3 + Mg. Cl 2 Вместо натрия в этой реакции могут быть использованы и другие металлы, например литий, магний, цинк.
 Электролиз солей карбоновых кислот (синтез Кольбе) 2 R–COONa +2 H 2 O → R–R + 2 CO 2 + H 2+2 Na. OH Разложение карбида Al водой или кислотами Al 4 C 3 + 12 H 2 O → 3 СН 4 + 4 Al(OH)3 Al 4 C 3 + 12 НCl → 3 СН 4 + 4 Al. Cl 3 Этим способом в лабораторных условиях можно получить метан.
Электролиз солей карбоновых кислот (синтез Кольбе) 2 R–COONa +2 H 2 O → R–R + 2 CO 2 + H 2+2 Na. OH Разложение карбида Al водой или кислотами Al 4 C 3 + 12 H 2 O → 3 СН 4 + 4 Al(OH)3 Al 4 C 3 + 12 НCl → 3 СН 4 + 4 Al. Cl 3 Этим способом в лабораторных условиях можно получить метан.


