5080d0948130c0a34e6d1b1805f1044f.ppt
- Количество слайдов: 20
 Правові засади допуску ЛЗ на український фармацевтичний ринок України Директор Фармакологічного Центру МОЗ України Чумак Віктор Тимофійович Chumak@pharma-center. kiev. ua, http: //www. pharma-center. kiev. ua/
Правові засади допуску ЛЗ на український фармацевтичний ринок України Директор Фармакологічного Центру МОЗ України Чумак Віктор Тимофійович Chumak@pharma-center. kiev. ua, http: //www. pharma-center. kiev. ua/
 РЕЄСТРАЦІЯ ЛІКІВ в Україні ТА ВИМОГИ СОТ ЗАКОНОДАСТВО: ІНФРАСТРУКТУРА, - СТ. 6, 7, 8, 9, 12 Закону “Про лікарські засоби” яка має забезпечити виконання законодавства: - Постанови КМУ – № 376 від 25. 05. 2005; Постанова КМУ № 376 від 26. 05. 2005: № 509 від 21. 03. 2007; РЕЄСТРАЦІЯ – МОЗ; № 1277 від 31. 10. 2007; ЕКСПЕРТИЗА - ДФЦ № 372 від 17. 04. 2008 - 29 наказів МОЗ Наказ МОЗ № 186 ПРОЦЕДУРИ, які мають забезпечити виконання законодавства: Наказ МОЗ № 426 від 26. 08. 2005 ДФЦ; 26 інструкцій регламентуючих роботу ДФЦ; від 17. 05. 2002; На основі Директив 2001/83/ЄС та 2003/63/ЄC Європейського Союзу та рекомендацій ВООЗ, зокрема: WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations, 2006 та MARKETING AUTHORIZATION OF PHARMACEUTICAL PRODUCTS WITH SPECIAL REFERENCE TO MULTISOURCE (GENERIC) PRODUCTS: A MANUAL FOR DRUG REGULATORY AUTHORITIES
РЕЄСТРАЦІЯ ЛІКІВ в Україні ТА ВИМОГИ СОТ ЗАКОНОДАСТВО: ІНФРАСТРУКТУРА, - СТ. 6, 7, 8, 9, 12 Закону “Про лікарські засоби” яка має забезпечити виконання законодавства: - Постанови КМУ – № 376 від 25. 05. 2005; Постанова КМУ № 376 від 26. 05. 2005: № 509 від 21. 03. 2007; РЕЄСТРАЦІЯ – МОЗ; № 1277 від 31. 10. 2007; ЕКСПЕРТИЗА - ДФЦ № 372 від 17. 04. 2008 - 29 наказів МОЗ Наказ МОЗ № 186 ПРОЦЕДУРИ, які мають забезпечити виконання законодавства: Наказ МОЗ № 426 від 26. 08. 2005 ДФЦ; 26 інструкцій регламентуючих роботу ДФЦ; від 17. 05. 2002; На основі Директив 2001/83/ЄС та 2003/63/ЄC Європейського Союзу та рекомендацій ВООЗ, зокрема: WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations, 2006 та MARKETING AUTHORIZATION OF PHARMACEUTICAL PRODUCTS WITH SPECIAL REFERENCE TO MULTISOURCE (GENERIC) PRODUCTS: A MANUAL FOR DRUG REGULATORY AUTHORITIES
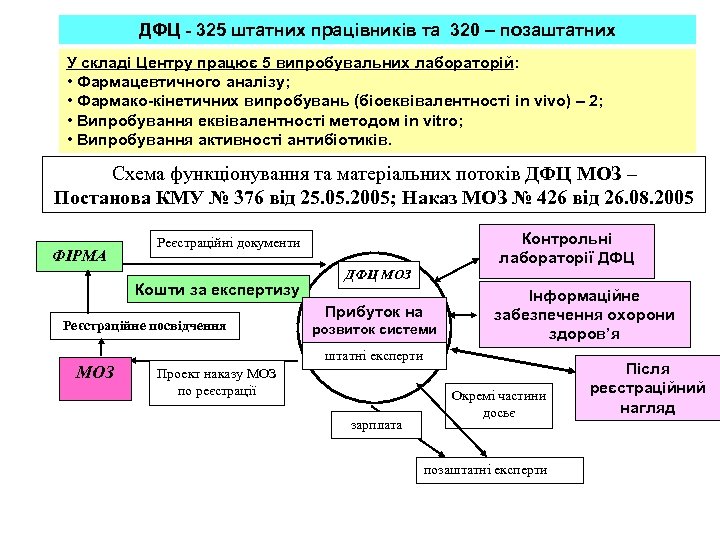 ДФЦ - 325 штатних працівників та 320 – позаштатних У складі Центру працює 5 випробувальних лабораторій: • Фармацевтичного аналізу; • Фармако-кінетичних випробувань (біоеквівалентності in vivo) – 2; • Випробування еквівалентності методом in vitro; • Випробування активності антибіотиків. Схема функціонування та матеріальних потоків ДФЦ МОЗ – Постанова КМУ № 376 від 25. 05. 2005; Наказ МОЗ № 426 від 26. 08. 2005 ФІРМА Кошти за експертизу Реєстраційне посвідчення МОЗ Контрольні лабораторії ДФЦ Реєстраційні документи ДФЦ МОЗ Прибуток на розвиток системи Інформаційне забезпечення охорони здоров’я штатні експерти Проект наказу МОЗ по реєстрації зарплата Окремі частини досьє позаштатні експерти Після реєстраційний нагляд
ДФЦ - 325 штатних працівників та 320 – позаштатних У складі Центру працює 5 випробувальних лабораторій: • Фармацевтичного аналізу; • Фармако-кінетичних випробувань (біоеквівалентності in vivo) – 2; • Випробування еквівалентності методом in vitro; • Випробування активності антибіотиків. Схема функціонування та матеріальних потоків ДФЦ МОЗ – Постанова КМУ № 376 від 25. 05. 2005; Наказ МОЗ № 426 від 26. 08. 2005 ФІРМА Кошти за експертизу Реєстраційне посвідчення МОЗ Контрольні лабораторії ДФЦ Реєстраційні документи ДФЦ МОЗ Прибуток на розвиток системи Інформаційне забезпечення охорони здоров’я штатні експерти Проект наказу МОЗ по реєстрації зарплата Окремі частини досьє позаштатні експерти Після реєстраційний нагляд
 Із висновків Комісії, створеною Указом Президента від 24. 08 р. № 396 У системі МОЗ України процедуру державної реєстрації проходять шість основних видів медичної продукції: лікарські засоби, медичні імунобіологічні препарати, біологічно активні добавки, вироби медичного призначення, медична техніка та дезінфікуючі речовини. Найбільш розвиненою є нормативна база, яка регламентує державну реєстрацію лікарських засобів – визнана кращою серед країн СНД. Так, досить чітко виписано процедури прийняття та розгляду реєстраційних матеріалів, підстав для призначання додаткових доклінічних і клінічних випробувань та механізмів їх проведення, передреєстраційного контролю якості, дотримання прав інтелектуальної власності, забезпечення конфіденційності матеріалів. Водночас система державної реєстрації решти видів медичної продукції відрізняється недосконалістю нормативної бази, яка створює численні передумови до корупційних проявів. При цьому запроваджені механізми державної реєстрації цих видів медичної продукції створюють передумови до потрапляння в обіг МІБП, виробів медичного призначення, БАД та дезінфектантів, які створюють загрозу життю та здоров’ю населення
Із висновків Комісії, створеною Указом Президента від 24. 08 р. № 396 У системі МОЗ України процедуру державної реєстрації проходять шість основних видів медичної продукції: лікарські засоби, медичні імунобіологічні препарати, біологічно активні добавки, вироби медичного призначення, медична техніка та дезінфікуючі речовини. Найбільш розвиненою є нормативна база, яка регламентує державну реєстрацію лікарських засобів – визнана кращою серед країн СНД. Так, досить чітко виписано процедури прийняття та розгляду реєстраційних матеріалів, підстав для призначання додаткових доклінічних і клінічних випробувань та механізмів їх проведення, передреєстраційного контролю якості, дотримання прав інтелектуальної власності, забезпечення конфіденційності матеріалів. Водночас система державної реєстрації решти видів медичної продукції відрізняється недосконалістю нормативної бази, яка створює численні передумови до корупційних проявів. При цьому запроваджені механізми державної реєстрації цих видів медичної продукції створюють передумови до потрапляння в обіг МІБП, виробів медичного призначення, БАД та дезінфектантів, які створюють загрозу життю та здоров’ю населення
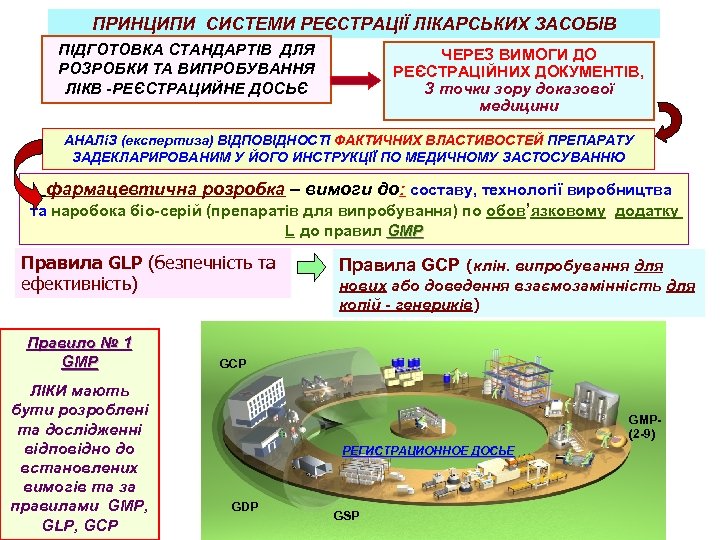 ПРИНЦИПИ СИСТЕМИ РЕЄСТРАЦІЇ ЛІКАРСЬКИХ ЗАСОБІВ ПІДГОТОВКА СТАНДАРТІВ ДЛЯ РОЗРОБКИ ТА ВИПРОБУВАННЯ ЛІКВ -РЕЄСТРАЦИЙНЕ ДОСЬЄ ЧЕРЕЗ ВИМОГИ ДО РЕЄСТРАЦІЙНИХ ДОКУМЕНТІВ, З точки зору доказової медицини АНАЛіЗ (експертиза) ВІДПОВІДНОСТІ ФАКТИЧНИХ ВЛАСТИВОСТЕЙ ПРЕПАРАТУ ЗАДЕКЛАРИРОВАНИМ У ЙОГО ИНСТРУКЦІЇ ПО МЕДИЧНОМУ ЗАСТОСУВАННЮ фармацевтична розробка – вимоги до: составу, технології виробництва та наробока біо-серій (препаратів для випробування) по обов’язковому додатку L до правил GMP Правила GLP (безпечність та ефективність) Правило № 1 GMP ЛІКИ мають бути розроблені та дослідженні відповідно до встановлених вимогів та за правилами GMP, GLP, GCP Правила GCP (клін. випробування для нових або доведення взаємозамінність для копій - генериків) GСP GMP(2 -9) РЕГИСТРАЦИОННОЕ ДОСЬЕ GDP GSP
ПРИНЦИПИ СИСТЕМИ РЕЄСТРАЦІЇ ЛІКАРСЬКИХ ЗАСОБІВ ПІДГОТОВКА СТАНДАРТІВ ДЛЯ РОЗРОБКИ ТА ВИПРОБУВАННЯ ЛІКВ -РЕЄСТРАЦИЙНЕ ДОСЬЄ ЧЕРЕЗ ВИМОГИ ДО РЕЄСТРАЦІЙНИХ ДОКУМЕНТІВ, З точки зору доказової медицини АНАЛіЗ (експертиза) ВІДПОВІДНОСТІ ФАКТИЧНИХ ВЛАСТИВОСТЕЙ ПРЕПАРАТУ ЗАДЕКЛАРИРОВАНИМ У ЙОГО ИНСТРУКЦІЇ ПО МЕДИЧНОМУ ЗАСТОСУВАННЮ фармацевтична розробка – вимоги до: составу, технології виробництва та наробока біо-серій (препаратів для випробування) по обов’язковому додатку L до правил GMP Правила GLP (безпечність та ефективність) Правило № 1 GMP ЛІКИ мають бути розроблені та дослідженні відповідно до встановлених вимогів та за правилами GMP, GLP, GCP Правила GCP (клін. випробування для нових або доведення взаємозамінність для копій - генериків) GСP GMP(2 -9) РЕГИСТРАЦИОННОЕ ДОСЬЕ GDP GSP
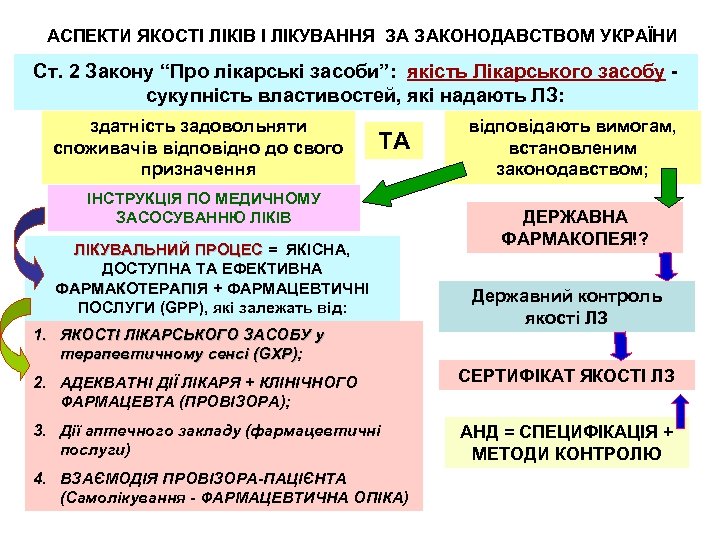 АСПЕКТИ ЯКОСТІ ЛІКІВ І ЛІКУВАННЯ ЗА ЗАКОНОДАВСТВОМ УКРАЇНИ Ст. 2 Закону “Про лікарські засоби”: якість Лікарського засобу сукупність властивостей, які надають ЛЗ: здатність задовольняти споживачів відповідно до свого призначення ТА ІНСТРУКЦІЯ ПО МЕДИЧНОМУ ЗАСОСУВАННЮ ЛІКІВ ЛІКУВАЛЬНИЙ ПРОЦЕС = ЯКІСНА, ДОСТУПНА ТА ЕФЕКТИВНА ФАРМАКОТЕРАПІЯ + ФАРМАЦЕВТИЧНІ ПОСЛУГИ (GPP), які залежать від: 1. ЯКОСТІ ЛІКАРСЬКОГО ЗАСОБУ у терапевтичному сенсі (GXP); GXP) відповідають вимогам, встановленим законодавством; ДЕРЖАВНА ФАРМАКОПЕЯ!? Державний контроль якості ЛЗ 2. АДЕКВАТНІ ДІЇ ЛІКАРЯ + КЛІНІЧНОГО ФАРМАЦЕВТА (ПРОВІЗОРА); СЕРТИФІКАТ ЯКОСТІ ЛЗ 3. Дії аптечного закладу (фармацевтичні послуги) АНД = СПЕЦИФІКАЦІЯ + МЕТОДИ КОНТРОЛЮ 4. ВЗАЄМОДІЯ ПРОВІЗОРА-ПАЦІЄНТА (Самолікування - ФАРМАЦЕВТИЧНА ОПІКА)
АСПЕКТИ ЯКОСТІ ЛІКІВ І ЛІКУВАННЯ ЗА ЗАКОНОДАВСТВОМ УКРАЇНИ Ст. 2 Закону “Про лікарські засоби”: якість Лікарського засобу сукупність властивостей, які надають ЛЗ: здатність задовольняти споживачів відповідно до свого призначення ТА ІНСТРУКЦІЯ ПО МЕДИЧНОМУ ЗАСОСУВАННЮ ЛІКІВ ЛІКУВАЛЬНИЙ ПРОЦЕС = ЯКІСНА, ДОСТУПНА ТА ЕФЕКТИВНА ФАРМАКОТЕРАПІЯ + ФАРМАЦЕВТИЧНІ ПОСЛУГИ (GPP), які залежать від: 1. ЯКОСТІ ЛІКАРСЬКОГО ЗАСОБУ у терапевтичному сенсі (GXP); GXP) відповідають вимогам, встановленим законодавством; ДЕРЖАВНА ФАРМАКОПЕЯ!? Державний контроль якості ЛЗ 2. АДЕКВАТНІ ДІЇ ЛІКАРЯ + КЛІНІЧНОГО ФАРМАЦЕВТА (ПРОВІЗОРА); СЕРТИФІКАТ ЯКОСТІ ЛЗ 3. Дії аптечного закладу (фармацевтичні послуги) АНД = СПЕЦИФІКАЦІЯ + МЕТОДИ КОНТРОЛЮ 4. ВЗАЄМОДІЯ ПРОВІЗОРА-ПАЦІЄНТА (Самолікування - ФАРМАЦЕВТИЧНА ОПІКА)
 ПРИНЦИПЫ СИСТЕМЫ РЕГИСТРАЦИИ ЛЕКАРСТВ ЧЕРЕЗ ТРЕБОВАНИЯ К РЕГИСТРАЦИОННЫМ ДОКУМЕНТАМ, с точки зрения доказательной медицины Приказ МЗ № 500/2006; № 339/2007; № 95/2009 ПОДГОТОВКА СТАНДАРТОВ ДЛЯ РОЗРАБОТКИ И ИСПЫТАНИЯМ ЛЕКАРСТВ – ОСНОВА РЕГИСТРАЦИОННОГО ДОСЬЕ Розработка лекарства фармацевтическая розработка – требования к: составу, технологии производства и наработка био-серий (препарата для испытания) – требования приложения L правил GMP Приказ МЗ № 944/2009 Доклинические испытания Приказы МЗ № 373/2005; № 66/2006; № 560/2006; № 81/2007; № 245/2007; № 690/2009 Приказ МЗ № 190/2006; № 663/2009 Клинические испытания Испытания на биоэквивалентность Правила GLP (безопасность и эффективность) Правила GCP (клин. испытания для новых или доказательство взаимозаменяемости для копий - генериков) АНАЛИЗ (экспертиза) СООТВЕТСВИЯ ФАКТИЧЕСКИХ СВОЙСТВ ПРЕПАРАТА ЗАДЕКЛАРИРОВАНЫМ В ЕГО ИНСТРУКЦИИ ПО МЕДИЦИНСКОМУ ПРИМИНЕНИЮ Приказ МЗ № 426/2005; № 95/2006; № 543/2008; № 754/2008; 543/2008; № 423/2009 ТРЕБОВАНИЯ приказов МЗ соответствуют документам ВОЗ и директивам ЕС: Директивы 2001/83/ЕС и 2003/63/EC Европейского Союза WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations, 2006
ПРИНЦИПЫ СИСТЕМЫ РЕГИСТРАЦИИ ЛЕКАРСТВ ЧЕРЕЗ ТРЕБОВАНИЯ К РЕГИСТРАЦИОННЫМ ДОКУМЕНТАМ, с точки зрения доказательной медицины Приказ МЗ № 500/2006; № 339/2007; № 95/2009 ПОДГОТОВКА СТАНДАРТОВ ДЛЯ РОЗРАБОТКИ И ИСПЫТАНИЯМ ЛЕКАРСТВ – ОСНОВА РЕГИСТРАЦИОННОГО ДОСЬЕ Розработка лекарства фармацевтическая розработка – требования к: составу, технологии производства и наработка био-серий (препарата для испытания) – требования приложения L правил GMP Приказ МЗ № 944/2009 Доклинические испытания Приказы МЗ № 373/2005; № 66/2006; № 560/2006; № 81/2007; № 245/2007; № 690/2009 Приказ МЗ № 190/2006; № 663/2009 Клинические испытания Испытания на биоэквивалентность Правила GLP (безопасность и эффективность) Правила GCP (клин. испытания для новых или доказательство взаимозаменяемости для копий - генериков) АНАЛИЗ (экспертиза) СООТВЕТСВИЯ ФАКТИЧЕСКИХ СВОЙСТВ ПРЕПАРАТА ЗАДЕКЛАРИРОВАНЫМ В ЕГО ИНСТРУКЦИИ ПО МЕДИЦИНСКОМУ ПРИМИНЕНИЮ Приказ МЗ № 426/2005; № 95/2006; № 543/2008; № 754/2008; 543/2008; № 423/2009 ТРЕБОВАНИЯ приказов МЗ соответствуют документам ВОЗ и директивам ЕС: Директивы 2001/83/ЕС и 2003/63/EC Европейского Союза WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations, 2006
 Э кв и в а л е н т н о с т ь РУКОВОДСТВА ПО ПРОВЕДЕНИЮ ОЦЕНКИ ЭКВИВАЛЕНТНОСТИ • FDA – Guidance for Industry. Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based an a Biopharmaceutics Classification System, 2000 • Guideline for Bioequivalence Studies for Different Strengths of Oral Solid Dosage Forms, Japan, 14. 02. 2000 • CPMP/EWP/QWP/1401/98 Note for Guidance on Investigation of Bioavailability and Bioequivalence, 2001 the • WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations, 2006 • Приказ МЗ Украины от 17. 04. 2007 г. № 190
Э кв и в а л е н т н о с т ь РУКОВОДСТВА ПО ПРОВЕДЕНИЮ ОЦЕНКИ ЭКВИВАЛЕНТНОСТИ • FDA – Guidance for Industry. Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based an a Biopharmaceutics Classification System, 2000 • Guideline for Bioequivalence Studies for Different Strengths of Oral Solid Dosage Forms, Japan, 14. 02. 2000 • CPMP/EWP/QWP/1401/98 Note for Guidance on Investigation of Bioavailability and Bioequivalence, 2001 the • WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations, 2006 • Приказ МЗ Украины от 17. 04. 2007 г. № 190
 ИССЛЕДОВАНИЯ БИОЭКВИВАЛЕНТНОСТИ (КАК И ДРУГИЕ ДОКЛИНИЧЕСКИЕ ИЛИ КЛИНИЧЕСКИЕ) НИЧЕГО НЕ ЗНАЧАТ, ЕСЛИ: • для исследуемого препарата (био-серии) не био-серии известны результаты теста «растворение» ; • исследуемый препарат — лабораторный и его качество не спроецировано в масштабах промышленного производства; • имеются непостоянные производственные особенности в составе продукта, технологии его получения влияющей на фармако-кинетику; Д-р Лембит Раго, штаб-квартира ВОЗ (Женева) 2 -3 ноября 2006, (Киев) • отсутствуют регуляторные требования или контроль изменения качества в постмаркетиновый период.
ИССЛЕДОВАНИЯ БИОЭКВИВАЛЕНТНОСТИ (КАК И ДРУГИЕ ДОКЛИНИЧЕСКИЕ ИЛИ КЛИНИЧЕСКИЕ) НИЧЕГО НЕ ЗНАЧАТ, ЕСЛИ: • для исследуемого препарата (био-серии) не био-серии известны результаты теста «растворение» ; • исследуемый препарат — лабораторный и его качество не спроецировано в масштабах промышленного производства; • имеются непостоянные производственные особенности в составе продукта, технологии его получения влияющей на фармако-кинетику; Д-р Лембит Раго, штаб-квартира ВОЗ (Женева) 2 -3 ноября 2006, (Киев) • отсутствуют регуляторные требования или контроль изменения качества в постмаркетиновый период.
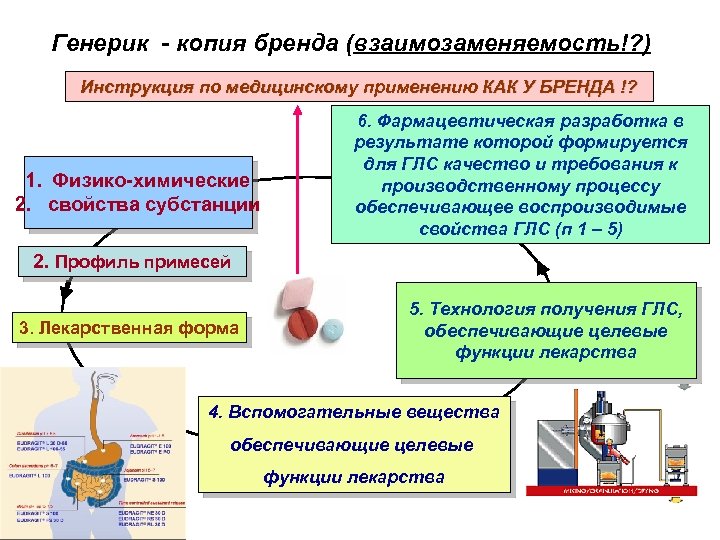 Генерик - копия бренда (взаимозаменяемость!? ) Инструкция по медицинскому применению КАК У БРЕНДА !? 1. Физико-химические 2. свойства субстанции 6. Фармацевтическая разработка в результате которой формируется для ГЛС качество и требования к производственному процессу обеспечивающее воспроизводимые свойства ГЛС (п 1 – 5) 2. Профиль примесей 3. Лекарственная форма 5. Технология получения ГЛС, обеспечивающие целевые функции лекарства 4. Вспомогательные вещества обеспечивающие целевые функции лекарства
Генерик - копия бренда (взаимозаменяемость!? ) Инструкция по медицинскому применению КАК У БРЕНДА !? 1. Физико-химические 2. свойства субстанции 6. Фармацевтическая разработка в результате которой формируется для ГЛС качество и требования к производственному процессу обеспечивающее воспроизводимые свойства ГЛС (п 1 – 5) 2. Профиль примесей 3. Лекарственная форма 5. Технология получения ГЛС, обеспечивающие целевые функции лекарства 4. Вспомогательные вещества обеспечивающие целевые функции лекарства
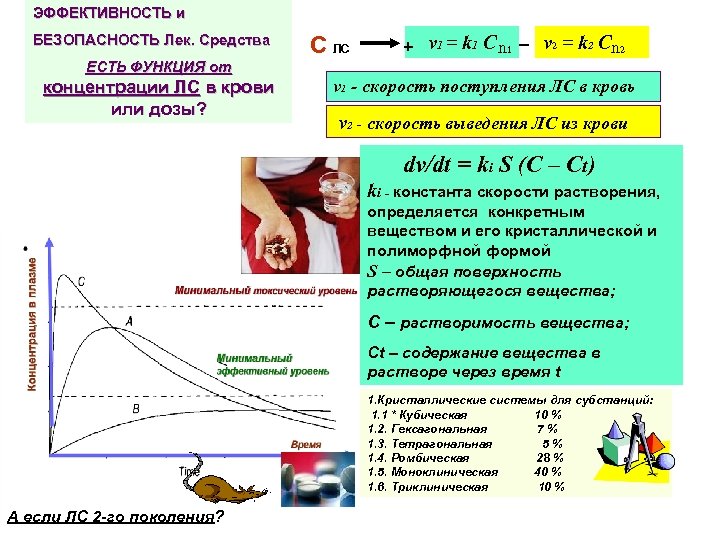 ЭФФЕКТИВНОСТЬ и БЕЗОПАСНОСТЬ Лек. Средства С ЛС _ v 2 = k 2 C n 2 + v 1 = k 1 C n 1 ЕСТЬ ФУНКЦИЯ от концентрации ЛС в крови или дозы? v 1 - скорость поступления ЛС в кровь v 2 - скорость выведения ЛС из крови dv/dt = ki S (C – Ct) ki - константа скорости растворения, определяется конкретным веществом и его кристаллической и полиморфной формой S – общая поверхность растворяющегося вещества; C – растворимость вещества; Ct – содержание вещества в растворе через время t 1. Кристаллические системы для субстанций: 1. 1 * Кубическая 10 % 1. 2. Гексагональная 7% 1. 3. Тетрагональная 5% 1. 4. Ромбическая 28 % 1. 5. Моноклиническая 40 % 1. 6. Триклиническая 10 % А если ЛС 2 -го поколения?
ЭФФЕКТИВНОСТЬ и БЕЗОПАСНОСТЬ Лек. Средства С ЛС _ v 2 = k 2 C n 2 + v 1 = k 1 C n 1 ЕСТЬ ФУНКЦИЯ от концентрации ЛС в крови или дозы? v 1 - скорость поступления ЛС в кровь v 2 - скорость выведения ЛС из крови dv/dt = ki S (C – Ct) ki - константа скорости растворения, определяется конкретным веществом и его кристаллической и полиморфной формой S – общая поверхность растворяющегося вещества; C – растворимость вещества; Ct – содержание вещества в растворе через время t 1. Кристаллические системы для субстанций: 1. 1 * Кубическая 10 % 1. 2. Гексагональная 7% 1. 3. Тетрагональная 5% 1. 4. Ромбическая 28 % 1. 5. Моноклиническая 40 % 1. 6. Триклиническая 10 % А если ЛС 2 -го поколения?
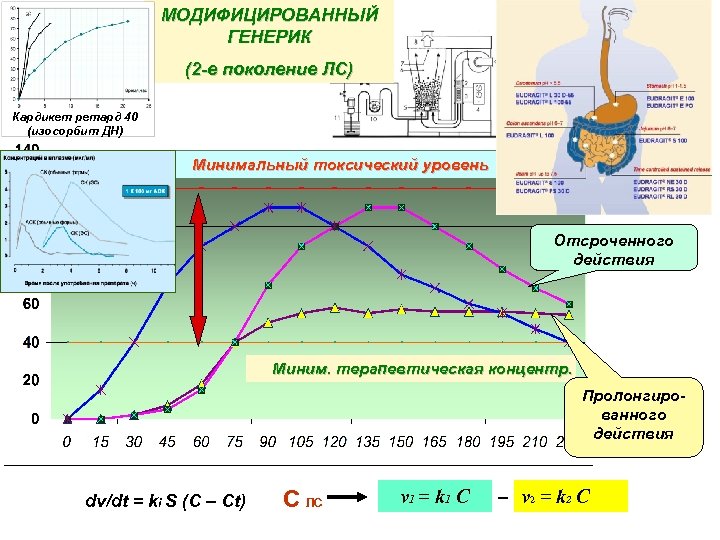 МОДИФИЦИРОВАННЫЙ ГЕНЕРИК (2 -е поколение ЛС) Кардикет ретард 40 (изосорбит ДН) Минимальный токсический уровень Отсроченного действия Миним. терапевтическая концентр. Пролонгированного действия dv/dt = ki S (C – Ct) С ЛС v 1 = k 1 C _ v 2 = k 2 C
МОДИФИЦИРОВАННЫЙ ГЕНЕРИК (2 -е поколение ЛС) Кардикет ретард 40 (изосорбит ДН) Минимальный токсический уровень Отсроченного действия Миним. терапевтическая концентр. Пролонгированного действия dv/dt = ki S (C – Ct) С ЛС v 1 = k 1 C _ v 2 = k 2 C
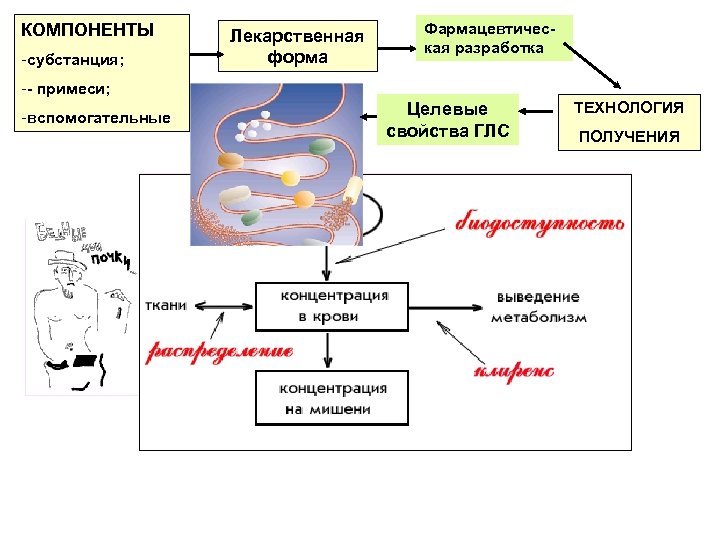 КОМПОНЕНТЫ -субстанция; Лекарственная форма Фармацевтическая разработка -- примеси; -вспомогательные Целевые свойства ГЛС ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ
КОМПОНЕНТЫ -субстанция; Лекарственная форма Фармацевтическая разработка -- примеси; -вспомогательные Целевые свойства ГЛС ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ
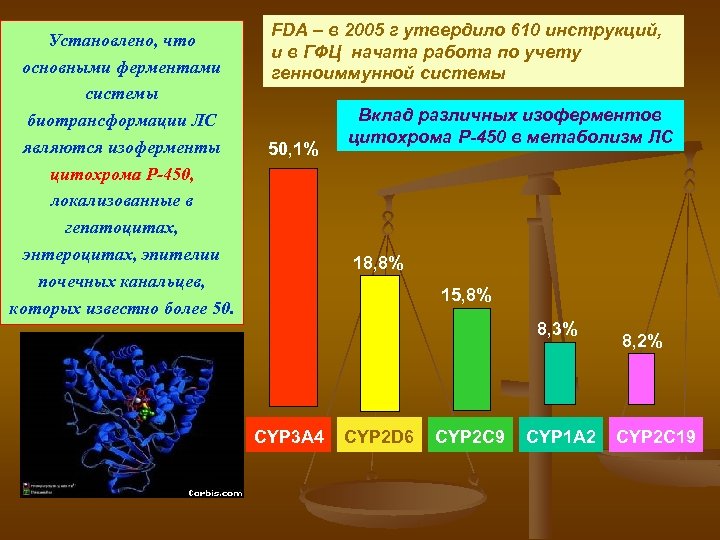 Установлено, что основными ферментами системы биотрансформации ЛС являются изоферменты цитохрома Р-450, Р-450 локализованные в гепатоцитах, энтероцитах, эпителии почечных канальцев, которых известно более 50. FDA – в 2005 г утвердило 610 инструкций, и в ГФЦ начата работа по учету генноиммунной системы 50, 1% Вклад различных изоферментов цитохрома Р-450 в метаболизм ЛС 18, 8% 15, 8% 8, 3% CYP 3 A 4 CYP 2 D 6 CYP 2 C 9 CYP 1 A 2 8, 2% CYP 2 C 19
Установлено, что основными ферментами системы биотрансформации ЛС являются изоферменты цитохрома Р-450, Р-450 локализованные в гепатоцитах, энтероцитах, эпителии почечных канальцев, которых известно более 50. FDA – в 2005 г утвердило 610 инструкций, и в ГФЦ начата работа по учету генноиммунной системы 50, 1% Вклад различных изоферментов цитохрома Р-450 в метаболизм ЛС 18, 8% 15, 8% 8, 3% CYP 3 A 4 CYP 2 D 6 CYP 2 C 9 CYP 1 A 2 8, 2% CYP 2 C 19
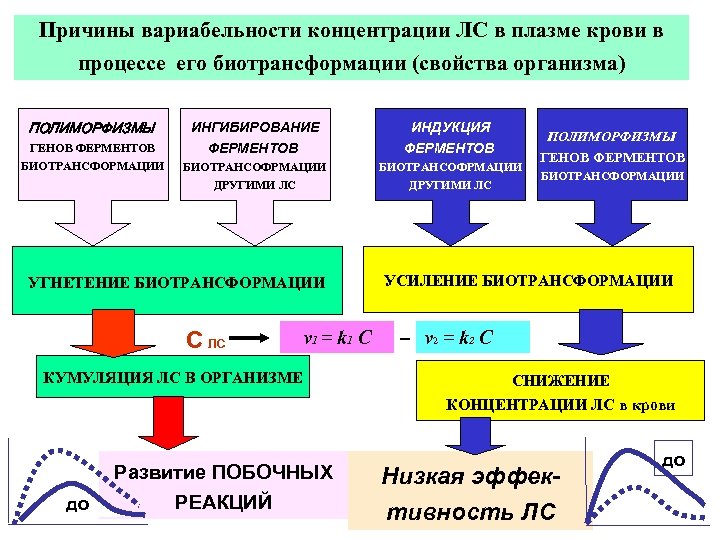 Причины вариабельности концентрации ЛС в плазме крови в процессе его биотрансформации (свойства организма) ПОЛИМОРФИЗМЫ ГЕНОВ ФЕРМЕНТОВ БИОТРАНСФОРМАЦИИ ИНГИБИРОВАНИЕ ФЕРМЕНТОВ ИНДУКЦИЯ ФЕРМЕНТОВ БИОТРАНСОФРМАЦИИ ДРУГИМИ ЛС УГНЕТЕНИЕ БИОТРАНСФОРМАЦИИ С ЛС v 1 = k 1 C КУМУЛЯЦИЯ ЛС В ОРГАНИЗМЕ до Развитие ПОБОЧНЫХ РЕАКЦИЙ ПОЛИМОРФИЗМЫ ГЕНОВ ФЕРМЕНТОВ БИОТРАНСФОРМАЦИИ УСИЛЕНИЕ БИОТРАНСФОРМАЦИИ _ v 2 = k 2 C СНИЖЕНИЕ КОНЦЕНТРАЦИИ ЛС в крови Низкая эффективность ЛС до
Причины вариабельности концентрации ЛС в плазме крови в процессе его биотрансформации (свойства организма) ПОЛИМОРФИЗМЫ ГЕНОВ ФЕРМЕНТОВ БИОТРАНСФОРМАЦИИ ИНГИБИРОВАНИЕ ФЕРМЕНТОВ ИНДУКЦИЯ ФЕРМЕНТОВ БИОТРАНСОФРМАЦИИ ДРУГИМИ ЛС УГНЕТЕНИЕ БИОТРАНСФОРМАЦИИ С ЛС v 1 = k 1 C КУМУЛЯЦИЯ ЛС В ОРГАНИЗМЕ до Развитие ПОБОЧНЫХ РЕАКЦИЙ ПОЛИМОРФИЗМЫ ГЕНОВ ФЕРМЕНТОВ БИОТРАНСФОРМАЦИИ УСИЛЕНИЕ БИОТРАНСФОРМАЦИИ _ v 2 = k 2 C СНИЖЕНИЕ КОНЦЕНТРАЦИИ ЛС в крови Низкая эффективность ЛС до
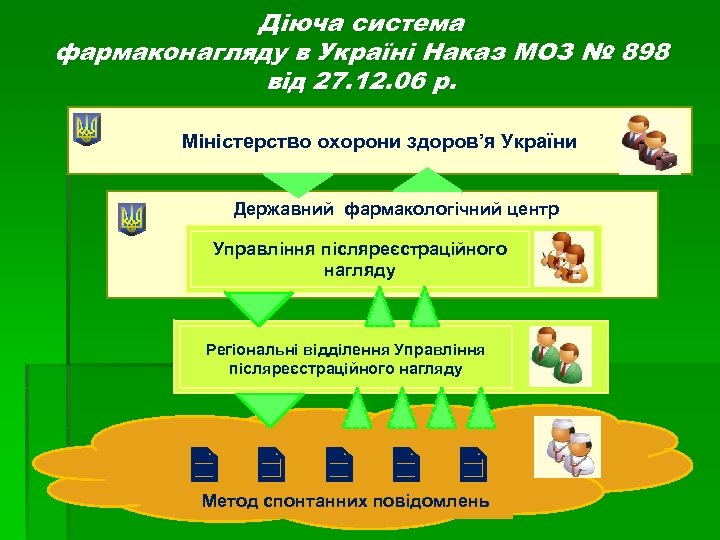 Діюча система фармаконагляду в Україні Наказ МОЗ № 898 від 27. 12. 06 р. Міністерство охорони здоров’я України Державний фармакологічний центр Управління післяреєстраційного нагляду Регіональні відділення Управління післяреєстраційного нагляду Метод спонтанних повідомлень
Діюча система фармаконагляду в Україні Наказ МОЗ № 898 від 27. 12. 06 р. Міністерство охорони здоров’я України Державний фармакологічний центр Управління післяреєстраційного нагляду Регіональні відділення Управління післяреєстраційного нагляду Метод спонтанних повідомлень
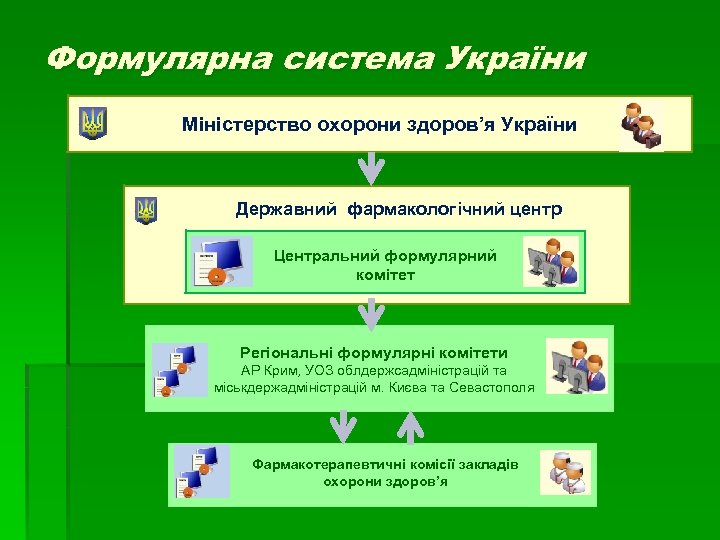 Формулярна система України Міністерство охорони здоров’я України Державний фармакологічний центр Центральний формулярний комітет Регіональні формулярні комітети АР Крим, УОЗ облдержсадміністрацій та міськдержадміністрацій м. Києва та Севастополя Фармакотерапевтичні комісії закладів охорони здоров’я
Формулярна система України Міністерство охорони здоров’я України Державний фармакологічний центр Центральний формулярний комітет Регіональні формулярні комітети АР Крим, УОЗ облдержсадміністрацій та міськдержадміністрацій м. Києва та Севастополя Фармакотерапевтичні комісії закладів охорони здоров’я
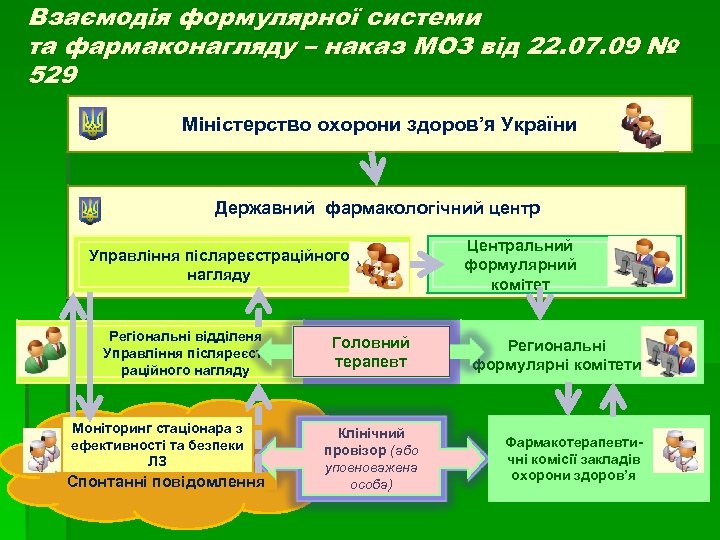 Взаємодія формулярної системи та фармаконагляду – наказ МОЗ від 22. 07. 09 № 529 Міністерство охорони здоров’я України Державний фармакологічний центр Управління післяреєстраційного нагляду Регіональні відділеня Управління післяреєстраційного нагляду Моніторинг стаціонара з ефективності та безпеки ЛЗ Спонтанні повідомлення Головний терапевт Клінічний провізор (або уповноважена особа) Центральний формулярний комітет Региональні формулярні комітети Фармакотерапевтичні комісії закладів охорони здоров’я
Взаємодія формулярної системи та фармаконагляду – наказ МОЗ від 22. 07. 09 № 529 Міністерство охорони здоров’я України Державний фармакологічний центр Управління післяреєстраційного нагляду Регіональні відділеня Управління післяреєстраційного нагляду Моніторинг стаціонара з ефективності та безпеки ЛЗ Спонтанні повідомлення Головний терапевт Клінічний провізор (або уповноважена особа) Центральний формулярний комітет Региональні формулярні комітети Фармакотерапевтичні комісії закладів охорони здоров’я
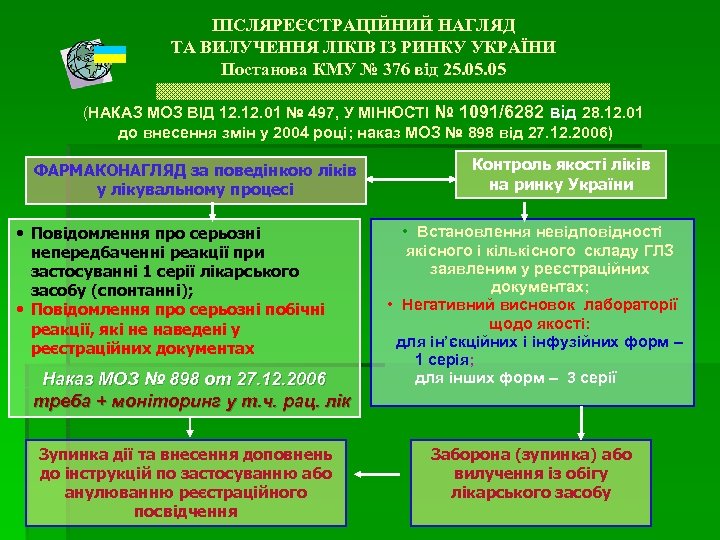 ПІСЛЯРЕЄСТРАЦІЙНИЙ НАГЛЯД ТА ВИЛУЧЕННЯ ЛІКІВ ІЗ РИНКУ УКРАЇНИ Постанова КМУ № 376 від 25. 05 (НАКАЗ МОЗ ВІД 12. 01 № 497, У МІНЮСТІ № 1091/6282 від 28. 12. 01 до внесення змін у 2004 році; наказ МОЗ № 898 від 27. 12. 2006) ФАРМАКОНАГЛЯД за поведінкою ліків у лікувальному процесі • Повідомлення про серьозні непередбаченні реакції при застосуванні 1 серії лікарського засобу (спонтанні); • Повідомлення про серьозні побічні реакції, які не наведені у реєстраційних документах Наказ МОЗ № 898 от 27. 12. 2006 треба + моніторинг у т. ч. рац. лік Зупинка дії та внесення доповнень до інструкцій по застосуванню або анулюванню реєстраційного посвідчення Контроль якості ліків на ринку України • Встановлення невідповідності якісного і кількісного складу ГЛЗ заявленим у реєстраційних документах; • Негативний висновок лабораторії щодо якості: для ін’єкційних і інфузійних форм – 1 серія; для інших форм – 3 серії Заборона (зупинка) або вилучення із обігу лікарського засобу
ПІСЛЯРЕЄСТРАЦІЙНИЙ НАГЛЯД ТА ВИЛУЧЕННЯ ЛІКІВ ІЗ РИНКУ УКРАЇНИ Постанова КМУ № 376 від 25. 05 (НАКАЗ МОЗ ВІД 12. 01 № 497, У МІНЮСТІ № 1091/6282 від 28. 12. 01 до внесення змін у 2004 році; наказ МОЗ № 898 від 27. 12. 2006) ФАРМАКОНАГЛЯД за поведінкою ліків у лікувальному процесі • Повідомлення про серьозні непередбаченні реакції при застосуванні 1 серії лікарського засобу (спонтанні); • Повідомлення про серьозні побічні реакції, які не наведені у реєстраційних документах Наказ МОЗ № 898 от 27. 12. 2006 треба + моніторинг у т. ч. рац. лік Зупинка дії та внесення доповнень до інструкцій по застосуванню або анулюванню реєстраційного посвідчення Контроль якості ліків на ринку України • Встановлення невідповідності якісного і кількісного складу ГЛЗ заявленим у реєстраційних документах; • Негативний висновок лабораторії щодо якості: для ін’єкційних і інфузійних форм – 1 серія; для інших форм – 3 серії Заборона (зупинка) або вилучення із обігу лікарського засобу
 Дякую за увагу!
Дякую за увагу!
