7 персонал помещения оборудование производство.ppt
- Количество слайдов: 130
 Правила GMP
Правила GMP
 Персонал
Персонал
 ГОСТ Р 52249 -2009 ПРАВИЛА ПРОИЗВОДСТВА 52249 -2009 И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ Персонал • Общие положения. Обязанности • Обучение • Гигиена
ГОСТ Р 52249 -2009 ПРАВИЛА ПРОИЗВОДСТВА 52249 -2009 И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ Персонал • Общие положения. Обязанности • Обучение • Гигиена
 Требования Правил GMP ü Предприятие должно быть укомплектовано достаточным количеством персонала, имеющим необходимую квалификацию и практический опыт работы. ü Должностные обязанности отдельного сотрудника не должны быть слишком большими и приводить к его чрезмерной загруженности, отрицательно влияющей на качество продукции. ü Предприятие должно иметь четкую организационную структуру. ü Служебные обязанности руководящих работников должны быть изложены в должностных инструкциях.
Требования Правил GMP ü Предприятие должно быть укомплектовано достаточным количеством персонала, имеющим необходимую квалификацию и практический опыт работы. ü Должностные обязанности отдельного сотрудника не должны быть слишком большими и приводить к его чрезмерной загруженности, отрицательно влияющей на качество продукции. ü Предприятие должно иметь четкую организационную структуру. ü Служебные обязанности руководящих работников должны быть изложены в должностных инструкциях.
 Требования Правил GMP ü Руководители должны иметь достаточные полномочия для выполнения своих функций. Их полномочия могут быть переданы официально назначенным заместителям, имеющим достаточную квалификацию. ü Следует исключить неоправданное дублирование ответственности сотрудников, связанной с выполнением требований настоящего стандарта, и не допускать случаев, когда какие либо функции ни за кем не закреплены.
Требования Правил GMP ü Руководители должны иметь достаточные полномочия для выполнения своих функций. Их полномочия могут быть переданы официально назначенным заместителям, имеющим достаточную квалификацию. ü Следует исключить неоправданное дублирование ответственности сотрудников, связанной с выполнением требований настоящего стандарта, и не допускать случаев, когда какие либо функции ни за кем не закреплены.
 Руководящие работники Руководитель производства Руководитель службы контроля качества Уполномоченное лицо Требования GMP ØРуководители производства, руководитель службы (отдела) контроля качества и Уполномоченное лицо (лица) должны быть заняты на предприятии полный рабочий день. ØРуководители производства и службы (отдела) контроля качества должны быть независимыми друг от друга.
Руководящие работники Руководитель производства Руководитель службы контроля качества Уполномоченное лицо Требования GMP ØРуководители производства, руководитель службы (отдела) контроля качества и Уполномоченное лицо (лица) должны быть заняты на предприятии полный рабочий день. ØРуководители производства и службы (отдела) контроля качества должны быть независимыми друг от друга.
 Обязанности Уполномоченных лиц q В отношении лекарственных средств, выпущенных в Российской Федерации, уполномоченное лицо должно гарантировать, что каждая серия продукции была изготовлена и проверена в соответствии с установленными требованиями. q В отношении лекарственных средств, выпущенных за пределами Российской Федерации, уполномоченное лицо должно гарантировать, что импортируемая серия продукции прошла проверку в порядке, установленном в Российской Федерации. q До выдачи разрешения на выпуск лекарственных средств в сферу обращения уполномоченное лицо должно документально подтвердить, что каждая серия продукции удовлетворяет требованиям, установленным при государственной регистрации.
Обязанности Уполномоченных лиц q В отношении лекарственных средств, выпущенных в Российской Федерации, уполномоченное лицо должно гарантировать, что каждая серия продукции была изготовлена и проверена в соответствии с установленными требованиями. q В отношении лекарственных средств, выпущенных за пределами Российской Федерации, уполномоченное лицо должно гарантировать, что импортируемая серия продукции прошла проверку в порядке, установленном в Российской Федерации. q До выдачи разрешения на выпуск лекарственных средств в сферу обращения уполномоченное лицо должно документально подтвердить, что каждая серия продукции удовлетворяет требованиям, установленным при государственной регистрации.
 Обязанности руководителя производства q Организация производства и хранения продукции в соответствии с документацией с целью обеспечения требуемого качества. q Утверждение инструкций, связанных с производственным процессом, и обеспечение их точного выполнения. q Контроль рассмотрения и подписания всех производственных протоколов лицами, имеющими необходимые полномочия, до передачи их в службу контроля качества. q Контроль работы подведомственного подразделения, содержания помещений, эксплуатации и технического обслуживания оборудования. q Контроль проведения работ по аттестации (испытаниям). q Организация первичного и последующего обучения производственного персонала.
Обязанности руководителя производства q Организация производства и хранения продукции в соответствии с документацией с целью обеспечения требуемого качества. q Утверждение инструкций, связанных с производственным процессом, и обеспечение их точного выполнения. q Контроль рассмотрения и подписания всех производственных протоколов лицами, имеющими необходимые полномочия, до передачи их в службу контроля качества. q Контроль работы подведомственного подразделения, содержания помещений, эксплуатации и технического обслуживания оборудования. q Контроль проведения работ по аттестации (испытаниям). q Организация первичного и последующего обучения производственного персонала.
 Обязанности руководителя службы контроля качества q Утверждение или отклонение исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции. q Оценка протоколов на серию продукции. q Проведение необходимых испытаний. q Утверждение спецификаций, инструкций по отбору проб, методик испытаний и других методик по контролю качества. q Допуск к работе специалистов аналитиков, работающих по контракту, и контроль их деятельности. q Контроль работы подведомственного отдела, обслуживания его помещений и оборудования. q Контроль проведения аттестации (испытаний). q Организация первичного и последующего обучения персонала подведомственного отдела с учетом особенностей производства.
Обязанности руководителя службы контроля качества q Утверждение или отклонение исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции. q Оценка протоколов на серию продукции. q Проведение необходимых испытаний. q Утверждение спецификаций, инструкций по отбору проб, методик испытаний и других методик по контролю качества. q Допуск к работе специалистов аналитиков, работающих по контракту, и контроль их деятельности. q Контроль работы подведомственного отдела, обслуживания его помещений и оборудования. q Контроль проведения аттестации (испытаний). q Организация первичного и последующего обучения персонала подведомственного отдела с учетом особенностей производства.
 Руководители производства и отдела контроля качества имеют ряд совместных обязанностей, относящихся к обеспечению качества продукции. v утверждение письменных инструкций, методик и других документов, в т. ч. внесение изменений в них; v контроль производственной среды; v контроль за соблюдением правил производственной гигиены; v аттестацию (испытания) процессов; v обучение персонала; v утверждение и контроль поставщиков исходных материалов; v утверждение и контроль производителей, работающих по контракту; v определение условий хранения материалов, продукции и контроль за их соблюдением; v хранение протоколов; v постоянный контроль соответствия требованиям настоящего стандарта; v проведение инспекций, расследований и отборов проб с целью выявления факторов, способных повлиять на качество продукции.
Руководители производства и отдела контроля качества имеют ряд совместных обязанностей, относящихся к обеспечению качества продукции. v утверждение письменных инструкций, методик и других документов, в т. ч. внесение изменений в них; v контроль производственной среды; v контроль за соблюдением правил производственной гигиены; v аттестацию (испытания) процессов; v обучение персонала; v утверждение и контроль поставщиков исходных материалов; v утверждение и контроль производителей, работающих по контракту; v определение условий хранения материалов, продукции и контроль за их соблюдением; v хранение протоколов; v постоянный контроль соответствия требованиям настоящего стандарта; v проведение инспекций, расследований и отборов проб с целью выявления факторов, способных повлиять на качество продукции.
 Обучение ü Предприятие производитель должно обеспечить обучение всех сотрудников, занятых производством или контролем качества, а также других сотрудников, деятельность которых может повлиять на качество продукции. ü Помимо базового обучения требованиям настоящего стандарта вновь принятые сотрудники должны пройти обучение в соответствии с их должностными обязанностями. Следует организовать периодическое обучение персонала и оценивать эффективность этого обучения на практике. Обучение следует проводить по программам, утвержденным руководителями производства или службы контроля качества. Протоколы обучения должны храниться на предприятии. ü Сотрудники, работающие в зонах, в которых загрязнение представляет опасность, например, в чистых зонах или в зонах работы с сильнодействующими, токсичными, инфицирующими или сенсибилизирующими веществами, должны пройти специальное обучение. ü Посетители и/или необученные сотрудники не должны допускаться в зоны, связанные с производством и контролем качества. При необходимости, они должны предварительно пройти инструктаж по правилам личной гигиены, порядку переодевания и ношению специальной одежды. За этими лицами должен быть организован тщательный контроль.
Обучение ü Предприятие производитель должно обеспечить обучение всех сотрудников, занятых производством или контролем качества, а также других сотрудников, деятельность которых может повлиять на качество продукции. ü Помимо базового обучения требованиям настоящего стандарта вновь принятые сотрудники должны пройти обучение в соответствии с их должностными обязанностями. Следует организовать периодическое обучение персонала и оценивать эффективность этого обучения на практике. Обучение следует проводить по программам, утвержденным руководителями производства или службы контроля качества. Протоколы обучения должны храниться на предприятии. ü Сотрудники, работающие в зонах, в которых загрязнение представляет опасность, например, в чистых зонах или в зонах работы с сильнодействующими, токсичными, инфицирующими или сенсибилизирующими веществами, должны пройти специальное обучение. ü Посетители и/или необученные сотрудники не должны допускаться в зоны, связанные с производством и контролем качества. При необходимости, они должны предварительно пройти инструктаж по правилам личной гигиены, порядку переодевания и ношению специальной одежды. За этими лицами должен быть организован тщательный контроль.
 Обучение На предприятии должна быть организована постоянно действующая образовательная система, которая должна охватывать всех работающих на производстве и иметь: • установочные документы (приказ руководителя предприятия об организации образовательной системы, "Положения", регламентирующие деятельность системы и ее руководителей); • ясно сформулированные цели и задачи; • программу образовательной деятельности; • четкую организационную структуру; • детально разработанную дoкyмeнтaцию; • Стандарты предприятия "Обучение персонала", "Спецификации персонала", "Аттестация персонала" (их можно объединить); • необходимые людские ресурсы; • материально техническое обеспечение.
Обучение На предприятии должна быть организована постоянно действующая образовательная система, которая должна охватывать всех работающих на производстве и иметь: • установочные документы (приказ руководителя предприятия об организации образовательной системы, "Положения", регламентирующие деятельность системы и ее руководителей); • ясно сформулированные цели и задачи; • программу образовательной деятельности; • четкую организационную структуру; • детально разработанную дoкyмeнтaцию; • Стандарты предприятия "Обучение персонала", "Спецификации персонала", "Аттестация персонала" (их можно объединить); • необходимые людские ресурсы; • материально техническое обеспечение.
 Обучение Организация образовательной системы предприятия необходима для достижения следующих целей: привлечение всего производственного персонала к активному участию в системе управления качеством; обеспечение качества продукции и контроль качества на всех этапах производственного процесса; обеспечение максимально эффективного использования оборудования, расходных продуктов и материалов; воспитание у персонала чувства ответственности; осознание каждым сотрудником, что в производстве лекарственных средств даже малейшее отклонение от установленной процедуры может обернуться для потребителя тяжелыми последствиями вплоть до смертельного исхода; обеспечение преемственности лучших традиций предприятия.
Обучение Организация образовательной системы предприятия необходима для достижения следующих целей: привлечение всего производственного персонала к активному участию в системе управления качеством; обеспечение качества продукции и контроль качества на всех этапах производственного процесса; обеспечение максимально эффективного использования оборудования, расходных продуктов и материалов; воспитание у персонала чувства ответственности; осознание каждым сотрудником, что в производстве лекарственных средств даже малейшее отклонение от установленной процедуры может обернуться для потребителя тяжелыми последствиями вплоть до смертельного исхода; обеспечение преемственности лучших традиций предприятия.
 Обучение Для образовательной системы предприятия должны быть четко определены задачи, решение которых обеспечит главное - достижение высокого уровня качества производимой продукции: формирование и структурирование образовательной системы; разработка Стандарта предприятия "Обучение персонала"; разработка образовательной составляющей в спецификации персонала (образовательные стандарты для профессиональных групп сотрудников); разработка системы сертификации сотрудников; привлечение к образовательной системе наиболее квалифицированных сотрудников, независимых экспертов и консультантов; включение в должностные инструкции ответственных сотрудников и вспомогательного персонала предписаний относительно их участия в образовательной системе; введение ответственности за уклонение от участия в образовательной системе сотрудников предприятия;
Обучение Для образовательной системы предприятия должны быть четко определены задачи, решение которых обеспечит главное - достижение высокого уровня качества производимой продукции: формирование и структурирование образовательной системы; разработка Стандарта предприятия "Обучение персонала"; разработка образовательной составляющей в спецификации персонала (образовательные стандарты для профессиональных групп сотрудников); разработка системы сертификации сотрудников; привлечение к образовательной системе наиболее квалифицированных сотрудников, независимых экспертов и консультантов; включение в должностные инструкции ответственных сотрудников и вспомогательного персонала предписаний относительно их участия в образовательной системе; введение ответственности за уклонение от участия в образовательной системе сотрудников предприятия;
 Обучение Для образовательной системы предприятия должны быть четко определены задачи, решение которых обеспечит главное - достижение высокого уровня качества производимой продукции: формирование группы преподавателей из числа наиболее опытных специалистов, имеющих склонность к образовательной деятельности; привлечение к работе профессиональных педагогов; разработка и реализация системы поощрения участников образовательной системы; разработка программ и методических пособий, тестов, контрольных вопросов и т. д. для образовательной системы; введение в должность (первичное обучение) всех принятых на работy; постоянное и непрерывное повышение квалификации всех сотрудников предприятия; разработка системы контроля "выживания" знаний; систематическое проведение самоинспекции образовательной системы; обеспечение всеми необходимыми техническими средствами.
Обучение Для образовательной системы предприятия должны быть четко определены задачи, решение которых обеспечит главное - достижение высокого уровня качества производимой продукции: формирование группы преподавателей из числа наиболее опытных специалистов, имеющих склонность к образовательной деятельности; привлечение к работе профессиональных педагогов; разработка и реализация системы поощрения участников образовательной системы; разработка программ и методических пособий, тестов, контрольных вопросов и т. д. для образовательной системы; введение в должность (первичное обучение) всех принятых на работy; постоянное и непрерывное повышение квалификации всех сотрудников предприятия; разработка системы контроля "выживания" знаний; систематическое проведение самоинспекции образовательной системы; обеспечение всеми необходимыми техническими средствами.
 Организационная структура образовательной системы предприятия
Организационная структура образовательной системы предприятия
 Обучение Одной из главных задач Отдела обеспечения качества и его Руководителя является формирование и постоянное обеспечение эффективной работы образовательной системы. Он несет персональную ответственность за организацию обучения сотрудников и состояние образовательной системы на предприятии в целом. Вместе с тем, Руководитель отдела принимает непосредственное участие в проведении образовательных мероприятий (лекции, семинары и др. ).
Обучение Одной из главных задач Отдела обеспечения качества и его Руководителя является формирование и постоянное обеспечение эффективной работы образовательной системы. Он несет персональную ответственность за организацию обучения сотрудников и состояние образовательной системы на предприятии в целом. Вместе с тем, Руководитель отдела принимает непосредственное участие в проведении образовательных мероприятий (лекции, семинары и др. ).
 Обучение Начальник отдела обеспечения качества может решать следующие задачи применительно к образовательной системе: разрабатывает структуру образовательной системы предприятия, согласовывает ее с Директором по качеству и представляет на утверждение Руководителю предприятия; вносит предложение по кандидатуре Руководителя учебно методического кабинета Заместителя начальника отдела; согласовывает "Положение об учебно методическом кабинете предприятия", "Положение о руководителе учебно методического кабинета" и другие документы предприятия, регламентиpующие работу образовательной системы, которые подаются на утверждение Генеральному директору; согласовывает документы образовательной системы, которые подлежат утверждению Директором по качеству; вносит предложения по моральному и материальному стимулированию участников образовательной системы.
Обучение Начальник отдела обеспечения качества может решать следующие задачи применительно к образовательной системе: разрабатывает структуру образовательной системы предприятия, согласовывает ее с Директором по качеству и представляет на утверждение Руководителю предприятия; вносит предложение по кандидатуре Руководителя учебно методического кабинета Заместителя начальника отдела; согласовывает "Положение об учебно методическом кабинете предприятия", "Положение о руководителе учебно методического кабинета" и другие документы предприятия, регламентиpующие работу образовательной системы, которые подаются на утверждение Генеральному директору; согласовывает документы образовательной системы, которые подлежат утверждению Директором по качеству; вносит предложения по моральному и материальному стимулированию участников образовательной системы.
 Обучение Учебные программы по контролю лекарственных средств, рекомендованные Всемирной организацией здравоохранения (ВОЗ) для последипломного обучения Вводные положения Ø Ø Ø Введение в национальную систему регламентации сферы лекарственных средств и деятельность в области фармацевтической инспекции. Причины, по которым необходимо производить оценку качества лекарственных средств, включая контроль качества в процессе производства и анализ готовых продуктов. Знакомство с законодательными документами, действующими в данной местности. Роль правительственных лабораторий контроля лекарственных средств в осуществлении программ надзора за качеством последних. Знакомство с применением региональных, национальных и международных фармакопеи; отбор требований и методов анализа, пригодных для определенного продукта. Работа аналитической лаборатории. Обязанности и ответственность аналитика. Высокоэффективная практика производства в государственных лабораториях контроля качества лекарственных средств. Эксплуатация аналитических приборов. Техника безопасности в аналитических лабораториях. Ведение документации; важность надлежащим образом документированной лабораторной работы; ведение лабораторных журналов и подготовка сертификатов анализов.
Обучение Учебные программы по контролю лекарственных средств, рекомендованные Всемирной организацией здравоохранения (ВОЗ) для последипломного обучения Вводные положения Ø Ø Ø Введение в национальную систему регламентации сферы лекарственных средств и деятельность в области фармацевтической инспекции. Причины, по которым необходимо производить оценку качества лекарственных средств, включая контроль качества в процессе производства и анализ готовых продуктов. Знакомство с законодательными документами, действующими в данной местности. Роль правительственных лабораторий контроля лекарственных средств в осуществлении программ надзора за качеством последних. Знакомство с применением региональных, национальных и международных фармакопеи; отбор требований и методов анализа, пригодных для определенного продукта. Работа аналитической лаборатории. Обязанности и ответственность аналитика. Высокоэффективная практика производства в государственных лабораториях контроля качества лекарственных средств. Эксплуатация аналитических приборов. Техника безопасности в аналитических лабораториях. Ведение документации; важность надлежащим образом документированной лабораторной работы; ведение лабораторных журналов и подготовка сертификатов анализов.
 Обучение Учебная программа по химическому контролю лекарственных средств. Общие вопросы. Проверка и калибровка простых лабораторных приборов, включая аналитические весы. Общие стандарты качества и оценка предельного содержания примесей (сульфатная зола, потеря массы при высушивании, железо, мышьяк, хлориды, сульфаты, свинец и тяжелые металлы). Анализ упаковочного материала. Подготовка реактивов для количественного анализа фармацевтических продуктов. Оценка результатов анализов и концепция статистической оценки результатов анализа. Физические тесты. Определение точки плавления и концепция смешанных точек плавления. Вязкость. Показатель преломления. Удельное оптическое вращение. Относительная плотность. Осмолярность. Азеотропная дистилляция. Гравиметрические методы (пробирочные методы). Анализ гравиметрическим методом. Потенциометрические методы. Определение р. Н. Ионоизбирательные злектроды. Титрометрические и подобные им методы (с применением как визуального, так и потенциометрического конечного определения). Кислотно основное титрование. Окислительно восстановительное титрование. Безводное титрование. Комплексометрическое титрование. Метод Карла Фишера. Полярография. Определение йодного числа. Омыление и определение кислотных чисел. Метод анализа азота по Кьельдалю. Метод сжигания кислорода. Спектрофотометрические методы. УФ видимая часть спектра. Инфракрасная спектрофотометрия. Пламенная фотометрия. Атомно абсорбционная спектрофотометрия. Флюоресценция (особенно при анализе витаминов). Хроматографические методы. Тонкослойная хроматография. Хроматография на бумаге. Хроматография на колонках. Газожидкостная хроматография. Высокоэффективная жидкостная хроматография. Электрофорез. Фармакогностическое исследование. Органолептический анализ. Микроскопическое исследование лекарственного сырья. Микрохимическая и фитохимическая оценка (алкалоиды, гликозиды, сапонины и т. д. ). Физическая оценка (зольное число, флюоресценция, содержание влаги в лекарственном сырье, экстракционное число). Физико химический и химический анализ лекарственного сырья. Исследование готовых лекарственных форм. Общие аналитические методики. Концепции биодоступности и биоэквивалентности. Дезинтеграция. Растворение. Однородность массы. Однородность содержимого фармацевтических продуктов в одноразовых дозах. Твердость и Ломкость таблеток. Анализ консервантов в парентеральных препаратах. Контроль за окрашивающими веществами, добавляемыми в таблетки и пероральные жидкие препараты. Анализ предельного содержания механических включений в паренте ральных препаратах большого объема. Оценка стабильности. Определение сроков хранения одно и много компонентных препара тов при комнатной и повышенной температуре (ускоренное старение) при различных уровнях влажности. Контроль продуктов, требующих применения ферментативных методов определения.
Обучение Учебная программа по химическому контролю лекарственных средств. Общие вопросы. Проверка и калибровка простых лабораторных приборов, включая аналитические весы. Общие стандарты качества и оценка предельного содержания примесей (сульфатная зола, потеря массы при высушивании, железо, мышьяк, хлориды, сульфаты, свинец и тяжелые металлы). Анализ упаковочного материала. Подготовка реактивов для количественного анализа фармацевтических продуктов. Оценка результатов анализов и концепция статистической оценки результатов анализа. Физические тесты. Определение точки плавления и концепция смешанных точек плавления. Вязкость. Показатель преломления. Удельное оптическое вращение. Относительная плотность. Осмолярность. Азеотропная дистилляция. Гравиметрические методы (пробирочные методы). Анализ гравиметрическим методом. Потенциометрические методы. Определение р. Н. Ионоизбирательные злектроды. Титрометрические и подобные им методы (с применением как визуального, так и потенциометрического конечного определения). Кислотно основное титрование. Окислительно восстановительное титрование. Безводное титрование. Комплексометрическое титрование. Метод Карла Фишера. Полярография. Определение йодного числа. Омыление и определение кислотных чисел. Метод анализа азота по Кьельдалю. Метод сжигания кислорода. Спектрофотометрические методы. УФ видимая часть спектра. Инфракрасная спектрофотометрия. Пламенная фотометрия. Атомно абсорбционная спектрофотометрия. Флюоресценция (особенно при анализе витаминов). Хроматографические методы. Тонкослойная хроматография. Хроматография на бумаге. Хроматография на колонках. Газожидкостная хроматография. Высокоэффективная жидкостная хроматография. Электрофорез. Фармакогностическое исследование. Органолептический анализ. Микроскопическое исследование лекарственного сырья. Микрохимическая и фитохимическая оценка (алкалоиды, гликозиды, сапонины и т. д. ). Физическая оценка (зольное число, флюоресценция, содержание влаги в лекарственном сырье, экстракционное число). Физико химический и химический анализ лекарственного сырья. Исследование готовых лекарственных форм. Общие аналитические методики. Концепции биодоступности и биоэквивалентности. Дезинтеграция. Растворение. Однородность массы. Однородность содержимого фармацевтических продуктов в одноразовых дозах. Твердость и Ломкость таблеток. Анализ консервантов в парентеральных препаратах. Контроль за окрашивающими веществами, добавляемыми в таблетки и пероральные жидкие препараты. Анализ предельного содержания механических включений в паренте ральных препаратах большого объема. Оценка стабильности. Определение сроков хранения одно и много компонентных препара тов при комнатной и повышенной температуре (ускоренное старение) при различных уровнях влажности. Контроль продуктов, требующих применения ферментативных методов определения.
 Обучение Учебная программа по микробиологическому контролю. Теоретические основы. Морфология и тонкая структура бактерий, грибков и вирусов; классификация и номенклaтуpа бактерий; культивирование микроорганизмов: потребность в определенных питательных веществах; ингpeдиенты, типы и способы пригoтoвления культуральных сред; физические условия, необходимые для роста микроорганизмов; чистые культуры и их свойства; методы выделения чистых культур; методы поддержания кулькур микроорганизмов. Воздействие физических факторов: пастеризация; стерилизация сухим нагревом, влажным нагревом, облучением и этиленоксидом; фильтрация; оценка стерильности. Воздействие химических агентов; характеристика и классификаuия дезинфицирующих веществ; их отбор и оценка. Антибиотики и другие химиотерапевтические средства; история химио терапии; классификация антибиотиков; общие химические свойства; механизм действия; антимикробный спектр; развитие устойчивости к антибиотикам. Введение в общую биометрию, включая основы расчетов вероятности и значимости. Анализ антибиотиков. Микробиологический контроль препаратов, которые в норме не должны бьпь стерильными. Документация и оценка результатов анализов. Лабораторная работа (общая микробиология). Приготовление и дозирование культуpальных сред. Стерилизация стеклянной посуды. Приготовление стерильных жидкостей в малых масштабах. Асептический пересев микробных культур. Микробиологический метод оценки эффективности вытяжного шкафа с ламинарным потоком воздуха. Подсчет микроорганизмов: чашечный метод и метод наиболее вероятного числа. Изучение морфологии микроорганизмов с помощью различных методов окращивания: окрашивание по Грамму; окрашивание спор; окрашивание капсул. Тесты на предельное содержание патогенных организмов (Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia соlle и Salmonella). о Оценка стерильности препаратов для инъекций: не содержащих ингибиторы; содержащих ингибиторы (метод мембранных фильтров). Выделение микроорганизмов из материалов, имеющихся в данной местности; хранение их; хранение эталонных микробных культур. Оценка микробного загрязнения. Оценка эффективности антимикробных консервантов. Лабораторная работа (микробиологический анализ). Анализ антибиотиков методом диффузии в агар с использованием, как маленьких (чашки Петри), так и больших чашек, с последующей обработкой результатов (включая статистический анализ): схема 2 + 2 и 3 + 3 как для больших, так и для маленьких чашек; схема латинский квадрат для больших квадратных чашек. Турбидиметрический анализ антибиотиков с уделением особого внимания плану эксперимента. Анализ витаминов с использованием, как турбидиметрических методов, так и метода диффузии в агар. Биоаутографический метод. Определение эффективности дезинфицирующих средств (коэффициент Riddle Walker).
Обучение Учебная программа по микробиологическому контролю. Теоретические основы. Морфология и тонкая структура бактерий, грибков и вирусов; классификация и номенклaтуpа бактерий; культивирование микроорганизмов: потребность в определенных питательных веществах; ингpeдиенты, типы и способы пригoтoвления культуральных сред; физические условия, необходимые для роста микроорганизмов; чистые культуры и их свойства; методы выделения чистых культур; методы поддержания кулькур микроорганизмов. Воздействие физических факторов: пастеризация; стерилизация сухим нагревом, влажным нагревом, облучением и этиленоксидом; фильтрация; оценка стерильности. Воздействие химических агентов; характеристика и классификаuия дезинфицирующих веществ; их отбор и оценка. Антибиотики и другие химиотерапевтические средства; история химио терапии; классификация антибиотиков; общие химические свойства; механизм действия; антимикробный спектр; развитие устойчивости к антибиотикам. Введение в общую биометрию, включая основы расчетов вероятности и значимости. Анализ антибиотиков. Микробиологический контроль препаратов, которые в норме не должны бьпь стерильными. Документация и оценка результатов анализов. Лабораторная работа (общая микробиология). Приготовление и дозирование культуpальных сред. Стерилизация стеклянной посуды. Приготовление стерильных жидкостей в малых масштабах. Асептический пересев микробных культур. Микробиологический метод оценки эффективности вытяжного шкафа с ламинарным потоком воздуха. Подсчет микроорганизмов: чашечный метод и метод наиболее вероятного числа. Изучение морфологии микроорганизмов с помощью различных методов окращивания: окрашивание по Грамму; окрашивание спор; окрашивание капсул. Тесты на предельное содержание патогенных организмов (Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia соlle и Salmonella). о Оценка стерильности препаратов для инъекций: не содержащих ингибиторы; содержащих ингибиторы (метод мембранных фильтров). Выделение микроорганизмов из материалов, имеющихся в данной местности; хранение их; хранение эталонных микробных культур. Оценка микробного загрязнения. Оценка эффективности антимикробных консервантов. Лабораторная работа (микробиологический анализ). Анализ антибиотиков методом диффузии в агар с использованием, как маленьких (чашки Петри), так и больших чашек, с последующей обработкой результатов (включая статистический анализ): схема 2 + 2 и 3 + 3 как для больших, так и для маленьких чашек; схема латинский квадрат для больших квадратных чашек. Турбидиметрический анализ антибиотиков с уделением особого внимания плану эксперимента. Анализ витаминов с использованием, как турбидиметрических методов, так и метода диффузии в агар. Биоаутографический метод. Определение эффективности дезинфицирующих средств (коэффициент Riddle Walker).
 Обучение Учебная программа по биологическому контролю. Теоретические основы. Общее введение в фармакологию. Абсорбция, распределение, биотрансформация и экскреция. Лекарственныe формы; различные способы применения и их влияние нa реакцию организма. Фармакологическая классификация лекарственных средств с репрезентативными примерами. Механизм действия лекарственных средств с приведением примеров: внеклеточный и внутриклеточный эффекты, мембранныe эффекты, воздействие на ферменты, воздействие на специфические рецепторы, взаимодействия. Реакции в изолированных тканях и у интактных животных; ступенчатые реакции (воздействие окситоцина на матку крыс, вазопрессина на кровяное давление кошек). Природа, источник и эффект пирогенов. Определение дозы и выбор растворителя при проведении теста на пирогены в опытах с кроликами. Введение в общую биометрию, влючая основы расчетов вероятности и значимости. Количественные реакции: минимальная летальная доза (токсичность стибоглюконата натрия), процент животных, реагирующих на различные дозы (инсулиновые пробы на мышах). Ведение записей и оценка результатов анализов. Этическая ответственность при проведении испытаний на животных и обсуждение проблемы использования альтернативных методов испытаний. Лабораторная работа Виварий: отбор, содержание лабораторных животных и уход за ними; вопросы безопасности; демонстрация и инструктирование. Пирогены: подготовка стеклянно. Й посуды, воды и растворов, не содержащих пирогенов; тест на пирогены на кроликах; проба с лизатом амебоцитов на наличие эндотоксинов (ЛАЛ тест). Тест на местное раздражение. Тест на аномальную токсичность. Tecты, проводимые на мышах. Гистаминоподобные вещества. Биоанализ. Оценка активности инсулина в опытах с мышами. Гепарин.
Обучение Учебная программа по биологическому контролю. Теоретические основы. Общее введение в фармакологию. Абсорбция, распределение, биотрансформация и экскреция. Лекарственныe формы; различные способы применения и их влияние нa реакцию организма. Фармакологическая классификация лекарственных средств с репрезентативными примерами. Механизм действия лекарственных средств с приведением примеров: внеклеточный и внутриклеточный эффекты, мембранныe эффекты, воздействие на ферменты, воздействие на специфические рецепторы, взаимодействия. Реакции в изолированных тканях и у интактных животных; ступенчатые реакции (воздействие окситоцина на матку крыс, вазопрессина на кровяное давление кошек). Природа, источник и эффект пирогенов. Определение дозы и выбор растворителя при проведении теста на пирогены в опытах с кроликами. Введение в общую биометрию, влючая основы расчетов вероятности и значимости. Количественные реакции: минимальная летальная доза (токсичность стибоглюконата натрия), процент животных, реагирующих на различные дозы (инсулиновые пробы на мышах). Ведение записей и оценка результатов анализов. Этическая ответственность при проведении испытаний на животных и обсуждение проблемы использования альтернативных методов испытаний. Лабораторная работа Виварий: отбор, содержание лабораторных животных и уход за ними; вопросы безопасности; демонстрация и инструктирование. Пирогены: подготовка стеклянно. Й посуды, воды и растворов, не содержащих пирогенов; тест на пирогены на кроликах; проба с лизатом амебоцитов на наличие эндотоксинов (ЛАЛ тест). Тест на местное раздражение. Тест на аномальную токсичность. Tecты, проводимые на мышах. Гистаминоподобные вещества. Биоанализ. Оценка активности инсулина в опытах с мышами. Гепарин.
 Обучение В образовательной системе предприятия используются следующие виды обучения: q начальное обучение; q введение в должность; q плановое обучение в соответствии с общей образовательной программой предприятия; q экстремальное обучение; q специальное обучение; q индивидуальное (инициативное, факультативное) обучение; q обучение на базе факультетов повышения квалификации ВУЗов; q участие в профессиональных съездах, конференциях, симпозиумах, выставках и т. д.
Обучение В образовательной системе предприятия используются следующие виды обучения: q начальное обучение; q введение в должность; q плановое обучение в соответствии с общей образовательной программой предприятия; q экстремальное обучение; q специальное обучение; q индивидуальное (инициативное, факультативное) обучение; q обучение на базе факультетов повышения квалификации ВУЗов; q участие в профессиональных съездах, конференциях, симпозиумах, выставках и т. д.
 Обучение На предприятии должна быть разработана Программа первичного обучения (для сотрудников вновь принятых на работу). Она включает в себя § все аспекты предполагаемой деятельности лица принимаемого на работу, § изучение документов, регламентирующих • соответствующий вид деятельности, • обеспечение качества, • правила производственной санитарии и гигиены, • техники безопасности и • другие правила, установленные для сотрудников предприятия. Необходимо иметь СОП "Организация первичного обучения персонала"
Обучение На предприятии должна быть разработана Программа первичного обучения (для сотрудников вновь принятых на работу). Она включает в себя § все аспекты предполагаемой деятельности лица принимаемого на работу, § изучение документов, регламентирующих • соответствующий вид деятельности, • обеспечение качества, • правила производственной санитарии и гигиены, • техники безопасности и • другие правила, установленные для сотрудников предприятия. Необходимо иметь СОП "Организация первичного обучения персонала"
 Обучение Введение в должность является завершающим элементом программы первичного обучения для сотрудников, вновь принятых на работу. Процедуру "введения" в должность проводит непосредственный руководитель принятого на работу сотрудника в соответствии с инструкцией: СОП "Введение в должность". Затем он путем собеседования и проверки практических навыков устанавливает степень готовности и только после этого допускает к самостоятельной работе. При этом сотрудник должен быть ознакомлен: § с производственным участком в целом; § с рабочим местом и объемом производственных операций; § с должностной инструкцией; § со смежными производственными операциями; § с документацией предприятия нормирующей предполагаемую деятельность сотрудника на рабочем месте, прежде всего со стандартными операционными процедурами (СОП); § с сотрудниками производственного участка; § с правилами внутреннего распорядка на производстве и производственном участке; § правилами охрaны труда и техники безопасности; § правилами санитарии и гигиены на производственном участке.
Обучение Введение в должность является завершающим элементом программы первичного обучения для сотрудников, вновь принятых на работу. Процедуру "введения" в должность проводит непосредственный руководитель принятого на работу сотрудника в соответствии с инструкцией: СОП "Введение в должность". Затем он путем собеседования и проверки практических навыков устанавливает степень готовности и только после этого допускает к самостоятельной работе. При этом сотрудник должен быть ознакомлен: § с производственным участком в целом; § с рабочим местом и объемом производственных операций; § с должностной инструкцией; § со смежными производственными операциями; § с документацией предприятия нормирующей предполагаемую деятельность сотрудника на рабочем месте, прежде всего со стандартными операционными процедурами (СОП); § с сотрудниками производственного участка; § с правилами внутреннего распорядка на производстве и производственном участке; § правилами охрaны труда и техники безопасности; § правилами санитарии и гигиены на производственном участке.
 Обучение Плановое обучение это основная форма работы в образовательной системе предприятия. Оно проводится по графику в соответствии с планом, coглaсовaнным отделом обеспечения качества с учетом потребности производственных подразделений. Экстренное обучение является внеплановым и организуется по мере необходимости, например, при возникновении на каком либо производственном участке повторяющейся нештатной ситуации. Оно назначается по инициативе руководителя производственного участка, отдела обеспечения качества, ОКК или распоряжением Директора по качеству. К обучению привлекаются отдельные сотрудники, в работе которых выявлены отступления от установленного стандарта, или весь персонал производственного участка, если ошибки повлекли за собой снижение качества выпускаемого про дукта, остановку оборудования или аварию. Обучение должен проводить Руководитель или один из наиболее опытных специалистов структурного подразделения. В каждом отдельном случае составляется специальная проrpамма обучения на основе рекомендаций Комиссии по разбору не стандартных ситуаций. Экстренное обучение проводят не позднее срока, указанного Комиссией в рекомендациях по устранению ошибок. На предприятии необходимо иметь СОП "Организация и проведение экстренного обучения персонала".
Обучение Плановое обучение это основная форма работы в образовательной системе предприятия. Оно проводится по графику в соответствии с планом, coглaсовaнным отделом обеспечения качества с учетом потребности производственных подразделений. Экстренное обучение является внеплановым и организуется по мере необходимости, например, при возникновении на каком либо производственном участке повторяющейся нештатной ситуации. Оно назначается по инициативе руководителя производственного участка, отдела обеспечения качества, ОКК или распоряжением Директора по качеству. К обучению привлекаются отдельные сотрудники, в работе которых выявлены отступления от установленного стандарта, или весь персонал производственного участка, если ошибки повлекли за собой снижение качества выпускаемого про дукта, остановку оборудования или аварию. Обучение должен проводить Руководитель или один из наиболее опытных специалистов структурного подразделения. В каждом отдельном случае составляется специальная проrpамма обучения на основе рекомендаций Комиссии по разбору не стандартных ситуаций. Экстренное обучение проводят не позднее срока, указанного Комиссией в рекомендациях по устранению ошибок. На предприятии необходимо иметь СОП "Организация и проведение экстренного обучения персонала".
 Обучение Специальное обучение проводится, как правило, индивидуально при возникновении производственной необходимости, которая может возникнуть, например, в следующих ситуациях: • установка нового или дополнительного оборудования; • внедрение новых методик или технологических приемов; • введение новых форм рабочих документов; • внесение изменений в СОП для конкретного рабочего места; • изменение схем движения материальных потоков, если это влияет на процесс в работе конкретного исполнителя и т. д. В каждом отдельном случае Руководителем структурного подразделения по принадлежности составляется Программа специального обучения, которая согласовывается с Начальником отдела обеспечения качества и утверждается Директором по качеству. Специальное обучение обычно проводится руководителями структурных подразделений и производственных участков, работа которых непосредственно связана с вводимыми изменениями. При установке нового оборудования или внедрении новых технологий обучение проводят в специальных учебных центрах или на рабочем месте с приглашением инструктора. В таком случае Руководитель производственного подразделения должен ознакомиться с программой обучения и согласовать учебный план. На предприятии необходимо иметь СОП "Организация и проведение специального обучения персонала".
Обучение Специальное обучение проводится, как правило, индивидуально при возникновении производственной необходимости, которая может возникнуть, например, в следующих ситуациях: • установка нового или дополнительного оборудования; • внедрение новых методик или технологических приемов; • введение новых форм рабочих документов; • внесение изменений в СОП для конкретного рабочего места; • изменение схем движения материальных потоков, если это влияет на процесс в работе конкретного исполнителя и т. д. В каждом отдельном случае Руководителем структурного подразделения по принадлежности составляется Программа специального обучения, которая согласовывается с Начальником отдела обеспечения качества и утверждается Директором по качеству. Специальное обучение обычно проводится руководителями структурных подразделений и производственных участков, работа которых непосредственно связана с вводимыми изменениями. При установке нового оборудования или внедрении новых технологий обучение проводят в специальных учебных центрах или на рабочем месте с приглашением инструктора. В таком случае Руководитель производственного подразделения должен ознакомиться с программой обучения и согласовать учебный план. На предприятии необходимо иметь СОП "Организация и проведение специального обучения персонала".
 ГОСТ Р 52249 -2009 ПРАВИЛА ПРОИЗВОДСТВА 52249 -2009 И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ Гигиена персонала ü ü ü На предприятии должны быть разработаны правила личной гигиены персонала с учетом особенностей конкретного производства. Правила должны содержать инструкции, регламентирующие требования к состоянию здоровья, соблюдению гигиены и порядку ношения одежды. Все лица, принимаемые на работу, должны проходить медицинский осмотр. На предприятии должны быть инструкции с перечнем показателей состояния здоровья, которые могут оказать влияние на качество продукции. Лица с инфекционными заболеваниями и повреждениями на открытых участках тела не допускаются к производству лекарственных средств. Одежда входящего в производственные помещения должна соответствовать назначению этого помещения. В производственных и складских зонах запрещаются курение, прием пищи или питье, жевание резинки, а также хранение пищевых продуктов, напитков, табачных изделий и личных лекарственных средств. Не допускается любая деятельность, нарушающая правила гигиены в производственных помещениях или других местах, которая может оказать отрицательное влияние на качество продукции. Непосредственный контакт операторов с открытой продукцией или любыми деталями оборудования, контактирующими с продукцией, не допускается.
ГОСТ Р 52249 -2009 ПРАВИЛА ПРОИЗВОДСТВА 52249 -2009 И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ Гигиена персонала ü ü ü На предприятии должны быть разработаны правила личной гигиены персонала с учетом особенностей конкретного производства. Правила должны содержать инструкции, регламентирующие требования к состоянию здоровья, соблюдению гигиены и порядку ношения одежды. Все лица, принимаемые на работу, должны проходить медицинский осмотр. На предприятии должны быть инструкции с перечнем показателей состояния здоровья, которые могут оказать влияние на качество продукции. Лица с инфекционными заболеваниями и повреждениями на открытых участках тела не допускаются к производству лекарственных средств. Одежда входящего в производственные помещения должна соответствовать назначению этого помещения. В производственных и складских зонах запрещаются курение, прием пищи или питье, жевание резинки, а также хранение пищевых продуктов, напитков, табачных изделий и личных лекарственных средств. Не допускается любая деятельность, нарушающая правила гигиены в производственных помещениях или других местах, которая может оказать отрицательное влияние на качество продукции. Непосредственный контакт операторов с открытой продукцией или любыми деталями оборудования, контактирующими с продукцией, не допускается.
 ГОСТ Р 52249 -2009 Приложение 1. Производство стерильных лекарственных 52249 -2009 средств q В чистых зонах должно находиться минимально необходимое количество персонала. Это особенно важно для асептического производства. Проверки и контрольные операции следует, по возможности, проводить, находясь за пределами чистых зон. q Весь персонал (в т. ч. персонал, занятый очисткой и техническим обслуживанием), работающий в таких зонах, должен проходить систематическое обучение по вопросам производства стерильных продуктов, включая гигиену и основы микробиологии. Следует обратить особое внимание на инструктаж и контроль за работниками, не прошедшими такого обучения, но которым необходимо входить в чистую зону (например, лицам, занятым в строительстве или техническом обслуживании). q Не допускается вход в зоны стерильного производства персонала, работающего с материалами из тканей животных или культурами микроорганизмов, которые не используются в текущем технологическом процессе, за исключением особых случаев, при которых необходимо соблюдение специальных инструкций для входа в эти зоны.
ГОСТ Р 52249 -2009 Приложение 1. Производство стерильных лекарственных 52249 -2009 средств q В чистых зонах должно находиться минимально необходимое количество персонала. Это особенно важно для асептического производства. Проверки и контрольные операции следует, по возможности, проводить, находясь за пределами чистых зон. q Весь персонал (в т. ч. персонал, занятый очисткой и техническим обслуживанием), работающий в таких зонах, должен проходить систематическое обучение по вопросам производства стерильных продуктов, включая гигиену и основы микробиологии. Следует обратить особое внимание на инструктаж и контроль за работниками, не прошедшими такого обучения, но которым необходимо входить в чистую зону (например, лицам, занятым в строительстве или техническом обслуживании). q Не допускается вход в зоны стерильного производства персонала, работающего с материалами из тканей животных или культурами микроорганизмов, которые не используются в текущем технологическом процессе, за исключением особых случаев, при которых необходимо соблюдение специальных инструкций для входа в эти зоны.
 ГОСТ Р 52249 -2009 Приложение 1. Производство стерильных лекарственных 52249 -2009 средств q Необходимо выполнять требования к личной гигиене и чистоте. Персонал, занятый в производстве стерильных препаратов, должен знать порядок оповещения руководства (службы качества) о любых факторах, которые могут привести к повышению уровня загрязнения сверх допустимой нормы (как по количеству, так и по разновидностям). Следует организовать контроль за состоянием здоровья персонала. Решение о мерах в отношении персонала, который может стать источником микробного загрязнения, должно приниматься специально назначенным лицом. q Переодевание и мытье следует выполнять в соответствии с инструкциями, чтобы свести к минимуму риск загрязнения одежды, предназначенной для чистых зон, и внесения загрязнения в чистые зоны. q В чистых зонах персоналу запрещается носить наручные часы и ювелирные украшения, а также применять косметику. q Одежда и ее качество должны соответствовать технологическому процессу и типу зоны. Ее нужно носить так, чтобы обеспечить защиту продукта от загрязнений.
ГОСТ Р 52249 -2009 Приложение 1. Производство стерильных лекарственных 52249 -2009 средств q Необходимо выполнять требования к личной гигиене и чистоте. Персонал, занятый в производстве стерильных препаратов, должен знать порядок оповещения руководства (службы качества) о любых факторах, которые могут привести к повышению уровня загрязнения сверх допустимой нормы (как по количеству, так и по разновидностям). Следует организовать контроль за состоянием здоровья персонала. Решение о мерах в отношении персонала, который может стать источником микробного загрязнения, должно приниматься специально назначенным лицом. q Переодевание и мытье следует выполнять в соответствии с инструкциями, чтобы свести к минимуму риск загрязнения одежды, предназначенной для чистых зон, и внесения загрязнения в чистые зоны. q В чистых зонах персоналу запрещается носить наручные часы и ювелирные украшения, а также применять косметику. q Одежда и ее качество должны соответствовать технологическому процессу и типу зоны. Ее нужно носить так, чтобы обеспечить защиту продукта от загрязнений.
 ГОСТ Р 52249 -2009 Приложение 1. Производство стерильных лекарственных 52249 -2009 средств К одежде, предназначенной для зон различных типов, предъявляются следующие требования. Зона D. Головной убор должен закрывать волосы. Борода также должна быть закрыта (специальной маской). Следует носить защитный костюм общего назначения, соответствующую обувь или бахилы, надеваемые поверх обуви. Должны быть приняты меры для предотвращения проникания любого загрязнения в чистую зону извне. Зона С. Головной убор должен закрывать волосы. Борода и усы также должны быть закрыты. Следует носить костюм (цельный или состоящий из двух частей), плотно облегающий запястья, с воротником стойкой и соответствующую обувь или бахилы. Одежда и обувь не должны выделять волокна или частицы. Зоны А и В. Головной убор должен полностью закрывать волосы, а также бороду и усы (при их наличии). Края головного убора должны быть убраны под воротник костюма. Следует носить маску, чтобы предотвратить распространение капель, стерильные, неопудренные резиновые или полимерные перчатки и стерильные (или дезинфицированные) бахилы. Нижняя часть штанин должна быть заправлена внутрь бахил, а рукава одежды — в перчатки. Защитная одежда не должна выделять волокна или частицы и должна удерживать частицы, отделяющиеся от тела. Наружная одежда не должна попадать в комнаты для переодевания, ведущие в зоны В и С. Каждый работник в зонах А и В должен быть обеспечен чистой стерильной одеждой на каждую смену. Во время работы перчатки следует регулярно дезинфицировать. Маски и перчатки следует менять, по крайней мере, каждую смену.
ГОСТ Р 52249 -2009 Приложение 1. Производство стерильных лекарственных 52249 -2009 средств К одежде, предназначенной для зон различных типов, предъявляются следующие требования. Зона D. Головной убор должен закрывать волосы. Борода также должна быть закрыта (специальной маской). Следует носить защитный костюм общего назначения, соответствующую обувь или бахилы, надеваемые поверх обуви. Должны быть приняты меры для предотвращения проникания любого загрязнения в чистую зону извне. Зона С. Головной убор должен закрывать волосы. Борода и усы также должны быть закрыты. Следует носить костюм (цельный или состоящий из двух частей), плотно облегающий запястья, с воротником стойкой и соответствующую обувь или бахилы. Одежда и обувь не должны выделять волокна или частицы. Зоны А и В. Головной убор должен полностью закрывать волосы, а также бороду и усы (при их наличии). Края головного убора должны быть убраны под воротник костюма. Следует носить маску, чтобы предотвратить распространение капель, стерильные, неопудренные резиновые или полимерные перчатки и стерильные (или дезинфицированные) бахилы. Нижняя часть штанин должна быть заправлена внутрь бахил, а рукава одежды — в перчатки. Защитная одежда не должна выделять волокна или частицы и должна удерживать частицы, отделяющиеся от тела. Наружная одежда не должна попадать в комнаты для переодевания, ведущие в зоны В и С. Каждый работник в зонах А и В должен быть обеспечен чистой стерильной одеждой на каждую смену. Во время работы перчатки следует регулярно дезинфицировать. Маски и перчатки следует менять, по крайней мере, каждую смену.
 Помещения
Помещения
 Производственная зона
Производственная зона
 Для минимизации риска для здоровья людей из-за перекрестных загрязнений при производстве некоторых лекарственных средств, таких как сенсибилизирующие вещества (например, пенициллины) или биологические препараты (например, из живых микроорганизмов), следует предусмотреть специальные и изолированные технические средства (помещения, оборудование, средства обслуживания и др. ). В одних и тех же помещениях не допускается производство отдельных видов антибиотиков, некоторых гормонов, цитотоксинов, сильнодействующих лекарственных средств и продукции немедицинского назначения. В исключительных случаях производство таких препаратов допускается в одних помещениях при разделении циклов производства по времени, с соблюдением специальных мер предосторожности и проведением необходимой аттестации (валидации). В зданиях, используемых для производства лекарственных средств, не допускается производство ядов технического назначения (пестицидов и гербицидов).
Для минимизации риска для здоровья людей из-за перекрестных загрязнений при производстве некоторых лекарственных средств, таких как сенсибилизирующие вещества (например, пенициллины) или биологические препараты (например, из живых микроорганизмов), следует предусмотреть специальные и изолированные технические средства (помещения, оборудование, средства обслуживания и др. ). В одних и тех же помещениях не допускается производство отдельных видов антибиотиков, некоторых гормонов, цитотоксинов, сильнодействующих лекарственных средств и продукции немедицинского назначения. В исключительных случаях производство таких препаратов допускается в одних помещениях при разделении циклов производства по времени, с соблюдением специальных мер предосторожности и проведением необходимой аттестации (валидации). В зданиях, используемых для производства лекарственных средств, не допускается производство ядов технического назначения (пестицидов и гербицидов).
 Планировочные решения помещений по возможности должны соответствовать логической последовательности производственных операций и обеспечивать выполнение требований к чистоте. Планировочные решения рабочих зон и зон хранения внутри производства должны обеспечивать последовательное и логичное размещение оборудования и материалов, сводить к минимуму риск перепутывания различных лекарственных средств или их компонентов, перекрестного загрязнения и ошибочного выполнения или пропуска любых операций по производству или контролю. Если исходные и первичные упаковочные материалы, промежуточные или нерасфасованные продукты подвергаются воздействию окружающей среды, внутренние поверхности помещений (стены, пол и потолок) должны быть гладкими, не иметь открытых соединений и трещин, не выделять частиц и должны обеспечивать возможность беспрепятственной и эффективной уборки, а также, при необходимости, дезинфекции.
Планировочные решения помещений по возможности должны соответствовать логической последовательности производственных операций и обеспечивать выполнение требований к чистоте. Планировочные решения рабочих зон и зон хранения внутри производства должны обеспечивать последовательное и логичное размещение оборудования и материалов, сводить к минимуму риск перепутывания различных лекарственных средств или их компонентов, перекрестного загрязнения и ошибочного выполнения или пропуска любых операций по производству или контролю. Если исходные и первичные упаковочные материалы, промежуточные или нерасфасованные продукты подвергаются воздействию окружающей среды, внутренние поверхности помещений (стены, пол и потолок) должны быть гладкими, не иметь открытых соединений и трещин, не выделять частиц и должны обеспечивать возможность беспрепятственной и эффективной уборки, а также, при необходимости, дезинфекции.
 Конструкция и размещение труб, осветительных приборов, оборудования вентиляции и т. п. не должны иметь мест, труднодоступных для очистки. По возможности их обслуживание должно осуществляться с внешней стороны производственных помещений. Трубопроводы для стоков (канализация) должны иметь необходимые размеры и быть оборудованы устройствами, предотвращающими обратный поток. Следует избегать открытых желобов. При необходимости они должны быть неглубокими для удобства очистки и дезинфекции. В производственных зонах, в зависимости от выпускаемой продукции, выполняемых операций и требований к окружающей среде, следует предусматривать эффективную систему вентиляции с обеспечением требуемой температуры и, при необходимости, влажности воздуха и его фильтрации. Исходные материалы взвешивают, как правило, в специально оборудованных для этого помещениях.
Конструкция и размещение труб, осветительных приборов, оборудования вентиляции и т. п. не должны иметь мест, труднодоступных для очистки. По возможности их обслуживание должно осуществляться с внешней стороны производственных помещений. Трубопроводы для стоков (канализация) должны иметь необходимые размеры и быть оборудованы устройствами, предотвращающими обратный поток. Следует избегать открытых желобов. При необходимости они должны быть неглубокими для удобства очистки и дезинфекции. В производственных зонах, в зависимости от выпускаемой продукции, выполняемых операций и требований к окружающей среде, следует предусматривать эффективную систему вентиляции с обеспечением требуемой температуры и, при необходимости, влажности воздуха и его фильтрации. Исходные материалы взвешивают, как правило, в специально оборудованных для этого помещениях.
 Если выполнение работы сопровождается выделением пыли (например, при отборе проб, взвешивании, смешении, производственных операциях и упаковке сухих продуктов), то необходимо предусмотреть меры по предотвращению перекрестного загрязнения и проведению очистки. При проектировании (в т. ч. разработке планировочных решений) помещений для упаковки лекарственных средств следует предусматривать специальные меры против перепутывания или перекрестного загрязнения материалов и продукции. Производственные помещения должны быть хорошо освещены, особенно в местах выполнения визуального контроля. Внутрипроизводственный контроль может проводиться в зоне производства, если это не создает помех для технологического процесса.
Если выполнение работы сопровождается выделением пыли (например, при отборе проб, взвешивании, смешении, производственных операциях и упаковке сухих продуктов), то необходимо предусмотреть меры по предотвращению перекрестного загрязнения и проведению очистки. При проектировании (в т. ч. разработке планировочных решений) помещений для упаковки лекарственных средств следует предусматривать специальные меры против перепутывания или перекрестного загрязнения материалов и продукции. Производственные помещения должны быть хорошо освещены, особенно в местах выполнения визуального контроля. Внутрипроизводственный контроль может проводиться в зоне производства, если это не создает помех для технологического процесса.
 Чистые помещения и связанные с ними контролируемые среды
Чистые помещения и связанные с ними контролируемые среды
 Международный стандарт ИСО 14644 подготовлен Техническим комитетом ИСО/ТК 209, Cleanrooms and associated controlled environments - Чистые помещения и связанные с ними контролируемые среды: - Часть 1: Классификация чистоты воздуха - Часть 2: Формы регистрации для контроля и мониторинга для обоснования непрерывного соответствия стандарту ИСО 14644 -1 - Часть 3: Метрология и методы испытаний - Часть 4: Проектирование, строительство и пуск в эксплуатацию - Часть 5: Эксплуатация - Часть 6: Термины и определения - Часть 7: Специальные устройства обеспечения чистоты.
Международный стандарт ИСО 14644 подготовлен Техническим комитетом ИСО/ТК 209, Cleanrooms and associated controlled environments - Чистые помещения и связанные с ними контролируемые среды: - Часть 1: Классификация чистоты воздуха - Часть 2: Формы регистрации для контроля и мониторинга для обоснования непрерывного соответствия стандарту ИСО 14644 -1 - Часть 3: Метрология и методы испытаний - Часть 4: Проектирование, строительство и пуск в эксплуатацию - Часть 5: Эксплуатация - Часть 6: Термины и определения - Часть 7: Специальные устройства обеспечения чистоты.
 ГОСТ Р ИСО 14644 -1 -2000 ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ ЧИСТЫЕ ПОМЕЩЕНИЯ И СВЯЗАННЫЕ С НИМИ КОНТРОЛИРУЕМЫЕ СРЕДЫ ЧАСТЬ 1 КЛАССИФИКАЦИЯ ЧИСТОТЫ ВОЗДУХА ГОССТАНДАРТ РОССИИ Москва
ГОСТ Р ИСО 14644 -1 -2000 ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ ЧИСТЫЕ ПОМЕЩЕНИЯ И СВЯЗАННЫЕ С НИМИ КОНТРОЛИРУЕМЫЕ СРЕДЫ ЧАСТЬ 1 КЛАССИФИКАЦИЯ ЧИСТОТЫ ВОЗДУХА ГОССТАНДАРТ РОССИИ Москва
 чистое помещение (cleanroom): Помещение, в котором контролируется концентрация взвешенных в воздухе частиц и которое построено и используется так, чтобы свести к минимуму поступление, выделение и удержание частиц внутри помещения, и в котором, по мере необходимости, контролируются другие параметры, например, температура, влажность и давление. чистая зона (clean zone): Определенное пространство, в котором контролируется концентрация взвешенных в воздухе частиц и которое построено и используется так, чтобы свести к минимуму поступление, выделение и удержание частиц внутри зоны, и в котором, по мере необходимости, контролируются другие параметры, например, температура, влажность и давление. класс чистоты (classification): Уровень чистоты по взвешенным в воздухе частицам, применимый к чистому помещению или чистой зоне, выраженный в терминах «класс N ИСО» , который определяет максимально допустимые концентрации (в частицах на кубометр воздуха) для рассматриваемых размеров частиц.
чистое помещение (cleanroom): Помещение, в котором контролируется концентрация взвешенных в воздухе частиц и которое построено и используется так, чтобы свести к минимуму поступление, выделение и удержание частиц внутри помещения, и в котором, по мере необходимости, контролируются другие параметры, например, температура, влажность и давление. чистая зона (clean zone): Определенное пространство, в котором контролируется концентрация взвешенных в воздухе частиц и которое построено и используется так, чтобы свести к минимуму поступление, выделение и удержание частиц внутри зоны, и в котором, по мере необходимости, контролируются другие параметры, например, температура, влажность и давление. класс чистоты (classification): Уровень чистоты по взвешенным в воздухе частицам, применимый к чистому помещению или чистой зоне, выраженный в терминах «класс N ИСО» , который определяет максимально допустимые концентрации (в частицах на кубометр воздуха) для рассматриваемых размеров частиц.
 Настоящий стандарт устанавливает классификацию чистоты воздуха в чистых помещениях и связанных с ними контролируемых средах только по концентрации взвешенных в воздухе частиц (аэрозолей). Для целей классификации рассматриваются только аэродисперсные системы (множества частиц), имеющие распределения с ограниченными снизу размерами частиц (предельными значениями) от 0, 1 до 5 мкм. Настоящий стандарт не дает классификацию аэродисперсных систем (множеств), размеры частиц которых находятся вне установленного диапазона (от 0, 1 до 5, 0 мкм). Настоящий стандарт не может быть использован для характеристики физической, химической, радиологической природы аэрозолей, а также жизнеспособных частиц.
Настоящий стандарт устанавливает классификацию чистоты воздуха в чистых помещениях и связанных с ними контролируемых средах только по концентрации взвешенных в воздухе частиц (аэрозолей). Для целей классификации рассматриваются только аэродисперсные системы (множества частиц), имеющие распределения с ограниченными снизу размерами частиц (предельными значениями) от 0, 1 до 5 мкм. Настоящий стандарт не дает классификацию аэродисперсных систем (множеств), размеры частиц которых находятся вне установленного диапазона (от 0, 1 до 5, 0 мкм). Настоящий стандарт не может быть использован для характеристики физической, химической, радиологической природы аэрозолей, а также жизнеспособных частиц.
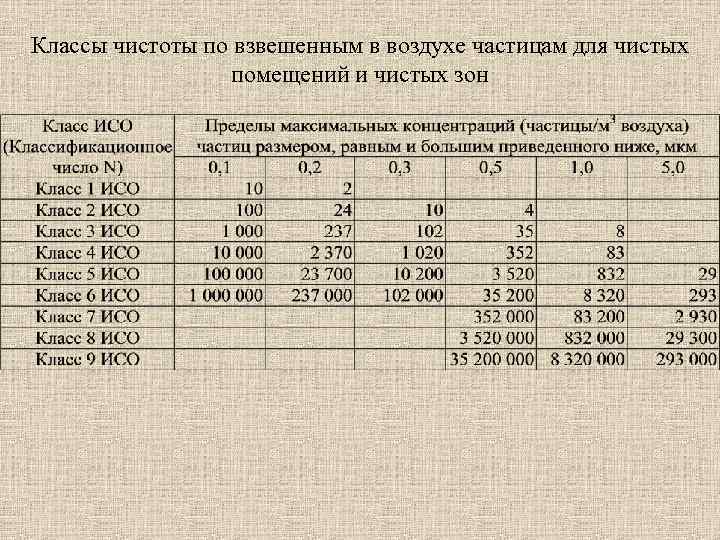 Классы чистоты по взвешенным в воздухе частицам для чистых помещений и чистых зон
Классы чистоты по взвешенным в воздухе частицам для чистых помещений и чистых зон
 Графическое представление пределов концентрации для принятых классов ИСО
Графическое представление пределов концентрации для принятых классов ИСО
 Состояния чистого помещения (Occupancy states) построенное (as-built): Состояние, в котором система чистых помещений завершена, все обслуживающие системы подключены, но отсутствует производственное оборудование, материалы и персонал. оснащенное (at-rest): Состояние, в котором система чистых помещений укомплектована оборудованием и отлажена в соответствии с соглашением между Заказчиком и Исполнителем, но персонал отсутствует. эксплуатируемое (operational): Состояние, в котором система чистых помещений функционирует установленным образом, с установленной численностью персонала, работающего в соответствии с документацией. состояние «построенное» может применяться к недавно построенным или недавно реконструированным чистым помещениям или чистым зонам. После испытания в состоянии «построенное» дальнейшие испытания должны выполняться по согласованию в состояниях «оснащенное» или «эксплуатируемое» ,
Состояния чистого помещения (Occupancy states) построенное (as-built): Состояние, в котором система чистых помещений завершена, все обслуживающие системы подключены, но отсутствует производственное оборудование, материалы и персонал. оснащенное (at-rest): Состояние, в котором система чистых помещений укомплектована оборудованием и отлажена в соответствии с соглашением между Заказчиком и Исполнителем, но персонал отсутствует. эксплуатируемое (operational): Состояние, в котором система чистых помещений функционирует установленным образом, с установленной численностью персонала, работающего в соответствии с документацией. состояние «построенное» может применяться к недавно построенным или недавно реконструированным чистым помещениям или чистым зонам. После испытания в состоянии «построенное» дальнейшие испытания должны выполняться по согласованию в состояниях «оснащенное» или «эксплуатируемое» ,
 ГОСТ Р ИСО 14644 -4 -2002 ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ ЧИСТЫЕ ПОМЕЩЕНИЯ И СВЯЗАННЫЕ С НИМИ КОНТРОЛИРУЕМЫЕ СРЕДЫ ЧАСТЬ 4 ПРОЕКТИРОВАНИЕ, СТРОИТЕЛЬСТВО И ВВОД В ЭКСПЛУАТАЦИЮ ГОССТАНДАРТ РОССИИ Москва
ГОСТ Р ИСО 14644 -4 -2002 ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ ЧИСТЫЕ ПОМЕЩЕНИЯ И СВЯЗАННЫЕ С НИМИ КОНТРОЛИРУЕМЫЕ СРЕДЫ ЧАСТЬ 4 ПРОЕКТИРОВАНИЕ, СТРОИТЕЛЬСТВО И ВВОД В ЭКСПЛУАТАЦИЮ ГОССТАНДАРТ РОССИИ Москва
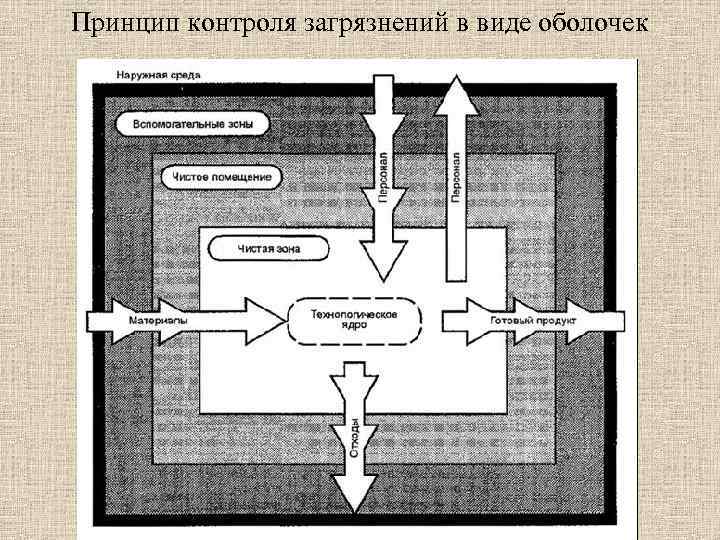 Принцип контроля загрязнений в виде оболочек
Принцип контроля загрязнений в виде оболочек
 В чистом помещении применяются однонаправленные и не однонаправленные потоки воздуха. В чистых помещениях классов 1 -5 ИСО, как правило, применяются однонаправленные потоки воздуха, а для помещений классов 6 -9 ИСО – не однонаправленные. Однонаправленный поток воздуха может быть вертикальным или горизонтальным. В обоих случаях потоки воздуха направлены от зон притока к вытяжкам, которые располагаются примерно одна против другой, чтобы обеспечивалось максимально возможное прямолинейное движение потока воздуха. При проектировании следует убедиться, что нарушения потока воздуха в технологическом ядре минимальны. В рабочей плоскости, перпендикулярной к направлению потока чистого воздуха, уровень чистоты во всех точках должен быть одинаковым. Следовательно, для процессов, происходящих горизонтально, нужен вертикальный поток, для процессов, ориентированных вертикально, - горизонтальный поток.
В чистом помещении применяются однонаправленные и не однонаправленные потоки воздуха. В чистых помещениях классов 1 -5 ИСО, как правило, применяются однонаправленные потоки воздуха, а для помещений классов 6 -9 ИСО – не однонаправленные. Однонаправленный поток воздуха может быть вертикальным или горизонтальным. В обоих случаях потоки воздуха направлены от зон притока к вытяжкам, которые располагаются примерно одна против другой, чтобы обеспечивалось максимально возможное прямолинейное движение потока воздуха. При проектировании следует убедиться, что нарушения потока воздуха в технологическом ядре минимальны. В рабочей плоскости, перпендикулярной к направлению потока чистого воздуха, уровень чистоты во всех точках должен быть одинаковым. Следовательно, для процессов, происходящих горизонтально, нужен вертикальный поток, для процессов, ориентированных вертикально, - горизонтальный поток.
 Примеры потоков воздуха в чистых помещениях а однонаправленный поток воздуха; b - неоднонаправленный поток воздуха; с смешанный поток воздуха; 1 приточный воздух; 2 вытяжной воздух
Примеры потоков воздуха в чистых помещениях а однонаправленный поток воздуха; b - неоднонаправленный поток воздуха; с смешанный поток воздуха; 1 приточный воздух; 2 вытяжной воздух
 Влияние персонала и объекта на однонаправленный поток воздуха а за счет лучшего расположения оборудования; b за счет лучшей формы оборудования и рабочего места; с за счет правильного поведения персонала; d за счет специальной организации потоков воздуха; 1 источник тепла; 2 локальный поток с повышенной скоростью
Влияние персонала и объекта на однонаправленный поток воздуха а за счет лучшего расположения оборудования; b за счет лучшей формы оборудования и рабочего места; с за счет правильного поведения персонала; d за счет специальной организации потоков воздуха; 1 источник тепла; 2 локальный поток с повышенной скоростью
 Принципы контроля загрязнений Любой контакт между продуктом и оператором/окружающей средой, перенос загрязнений в зону, защищающую процесс и/или персонал, можно предотвратить 1. аэродинамическими методами, например, формой и направлением потока воздуха или 2. применением физических барьеров: активной или пассивной изоляцией. При необходимости предусматривается очистка вытяжного воздуха с целью охраны окружающей среды.
Принципы контроля загрязнений Любой контакт между продуктом и оператором/окружающей средой, перенос загрязнений в зону, защищающую процесс и/или персонал, можно предотвратить 1. аэродинамическими методами, например, формой и направлением потока воздуха или 2. применением физических барьеров: активной или пассивной изоляцией. При необходимости предусматривается очистка вытяжного воздуха с целью охраны окружающей среды.
 Принципы организации чистых зон с использованием аэродинамических методов а защита продукта; b защита персонала и окружающей среды; с защита персонала, продукта и окружающей среды; 1 направление потока перпендикулярно к плоскости рисунка
Принципы организации чистых зон с использованием аэродинамических методов а защита продукта; b защита персонала и окружающей среды; с защита персонала, продукта и окружающей среды; 1 направление потока перпендикулярно к плоскости рисунка
 Принципы организации чистых зон с использованием физического барьера защиты продукта и персонала 1 безопасная зона для персонала; 2 зона защиты продукта
Принципы организации чистых зон с использованием физического барьера защиты продукта и персонала 1 безопасная зона для персонала; 2 зона защиты продукта
 Для защиты чистых помещений от загрязнений, вносимых из менее чистых зон, необходимо: поддерживать в чистых помещениях более высокое статическое давление по сравнению с соседними зонами; поддерживать достаточную скорость потока воздуха в месте разграничения чистой и менее чистой зоны. Обратное движение воздуха может представлять риск загрязнений; в качестве альтернативы может рассматриваться непроницаемый барьер.
Для защиты чистых помещений от загрязнений, вносимых из менее чистых зон, необходимо: поддерживать в чистых помещениях более высокое статическое давление по сравнению с соседними зонами; поддерживать достаточную скорость потока воздуха в месте разграничения чистой и менее чистой зоны. Обратное движение воздуха может представлять риск загрязнений; в качестве альтернативы может рассматриваться непроницаемый барьер.
 Примеры применения чистых помещений для асептического производства Класс Средняя Тип чистоты (по скорость потока Примеры применения частицам потока воздуха 0, 5 мкм) воздуха, м/с 5 ИСО O >0, 2 Асептическое производство 7 ИСО Н или С 8 ИСО Н или С Не Другие зоны, применяетс непосредственно я окружающие асептическое производство То же Вспомогательные зоны для асептического производства
Примеры применения чистых помещений для асептического производства Класс Средняя Тип чистоты (по скорость потока Примеры применения частицам потока воздуха 0, 5 мкм) воздуха, м/с 5 ИСО O >0, 2 Асептическое производство 7 ИСО Н или С 8 ИСО Н или С Не Другие зоны, применяетс непосредственно я окружающие асептическое производство То же Вспомогательные зоны для асептического производства

 Чистые зоны при производстве стерильных лекарственных средств подразделяются на четыре типа: А — локальная зона для проведения операций, представляющих высокий риск для качества продукции, например, зоны наполнения, укупорки, вскрытия ампул и флаконов, соединения частей оборудования в асептических условиях. Как правило, в таких зонах используются однонаправленный (ламинарный) поток воздуха, обеспечивающий в незамкнутой чистой зоне однородную скорость 0, 36— 0, 54 м/с (рекомендуемое значение). Поддержание однонаправленности воздушного потока должно быть подтверждено при аттестации (валидации). В закрытых изолирующих устройствах и перчаточных боксах можно использовать однонаправленный поток воздуха с меньшей скоростью; В — зона, непосредственно окружающая зону А и предназначенная для асептического приготовления и наполнения; С и D — чистые зоны для выполнения менее ответственных стадий производства стерильной продукции.
Чистые зоны при производстве стерильных лекарственных средств подразделяются на четыре типа: А — локальная зона для проведения операций, представляющих высокий риск для качества продукции, например, зоны наполнения, укупорки, вскрытия ампул и флаконов, соединения частей оборудования в асептических условиях. Как правило, в таких зонах используются однонаправленный (ламинарный) поток воздуха, обеспечивающий в незамкнутой чистой зоне однородную скорость 0, 36— 0, 54 м/с (рекомендуемое значение). Поддержание однонаправленности воздушного потока должно быть подтверждено при аттестации (валидации). В закрытых изолирующих устройствах и перчаточных боксах можно использовать однонаправленный поток воздуха с меньшей скоростью; В — зона, непосредственно окружающая зону А и предназначенная для асептического приготовления и наполнения; С и D — чистые зоны для выполнения менее ответственных стадий производства стерильной продукции.
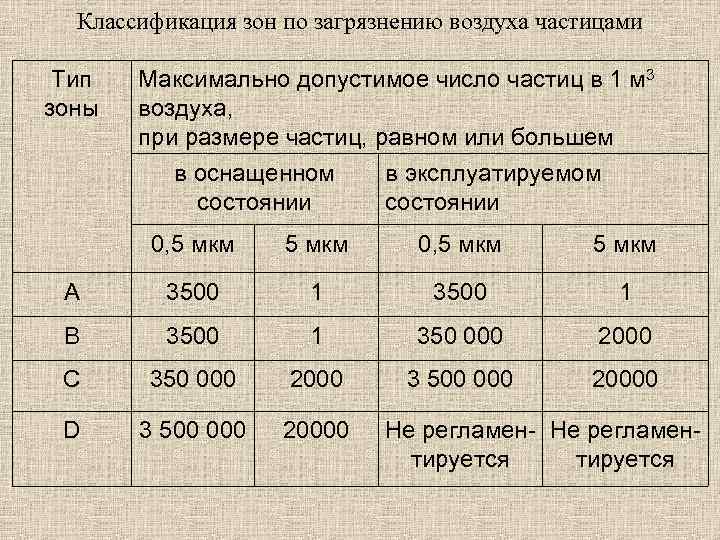 Классификация зон по загрязнению воздуха частицами Тип зоны Максимально допустимое число частиц в 1 м 3 воздуха, при размере частиц, равном или большем в оснащенном в эксплуатируемом состоянии 0, 5 мкм А 3500 1 В 3500 1 350 000 2000 С 350 000 2000 3 500 000 20000 D 3 500 000 20000 Не регламен- Не регламентируется
Классификация зон по загрязнению воздуха частицами Тип зоны Максимально допустимое число частиц в 1 м 3 воздуха, при размере частиц, равном или большем в оснащенном в эксплуатируемом состоянии 0, 5 мкм А 3500 1 В 3500 1 350 000 2000 С 350 000 2000 3 500 000 20000 D 3 500 000 20000 Не регламен- Не регламентируется
 Примеры операций для продуктов, подлежащих финишной стерилизации А Наполнение продуктом, когда его нельзя подвергать риску загрязнения. С Приготовление растворов, когда их нельзя подвергать риску загрязнения. Наполнение продуктом. D Приготовление растворов и подготовка первичной упаковки, материалов и др. для последующего наполнения. Примеры операций для асептического приготовления А Асептическое приготовление и наполнение. С Приготовление растворов, подлежащих фильтрации. D Операции с материалами после мойки.
Примеры операций для продуктов, подлежащих финишной стерилизации А Наполнение продуктом, когда его нельзя подвергать риску загрязнения. С Приготовление растворов, когда их нельзя подвергать риску загрязнения. Наполнение продуктом. D Приготовление растворов и подготовка первичной упаковки, материалов и др. для последующего наполнения. Примеры операций для асептического приготовления А Асептическое приготовление и наполнение. С Приготовление растворов, подлежащих фильтрации. D Операции с материалами после мойки.
 Рекомендуемые пределы микробного загрязнения седиментац Тип зоны в воздухе, ия на чашку диаметром 3 КОЕ /м 90 мм, КОЕ за 4 ч (Ь) контактные пластины диаметром 55 мм, КОЕ/пласти на отпечаток перчатки (5 пальцев), КОЕ/перчат ка А <1 <1 < 1 В 10 5 5 5 С 100 50 25 — D 200 100 50 —
Рекомендуемые пределы микробного загрязнения седиментац Тип зоны в воздухе, ия на чашку диаметром 3 КОЕ /м 90 мм, КОЕ за 4 ч (Ь) контактные пластины диаметром 55 мм, КОЕ/пласти на отпечаток перчатки (5 пальцев), КОЕ/перчат ка А <1 <1 < 1 В 10 5 5 5 С 100 50 25 — D 200 100 50 —
 Технология «выдувание — наполнение — герметизация» Устройство «выдувание — наполнение — герметизация» — оборудование специальной конструкции, в котором в течение одного непрерывного технологического цикла из термопластичного гранулята формируются упаковки, которые наполняются продуктом и герметизируются. Все эти операции проводятся в пределах одного автоматического комплекса. Оборудование «выдувание — наполнение — герметизация» , используемое в асептическом производстве и имеющее зону А с эффективным потоком воздуха, может быть установлено, по крайней мере, зоне С при условии использования персоналом одежды, применяемой в зонах А и В. Окружающая среда в оснащенном состоянии должна соответствовать установленным требованиям по частицам и по микроорганизмам, в эксплуатируемом состоянии — только по микроорганизмам. Оборудование «выдувание — наполнение — герметизация» , используемое в производстве продуктов, подлежащих финишной стерилизации, должно устанавливаться, по крайней мере, в зоне D.
Технология «выдувание — наполнение — герметизация» Устройство «выдувание — наполнение — герметизация» — оборудование специальной конструкции, в котором в течение одного непрерывного технологического цикла из термопластичного гранулята формируются упаковки, которые наполняются продуктом и герметизируются. Все эти операции проводятся в пределах одного автоматического комплекса. Оборудование «выдувание — наполнение — герметизация» , используемое в асептическом производстве и имеющее зону А с эффективным потоком воздуха, может быть установлено, по крайней мере, зоне С при условии использования персоналом одежды, применяемой в зонах А и В. Окружающая среда в оснащенном состоянии должна соответствовать установленным требованиям по частицам и по микроорганизмам, в эксплуатируемом состоянии — только по микроорганизмам. Оборудование «выдувание — наполнение — герметизация» , используемое в производстве продуктов, подлежащих финишной стерилизации, должно устанавливаться, по крайней мере, в зоне D.
 Продукты, подлежащие финишной стерилизации Подготовка первичной упаковки, материалов и большинства продуктов должна проводиться, по крайней мере, в зоне D, чтобы обеспечить достаточно низкий уровень загрязнения микроорганизмами и частицами перед стадиями фильтрации и стерилизации. При повышенном риске загрязнения микроорганизмами (например, когда продукт, являющийся хорошей питательной средой для микроорганизмов, должен храниться в течение длительного времени до стерилизации или он обычно готовится в открытых емкостях) технологические операции следует проводить в окружающей среде типа С. Наполнение продуктами, подлежащими финишной стерилизации, должно проводиться, по крайней мере, в зоне С. При повышенном риске загрязнения продукта от окружающей среды, например, если операции наполнения проходят медленно или упаковки имеют широкое горло, или их необходимо держать открытыми более нескольких секунд до герметизации, наполнение должно проводиться в зоне А, находящейся в окружающей среде типа С. Приготовление и наполнение мазями, кремами, суспензиями и эмульсиями перед финишной стерилизацией следует, как правило, проводить в окружающей среде типа С.
Продукты, подлежащие финишной стерилизации Подготовка первичной упаковки, материалов и большинства продуктов должна проводиться, по крайней мере, в зоне D, чтобы обеспечить достаточно низкий уровень загрязнения микроорганизмами и частицами перед стадиями фильтрации и стерилизации. При повышенном риске загрязнения микроорганизмами (например, когда продукт, являющийся хорошей питательной средой для микроорганизмов, должен храниться в течение длительного времени до стерилизации или он обычно готовится в открытых емкостях) технологические операции следует проводить в окружающей среде типа С. Наполнение продуктами, подлежащими финишной стерилизации, должно проводиться, по крайней мере, в зоне С. При повышенном риске загрязнения продукта от окружающей среды, например, если операции наполнения проходят медленно или упаковки имеют широкое горло, или их необходимо держать открытыми более нескольких секунд до герметизации, наполнение должно проводиться в зоне А, находящейся в окружающей среде типа С. Приготовление и наполнение мазями, кремами, суспензиями и эмульсиями перед финишной стерилизацией следует, как правило, проводить в окружающей среде типа С.
 Асептическое производство Операции с материалами после мойки должны проводиться, по крайней мере, в окружающей среде типа D. Операции со стерильными исходными материалами и компонентами, если на последующих стадиях процесса не предусмотрена их стерилизация или фильтрация через фильтры, удерживающие микроорганизмы, должны проводиться в зоне А, находящейся в окружающей среде типа В. Приготовление растворов, которые в ходе технологического процесса подлежат стерилизующей фильтрации, должно проводиться в зоне С. Если фильтрация не предусмотрена, приготовление материалов и продуктов должно проводиться в зоне А, которая находится в окружающей среде типа В. Операции по переработке и наполнению приготовленных в асептических условиях продуктов следует проводить в зоне А, находящейся в окружающей среде типа В. Транспортирование частично закрытых первичных упаковок, например, при лиофильной сушке, должно до завершения укупорки проводиться либо в зоне А, находящейся в окружающей среде типа В, либо в герметичных передаточных устройствах в окружающей среде типа В.
Асептическое производство Операции с материалами после мойки должны проводиться, по крайней мере, в окружающей среде типа D. Операции со стерильными исходными материалами и компонентами, если на последующих стадиях процесса не предусмотрена их стерилизация или фильтрация через фильтры, удерживающие микроорганизмы, должны проводиться в зоне А, находящейся в окружающей среде типа В. Приготовление растворов, которые в ходе технологического процесса подлежат стерилизующей фильтрации, должно проводиться в зоне С. Если фильтрация не предусмотрена, приготовление материалов и продуктов должно проводиться в зоне А, которая находится в окружающей среде типа В. Операции по переработке и наполнению приготовленных в асептических условиях продуктов следует проводить в зоне А, находящейся в окружающей среде типа В. Транспортирование частично закрытых первичных упаковок, например, при лиофильной сушке, должно до завершения укупорки проводиться либо в зоне А, находящейся в окружающей среде типа В, либо в герметичных передаточных устройствах в окружающей среде типа В.
 Зоны складирования
Зоны складирования
 Входной контроль сырья и упаковочных материалов и организация складского хозяйства
Входной контроль сырья и упаковочных материалов и организация складского хозяйства
 Входной контроль сырья, поступившего от поставщика на предприятие и предназначенного для использования в производственном процессе. часть системы обеспечения качества часть системы по обеспечению предприятия сырьем и материалами
Входной контроль сырья, поступившего от поставщика на предприятие и предназначенного для использования в производственном процессе. часть системы обеспечения качества часть системы по обеспечению предприятия сырьем и материалами
 Система обеспечения предприятия сырьем и материалами • Система требований ( связана с промышленным регламентом) • Система складского учета и хранения (связана с бухучетом) • Система входного контроля ( связана с лабораторным контролем, ОКК) • Система договоров и поставок ( связана с финансовым менеджментом)
Система обеспечения предприятия сырьем и материалами • Система требований ( связана с промышленным регламентом) • Система складского учета и хранения (связана с бухучетом) • Система входного контроля ( связана с лабораторным контролем, ОКК) • Система договоров и поставок ( связана с финансовым менеджментом)
 Матрица ответственности № Этапы работ п/п 1 Разработка спецификаций 2 Организация поставок 3 Прием на склад 4 Идентификация и складская документация 5 Отбор проб 6 Идентификация статуса 7 Хранение 8 Отпуск 9 Возврат неиспользованной продукции 10 Возврат/уничтожение брака + ответственный Руководители, отв. исполнители ОКК Марке- Бухгал- Склад Произтинг терия водство +, К У У + У У У К + + К К У + + У У у – участие У + к контроль У +
Матрица ответственности № Этапы работ п/п 1 Разработка спецификаций 2 Организация поставок 3 Прием на склад 4 Идентификация и складская документация 5 Отбор проб 6 Идентификация статуса 7 Хранение 8 Отпуск 9 Возврат неиспользованной продукции 10 Возврат/уничтожение брака + ответственный Руководители, отв. исполнители ОКК Марке- Бухгал- Склад Произтинг терия водство +, К У У + У У У К + + К К У + + У У у – участие У + к контроль У +
 Организация склада • Склады сырья зона растаривания, зона отбора проб, зона карантина • Склад материалов (печатной продукции, упаковочных материалов) • Помещения для забракованной продукции
Организация склада • Склады сырья зона растаривания, зона отбора проб, зона карантина • Склад материалов (печатной продукции, упаковочных материалов) • Помещения для забракованной продукции
 Требования к персоналу складов • Необходимое количество персонала • Должностные инструкции • Обучение персонала (общее и специальное, техника безопасности) • Соблюдение личной и коллективной гигиены: медицинское обследование ограничения по болезни • Соблюдение производственной дисциплины • Ношение специальной одежды
Требования к персоналу складов • Необходимое количество персонала • Должностные инструкции • Обучение персонала (общее и специальное, техника безопасности) • Соблюдение личной и коллективной гигиены: медицинское обследование ограничения по болезни • Соблюдение производственной дисциплины • Ношение специальной одежды
 Требования к зданиям и помещениям • Должны соблюдаться общие требования к складам (проектирование, расположение) • Предусмотрена защита от воздействия внешних факторов • Должна быть приточная вентиляция • Должна быть обеспечена требуемая температура и влажность, освещение • Отделка помещений соответствует нормативам • Предусмотрены санитарно бытовые помещения для персонала • Адекватная площадь помещений для хранения
Требования к зданиям и помещениям • Должны соблюдаться общие требования к складам (проектирование, расположение) • Предусмотрена защита от воздействия внешних факторов • Должна быть приточная вентиляция • Должна быть обеспечена требуемая температура и влажность, освещение • Отделка помещений соответствует нормативам • Предусмотрены санитарно бытовые помещения для персонала • Адекватная площадь помещений для хранения
 Планировка складских помещений • Зона приема, растаривания • Зона хранения (в том числе карантинная зона) • Зона комплектации заказов • Зона отбора проб • Зона отпуска Расположение зон должно соответствовать выполняемым функциям
Планировка складских помещений • Зона приема, растаривания • Зона хранения (в том числе карантинная зона) • Зона комплектации заказов • Зона отбора проб • Зона отпуска Расположение зон должно соответствовать выполняемым функциям
 Склад оснащается: · стеллажами, поддонами, подтоварниками для хранения сырья, вспомогательных, упаковочных материалов и готовой продукции; · холодильными камерами для хранения термолабильных лекарственных средств; · ламинарными установками для отбора проб; · весами (калибровка/поверка); · средствами механизации для погрузочно разгрузочных работ; · приборами для регистрации параметров окружающей среды (термометрами, гигрометрами или психрометрами); · запирающимися шкафами и сейфами для хранения отдельных групп лекарственных препаратов, учетной документации и справочной литературы; · шкафами для хранения верхней и специальной одежды, обуви в гардеробной; · хозяйственным инвентарем для обеспечения санитарного режима.
Склад оснащается: · стеллажами, поддонами, подтоварниками для хранения сырья, вспомогательных, упаковочных материалов и готовой продукции; · холодильными камерами для хранения термолабильных лекарственных средств; · ламинарными установками для отбора проб; · весами (калибровка/поверка); · средствами механизации для погрузочно разгрузочных работ; · приборами для регистрации параметров окружающей среды (термометрами, гигрометрами или психрометрами); · запирающимися шкафами и сейфами для хранения отдельных групп лекарственных препаратов, учетной документации и справочной литературы; · шкафами для хранения верхней и специальной одежды, обуви в гардеробной; · хозяйственным инвентарем для обеспечения санитарного режима.
 Размещение оборудования • Термометры и гигрометры или психрометры размещают на внутренней стене помещения, вдали от нагревательных приборов на высоте 1, 5 1, 7 м от пола и на расстоянии не менее 3 м от дверей. • Стеллажи для хранения лекарственных средств и вспомогательных материалов должны быть установлены следующим образом: · расстояние до наружных стен не менее 0, 6 0, 7 м; · расстояние до потолка не менее 0, 5 м; · расстояние от пола не менее 0, 25 м; · проходы между стеллажами не менее 0, 75 м; · на всех стеллажах, шкафах, полках прикрепляется стеллажная карта с указанием наименования продукта, серии (партии), производителя, поставщика, срока годности, количества единиц хранения.
Размещение оборудования • Термометры и гигрометры или психрометры размещают на внутренней стене помещения, вдали от нагревательных приборов на высоте 1, 5 1, 7 м от пола и на расстоянии не менее 3 м от дверей. • Стеллажи для хранения лекарственных средств и вспомогательных материалов должны быть установлены следующим образом: · расстояние до наружных стен не менее 0, 6 0, 7 м; · расстояние до потолка не менее 0, 5 м; · расстояние от пола не менее 0, 25 м; · проходы между стеллажами не менее 0, 75 м; · на всех стеллажах, шкафах, полках прикрепляется стеллажная карта с указанием наименования продукта, серии (партии), производителя, поставщика, срока годности, количества единиц хранения.
 Санитарный режим склада • Помещения хранения следует содержать в соответствии с правилами санитарного режима в чистоте и надлежащем порядке. Не допускается разведение цветов, скопление мусора, появление насекомых паразитов и грызунов. • В соответствии с программой предприятия по проведению санитарных мероприятий на складах должны быть установлены: перечень помещений и оборудования, подлежащих уборке и обработке, методы и периодичность их проведения; перечень инвентаря, материалов, моющих и дезинфицирующих средств, применяемых при уборке помещений и обработке оборудования; перечень сотрудников, непосредственно выполняющих уборку помещений и обработку оборудования и руководящих их проведением; график уборки помещений.
Санитарный режим склада • Помещения хранения следует содержать в соответствии с правилами санитарного режима в чистоте и надлежащем порядке. Не допускается разведение цветов, скопление мусора, появление насекомых паразитов и грызунов. • В соответствии с программой предприятия по проведению санитарных мероприятий на складах должны быть установлены: перечень помещений и оборудования, подлежащих уборке и обработке, методы и периодичность их проведения; перечень инвентаря, материалов, моющих и дезинфицирующих средств, применяемых при уборке помещений и обработке оборудования; перечень сотрудников, непосредственно выполняющих уборку помещений и обработку оборудования и руководящих их проведением; график уборки помещений.
 Санитарный режим склада • Проведение уборок должно регистрироваться в соответствующем журнале. • Инструкции по уборке помещений постоянно доводят до сведения соответствующего персонала и включают в программу подготовки и повышения квалификации. • На складе необходимо выделить помещение для хранения моющих и дезинфицирующих средств, инвентаря и материалов, применяемых при уборке помещений и обработке оборудования. • Необходимо чередование дезинфицирующих средств для предотвращения устойчивых форм микроорганизмов. Желательно использование спороцидных дезинфицирующих средств.
Санитарный режим склада • Проведение уборок должно регистрироваться в соответствующем журнале. • Инструкции по уборке помещений постоянно доводят до сведения соответствующего персонала и включают в программу подготовки и повышения квалификации. • На складе необходимо выделить помещение для хранения моющих и дезинфицирующих средств, инвентаря и материалов, применяемых при уборке помещений и обработке оборудования. • Необходимо чередование дезинфицирующих средств для предотвращения устойчивых форм микроорганизмов. Желательно использование спороцидных дезинфицирующих средств.
 Основые операции, выполняемые складом • Прием сырья, материалов, готового продукта на склад, их идентификация • Хранение продукции на складе хранение отдельных групп карантинное хранение • Отпуск продукции со склада взвешивание • Материальный учет • Уничтожение забракованной продукции, с истекшим сроком годности
Основые операции, выполняемые складом • Прием сырья, материалов, готового продукта на склад, их идентификация • Хранение продукции на складе хранение отдельных групп карантинное хранение • Отпуск продукции со склада взвешивание • Материальный учет • Уничтожение забракованной продукции, с истекшим сроком годности
 Требования к организации хранения 1. Все товары на складе должны размещаться на стеллажах или на подтоварниках (поддонах) высотой не ниже 14, 5 см. 2. Не допускается размещение товара на полу без поддона. 3. Каждое наименование и каждая серия лекарственных средств должны храниться на отдельных поддонах. 4. Не допускается размещение поддонов с лекарственными средствами друг на друга без стеллажей. 5. Высота укладки товара на полке стеллажа не должна превышать 1, 5 метров. 6. Все перемещения товаров на складе регистрируются
Требования к организации хранения 1. Все товары на складе должны размещаться на стеллажах или на подтоварниках (поддонах) высотой не ниже 14, 5 см. 2. Не допускается размещение товара на полу без поддона. 3. Каждое наименование и каждая серия лекарственных средств должны храниться на отдельных поддонах. 4. Не допускается размещение поддонов с лекарственными средствами друг на друга без стеллажей. 5. Высота укладки товара на полке стеллажа не должна превышать 1, 5 метров. 6. Все перемещения товаров на складе регистрируются
 Требования к организации хранения • Хранение медикаментов может быть систематизировано по наименованиям и сериям • Продукция должны укладываться и устанавливаться в оригинальной упаковке этикеткой наружу • Должен вестись учет продукции средств по срокам годности, в том числе и на бумажном носителе • Продукция в поврежденных упаковках должна быть изъята из помещений хранения, промаркирована и помещена в отдельную зону • При хранении учитываются физико химические свойства продукции ( требующие защиты от света, влаги; защиты от улетучивания; от газов в окружающей среде; тремолабильные в ва; наркотические, психотропные, сильнодействующие и ядовитые; пахучие и красящие в ва; лекарственное растительное сырье; дез. средства; взрывоопасные и легковоспламеняющиеся
Требования к организации хранения • Хранение медикаментов может быть систематизировано по наименованиям и сериям • Продукция должны укладываться и устанавливаться в оригинальной упаковке этикеткой наружу • Должен вестись учет продукции средств по срокам годности, в том числе и на бумажном носителе • Продукция в поврежденных упаковках должна быть изъята из помещений хранения, промаркирована и помещена в отдельную зону • При хранении учитываются физико химические свойства продукции ( требующие защиты от света, влаги; защиты от улетучивания; от газов в окружающей среде; тремолабильные в ва; наркотические, психотропные, сильнодействующие и ядовитые; пахучие и красящие в ва; лекарственное растительное сырье; дез. средства; взрывоопасные и легковоспламеняющиеся
 Схемы размещения • Критерии: – Периодичность поступления и отгрузки – Способы укладки • Постоянные или переменные места хранения • Группировка по размерам • Адресная система – – Код склада Номер стеллажа; Номер секции Номер полки
Схемы размещения • Критерии: – Периодичность поступления и отгрузки – Способы укладки • Постоянные или переменные места хранения • Группировка по размерам • Адресная система – – Код склада Номер стеллажа; Номер секции Номер полки
 Особенности работы склада упаковочных материалов • Инструкция по приемке ( поступает в упакованном виде, должен быть номер серии, документ о качестве) • Спецификация • Правила хранения (приспособленные помещения) • Должны соблюдаться допустимые сроки хранения • Устаревшая упаковка уничтожается • Все операции регистрируются
Особенности работы склада упаковочных материалов • Инструкция по приемке ( поступает в упакованном виде, должен быть номер серии, документ о качестве) • Спецификация • Правила хранения (приспособленные помещения) • Должны соблюдаться допустимые сроки хранения • Устаревшая упаковка уничтожается • Все операции регистрируются
 Особенности хранения печатных материалов • Инструкция по приемке и идентификации (номер серии/партии, документ о качестве) • Хранение в контейнерах • Хранение по наименованиям, дозам • Четкий учет количества • Транспортирование в закрытых контейнерах (избежать подделки и перепутывание) • Устаревшие уничтожаются • Неиспользованные материалы возвращаются на склад • Все операции регистрируются
Особенности хранения печатных материалов • Инструкция по приемке и идентификации (номер серии/партии, документ о качестве) • Хранение в контейнерах • Хранение по наименованиям, дозам • Четкий учет количества • Транспортирование в закрытых контейнерах (избежать подделки и перепутывание) • Устаревшие уничтожаются • Неиспользованные материалы возвращаются на склад • Все операции регистрируются
 Документация на складе • Выполняются общие требования к документации • СОП ( инструкции) по приему, хранению и отпуску • Журналы движения товарно материальных ценностей на складе (журнал регистрации поступившей продукции, акты приемки, журнал регистрации приемных актов, журнал регистрации счетов поставщиков, журнал регистрации накладных по отпуску товаров со склада) • Журналы регистрации мониторинга окружающей среды • Документы, подтверждающие качество продукции • Стеллажные карточки • Картотека по срокам годности • Карточки складского учета • Журнал регистрации инструктажей по технике безопасности и пожарной безопасности
Документация на складе • Выполняются общие требования к документации • СОП ( инструкции) по приему, хранению и отпуску • Журналы движения товарно материальных ценностей на складе (журнал регистрации поступившей продукции, акты приемки, журнал регистрации приемных актов, журнал регистрации счетов поставщиков, журнал регистрации накладных по отпуску товаров со склада) • Журналы регистрации мониторинга окружающей среды • Документы, подтверждающие качество продукции • Стеллажные карточки • Картотека по срокам годности • Карточки складского учета • Журнал регистрации инструктажей по технике безопасности и пожарной безопасности
 Организация отбора проб • Ответственное подразделение – ОКК. Может быть организована группа входного контроля • На складе имеется место для отбора проб. • Особенности отбора проб – указаны в спецификации • Определить объем отбираемой пробы ( 3 полных анализа + для работ по стабильности ± архивные образцы) • Определить объем тестируемой пробы (согласно ФС или ТУ/ГОСТ)
Организация отбора проб • Ответственное подразделение – ОКК. Может быть организована группа входного контроля • На складе имеется место для отбора проб. • Особенности отбора проб – указаны в спецификации • Определить объем отбираемой пробы ( 3 полных анализа + для работ по стабильности ± архивные образцы) • Определить объем тестируемой пробы (согласно ФС или ТУ/ГОСТ)
 Организация отбора проб • Обеспечить однородность отбираемой пробы (метод отбора будет разным для штучной и нештучной продукции) • Свойства отбираемого образца (термолабильность, светочувствительность, агрессивные вещества, агрегатное состояние, стерильность и т. д. ) • Материал контейнера • Условия отбора и хранения • Оборудование для отбора проб • Условия проведения испытаний
Организация отбора проб • Обеспечить однородность отбираемой пробы (метод отбора будет разным для штучной и нештучной продукции) • Свойства отбираемого образца (термолабильность, светочувствительность, агрессивные вещества, агрегатное состояние, стерильность и т. д. ) • Материал контейнера • Условия отбора и хранения • Оборудование для отбора проб • Условия проведения испытаний
 Организация отбора проб • Для показателя «идентификация» отбор из каждой упаковки (не смешивают) • Для остальных – проба может быть объединена • Идентификация контейнеров с отобранными пробами. Архивная часть – опечатывается! • Все образцы регистрируются.
Организация отбора проб • Для показателя «идентификация» отбор из каждой упаковки (не смешивают) • Для остальных – проба может быть объединена • Идентификация контейнеров с отобранными пробами. Архивная часть – опечатывается! • Все образцы регистрируются.
 Процедуры карантина • Идентификация статуса • Физическая изоляция • Компьютерный контроль
Процедуры карантина • Идентификация статуса • Физическая изоляция • Компьютерный контроль
 Хранение архивных образцов • В соответствующих условиях (можно подтвердить) • Образцы активных исходных веществ должны храниться в течение одного года после истечения срока годности лекарственного средства, в состав которого они входят, но не менее трех лет. • Вспомогательные вещества (кроме растворителей, газов и воды) должны храниться минимально три года.
Хранение архивных образцов • В соответствующих условиях (можно подтвердить) • Образцы активных исходных веществ должны храниться в течение одного года после истечения срока годности лекарственного средства, в состав которого они входят, но не менее трех лет. • Вспомогательные вещества (кроме растворителей, газов и воды) должны храниться минимально три года.
 Зоны контроля качества
Зоны контроля качества
 Как правило, лаборатории контроля качества должны быть отделены от производственных помещений. Это особенно важно для лабораторий контроля биологических, микробиологических препаратов или радиоизотопов, которые также должны быть отделены друг от друга. Проект контрольных лабораторий должен соответствовать требованиям к выполняемым в них операциям. Площадь лабораторий должна быть достаточной для исключения перепутывания и перекрестного загрязнения, а также для хранения образцов и документации. Для размещения чувствительных приборов, нуждающихся в защите от электромагнитных полей, вибрации, повышенной влажности или других внешних факторов, могут быть предусмотрены отдельные помещения. Особые требования предъявляются к лабораториям, в которых проводятся работы с образцами специфических веществ, например, биологическими или радиоактивными материалами.
Как правило, лаборатории контроля качества должны быть отделены от производственных помещений. Это особенно важно для лабораторий контроля биологических, микробиологических препаратов или радиоизотопов, которые также должны быть отделены друг от друга. Проект контрольных лабораторий должен соответствовать требованиям к выполняемым в них операциям. Площадь лабораторий должна быть достаточной для исключения перепутывания и перекрестного загрязнения, а также для хранения образцов и документации. Для размещения чувствительных приборов, нуждающихся в защите от электромагнитных полей, вибрации, повышенной влажности или других внешних факторов, могут быть предусмотрены отдельные помещения. Особые требования предъявляются к лабораториям, в которых проводятся работы с образцами специфических веществ, например, биологическими или радиоактивными материалами.
 Вспомогательные зоны
Вспомогательные зоны
 Комнаты отдыха и приема пищи должны быть отделены от производственных помещений. Помещения для переодевания и хранения одежды, туалеты и душевые должны иметь удобный доступ, их планировка и размеры должны соответствовать численности персонала. Не допускается выход из туалетов непосредственно в производственные или складские зоны. Ремонтные участки должны быть, по возможности, отделены от производственных помещений. При необходимости хранения запасных частей и инструментов в зоне производства должны быть предусмотрены специальные помещения или шкафы. Помещения для содержания животных должны быть изолированы от остальных зон, оборудованы отдельными системами подготовки воздуха и отдельным входом.
Комнаты отдыха и приема пищи должны быть отделены от производственных помещений. Помещения для переодевания и хранения одежды, туалеты и душевые должны иметь удобный доступ, их планировка и размеры должны соответствовать численности персонала. Не допускается выход из туалетов непосредственно в производственные или складские зоны. Ремонтные участки должны быть, по возможности, отделены от производственных помещений. При необходимости хранения запасных частей и инструментов в зоне производства должны быть предусмотрены специальные помещения или шкафы. Помещения для содержания животных должны быть изолированы от остальных зон, оборудованы отдельными системами подготовки воздуха и отдельным входом.
 Оборудование
Оборудование
 Конструкция, монтаж и порядок технического обслуживания оборудования должны соответствовать его назначению. Работы по ремонту и техническому обслуживанию оборудования не должны оказывать отрицательного влияния на качество продукции. Конструкция производственного оборудования должна обеспечивать удобство и возможность его очистки. Операции по очистке оборудования должны выполняться в соответствии с подробными письменными инструкциями. Оборудование следует содержать в сухом и чистом состоянии. Инвентарь и материалы для очистки не должны быть источниками загрязнения. Оборудование должно быть установлено так, чтобы, по возможности, исключить риск загрязнения или выполнения ошибочных действий.
Конструкция, монтаж и порядок технического обслуживания оборудования должны соответствовать его назначению. Работы по ремонту и техническому обслуживанию оборудования не должны оказывать отрицательного влияния на качество продукции. Конструкция производственного оборудования должна обеспечивать удобство и возможность его очистки. Операции по очистке оборудования должны выполняться в соответствии с подробными письменными инструкциями. Оборудование следует содержать в сухом и чистом состоянии. Инвентарь и материалы для очистки не должны быть источниками загрязнения. Оборудование должно быть установлено так, чтобы, по возможности, исключить риск загрязнения или выполнения ошибочных действий.
 Технологическое оборудование не должно влиять на качество продукции и представлять какую либо опасность. Части технологического оборудования, контактирующие с продукцией, не должны вступать с ней в реакцию, выделять или абсорбировать вещества, оказывающие влияние на качество продукции, в такой степени, чтобы это могло представлять опасность. Погрешность приборов для измерения массы и другого измерительного оборудования должна соответствовать производственным и контрольным операциям, в которых они используются. Периодичность калибровки (поверки) измерительных, регистрирующих, контрольных приборов и оборудования для измерения массы должна соответствовать указанной в соответствующих методиках. Результаты калибровки (поверки) должны быть документированы.
Технологическое оборудование не должно влиять на качество продукции и представлять какую либо опасность. Части технологического оборудования, контактирующие с продукцией, не должны вступать с ней в реакцию, выделять или абсорбировать вещества, оказывающие влияние на качество продукции, в такой степени, чтобы это могло представлять опасность. Погрешность приборов для измерения массы и другого измерительного оборудования должна соответствовать производственным и контрольным операциям, в которых они используются. Периодичность калибровки (поверки) измерительных, регистрирующих, контрольных приборов и оборудования для измерения массы должна соответствовать указанной в соответствующих методиках. Результаты калибровки (поверки) должны быть документированы.
 Технологическое оборудование не должно влиять на качество продукции и представлять собой какую либо опасность для продукции. Части технологического оборудования, контактирующие с продукцией, не должны вступать с ней в химическую реакцию, выделять или абсорбировать вещества, оказывающие влияние на качество продукции. Погрешность приборов для измерения массы и другого измерительного оборудования должна соответствовать производственным и контрольным операциям, в которых они используются. Периодичность калибровки (поверки) измерительных, регистрирующих, контрольных приборов и оборудования для измерения массы должна соответствовать указанной в соответствующих методиках. Результаты калибровки (поверки) должны быть документированы.
Технологическое оборудование не должно влиять на качество продукции и представлять собой какую либо опасность для продукции. Части технологического оборудования, контактирующие с продукцией, не должны вступать с ней в химическую реакцию, выделять или абсорбировать вещества, оказывающие влияние на качество продукции. Погрешность приборов для измерения массы и другого измерительного оборудования должна соответствовать производственным и контрольным операциям, в которых они используются. Периодичность калибровки (поверки) измерительных, регистрирующих, контрольных приборов и оборудования для измерения массы должна соответствовать указанной в соответствующих методиках. Результаты калибровки (поверки) должны быть документированы.
 Стационарные трубопроводы должны быть маркированы с указанием проходящих по ним веществ и, если требуется, направления потока. Трубопроводы для воды очищенной и воды для инъекций (дистиллированной, деионизованной и др. ) следует обрабатывать в соответствии с инструкциями, в которых указаны пределы микробного загрязнения и принимаемые меры в случае их превышения. Неисправное оборудование должно быть производства и контроля качества соответствующим образом. изъято из зоны или обозначено
Стационарные трубопроводы должны быть маркированы с указанием проходящих по ним веществ и, если требуется, направления потока. Трубопроводы для воды очищенной и воды для инъекций (дистиллированной, деионизованной и др. ) следует обрабатывать в соответствии с инструкциями, в которых указаны пределы микробного загрязнения и принимаемые меры в случае их превышения. Неисправное оборудование должно быть производства и контроля качества соответствующим образом. изъято из зоны или обозначено
 Федеральный закон Российской Федерации от 12 апреля 2010 г. N 61 -ФЗ "Об обращении лекарственных средств" Глава 8. Производство и маркировка лекарственных средств Статья 45. Производство лекарственных средств
Федеральный закон Российской Федерации от 12 апреля 2010 г. N 61 -ФЗ "Об обращении лекарственных средств" Глава 8. Производство и маркировка лекарственных средств Статья 45. Производство лекарственных средств
 1. Производство лекарственных средств должно соответствовать правилам организации производства и контроля качества лекарственных средств, утвержденным Правительством Российской Федерации. 2. Производство лекарственных средств на территории Российской Федерации осуществляется производителями лекарственных средств, имеющими лицензию на производство лекарственных средств.
1. Производство лекарственных средств должно соответствовать правилам организации производства и контроля качества лекарственных средств, утвержденным Правительством Российской Федерации. 2. Производство лекарственных средств на территории Российской Федерации осуществляется производителями лекарственных средств, имеющими лицензию на производство лекарственных средств.
 3. Производство лекарственных средств осуществляется с соблюдением требований промышленного регламента, который утверждается руководителем производителя лекарственных средств и включает в себя перечень используемых фармацевтических субстанций и вспомогательных веществ с указанием количества каждого из них, данные об используемом оборудовании, описание технологического процесса и методов контроля на всех этапах производства лекарственных средств. 4. При производстве лекарственных средств используются фармацевтические субстанции, включенные в государственный реестр лекарственных средств.
3. Производство лекарственных средств осуществляется с соблюдением требований промышленного регламента, который утверждается руководителем производителя лекарственных средств и включает в себя перечень используемых фармацевтических субстанций и вспомогательных веществ с указанием количества каждого из них, данные об используемом оборудовании, описание технологического процесса и методов контроля на всех этапах производства лекарственных средств. 4. При производстве лекарственных средств используются фармацевтические субстанции, включенные в государственный реестр лекарственных средств.
 Запрещается производство: 1) лекарственных средств, не включенных в государственный реестр лекарственных средств, за исключением лекарственных средств, производимых для проведения клинических исследований и для экспорта; 2) фальсифицированных лекарственных средств; 3) лекарственных средств без лицензии на производство лекарственных средств; 4) лекарственных средств с нарушением правил организации производства и контроля качества лекарственных средств.
Запрещается производство: 1) лекарственных средств, не включенных в государственный реестр лекарственных средств, за исключением лекарственных средств, производимых для проведения клинических исследований и для экспорта; 2) фальсифицированных лекарственных средств; 3) лекарственных средств без лицензии на производство лекарственных средств; 4) лекарственных средств с нарушением правил организации производства и контроля качества лекарственных средств.
 НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ ГОСТ Р 52249 -2009 ПРАВИЛА ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ Москва
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ ГОСТ Р 52249 -2009 ПРАВИЛА ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ Москва
 Производство
Производство
 1. Производственный процесс и его контроль должны осуществляться квалифицированным персоналом. 2. Все операции с материалами и продукцией (например, приемка, карантин, отбор проб, хранение, маркировка, подготовка, приготовление, упаковка и отгрузка) должны выполняться согласно письменным инструкциям или методикам и, при необходимости, протоколироваться. 3. Все поступающие материалы должны быть проверены на соответствие заказу. Тару и упаковку следует очищать и маркировать. 4. Факты повреждения тары и упаковки, которые могут оказать отрицательное влияние на качество материалов, следует расследовать и протоколировать с последующим сообщением в отдел контроля качества.
1. Производственный процесс и его контроль должны осуществляться квалифицированным персоналом. 2. Все операции с материалами и продукцией (например, приемка, карантин, отбор проб, хранение, маркировка, подготовка, приготовление, упаковка и отгрузка) должны выполняться согласно письменным инструкциям или методикам и, при необходимости, протоколироваться. 3. Все поступающие материалы должны быть проверены на соответствие заказу. Тару и упаковку следует очищать и маркировать. 4. Факты повреждения тары и упаковки, которые могут оказать отрицательное влияние на качество материалов, следует расследовать и протоколировать с последующим сообщением в отдел контроля качества.
 5. Поступающие материалы и произведенная готовая продукция должны немедленно помещаться в карантин, действующий по принципу раздельного хранения или за счет организационных мер, и содержаться в нем до получения разрешения на использование или отгрузку. 6. Приемка промежуточной и нерасфасованной продукции выполняется по правилам, действующим для исходных материалов. 7. Все материалы и продукцию следует хранить в соответствующих условиях, определяемых производителем, в порядке, обеспечивающем разделение серий продукции и ее оборот на складе. 8. Для гарантии отсутствия отклонений за допустимые пределы следует обеспечить контроль выхода продукции и количественное сопоставление его с данными промышленного регламента.
5. Поступающие материалы и произведенная готовая продукция должны немедленно помещаться в карантин, действующий по принципу раздельного хранения или за счет организационных мер, и содержаться в нем до получения разрешения на использование или отгрузку. 6. Приемка промежуточной и нерасфасованной продукции выполняется по правилам, действующим для исходных материалов. 7. Все материалы и продукцию следует хранить в соответствующих условиях, определяемых производителем, в порядке, обеспечивающем разделение серий продукции и ее оборот на складе. 8. Для гарантии отсутствия отклонений за допустимые пределы следует обеспечить контроль выхода продукции и количественное сопоставление его с данными промышленного регламента.
 9. Не допускается одновременное или последовательное проведение операций с различными продуктами в одном и том же помещении при отсутствии защиты от риска перепутывания или перекрестного загрязнения. 10. Продукция и материалы должны быть защищены от микробного и других видов загрязнений на всех этапах производства. 11. При работе с сухими материалами и продуктами необходимо принимать особые меры предосторожности по предотвращению образования и распространения пыли, особенно при работе с сильнодействующими и сенсибилизирующими веществами. 12 В ходе выполнения технологического процесса на всех материалах, упаковках с нерасфасованной продукцией, основном оборудовании и помещениях должны быть обозначения (маркировка) с указанием производимой продукции или материала, его дозировки (при необходимости) и номера серии. При необходимости следует указывать стадию технологического процесса.
9. Не допускается одновременное или последовательное проведение операций с различными продуктами в одном и том же помещении при отсутствии защиты от риска перепутывания или перекрестного загрязнения. 10. Продукция и материалы должны быть защищены от микробного и других видов загрязнений на всех этапах производства. 11. При работе с сухими материалами и продуктами необходимо принимать особые меры предосторожности по предотвращению образования и распространения пыли, особенно при работе с сильнодействующими и сенсибилизирующими веществами. 12 В ходе выполнения технологического процесса на всех материалах, упаковках с нерасфасованной продукцией, основном оборудовании и помещениях должны быть обозначения (маркировка) с указанием производимой продукции или материала, его дозировки (при необходимости) и номера серии. При необходимости следует указывать стадию технологического процесса.
 13. Обозначения (маркировка) на упаковке, оборудовании или помещениях должны быть четкими, однозначными, установленной формы. Кроме применения буквенных обозначений, рекомендуется использовать цветовую маркировку, указывающую статус продукции (например, "Карантин", "Принято", "Отклонено", "Чистое" и т. п. ). 14. Следует контролировать правильность соединения трубопроводов и другого оборудования, предназначенного для транспортирования продукции из одной зоны в другую. 15. Не допускается отклонение от инструкций. При необходимости письменное разрешение на отклонение от инструкций должно быть получено от компетентных лиц и отдела контроля качества. 16. В производственные помещения может входить только персонал, имеющий право доступа в них.
13. Обозначения (маркировка) на упаковке, оборудовании или помещениях должны быть четкими, однозначными, установленной формы. Кроме применения буквенных обозначений, рекомендуется использовать цветовую маркировку, указывающую статус продукции (например, "Карантин", "Принято", "Отклонено", "Чистое" и т. п. ). 14. Следует контролировать правильность соединения трубопроводов и другого оборудования, предназначенного для транспортирования продукции из одной зоны в другую. 15. Не допускается отклонение от инструкций. При необходимости письменное разрешение на отклонение от инструкций должно быть получено от компетентных лиц и отдела контроля качества. 16. В производственные помещения может входить только персонал, имеющий право доступа в них.
 17. Как правило, в помещениях и на оборудовании, предназначенных для производства лекарственных средств, не допускается изготовление продукции немедицинского назначения.
17. Как правило, в помещениях и на оборудовании, предназначенных для производства лекарственных средств, не допускается изготовление продукции немедицинского назначения.
 Предотвращение перекрестного загрязнения при производстве
Предотвращение перекрестного загрязнения при производстве
 1. производство в выделенных зонах (обязательное для пенициллинов, живых вакцин, бактериальных препаратов из живых микроорганизмов и некоторых других биологических препаратов) или разделение циклов производства во времени с соответствующей уборкой помещения и оборудования между циклами; 2. организация воздушных шлюзов и вытяжных устройств; 3. сведение к минимуму риска загрязнения, вызываемого рециркуляцией или повторным поступлением необработанного или недостаточно обработанного воздуха; 4. хранение защитной (специальной) одежды в пределах зон производства продукции с высоким риском перекрестного загрязнения; 5. использование высокоэффективных методов очистки и обработки с целью исключения недостаточной очистки, часто являющейся причиной перекрестного загрязнения; 6. использование «закрытых систем» производства; 7. контроль наличия остатков предыдущего продукта или моющих средств и маркировка оборудования с указанием статуса чистоты.
1. производство в выделенных зонах (обязательное для пенициллинов, живых вакцин, бактериальных препаратов из живых микроорганизмов и некоторых других биологических препаратов) или разделение циклов производства во времени с соответствующей уборкой помещения и оборудования между циклами; 2. организация воздушных шлюзов и вытяжных устройств; 3. сведение к минимуму риска загрязнения, вызываемого рециркуляцией или повторным поступлением необработанного или недостаточно обработанного воздуха; 4. хранение защитной (специальной) одежды в пределах зон производства продукции с высоким риском перекрестного загрязнения; 5. использование высокоэффективных методов очистки и обработки с целью исключения недостаточной очистки, часто являющейся причиной перекрестного загрязнения; 6. использование «закрытых систем» производства; 7. контроль наличия остатков предыдущего продукта или моющих средств и маркировка оборудования с указанием статуса чистоты.
 Исходные материалы
Исходные материалы
 Исходные материалы следует закупать только у утвержденных поставщиков (указанных в спецификации) и, по возможности, непосредственно у производителей этих материалов. Требования к ним должны быть указаны в спецификациях на исходные материалы, утвержденных производителем лекарственных средств, и согласованы с поставщиком. Все вопросы, связанные с производством и контролем исходных материалов, в т. ч. работу с ними, маркировку, упаковку, порядок предъявления рекламаций и отклонения, следует согласовывать с производителем и поставщиком. В каждой поставке следует проверять целостность тары, упаковки и пломб, соответствие накладной маркировке на таре (упаковке). При поставке исходных материалов из нескольких серий каждую серию следует рассматривать как независимую в отношении отбора проб, проведения испытаний и получения разрешения на использование.
Исходные материалы следует закупать только у утвержденных поставщиков (указанных в спецификации) и, по возможности, непосредственно у производителей этих материалов. Требования к ним должны быть указаны в спецификациях на исходные материалы, утвержденных производителем лекарственных средств, и согласованы с поставщиком. Все вопросы, связанные с производством и контролем исходных материалов, в т. ч. работу с ними, маркировку, упаковку, порядок предъявления рекламаций и отклонения, следует согласовывать с производителем и поставщиком. В каждой поставке следует проверять целостность тары, упаковки и пломб, соответствие накладной маркировке на таре (упаковке). При поставке исходных материалов из нескольких серий каждую серию следует рассматривать как независимую в отношении отбора проб, проведения испытаний и получения разрешения на использование.
 Исходные материалы, находящиеся на складе, должны быть маркированы соответствующим образом. Маркировка должна содержать, как минимум, следующую информацию: обозначение исходного продукта и внутризаводской код; номер серии, присвоенный приемке; статус материала (например, «Карантин» , «Испытания» , «Разрешено» , «Отклонено» и т. п. ); срок годности или дату, после которой необходим повторный контроль. Если складское хозяйство полностью оснащено компьютерами, указывать всю информацию на маркировке необязательно. Контроль подлинности содержимого каждой упаковки с исходными материалами регламентируется соответствующими инструкциями и методиками. Упаковки с не расфасованной продукцией, из которых были отобраны пробы, должны иметь соответствующую маркировку.
Исходные материалы, находящиеся на складе, должны быть маркированы соответствующим образом. Маркировка должна содержать, как минимум, следующую информацию: обозначение исходного продукта и внутризаводской код; номер серии, присвоенный приемке; статус материала (например, «Карантин» , «Испытания» , «Разрешено» , «Отклонено» и т. п. ); срок годности или дату, после которой необходим повторный контроль. Если складское хозяйство полностью оснащено компьютерами, указывать всю информацию на маркировке необязательно. Контроль подлинности содержимого каждой упаковки с исходными материалами регламентируется соответствующими инструкциями и методиками. Упаковки с не расфасованной продукцией, из которых были отобраны пробы, должны иметь соответствующую маркировку.
 При производстве лекарственных средств могут использоваться только исходные материалы с не истекшим сроком годности и допущенные отделом контроля качества. Исходные материалы должны выдаваться только специально назначенными лицами в соответствии с письменной инструкцией, при этом должны выполняться требования по точности взвешивания и отмеривания материалов в чистую и маркированную тару. Следует выполнять независимую проверку каждого выданного вещества, его массы и объема. Результаты проверки должны быть оформлены документально. Материалы, выданные для каждой серии, следует хранить в одном месте с четкой маркировкой.
При производстве лекарственных средств могут использоваться только исходные материалы с не истекшим сроком годности и допущенные отделом контроля качества. Исходные материалы должны выдаваться только специально назначенными лицами в соответствии с письменной инструкцией, при этом должны выполняться требования по точности взвешивания и отмеривания материалов в чистую и маркированную тару. Следует выполнять независимую проверку каждого выданного вещества, его массы и объема. Результаты проверки должны быть оформлены документально. Материалы, выданные для каждой серии, следует хранить в одном месте с четкой маркировкой.
 Промежуточная и не расфасованная продукция
Промежуточная и не расфасованная продукция
 Перед началом любой технологической операции следует принять меры, гарантирующие чистоту производственной зоны и оборудования, отсутствие любых исходных материалов, продукции, остатков продукции или документации, не относящихся к данному процессу. Промежуточную и не расфасованную продукцию следует хранить в надлежащих условиях. Критические процессы должны быть аттестованы (валидированы). Выполнение всех необходимых операций по внутрипроизводственному контролю и контролю окружающей среды должно быть оформлено документально. Все факты существенного отклонения выхода продукции от ожидаемого следует регистрировать и расследовать.
Перед началом любой технологической операции следует принять меры, гарантирующие чистоту производственной зоны и оборудования, отсутствие любых исходных материалов, продукции, остатков продукции или документации, не относящихся к данному процессу. Промежуточную и не расфасованную продукцию следует хранить в надлежащих условиях. Критические процессы должны быть аттестованы (валидированы). Выполнение всех необходимых операций по внутрипроизводственному контролю и контролю окружающей среды должно быть оформлено документально. Все факты существенного отклонения выхода продукции от ожидаемого следует регистрировать и расследовать.
 Упаковочные материалы
Упаковочные материалы
 Закупке, хранению и контролю первичных и печатных упаковочных материалов следует уделять такое же внимание, как и исходному сырью. Особое внимание следует уделять печатным материалам. Их следует хранить в безопасных условиях, исключающих доступ посторонних лиц. Разрезанные этикетки и другие разрозненные мате риалы должны храниться и транспортироваться раздельно в закрытой таре, исключающей их перепутывание. Разрешение на использование упаковочных материалов должно выдаваться только специально назначенными лицами в соответствии с утвержденной инструкцией. Каждой поставке или серии первичных или печатных упаковочных материалов должен быть присвоен номер или отличительный знак. Просроченные или непригодные к использованию печатные или первичные упаковочные материалы должны быть уничтожены с оформлением протокола.
Закупке, хранению и контролю первичных и печатных упаковочных материалов следует уделять такое же внимание, как и исходному сырью. Особое внимание следует уделять печатным материалам. Их следует хранить в безопасных условиях, исключающих доступ посторонних лиц. Разрезанные этикетки и другие разрозненные мате риалы должны храниться и транспортироваться раздельно в закрытой таре, исключающей их перепутывание. Разрешение на использование упаковочных материалов должно выдаваться только специально назначенными лицами в соответствии с утвержденной инструкцией. Каждой поставке или серии первичных или печатных упаковочных материалов должен быть присвоен номер или отличительный знак. Просроченные или непригодные к использованию печатные или первичные упаковочные материалы должны быть уничтожены с оформлением протокола.
 Операции по упаковке
Операции по упаковке
 При упаковке продукции должен быть сведен к минимуму риск перекрестного загрязнения, перепутывания или подмены. Не допускается упаковывать продукцию различных видов в непосредственной близости друг от друга при отсутствии физического разделения зон. Перед началом операций по упаковке следует убедиться в том, что рабочая зона, упаковочные линии, печатные машины и другое оборудование находятся в чистом состоянии и не содержат материалов, продукции или документов, относящихся к предшествующей работе и не использующихся в текущем процессе. Очистка линии упаковки продукции должна выполняться по специальным инструкциям. Наименование и номер серии упаковываемой продукции должны быть указаны на каждой линии или установке.
При упаковке продукции должен быть сведен к минимуму риск перекрестного загрязнения, перепутывания или подмены. Не допускается упаковывать продукцию различных видов в непосредственной близости друг от друга при отсутствии физического разделения зон. Перед началом операций по упаковке следует убедиться в том, что рабочая зона, упаковочные линии, печатные машины и другое оборудование находятся в чистом состоянии и не содержат материалов, продукции или документов, относящихся к предшествующей работе и не использующихся в текущем процессе. Очистка линии упаковки продукции должна выполняться по специальным инструкциям. Наименование и номер серии упаковываемой продукции должны быть указаны на каждой линии или установке.
 При поступлении продукции и упаковочных материалов на участок упаковки следует проверить их количество, подлинность и соответствие инструкциям по упаковке. Первичная упаковка для наполнения перед началом операции наполнения должна быть чистой. Особое внимание следует обратить на удаление любых загрязняющих веществ (осколков стекла, металлических частиц и пр. ). После наполнения и укупоривания продукции ее маркировку следует выполнять как можно быстрее. Если это невозможно, то следует принять необходимые меры предотвращающие перепутывание продукции или ошибочную маркировку. Правильность выполнения любых печатных операций (например, нанесения кодов или срока годности) при упаковке и после нее тщательно контролируется и оформляется документально. Особое внимание следует уделять ручной маркировке, которую следует контролировать через определенные интервалы времени.
При поступлении продукции и упаковочных материалов на участок упаковки следует проверить их количество, подлинность и соответствие инструкциям по упаковке. Первичная упаковка для наполнения перед началом операции наполнения должна быть чистой. Особое внимание следует обратить на удаление любых загрязняющих веществ (осколков стекла, металлических частиц и пр. ). После наполнения и укупоривания продукции ее маркировку следует выполнять как можно быстрее. Если это невозможно, то следует принять необходимые меры предотвращающие перепутывание продукции или ошибочную маркировку. Правильность выполнения любых печатных операций (например, нанесения кодов или срока годности) при упаковке и после нее тщательно контролируется и оформляется документально. Особое внимание следует уделять ручной маркировке, которую следует контролировать через определенные интервалы времени.
 Особые меры предосторожности должны приниматься при использовании разрезанных этикеток и нанесении печати вне линии упаковки. Для предотвращения перепутывания печатного материала рекомендуется использовать этикетки в рулоне вместо разрезанных этикеток. Следует контролировать правильность работы электронных считывателей кодов, счетчиков этикеток и других подобных устройств. Маркировка упаковочных материалов, нанесенная с помощью печати или методом тиснения, должна быть отчетливой, устойчивой к воздействию света (выгоранию) и удалению.
Особые меры предосторожности должны приниматься при использовании разрезанных этикеток и нанесении печати вне линии упаковки. Для предотвращения перепутывания печатного материала рекомендуется использовать этикетки в рулоне вместо разрезанных этикеток. Следует контролировать правильность работы электронных считывателей кодов, счетчиков этикеток и других подобных устройств. Маркировка упаковочных материалов, нанесенная с помощью печати или методом тиснения, должна быть отчетливой, устойчивой к воздействию света (выгоранию) и удалению.
 При контроле процесса упаковки продукции на линии следует проверять, как минимум, следующее: a) общий вид упаковки; b) комплектность упаковки; c) правильность использования упаковочных материалов в соответствии с требованиями документации на данную продукцию; d) правильность нанесения печатных надписей; e) правильность работы устройств контроля на линии. Образцы продукции, отобранные с упаковочной линии, повторно на линию не возвращают. Если при упаковке продукции возникли непредвиденные обстоятельства, она может быть возвращена в производство только после специальной проверки, проведения расследования и с разрешения лица, имеющего соответствующие полномочия. Указанные действия должны быть оформлены в виде протоколов, которые следует хранить в установленном порядке.
При контроле процесса упаковки продукции на линии следует проверять, как минимум, следующее: a) общий вид упаковки; b) комплектность упаковки; c) правильность использования упаковочных материалов в соответствии с требованиями документации на данную продукцию; d) правильность нанесения печатных надписей; e) правильность работы устройств контроля на линии. Образцы продукции, отобранные с упаковочной линии, повторно на линию не возвращают. Если при упаковке продукции возникли непредвиденные обстоятельства, она может быть возвращена в производство только после специальной проверки, проведения расследования и с разрешения лица, имеющего соответствующие полномочия. Указанные действия должны быть оформлены в виде протоколов, которые следует хранить в установленном порядке.
 При существенном или необычном расхождении, установленном при сопоставлении количества нерасфасованной продукции, печатных упаковочных материалов и количества единиц полученной готовой продукции, следует провести расследование и установить причину этого расхождения до получения разрешения на реализацию данной продукции. После завершения операций по упаковке любые оставшиеся упаковочные материалы с нанесенным на них номером серии должны быть уничтожены с последующим составлением протокола. Возврат на склад немаркированных упаковочных материалов производят в соответствии с утвержденной инструкцией.
При существенном или необычном расхождении, установленном при сопоставлении количества нерасфасованной продукции, печатных упаковочных материалов и количества единиц полученной готовой продукции, следует провести расследование и установить причину этого расхождения до получения разрешения на реализацию данной продукции. После завершения операций по упаковке любые оставшиеся упаковочные материалы с нанесенным на них номером серии должны быть уничтожены с последующим составлением протокола. Возврат на склад немаркированных упаковочных материалов производят в соответствии с утвержденной инструкцией.
 Готовая продукция
Готовая продукция
 До выдачи разрешения на реализацию готовая продукция должна содержаться под карантином в условиях хранения, установленных производителем. После выдачи разрешения на реализацию готовая продукция хранится на складе готовой продукции в условиях, установленных производителем.
До выдачи разрешения на реализацию готовая продукция должна содержаться под карантином в условиях хранения, установленных производителем. После выдачи разрешения на реализацию готовая продукция хранится на складе готовой продукции в условиях, установленных производителем.
 Отклоненные, повторно использованные и возвращенные материалы
Отклоненные, повторно использованные и возвращенные материалы
 Отклоненные материалы и продукция должны иметь четкую маркировку и храниться раздельно в зонах с ограниченным доступом. Они подлежат возврату поставщику, переработке (если это допустимо) или уничтожению. Любые выполненные действия должны быть документально оформлены и утверждены лицами, имеющими соответствующие полномочия. Переработка отклоненной продукции допускается в исключительных случаях при условии отсутствия ухудшения качества готовой продукции и выполнения всех требований спецификаций. Переработка осуществляется в соответствии с утвержденными инструкциями после оценки возможного риска с последующим документальным оформлением.
Отклоненные материалы и продукция должны иметь четкую маркировку и храниться раздельно в зонах с ограниченным доступом. Они подлежат возврату поставщику, переработке (если это допустимо) или уничтожению. Любые выполненные действия должны быть документально оформлены и утверждены лицами, имеющими соответствующие полномочия. Переработка отклоненной продукции допускается в исключительных случаях при условии отсутствия ухудшения качества готовой продукции и выполнения всех требований спецификаций. Переработка осуществляется в соответствии с утвержденными инструкциями после оценки возможного риска с последующим документальным оформлением.
 Повторное использование всей (или части) ранее произведенной серии продукции требуемого качества путем объединения ее с другой серией того же продукта на определенном этапе производства допускается только после получения предварительного разрешения, подписанного ответственными лицами. Повторное использование продукции допускается только после оценки возможного риска (в т. ч. его влияния на срок годности серии) по утвержденной инструкции с оформлением протокола. Необходимость дополнительного контроля готовой продукции, прошедшей переработку, или продукции, в которую была включена ранее изготовленная продукция, определяет отдел контроля качества.
Повторное использование всей (или части) ранее произведенной серии продукции требуемого качества путем объединения ее с другой серией того же продукта на определенном этапе производства допускается только после получения предварительного разрешения, подписанного ответственными лицами. Повторное использование продукции допускается только после оценки возможного риска (в т. ч. его влияния на срок годности серии) по утвержденной инструкции с оформлением протокола. Необходимость дополнительного контроля готовой продукции, прошедшей переработку, или продукции, в которую была включена ранее изготовленная продукция, определяет отдел контроля качества.
 Возвращенная с рынка продукция, над которой был утрачен контроль со стороны производителя, должна быть уничтожена, если не подтверждено соответствие ее качества заданным требованиям. Решение о повторной продаже, перемаркировке или повторном использовании может быть принято только после специального анализа, проведенного отделом контроля качества в соответствии с письменной инструкцией. При этом необходимо учитывать характер продукции, ее предысторию и состояние, соблюдение специальных условий хранения и время, прошедшее с даты выпуска. При любых сомнениях в отношении качества продукции не допускается ее повторное использование или повторный выпуск, но допускается ее химическая переработка с целью регенерации активных ингредиентов. Все выполняемые действия должны быть оформлены документально.
Возвращенная с рынка продукция, над которой был утрачен контроль со стороны производителя, должна быть уничтожена, если не подтверждено соответствие ее качества заданным требованиям. Решение о повторной продаже, перемаркировке или повторном использовании может быть принято только после специального анализа, проведенного отделом контроля качества в соответствии с письменной инструкцией. При этом необходимо учитывать характер продукции, ее предысторию и состояние, соблюдение специальных условий хранения и время, прошедшее с даты выпуска. При любых сомнениях в отношении качества продукции не допускается ее повторное использование или повторный выпуск, но допускается ее химическая переработка с целью регенерации активных ингредиентов. Все выполняемые действия должны быть оформлены документально.


