Практикум по органической и биоорганической химии.pptx
- Количество слайдов: 16

Практикум по органической и биоорганической химии Эшмаков Р. С.

Качественные реакции в биохимии Реакции на углеводы

Качественная реакция на углеводы (и все прочие гликоли) • Образование хелатных комплексов с медью -II в щелочной среде (растворение осадка гидроксида и синее окрашивание) • Специфическая качественная реакция на крахмал – образование внутрикомплексного соединения с йодом

Выявление восстанавливающих сахаров • Альдозы при смешении с щелочным раствором гидроксида меди-II дают желтый, а затем оранжевый осадок (даже при стоянии раствора гликолята): R-CHO + Cu(OH)2 + OH- = RCOOH + Cu(OH) + H 2 O 2 Cu. OH = Cu 2 O + H 2 O • Кетозы дают эту же реакцию при кипячении, а поли- и олигосахариды эту реакцию не дают.

Гидролиз олиго- и полисахараидов • Сахароза и крахмал в кислой среде расщепляются при нагревании до мономеров. (C 6 H 10 O 5)n + H 2 O H+ n C 6 H 12 O 6 C 12 H 22 O 11 + H 2 O = 2 C 6 H 12 O 6 • Доказательством наличия восстанавливающего сахара (глюкозы) в составе крахмала и сахарозы служит окислительно-восстановительная реакция с гидроксидом меди-II.

Качественные реакции в биохимии Реакции на белки

Биуретовая реакция (на амидные группы) • Ион меди-II в щелочном растворе белка координируется 4 азотами амидных групп белка: Получившийся раствор имеет фиолетовую окраску. • Реакция идет со всеми белками, начиная с дипептидов (или с биурета)
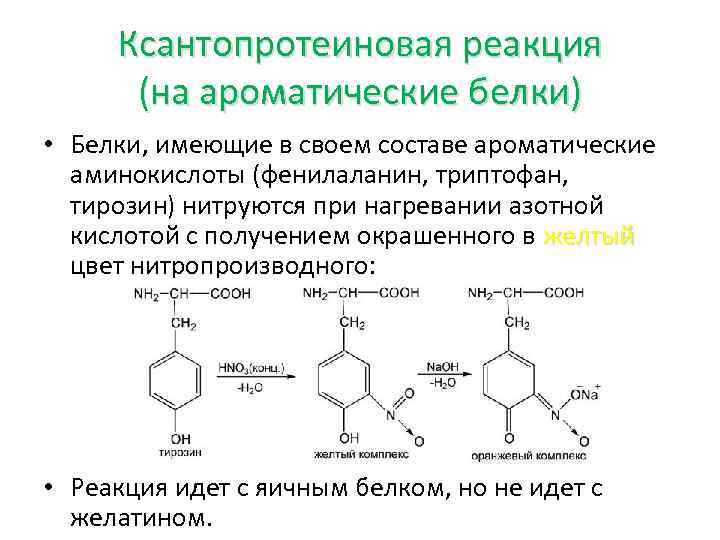
Ксантопротеиновая реакция (на ароматические белки) • Белки, имеющие в своем составе ароматические аминокислоты (фенилаланин, триптофан, тирозин) нитруются при нагревании азотной кислотой с получением окрашенного в желтый цвет нитропроизводного: • Реакция идет с яичным белком, но не идет с желатином.

Выявление серосодержащих белков • Белки, в состав которых входят серосодержащие аминокислоты (цистеин, метионин), при взаимодействии с щелочным раствором гидроксида свинца образуют сульфид свинца бурого цвета при нагревании: (CH 3 COO)2 Pb + 4 Na. OH = CH 3 COONa + Na 2[Pb(OH)4] Na 2 S + Na 2[Pb(OH)4] = 4 Na. OH + Pb. S

Осаждение белка Белки осаждаются без денатурации в разных условиях: • При нагревании белка вблизи изоэлектрической точки; • При добавлении сильных кислот; • При добавлении сильного электролита (соли) до насыщения (альбумины) или полунасыщения (глобулины).

Качественные реакции в органической химии Различение органических кислот

Различение органических кислот, дающих нерастворимые осадки • Некоторые анионы органических кислоты способны давать нерастворимые осадки с ионами металлов группы кальция (или с медью-II): 2 Na. OH + H 2 C 2 O 4 = Na 2 C 2 O 4 + 2 H 2 O Ba. Cl 2 + Na 2 C 2 O 4 = Ba. C 2 O 4 + 2 Na. Cl **Чистая щавелевая кислота - твердая ***Оксалат кальция ответственен за образование камней в почках и т. д.

Окисление органических кислот гидроксидом меди-II • Муравьиная кислота является не только кислотой, но и альдегидом. Потому ей тоже свойственна реакция «медного зеркала» : HCOOH + Na. OH = HCOONa + H 2 O 2 HCOONa + 4 Cu(OH)2 = Na 2 CO 3 + 4 Cu. OH + CO 2 + 3 H 2 O 2 Cu. OH = Cu 2 O + H 2 O **Муравьиная кислота так сильно пахнет, что ее часто проще отличить по запаху ***Однако все же большинство кислот каких-то специфических реакций не имеют

Качественные реакции в органической химии Проба на фенолы

Бромирование фенолов • Растворы фенолов реагируют с бромной водой с образованием малорастворимых производных. В случае с фенолом это белый трибромфенол, в случае же с гидрохиноном это тетрабромгидрохинон – игольчатые кристаллы цвета потемневшей латуни. **Самый обычный фенол проще определить по запаху – он пахнет гуашью (точнее, наоборот – гуашь пахнет фенолом) ***Обычно для реакции требуются весьма концентрированные растворы, иной раз раствор стоит подогреть

Образование фенолятов железа • Практически все фенолы способны давать сильно окрашенные соединения с ионами железа-III: Fe 3+ + 6 C 6 H 5 OH = [Fe(C 6 H 5 OH)6]3+ Простейшие фенолы дают темно-фиолетовую окраску, а сложные (танины, например) – почти черную. ***На этом основан один из опытов с получением «невидимых чернил»
Практикум по органической и биоорганической химии.pptx