Prakticheskiy_ekzamen.pptx
- Количество слайдов: 134

Практический экзамен

1. Окраска по Бурри-Гинсу Применяется для определения макрокапсулы. Техника: • смешать каплю взвеси бактерий с каплей туши, сделать мазок, высушить и зафиксировать • на мазок нанести водный раствор фуксина (на 1 2 минуты) • промыть водой, высушить и микроскопировать. Бактерии окрашиваются в розовый цвет, а неокрашенные капсулы контрастно выделяются на черно розовом фоне.

2. Окраска по Цилю-Нильсену Применяется для выявления кислотоустойчивых клеток (микобактерий) и обнаружения спор. Техника: • фиксировать мазок на пламени • окрашивать карболфуксином, нагревая на пламени спиртовки в течение 5 мин (или 20 мин на водяной бане) • промыть водой • обесцветить в смеси спирт кислота до сохранения слабо розовой окраски • промыть водой • дополнительно окрашивать метиленовым синим (или метиленовым синим Лёффлера) в течение 10 30 с • промыть водой и высушить на воздухе При строгом соблюдении режима окраски кислотоустойчивые клетки приобретают красный цвет, тогда как некислотоустойчивые синий. Кислотоустойчивость можно определять у клеток любого возраста.

3. Окраска по Нейссеру Применяется для обнаружения воллютина в клетках (Corynebacterium diphtheriae) Техника: • на фиксированный мазок нанести ацетат синьки Нейссера на 2 3 минуты • добавить раствор Люголя на 10 30 секунд • промыть водой • мазок докрасить водным раствором везувина или хризоидина в течение 30 60 секунд • промыть водой, высушить, микроскопировать Зерна волютина имеют щелочную реакцию, поэтому воспринимают ацетат синьки, окрашиваясь в темносиний цвет. Цитоплазма, имея кислую реакцию, воспринимает везувин и окрашивается в желтый цвет

4. Окраска по Граму Применяется для определения состава клеточной стенки Техника: • на фиксированный мазок нанести раствор генцианвиолета на 1 2 минуты, краситель слить • нанести раствор Люголя на 1 2 минуты • нанести спирт на 30 60 секунд • промыть водой • докрасить раствором фуксина в течение 1 2 минут, промыть водой, высушить и микроскопировать Гр+ бактерии – фиолетовые, Гр бактерии – красные.

5. Определение подвижности Пять методов: • Окраска по Лёффлеру • Окраска по Морозову • Метод раздавленной и висячей капли • Темнопольная микроскопия • Укол в полужидкий агар

Окраска по Лёффлеру (щелочной метиленовый синий) Для окраски жгутиков используют клетки, выращенные на скошенном агаре. Бактериальной петлей отбирают клетки, находящиеся у конденсационной воды и осторожно переносят в стерильную дистиллированную воду такой же температуры, что и температура инкубирования бактерий на скошенном агаре, а бактерии с петли не стряхивают, а осторожно погружают в воду. Пробирку с бактериями оставляют при комнатной температуре на 30 мин. Используют химически чистое (вымытое в хромовой смеси) стекло, на которое наносят 2– 3 капли суспензии. Суспензию распределяют по поверхности стекла, осторожно его наклоняя. Высушивают препарат на воздухе. Жгутики очень тонкие, поэтому их можно обнаружить только при специальной обработке. Вначале при помощи протравки достигается разбухание и увеличение их размера, а затем производится окраска препарата, благодаря чему они становятся видимыми при световой микроскопии. Жгутики окрашиваются в ярко красный цвет. Виды жгутиков: 1 – монотрихии, 2 – амфитрихии, 3 – лофотрихии, 4 – перитрихии

Окраска по Морозову (серебрение) 1) обработка препарата кислотой, при этом оболочки и жгутики разрыхляются; 2) закрепление разрыхленных структур танином; 3) обработка азотнокислым серебром, оно окутывает каждый жгутик и саму клетку толстым слоем, давая различные оттенки от жёлтого до тёмно коричневого.

Метод висячей капли Препарат готовят на покровном стекле, в центре которого наносят одну каплю бактериальной культуры. Затем предметное стекло с лункой, края которой предварительно смазывают вазелином, прижимают к покровному стеклу так, чтобы капля находилась в центре лунки. Быстрым движением переворачивают препарат покровным стеклом вверх. В правильно приготовленном препарате капля должна свободно висеть над лункой, не касаясь ее дна или края. Для микроскопии вначале используют малый сухой объектив 8 Х, под увеличением которого находят край капли, а затем устанавливают объектив 40 Х и исследуют препарат.

Метод раздавленной капли На поверхность обезжиренного предметного стекла наносят каплю исследуемого материала или суспензию бактерий и покрывают ее покровным стеклом. Капля должна быть небольшой, не выходящей за край покровного стекла. Микроскопируют препарат с объективом 40 Х. После микроскопии препараты «раздавленной» капли или «висячей» капли опускают в дезинфицирующий раствор.

Темнопольная микроскопия С помощью темнопольнои микроскопии изучают препараты типа раздавленная «капля» . Предметные стекла должны быть не толще 1, 1 1, 2 мм, покровные 0, 17 мм, без царапин и загрязнений. При приготовлении препарата следует избегать наличия пузырьков и крупных частиц (эти дефекты будут видны ярко святящимися и не позволят наблюдать препарат). Для темнопольной применяют более мощные осветители и максимальный накал лампы. Настройка темнопольного освещения в основном заключается в следующем: 1) устанавливают свет по Келеру; 2) заменяют светлопольный конденсор темнопольным; 3) на верхнюю линзу конденсора наносят иммерсионное масло или дистиллированную воду; 4) поднимают конденсор до соприкосновения с нижней поверхностью предметного стекла; 5) объектив малого увеличения фокусируют на препарат; 6)с помощью центрировочных винтов переводят в центр поля зрения светлое пятно (иногда имеющее затемненный центральный участок); 7) поднимая и опуская конденсор, добиваются исчезновения затемненного центрального участка и получения равномерно освещенного светлого пятна. Если этого сделать не удается, то надо проверить толщину предметного стекла (обычно такое явление наблюдается при использовании слишком толстых предметных стекол конус света фокусируется в толще стекла). После правильной настройки света устанавливают объектив нужного увеличения и исследуют препарат. На темном фоне видны светящиеся и подвижные микробы. Жгутики Proteus vulgaris. Темнопольная микроскопия.

Укол в полужидкий агар Культуру бактерий засевают уколом в столбик 0, 3 % питательной среды в пробирке. Пробирки помещают в термостат для инкубирования. Результаты учитывают через 24 – 48 часов. Подвижные бактерии растут по всей толще агара, вызывая диффузное помутнение среды, неподвижные – только по линии укола.

6. Бактериологический метод Это совокупность методик искусственного культивирования микроорганизмов на питательных средах в целях их идентификации при установлении диагноза инфекционного заболевания или иного вызванного микробами процесса и определения ряда физиологических свойств культуры с другими целями, например, при выборе химиотерапевтического препарата.

Этапы бактериологического анализа • Посев материала • Учёт первичных результатов • Выделение чистой культуры • Идентификация чистой культуры

Посев материала Исследуемый материал бактериальной петлёй или шпателем просеивается на поверхность плотной питательной среды (искл. кровь), чтобы получить рост изолированных колоний. Кровь засевается на жидкую питательную среду – среду обогащения, с которой затем будет сделан пересев на плотную питательную среду. Инкубация в термостате 18 24 часа при температуре 37 градусов.

Учёт первичных результатов (изучение посева) Проводят тщательное изучение подозрительных колоний, обращая внимания на следующие признаки: • Культуральные особенности (форма, величина, цвет, прозрачность) • Морфологические и тинкториальные свойства (форма, величина, расположение, окраска по Граму) • Определение подвижности • Ориентировочная реакция агглютинации на стекле (позволяет определить род по антигенной структуре)

Выделение чистой культуры Высеивают микробов, подозрительных как возбудители заболевания, на скошенный агар для выделения чистой культуры. Инкубация в термостате 18 24 часа при температуре 37 градусов. Затем проверяют культуру «на чистоту» бактериоскопическим методом.

Бактериоскопия С исследуемого материала делают мазок, окрашивают его по Граму, оценивают цвет, форму, расположение клеток. Для идентификации чистой культуры производят повторный мазок после её посева. Одна форма, цвет и размер всех клеток в мазке говорит о том, что это чистая культура. Мазок, окраска по Граму. Грамотрицательные диплококки (род Neisseria) внутри фагоцитов. Мазок чистой культуры. Грамотрицательные палочки (Pseudomonas aeruginosa)

Идентификация чистой культуры Тщательное изучение свойств чистой культуры: 1) Биохимические свойства (сахаро и протеолитические) 2) Определение факторов патогенности и вирулентности 3) Постановка серологических реакций 4) Антигенные свойства 5) Чувствительность к антибиотикам 6) Фаготипирование

7. Биохимическая идентификация Оцениваются сахаролитические и протеолитические свойства, а также активность некоторых ферментов.

Сахаролитические свойства (среды Гисса) В среду Гисса добавляется индикатор для определения сахаролитической активности: • Индикатор Андреде – кислый фуксин, едкий натр, вода дист. (от синего к красному) • Индикатор ВР водный голубой и розоловая кислота (от красного к синему) • Индикатор крезолрот (от красного к фиолетовому) I 'пестрый ряд': а жидкая среда с углеводами и индикатором Андреде; б полужидкая среда с индикатором ВР: 1 микроорганизмы не ферментируют углевод; 2 микроорганизмы ферментируют углевод с образованием кислоты; 3 микроорганизмы ферментируют углевод с образованием кислоты и газа

Сахаролитические свойства (среды Гисса) Посев культуры на «пёстрый ряд» (среды Гисса с добавлением различных углеводов, чаще всего это глюкоза, манит, мальтоза, лактоза, сахароза) и инкубация. Изменение цвета среды говорит о наличии кислоты, а разрыв среды – газа. Глюкоза, манит, мальтоза, сахароза

Сахаролитические свойства (среда Рапопорта) Жидкая среда Рапопорта (только энтеробактерии) применяется для определения продуктов ферментации углеводов. Изменение цвета среды после инкубации говорит о наличии кислоты, а поднятие поплавка на поверхность – о наличии газа. Поплавок на поверхности среды Вывод: данная культура ферментирует углеводы до кислоты и газа.
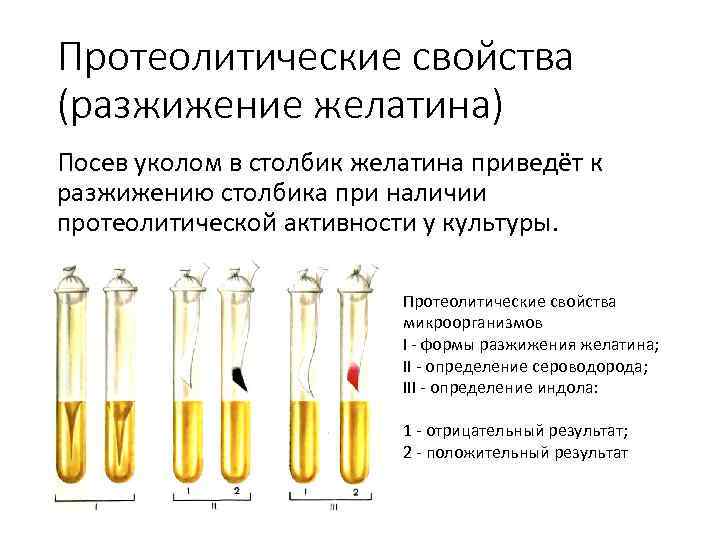
Протеолитические свойства (разжижение желатина) Посев уколом в столбик желатина приведёт к разжижению столбика при наличии протеолитической активности у культуры. Протеолитические свойства микроорганизмов I формы разжижения желатина; II определение сероводорода; III определение индола: 1 отрицательный результат; 2 положительный результат

Протеолитические свойства (образование индола) Индол определяют методом Мореля. Для этого делают посев культуры в МПБ с добавлением триптофана и под пробку помещают фильтровальную бумагу, пропитанную щавелевой кислотой. При наличии индола нижняя часть бумаги покраснеет. Также применяется реактив Эрлиха. В посев добавляют специальный реактив. При наличии индола наблюдается красное окрашивание.

Протеолитические свойства (образование сероводорода) Под пробку пробирки с посевом кладут фильтровальную бумагу, пропитанную ацетатом свинца. В присутствии сероводорода бумага почернеет. Также применяется посев на среды Клиглера или Олькеницкого. (см. питательные среды) – место посева в культуру почернеет.

Протеолитические свойства (образование аммиака) Под пробку пробирки с посевом кладут лакмусовую бумагу так, чтобы она не касалась среды. При наличии аммиака бумага посинеет. В растворе аммиака лакмус меняет цвет с красного на синий

Протеолитические свойства (гидролиз казеина) Обезжиренное молоко диализуют для удаления лактозы, которая ингибирует гидролиз казеина. В расплавленный питательный агар с двойной концентрацией агара добавляют равный объем стерилизованного автокла вированием диализованного молока. Исследуемую культуру бак терий засевают «штрихом» на поверхность питательной среды, разлитой в чашки Петри. Посевы инкубируют до 14 сут. Перед учетом результатов поверхность среды заливают 10% м раство ром соляной кислоты. Положительный результат — просветле ние среды вокруг колоний.

Восстановление нитратов (денитрификация) Диссимиляционное восстановление нитрата является процессом анаэробного дыхания, то есть использования нитратов и продуктов их частичного восстановления вместо кислорода для окисления веществ (у разных микроорганизмов как органических, так и минеральных) в ходе метаболизма с выделением энергии. Стадии: Катализируют реакции нитратредуктаза, NO образующая нитритредуктаза, редуктаза окиси азота и редуктаза закиси (гемиоксида) азота соответственно.

Восстановление нитратов в нитриты (денитрификация) Культуру микроорганизма засе вают в МПБ, содержащий 0, 2 % нитрата калия, инкубируют 48. . . 72 ч, затем в опытную и контрольную пробирки добавляют по 1 мл реактива с крахмалом (растворимый крахмал — 1 г, вода дистиллированная — 100 мл, йодид калия — 0, 5 г). К этому ра створу перед постановкой реакции добавляют несколько капель 10% го раствора соляной кислоты. Положительный результат— темно синее окрашивание.
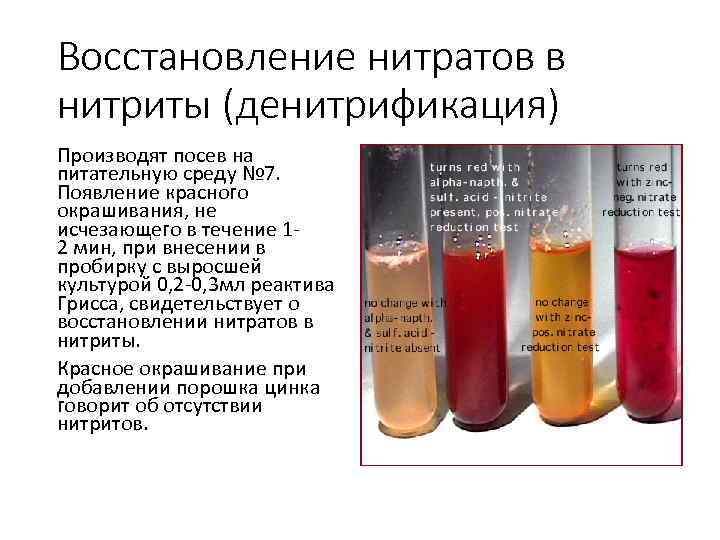
Восстановление нитратов в нитриты (денитрификация) Производят посев на питательную среду № 7. Появление красного окрашивания, не исчезающего в течение 1 2 мин, при внесении в пробирку с выросшей культурой 0, 2 0, 3 мл реактива Грисса, свидетельствует о восстановлении нитратов в нитриты. Красное окрашивание при добавлении порошка цинка говорит об отсутствии нитритов.

Восстановление нитратов в нитриты (нитрозаминовая проба) Используется для диагностики холеры. После выделения культуры холерного вибриона часть пептонной воды переносят в другую пробирку для постановки нитрозоиндоловой пробы. Для этого добавляют несколько капель серной кислоты. В положительном случае появляется розовое окрашивание вследствие образования нитрозоиндола (из индола и нитритов, которые образуются под влиянием холерного вибриона).

8. Питательные среды Простые среды Сложные среды: • Специальные • Селективные • Накопительные Дифференциально диагностические среды Транспортные и консервационные среды (среда Амиеса – полужидкий агар с активированным углём, глюкозодрожжевая среда) Среды для хранения культур (глицерин для среды Дорсе)

Простые питательные среды Служат для первичного выделения колоний с исследуемого материала. Это мясопептонный бульон (жидкая среда) и мясопептонный агар (плотная среда).

Специальные питательные среды Это среды, на которых создаются условия для выращивания тех бактерий, которые не растут на простых средах. Кровяной агар или кровяной бульон – получают путем добавле ния к питательной среде 5 10% подогретой стерильной дефибринированной крови барана, кролика лошади, человека. Среда используется для выделения стрептококков, пневмококков и других бактерий, а также для изучения гемолитической активности (A, B, Y гемолиз, см. Гемолизин).

Специальные питательные среды Сывороточный бульон или сывороточный агар получают, путем добавления к простым средам 15 20% лошадиной или бычьей сыворотки. Среда применяется для выделения пневмококков, менингококков. Желчный бульон или желчный агар получают путем добавления к питательной среде медицинской желчи без консерванта, или свежеполученной от крупного рогатого скота. Среда применяется для выделения брюшнотифозных, паратифозных и дизенте рийных палочек.

Специальные питательные среды Среда Китта-Тароцци состоит из питательного бульона, глю козы и кусочков печени или мясного фаршадля адсорбции кислорода.

Специальные питательные среды Казеиново-угольный агар плотная селективная питательная среда для выделения возбудителя коклюша, содержащая солянокислый гидролизат казеина, диализат дрожжей, активированный уголь, цистеин и неорганические соли.

Специальные питательные среды Среда Левенштейна-Йенсена используется для выявления культур микобактерий туберкулёза.

Элективные питательные среды содержат дополнительные вещества, задерживающие рост грамположительных бактерий. Селективные питательные среды стимулируют рост одних микробов и угнетают рост других. Селективные условия получают путем добавления в сре ду химических веществ. Так как в этих средах патогенные бактерии размножаются и накапливаются, их называют также средами обогащения (жидкие среды при этом называют средами накопления).

Элективные питательные среды Желточно-солевой агар (ЖСА) – среда для выделе ния стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта сре да является и дифференциально диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки. Лецитиназа расщеп ляет лецитин на фосфорхолины и нерастворимые в воде жирные кисло ты, поэтому среда вокруг лецитиназоположительных колоний мутнеет и появляется опалесцирующая зона в виде «радужного венчика» .

Элективные питательные среды Теллуритовые среды (сывороточно теллуритовый агар, кровяно теллуритовый агар) – селективные среды для выделения дифтерийных бактерий, содержат теллурит калия. Бесцветная соль теллура, содержащаяся в питательной среде, восстанавливается дифтерийными бактерия ми до металла, окрашивающего колонии в черный цвет. Corynebacterium diphteriae на кровяно теллуритовом агаре.

Элективные питательные среды Среда Плоскирева содержит кроме лактозы и индикатора (нейтрального красного) еще и бриллиантовый зеленый, соли желчных кислот, минеральные соли. Раньше эту среду часто называли «бактоагар Ж» . За рубежом аналогом этой среды выступает “Mac. Conkey Agar”. • Лактозо положительные колонии на среде Плоскирева – красные. • Лактозо отрицательные колонии на среде Плоскирева бесцветные.

Элективные питательные среды Сахарный бульон (МПБ + глюкоза 0, 2% р р) – среда для выделения стрептококков, а также для обогащения материала (посев крови > инкубация > пересев на селективную среду).

Элективные питательные среды Селенитовая среда является лучшей средой обогащена для сальмонелл и дизентерийных микробов Зонне. Селенит натрия, содержащийся в среде, стимулирует рост этих бактерий и подавляет рост сопутствующей флоры.
Элективные питательные среды Висмут-сульфит агар (среда Вильсона Блера) – содержит соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний чернота цвета. Другие виды бактерий на этой среде роста не дают.
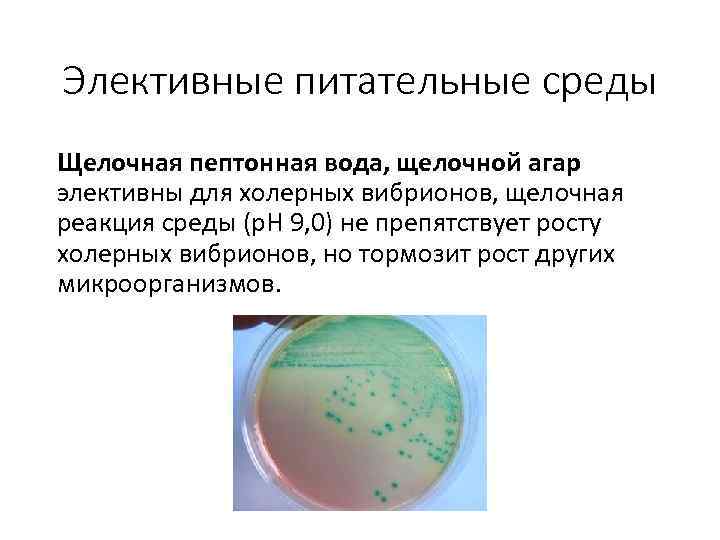
Элективные питательные среды Щелочная пептонная вода, щелочной агар элективны для холерных вибрионов, щелочная реакция среды (р. Н 9, 0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов.

Элективные питательные среды TCBS агар (тиосульфат агар) также применяется для диагностики холеры. Колонии холерных вибрионов имеют характерный жёлтый цвет.

Дифференциально-диагностические питательные среды Дифференциально-диагностические среды позволяют различить один вид микроба от другого. Принцип построения дифференциально диагностических сред основан на разной биохимической активности бактерий. В состав дифференциально диагностических сред входит основная пи тательная среда, обеспечивающая размножение бактерий, определенный химический субстрат, различное отношение к которому является диагнос тическим признаком, индикатор, изменение цвета которого свидетельству ет о разложении субстрата и образовании кислых продуктов. К дифференциально диагностическим средам относят агар Эндо, среду Левина, среды Гисса.

Дифференциально-диагностические питательные среды Среда Эндо (в англоязычной литературе “Endo Agar”) содержит в качестве индикатора основной фуксин, обесцвеченный сульфитом натрия. • Лактозо положительные колонии на среде Эндо – красные (кишечная палочка с типичной биохимической активностью образует на этой среде темно красные колонии с металлическим блеском, схожим с блеском ртути). • Лактозо отрицательные колонии на среде Эндо бесцветные, но так как энтеробактерии образуют прозрачные и полупрозрачные колонии, то они могут приобретать оттенок той среды, на которой вырастают.

Дифференциально-диагностические питательные среды Среда Левина содержит К 2 НРО 4 (гидроортофосфат калия), метиленовый синий и эозин. В англоязычной литературе более употребительное название для этой среды “Eosin Methylene Blue Agar”, иногда – “Eosin Methylene Blue Agar (Levine)”. • Лактозо положительные колонии на среде Левина – насыщенного синего цвета. • Лактозо отрицательные колонии на среде Левина бесцветные.

9. Методы вирусологических исследований • Вирусоскопическое исследование позволяет обнаружить характерные вирусные включения, а электронная микроскопия сами вирионы, и по особенностям их строения диагностировать соответствующую инфекцию (например, ротавирусную). • Вирусологическое исследование направлено на выделение вируса и его идентификацию. Для выделения вирусов используют заражение лабораторных животных, куриных эмбрионов или культуры тканей.

9. Методы вирусологических исследований Индикация вирусов лабораторный процесс установления присутствия неидентифицированных вирусов в исследуемом материале или в системе культивирования вирусов. Наличие вируса устанавливается: • По характеру специфических поражений оболочек и тела эмбриона • По феномену гемагглютинации • По цитопатическому действию вируса • По образованию в клетках включений • По образованию бляшек • По феномену гемадсорбции • По цветной реакции

9. Методы вирусологических исследований Первичную идентификацию выделенного вируса до уровня семейства можно провести с помощью: определения типа нуклеиновой кислоты (проба с бромдезоксиуридоном), особенностей ее строения (электронная микроскопия), размером вириона (фильтрование через мембранные фильтры с порами диаметром 50 и 100 нм), наличия суперкапсидной оболочки (проба с эфиром), гемагглютининов (реакция гемагглютинации), типа симметрии нуклеокапсида (электронная микроскопия).

9. Методы вирусологических исследований Для диагностики вирусных инфекций широкое применение нашли методы иммунодиагностики (серодиагностики и иммуноиндикации). Они реализуются в самых разнообразных реакциях иммунитета: • радиоизотопный иммунный анализ (РИА), • иммуноферментный анализ (ИФА), • реакция иммунофлюоресценции (РИФ), • реакция связывания комплемента (РСК), • реакция пассивной гемагглютинации (РПГА), • реакции торможения гемагглютинации (РТГА) и другие.

10, 11. Культивирование анаэробов Методы создания анаэробных условий 1. Физичесикие методы. Для удаления растворенного в питательных средах кислорода используют их регенерацию путем кипячения в течение 15 20 минут на водяной бане с последующим быстрым охлаждением до 50 градусов. После посева поверхность среды заливают парафином или вазелиновым маслом. Так же, возможен посев в столбик плотной или полужидкой среды на глубину 10 12 см. кислород с воздуха диффундирует на 1, 5 2 см, а в глубине создаются благоприятные условия. Применение анаэростатов и анаэробных боксов. 2. Химические методы. Для поглощения кислорода из замкнутого простанства можно использовать гидросульфит натрия. Для связывания кислорода в 1 л объема используют 100 мл свежеприготовленного 20% Na 2 S 2 O 4 и 16 мл 50% КОН. Для связывания остатков кислорода используют вещества редуценты, к которым относится тиогликоевая кислота или тиогликолат натрия, аскорбиновая кислота, различные сахара, цистин и цистеин, муравьинокислый натрий и т. д. 3. Биологические методы. Совместнео выращиевание анаэробов и аэробов (метод Фортнера). При нем на одну половину чашку засевают исследуемы материал, а на другую – культуру аэробного или факультативно анаэробного микроба, способного энергично поглощать кислород. Помещение в среду кусочков печени, почек, мозга. При это тканевые клетки активно поглощают и адсорбируют кислород, а в среде создаются анаэробные условия.

10, 11. Культивирование анаэробов Питательные среды, на которых выращивают анаэробы, по своему составу аналогичны обычным средам. Отличаются лишь тем, что они сами по себе должны создавать анаэробные условия. С этой целью питательные среды разливаются высоким столбиком, до посева жидкие среды кипятят для удаления из них кислорода, а на их поверхность наслаивают вазелиновое масло для изоляции от атмосферного кислорода. Кроме этого в состав питательных сред входят различные редуцирующие вещества, уменьшающие содержание в них свободного кислорода. В качестве редуцирующих веществ обычно используют глюкозу (1 2% ную), муравьинокислый натрий 0, 3 0, 5% ный и пр. Часто в жидкие питательные среды опускают какие либопористые вещества (кусочки тканей, пемзу, вату), которые адсорбируютна своей поверхности воздух. Для выделения анаэробных бактерий из патологического материала, а также для их накопления и сохранения используют жидкую питательную среду Китта Тароцци (мясо пептонный печеночный бульон — МППБ). В состав МППБ входит печеночный экстракт с МПБ (1: 1), который разливают по пробиркам высоким столбиком. На дно пробирки предварительно помещают кусочки вареной печени, а сверху после разлива среды наслаивают вазелиновое масло.

10, 11. Культивирование анаэробов • В ряде случаев к МППБ добавляют стерильный раствор глюкозы в количестве 0, 5 % (в пересчете на сухое вещество). • Для дифференциации патогенных анаэробов используют среды: кровяной агар Цейсслера, сахарный МПА, молоко, железо сульфатный агар (среда Вильсона Блера) и др. • Кровяной агар (Цейсслера): 3% ный мясо пептонный агар с 1 2 % глюкозы, смешивают (при температуре 50 °С) с 15 20 % свежей де фибринированной крови барана, крупного рогатого скота, лошади. • Пользуются также кровью кролика или морской свинки, добавляя ее в количестве 5 7 %. Питательную среду разливают по чашкам Петри и подсушивают в термостате 20 30 мин. После посева культуры выращивают в анаэробных условиях. • Сахарный агар готовят на бульоне Мартена с добавлением 0, 1 % глюкозы и 2 % агара. • Молоко обезжиривают и разливают по пробиркам высоким столбиком и сверху наслаивают вазелиновое масло. • Железо-сульфитный агар (Вильсона-Блера). К 100 мл 3% ного МПАс 10% глюкозы прибавляют 10 мл 20% ного раствора сульфита натрия и 1 мл 8% ного раствора хлорида железа. Черные колонии образуют анаэробные бактерии за счет восстановления сульфита натрия в сульфат натрия, который, соединяясь с хлорным железом, образует черный осадок сульфида железа.

10, 11. Культивирование анаэробов • Методы выделения чистых культур анаэробов. • Метод Цейсслера. Исследуемый материал сеют штрихами по поверхности плотной среды. Создают анаэробные условия. И инкубируют при 37 градусах 24 72 ч. Изолированные колонии анаэробов пересевают на среду контроля стерильности или среду Китта Тароцци. • Метод Вейнберга. Несколько капель исследуемого материал вносят в пробирку с 4 5 мл изотонического раствора. Перемешивают запаянным капилляром переносят в пробирку с охлажденным до 45 50 градусов сахарным агаром, разлитым высоким столбиком. После перемешивания этим же капилляром засевают еще две пробирки с сахарным агаром и быстро охлаждают под струей воды. Выросшие в глубине колонии пересевают на СКС или среду Китта. Тароцци. • Метод Перетца. Готовят разведение материала, как указано выше. Содержимое пробирки с соответствующим разведением выливают в чашку Петри, на дне которой на двух палочках лежит стеклянная пластина 6 х6 см. среду заливают так, что бы она заполнила пространство между пластиной и дном чашки. При появлении роста пластинку поднимают и чистые колонии пересевают.

10, 11. Культивирование анаэробов • Метод Фортнера – посев аэробов и анаэробов на одну среду, которая заливается вазелином. Инкубация. Сначала рост аэробов, затем их гибель. Рост анаэробов.

12. Культивирование аэробов • Метод Коха небольшое количество исследуемого материала вносят петлей в расплавленный и остуженный до 43°С агар в пробирке, тщательно перемешивают и смесь выливают в чашку Петри. Микробы в форме изолированных колоний растут как по поверхности агара (аэробы), так и внутри него (анаэробы).

12. Культивирование аэробов • Метод Дригальского широко применяется в бактериологической практике, при этом исследуемый материал разводят в пробирке стерильным физиологическим раствором или бульоном. Одну каплю материала вносят в первую чашку и стерильным стеклянным шпателем распределяют по поверхности среды. Затем этим же шпателем (не прожигая его в пламени горелки) делают такой же посев во второй и третьей чашках. С каждым посевом бактерий на шпателе остается все меньше и, при посеве на третью чашку, бактерии будут распределяться по поверхности питательной среды отдельно друг от друга. Через 1 7 сут выдерживания чашек в термостате (в зависимости от скорости роста микроорганизмов) на третьей чашке каждая бактерия дает клон клеток, образуя изолированную колонию, которую пересевают на скошенный агар с целью накопления чистой культуры.

12. Культивирование аэробов Метод Шукевича применяется для получения чистой культуры протея и других микроорганизмов обладающих «ползущим» ростом. Посев исследуемого материала производят в конденсационную воду у основания скошенного агара. Подвижные микробы (протей) способны подниматься вверх по скошенному агару , неподвижные формы остаются расти внизу на месте посева. Пересевая верхние края культуры можно получить чистую культуру.

12. Культивирование анаэробов • Метод Хангейта расплавленную агаризированную среду засевают бактериями при постоянном токе через пробирку инертного газа, освобожденного от примеси кислорода. Затем пробирку закрывают резиновой пробкой и помещают горизонтально в зажим, вращающий пробирку, среда при этом равномерно распределяется по стенкам пробирки и застывает тонким слоем. Применение тонкого слоя в пробирке, заполненной газовой смесью, позволяет получить изолированные колонии, хорошо видимые невооруженным глазом.

12. Культивирование аэробов Биологический метод получения чистых культур основан на заражении чувствительных экспериментальных животных исследуемым материалом, содержащим микробные ассоциации. Например, пневмококки можно выделить из мокроты, заражая чувствительную к ним белую мышь. Через 4 ч в крови мыши обнаруживают чистую культуру пневмококков, так как они опережают размножение других микроорганизмов.

13. Методы физической стерилизации • • • Прокаливание на огне Кипячение Высушивание Сухой жар Пар под давлением Текущий пар Пастеризация Тиндализация Лучистая энергия Ультразвук

Стерилизация сухим жаром • Стерилизация сухим жаром применяется для обеспложивания стеклянной посуды, пробирок, колб, чашек Петри и пипеток. Для этой цели используют сухожаровые шкафы (печи Пастера), в который необходимый эффект достигается при температуре 160 градусов в течение 2 часов или при температуре 170 градусов в течение 40 минут. • Принципиальные преимущества сухого жара заключаются в том, что при его применении не происходит коррозии металлов и инструментов, не повреждаются стеклянные поверхности. Он пригоден для стерилизации порошков и не содержащих воды нелетучих вязких жидкостей.

Стерилизация паром под давлением • Стерилизация паром под давлением – один из наиболее эффективных методов, основанный на сильном гидролизирущем действии насыщенного пара. Паром под давлением стерилизуют различные питательные среды (кроме содержащих нативные белки): жидкости, приборы, резиновые предметы, стеклянную посуду с резиновыми пробками. Для этого применяют автоклавы. • Питательные среды, перевязочные материалы и белье стерилизуют при 1 атм 15 20 минут, питательные среды с углеводами – при 0, 5 атм 15 минут, а патогенный материал обеззараживают при 2 атм.

14. Механическая стерилизация • Метод состоит в отделении микробов от жидкости с помощью стерильных микропористых фильтров • Механизм фильтрации объясняется главным образом адсорбцией микробов, происходящей в порах фильтрующих материалов, которые в большинстве случаев заряжены отрицательно. • В качестве микропористого фильтрующего материала используют каолин, фарфор, бумажно асбестовую массу, инфузорную землю, коллодий и другие пористые материалы, а также стекло.

14. Механическая стерилизация • По механизму действия фильтрующие перегородки, используемые для стерильной фильтрации, подразделяют на глубинные и поверхностные (мембранные) с размером пор не более 0, 3 мкм. • Глубинные фильтры характеризуются сложным механизмом задержания микроорганизмов (ситовым, адсорбционным, инерционным). Ввиду большой толщины таких фильтров удерживаются и частицы меньшего размера, чем размер пор фильтрующей перегородки. • Глубинные фильтры бывают: керамические и фарфоровые (размер пор 3 4 мкм), стеклянные (около 2 мкм), бумажно асбестовые (1 1, 8 мкм). Недостатками керамических и фарфоровых фильтров является продолжительность стерилизации, потеря раствора в порах толстого фильтра, образование микротрещин из за хрупкости материала и, следовательно, ненадежность стерилизации.

14. Механическая стерилизация • Стеклянные фильтры малопроизводительны, бумажно асбестовые фильтры не рекомендуются для стерилизации инъекционных растворов, поскольку они состоят из волокнистых материалов и имеется угроза отрыва волокон от фильтра. Попадая в организм с раствором, такие волокна могут вызывать различные патологические реакции. • Получившие в последние годы большое распространение для стерилизующей фильтрации микропористые мембранные фильтры, лишены этих недостатков. • Мембранные фильтры представляют собой тонкие (100 150 мкм) пластины из полимерных материалов, характеризующиеся ситовым механизмом задержания микроорганизмов и постоянным размером пор (около 0, 3 мкм). Во избежание быстрого засорения фильтра мембраны используют в сочетании с префильтрами, имеющими более крупные поры. При стерилизации больших объемов растворов оптимальным является применение фильтров обоих типов.

15. Дезинфекция • Это уничтожение или резкое подавление численности патогенных микроорганизмов с помощью химических веществ. • Различают профилактическую, текущую и заключительную дезинфекцию: • профилактическая — проводится постоянно, независимо от эпидемической обстановки: мытьё рук, окружающих предметов с использованием моющих и чистящих средств, содержащих бактерицидные добавки. • текущая — проводится у постели больного, в изоляторах медицинских пунктов, лечебных учреждениях с целью предупреждения распространения инфекционных заболеваний за пределы очага. • заключительная — проводится после изоляции, госпитализации, выздоровления или смерти больного с целью освобождения эпидемического очага от возбудителей, рассеянных больным.

15. Дезинфекция Виды химических веществ: 1. ПАВ 2. Фенол, крезол 3. Формальдегид 4. Окислители 5. Хлорсодержащие вещества 6. Акридины 7. Соли тяжёлых металлов

16. Контроль стерилизации и дезинфекции • Физические методы контроля осуществляются с помощью средств измерения температуры (термометры, термопары), давления (манометры, мановакуумметры) и времени (таймеры). Современные стерилизаторы оснащены также записывающими устройствами, фиксирующими отдельные параметры каждого цикла стерилизации.

16. Контроль стерилизации и дезинфекции • Химические методы – индикаторы • Индикаторы 1 -го класса являются индикаторами ("свидетелями") процесса. Примером такого индикатора является термоиндикаторная лента, наклеиваемая перед проведением стерилизации на текстильные упаковки или стерилизационные коробки. Изменение цвета ленты указывает, что упаковка подверглась воздействию процесса стерилизации. Такие же индикаторы могут помещаться в наборы хирургических инструментов или операционного белья. • 2 -й класс индикаторов предназначен для использования в специальных тестовых процедурах, например, при проведении теста Бовье Дика (Bowie Dick test). Этот тест не контролирует параметры стерилизации, он оценивает эффективность удаления воздуха из камеры парового стерилизатора. • Индикаторы 3 -го класса являются индикаторами одного параметра. Они оценивают максимальную температуру, но не дают представления о времени ее воздействия. Примерами такого рода индикаторов являются описанные выше химические вещества. • 4 -й класс это многопараметровые индикаторы. Они содержат красители, изменяющие свой цвет при сочетанном воздействии нескольких параметров стерилизации, чаще всего температуры и времени. Примером таких индикаторов служат термовременные индикаторы для контроля воздушной стерилизации. • 5 -й класс интегрирующие индикаторы. Эти индикаторы реагируют на все критические параметры метода стерилизации. Характеристика этого класса индикаторов сравнивается с инактивацией высокорезистентных микроорганизмов. • 6 -й класс индикаторы эмуляторы. Эти индикаторы должны реагировать на все контрольные значения критических параметров метода стерилизации.

16. Контроль стерилизации и дезинфекции • Наряду с физическими и химическими применяется бактериологический метод контроля стерилизации. Он предназначается для контроля эффективности стерилизационного оборудования. До недавнего времени для контроля паровой и воздушной стерилизации использовались пробы садовой земли, содержащей микроорганизмы, высокорезистентные к воздействию стерилизующих факторов. Однако устойчивость микроорганизмов в различных пробах неодинакова, что не позволяет стандартизировать результаты контроля. • В настоящее время для проведения бактериологического контроля используются биотесты, имеющие дозированное количество спор тест культуры. Контроль эффективности стерилизации с помощью биотестов рекомендуется проводить 1 раз в 2 недели. В зарубежной практике принято применять биологическое тестирование не реже 1 раза в неделю. • В ряде случаев возникает необходимость проведения контроля с помощью биотестов каждой загрузки стерилизатора. Прежде всего, речь идет о стерилизации инструментов, используемых для выполнения сложных оперативных вмешательств, требующих применения высоконадежных стерильных материалов. Каждая загрузка имплантируемых изделий также должна подвергаться бактериологическому контролю. При этом использование простерилизованных материалов задерживается до получения отрицательных результатов контроля. Тех же принципов при определении периодичности контроля рекомендуется придерживаться в отношении газовой стерилизации, являющейся по сравнению с другими методами более сложной.

16. Контроль стерилизации и дезинфекции • Контроль качества дезинфекции осуществляется методом смывов, которые берут с поверхности изделий медицинского назначения до проведения дезинфекции и после неё. У изделий, имеющих функциональные каналы, рабочий конец изделия опускают в пробирку со стерильной водопроводной водой или нейтрализатором и с помощью стерильного шприца или пипетки промывают канал этим раствором. Контролю подлежит 1% от одновременно обработанных изделий, но не менее 3 5 единиц. О качественно проведенной дезинфекции говорит отсутствие роста санитарно показательной микрофлоры (БГКП, синегнойной палочки, золотистого стафилококка).

17. Определение ОМЧ методом Коха • Суть метода: чашка с питательной средой ставится на рабочем столе, открывается на 10 мин, закрывается и ставится в термостат, где выдерживается двое суток при температуре 37°С, а затем двое суток при комнатной температуре. После этого проводится подсчет выросших колоний по формуле Омелянского.

17. Определение ОМЧ методом Коха • Расчет по модифицированной формуле Омелянского ведется на 1 м 2 поверхности: • X = n. 104 / p. r 2. t , • где X ОМЧ воздуха обследуемого помещения (КОЕ); п - количество колоний на чашке (КОЕ); t - время экспозиции чашки (мин); p. r 2 площадь чашки Петри (см 2); 104 пересчет м 2 в см 2. • Формула Омелянского, даже модифицированная, имеет ряд существенных недостатков: 1) нельзя определить точный объем воздуха, из которого микробы оседают на чашку; 2) мелкодисперсная фаза аэрозоля (а с ним и микробы) практически не оседает и токами воздуха постоянно поддерживается во взвешенном состоянии. • Результаты, получаемые с помощью этого метода, позволяют сравнить, сопоставить степень микробной обсемененности разных помещений и ориентироваться при разработке мероприятий по очищению воздушной среды.

18. Определение ОМЧ методом Кротова • Аспирационный метод изучения микрофлоры воздуха основан на использовании ударной струи воздуха, получаемый с помощью аппарата Кротова или других подобных ему аппаратов (импактеры (ПУ 1 Б), импинджеры (ПОВ 1), система Hi. Air Petri. TM. Последняя позволяет пропускать до 1000 л воздуха за 200 сек. ). Достоинства этого метода: • точно учитывается объем воздуха, пропускаемого через чашку с питательной средой, установленную в аппарате; • принцип ударной струи воздуха способствует фиксации на влажной поверхности питательной среде всех взвешенных частиц аэрозоля. • Таким образом, удается фиксировать на поверхности плотной питательной среды максимальное количество микроорганизмов, обитающих в воздухе. Используя различные виды элективных и дифференциально диагностических питательных сред, можно выявлять в воздухе все основные группы патогенных и условно патогенных микроорганизмов.

19. Метод мембранных фильтров • Сущность метода мембранных фильтров заключается в фильтровании определенных объемов исследуемой жидкости (или твердого вещества, разведенного в воде) через мембранные фильтры № 2 или № 3, на которых задерживаются бактерии. Фильтры переносят на чашки со средой Эндо, инкубируемые при t° 37°, а затем исследуют выросшие на поверхности фильтра темно красные с металлическим блеском, розовые и прозрачные колонии. Из колоний каждого типа готовят мазки и окрашивают их по Граму. Колонии разных типов проверяют на оксидазную активность, которая должна быть отрицательной. Бесцветные и розовые колонии дополнительно засевают на полужидкую среду с глюкозой и индикатором, на которой в течение 24 часовой инкубации при t° 37° должны образовываться кислота и газ. Для определения коли индекса подсчитывают выросшие на фильтре колонии кишечной палочки и затем проводят перерасчет на 1 л, 1 кг или 1 г в зависимости от исследуемого материала.

20. Метод Эйкмана • Первый этап (1 ый день) – делают посев на среду Эйкмана (глюкозопептонная среда – ГПС) с поплавками для сбора газа и посевы ставят в термостат (инкубируют) при 43°C на 24 часа. • Для посева малых объёмов воды используется разведённая среда Эйкмана (1% пептон; 0, 4% Na. Cl; 0, 5% глюкоза). • Для посева больших объёмов – концентрированная среда Эйкмана, содержащая 10 кратную концентрацию основных компонентов. • Концентрированную среду Эйкмана используют для анализа водопроводной воды. Делают посев двух проб воды по 100 мл в колбы с 10 мл среды и десяти проб по 10 мл воды в пробирки с 1 мл среды. Таким образом, объем засеянной воды – 300 мл: 2 колбы по 100 мл и 10 пробирок по 10 мл. • Второй этап (2 ой день) – делают пересевы на среду Эндо и РДА (розолово дифференциальный агар) из тех колб и пробирок, где наблюдается рост. Признаки роста E. coli на среде Эйкмана диффузное помутнение и образование газа. Посевы инкубируют при 37°C 24 часа.

20. Метод Эйкмана • Третий этап (3 ий день) – просматривают посевы на среде Эндо и РДА. Признаки роста E. coli на среде Эндо образование гладких колоний красного цвета, с металлическим блеском. Признаки роста E. coli на РДА пожелтение среды, вспенивание конденсационной жидкости и разрывы в РДА. • Проводят микроскопическое подтверждение E. coli: из подозрительных колоний делают мазки и окрашивают по Граму; под микроскопом наблюдают грам « » мелкие палочки. • Проводят биохимическое подтверждение E. coli оксидазный тест на цитохромоксидазу. Если есть цитохромоксидаза бумажка синеет в течение 1 минуты. E. coli оксидазоотрицательная. Оксидазный тест позволяет отличить E. coli от грамотрицательных, но оксидазоположительных бактерий семейства Pseudomonadaceae. • Если обнаруживают в мазках грам « » мелкие палочки, которые являются оксидазоотрицательными, результат анализа считается положительным (вывод: обнаружена кишечная палочка).

21. ОМЧ и фекальное загрязнение почвы • Для определения ОМЧ почву берут на глубине 10 15 см стерильным ножом (из разных мест не менее 10 проб) в стерильную банку. Из проб готовят навеску 30 г, которую вносят в колбу с водой (270 мл) и тщательно встряхивают. Готовят разведения 10 3, 10 4, 10 5. Из 2 х последних разведений 0, 1 мл смешивают с 40 мл 0, 7% расплавленного и остуженного до 450 С МПА, после чего выливают двойным слоем в чашки с 2% агаром. Инкубируют в термостате. Подсчитывают количество выросших колоний.

21. ОМЧ и фекальное загрязнение почвы • Присутствие в почве Е. coli и Streptococcus faecalis указывает на свежее; Citrobacter и Enterobacter – не свежее, a Clostridium perfringens – на давнее загрязнение. Более точная оценка – с помощью определения коли индекса (кол во БГКП в 1 г почвы), перфрингенс титра (масса почвы, в которой обнаружена особь вида Cl. perfringens), общей численности сапрофитных, термофильных и нитрифицирующих бактерий в 1 г почвы.

22. Метод стандартных дисков • Заселение культуры газоном на агар в чашке Петри • Диски с антибиотиком • Инкубация 24 ч. 37 градусов • Зоны подавления роста: <15 мм – слабая чувствительность 15 25 мм – средняя чувситвительность >25 мм – высокая чувствительность нет – нет чувствительности

23. Метод серийных разведений • Помещают антибиотик в бульон • Посев культуры • Инкубация 24 часа при температуре 37 градусов Если бульон мутный – нужно повысить концентрацию антибиотика и повторить. МПК – наименьшая концентрация для подавления роста МБК – наименьшая концентрация для гибели культуры. Определяется по заселению в прозрачный бульон с разными концентрациями, где помутнения нет после первого опыта – концентрация = МБК.
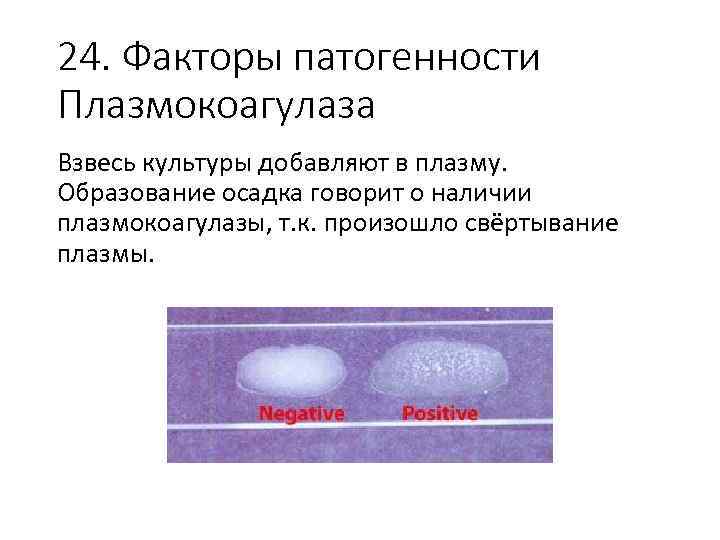
24. Факторы патогенности Плазмокоагулаза Взвесь культуры добавляют в плазму. Образование осадка говорит о наличии плазмокоагулазы, т. к. произошло свёртывание плазмы.

Гиалуронидаза В пробирку с экстрактом пупочного канатика добавляют чистую культуру и инкубируют 15 20 минут. Затем добавляют ледяную уксусную кислоту. Если гиалуронидаза есть, ткань пупочного канатика будет разрушена, поэтому содержимое пробирки будет прозрачным. Иначе будут наблюдаться муциновые (слизистые) сгустки.

Лецитиназа Производят посев культуры на желточно солевой агар (ЖСА). Лецитиназа разлагает желток, поэтому вокруг культур лецитиназо положительных микроорганизмов будет наблюдаться просветление среды в виде радужного венчика.

Гемолизин вызывает лизис (разложение) эритроцитов, поэтому для его определения засевают культуру на кровяной агар, при наличии гемолизина будет просветление среды. Возможны 3 варианта гемолиза: • Альфа гемолиз – частичный • Бета гемолиз – полный • Гамма гемолиз – отсутствие гемолиза

Фибринолизин Взвесь культуры добавляют в сгусток крови ( «тромб» ) или плазмы с нитями фибрина и инкубируют в термостате или греют на водяной бане. При наличии фибринолизина будет наблюдаться разжижение сгустка.

Каталаза Бактериальную массу снимают с поверхности агара бактериологической петлей и суспендируют в капле 3% го раствора перекиси водорода на предметном стекле. Положительный результат — образование пузырьков газа. Стафилококки каталазо положительные, поэтому материал с культурой будет вспениваться при добавлении перекиси водорода. Стрептококки каталазо отрицательные, поэтому при добавлении перекиси видимых изменений не будет.

Общая фосфатаза Исследуемую культу ру микроорганизма засевают «штрихом» на поверхность пита тельного агара с натриевой солью дифосфата фенолфталеина, инкубируют 4. . . 5 сут. Чашки переворачивают вниз крышкой, на внутреннюю поверхность которой наносят каплю 28. . . 30% го ра створа нашатырного спирта. При наличии фосфатазы колонии приобретают красный цвет.

Уреаза Исследуемую культуру микроорганиз ма асевают з на среду Кристенсена (пептон — 1 г, хлорид натрия — 5 г, дигидрофосфат калия — 2 г, агар — 20 г, глюкоза — 1 г, 0, 2% й раствор фенолрота — 6 мл, 20% й раствор мочевины — 100 мл, вода дистиллированная — 1000 мл) и выращивают 1. . . 4 сут. Положительный результат — покраснение среды в ре зультате ее защелачивания.

Некротоксин Ставится биологическая проба на лабораторных животных. Взвесь культуры вводится внутрикожно. Образование некроза говорит о наличии некротоксина.

Летальный токсин Ставится биологическая проба на лабораторных животных. Взвесь культуры вводят внутривенно. Смерть животных говорит о наличии летального токсина.

Энтеротоксин Культуру помещают в молоко и кормят им котят сосунков. Если культура вырабатывает энтеротоксин, то у котят будут наблюдаться диспептические явления (рвота, диарея. )

25. Биологический метод • Заражение лабораторных животных исследуемым материалом с последующим выделением чистой культуры патогена либо установлением факта присутствия микробного токсина и его природы. Моделирование экспериментальных инфекций у чувствительных животных — важный инструмент изучения патогенеза заболевания и характера взаимодействий внутри системы микроорганизм макроорганизм. Для проведения биологических проб используют только здоровых животных определённых массы тела и возраста. Инфекционный материал вводят внутрь, в дыхательные пути, внутрибрюшинно, внутривенно, внутримышечно, внутрикожно и подкожно, в переднюю камеру глаза, через трепанационное отверстие черепа, субокципитально (в большую цистерну головного мозга). У животных прижизненно забирают кровь, экссудат из брюшины, после гибели — кровь, кусочки различных органов, СМЖ, экссудат из различных полостей.

26. Реакция агглютинации на стекле На предметное стекло наносят разные диагностические сыворотки (против отдельных возбудителей или их антигенов), а затем в каждую каплю вносят стерильной петлей небольшое количество чистой культуры. За несколько минут наблюдают за феном агглютинации. Образование агглютината (хлопьев) свидетельствует о гомологичнисти антигенов возбудителя и антител диагностической сыворотки, что позволяет определить вид инфекционного агента. При наличии позитивной ориентировочной реакции агглютинации ее ставят в развернутом варианте (реакция агглютинации Грубера).

27. Развёрнутая реакция агглютинации Развернутая РА для серодиагностики ставится в сыворотке больных. Ее разводят и изотоническом растворе натрия хлорида от 1: 50 1: 100 до 1: 800 или 1: 1600. Так как в более низких титрах сыворотки могут находиться нормальные агглютинины, имеющиеся у здоровых людей или больных с другим диагнозом (диагностический титр). В качестве антигена в этой реакции используют диагностикумы заведомо известные взвеси, как правило, убитых бактерий, с которыми безопасно работать.

Развёрнутая реакция агглютинации Ставят реакцию следующим образом. В агглютинационные пробирки предварительно разливают по 1 мл изотонического раствора натрия хлорида. В первую из них доливают 1 мл сыворотки, разведенной 1: 100, и, смешав ее, 1 мл переносят во вторую, из второй в третью и т. д. В полученные двухкратные разведения сывороток (от 1: 100 до 1: 1600 и более) вносят по 1 2 капли взвеси бактерий, содержащей 3 млрд микробных тел в 1 мл. Пробирки встряхивают и помещают в термостат при 37°С на 2 часа, затем сутки выдерживают при комнатной температуре.

Развёрнутая реакция агглютинации Учет реакции развернутой агглютинации производят, оценивая последовательно каждую пробирку, начиная с контрольных, при осторожном встряхивании. В контрольных пробирках агглютинации не должно быть. Интенсивность реакции агглютинации отмечают следующими знаками: ++++ полная агглютинация (хлопья агглютината в абсолютной прозрачной жидкости); +++ неполная агглютинация (хлопья в слабоопалесцирующей жидкости); ++ частичная агглютинация (хлопья четко различимы, жидкость слегка мутная); + слабая, сомнительная агглютинация жидкость очень мутная, хлопья в ней плохо различимы; — отсутствие агглютинации (жидкость равномерно мутная). За титр сыворотки принимают последнее ее разведение, в котором интенсивность агглютинации оценивается не менее чем два плюса (++)

Развёрнутая реакция агглютинации

28. Реакция пассивной гемагглютинации (РПГА) Исследуемую сыворотку смешивают с эритроцитарным диагностикумом. Контролем слежит нормальная сыворотка. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном оседают в виде пуговки или колечка. В сыворотке больного обнаружен ботулотоксин тип Е.

РПГА для определения титра антител В реакции пассивной гемагглютинации (РПГА) в качестве носителя используют эритроциты. Нагруженные антигеном эритроциты склеиваются в присутствии специфических антител к данному антигену и выпадают в осадок. Сенсибилизированные антигеном эритроциты используют в РПГА как эритроцитарный диагностикум для обнаружения антител (серодиагностика). Постановка. В лунках полистироловых планшетов готовят ряд последовательных разведений сыворотки. В предпоследнюю лунку вносят 0, 5 мл заведомо положительной сыворотки и в последнюю 0, 5 мл физиологического раствора (контроли). Затем во все лунки добавляют по 0, 1 мл разведенного эритроцитарного диагностикума, встряхивают и помещают в термостат на 2 ч. Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном оседают в виде пуговки или колечка. Результат РНГА. Титр антител 1: 100

29. Реакция термокольцепреципитации • В узкую пробирку (диаметр 0, 5 см) наливают 0, 3 0, 5 мл неразведенной преципитирующей сыворотки. Пастеровской пипеткой медленно наслаивают по стенке (пробирку держат наклонно) аг в таком же объеме. Затем пробирку осторожно, что бы не смешать жидкости, ставят вертикально. При правильном наслоении аг на сыворотку четко видна граница между двумя жидкостями. РП должна обязательно сопровождаться контролем аг и сыворотки. Результаты учитывают в зависимости от вида микроорганизма через 5 10 минут, 1 2 часа, 20 24 часа. В случае положительной реакции в случае в пробирке на границе между сывороткой и исследуемым материалом появляется преципитат в виде кольца белого цвета.

30. Реакция преципитации в геле (метод Оухтерлони) • Чашки заливают ага ром, в котором вырезают несколько лунок на равном рассто янии друг от друга. • В центральную лунку вносят сыворотку, содержащую антитела, в остальные — различные испытуемые антигены или один и тот же антиген в различных разведениях. • При диффузии реагентов в агаровом геле в зонах оптимальных соотношений на месте встречи антигена и антител образуются мутные полосы — дуги преципитации. Полосы преципитации между антигенами в лунках G, E и иммунной сывороткой (антителами) в лунке A.

31. Реакция связывания комплемента Реакция протекает в две фазы. Первая фаза взаимодействие антигена и антител при обязательном участии комплемента. Вторая выявление результатов реакции при помощи индикаторной гемолитической системы (эритроциты барана и гемолитическая сыворотка). Разрушение эритроцитов гемолитической сывороткой происходит только в случае присоединения комплемента к гемолитической системе. Если же комплемент адсорбировался ранее на комплексе антиген антитело, то гемолиз эритроцитов не наступает.

Реакция связывания комплемента Результат опыта оценивают, отмечая наличие или отсутствие гемолиза во всех пробирках. Реакцию считают положительной при полной задержке гемолиза, когда жидкость в пробирке бесцветна и эритроциты оседают на дно, отрицательной при полном лизисе эритроцитов, когда жидкость интенсивно окрашена ( «лаковая» кровь). Степень задержки гемолиза оценивают в зависимости от интенсивности окраски жидкости и величины осадка эритроцитов на дне (++++, ++, +).
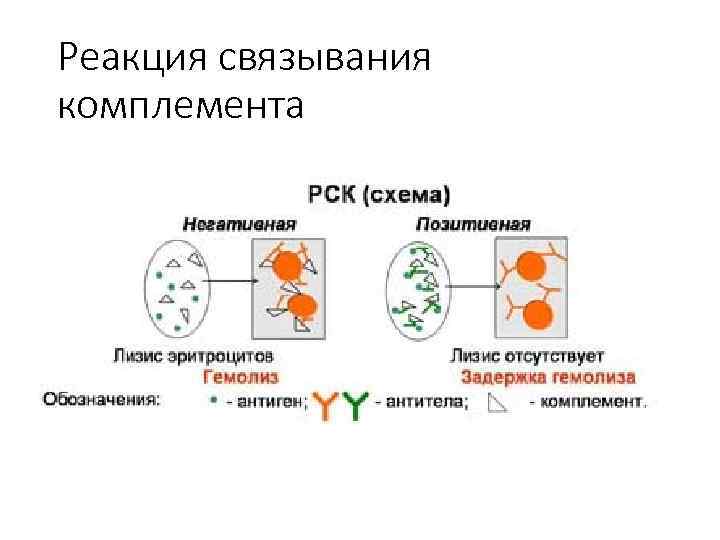
Реакция связывания комплемента

Реакция связывания комплемента Постановка и результат РСК В исследуемой сыворотке выявлены антитела.

Реакция связывания комплемента РСК позволяет выявить антитела к любому штамму одного и того же серотипа вируса. Диагностическое значение имеет четырехкратное увеличение титра антител в парных сыворотках (в период эпидемии гриппа) и двукратное нарастание в сыворотках крови больных при характерной клинической картине.
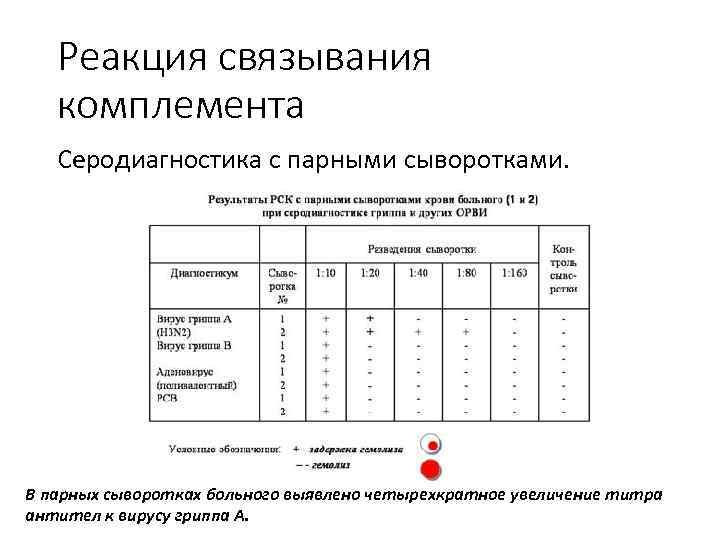
Реакция связывания комплемента Серодиагностика с парными сыворотками. В парных сыворотках больного выявлено четырехкратное увеличение титра антител к вирусу гриппа А.

32. Реакция иммунофлуоресценции Иммунофлюоресцентный метод является методом выбора для быстрого выявления и идентификации неизвестного микроорганизма в исследуемом материале. Аг + АТ + электролит = светящийся в УФ - лучах комплекс Микроб сыворотка, меченная флюорохромом Часто используют краситель изотиоционат флюоресциина - ФИТЦ При исследовании этим методом используют люминесцентный микроскоп.

Реакция иммунофлуоресценции Постановка РИФ • На мазок наносят 30 мкл раствора ФИТЦ меченных антител. • Помещают стекло во влажную камеру и выдерживают при комнатной температуре в течение 20 25 мин, или в термостате при 37° С в течение 15 мин. • Промывают стекло в проточной водопроводной воде 2 мин, ополаскивают дистиллированной водой и высушивают на воздухе. • На высушенный мазок наносят каплю монтирующей жидкости, мазок накрывают покровным стеклом и микроскопируют с использованием люминесцентного микроскопа или люминесцентной насадки к обычному оптическому микроскопу. Streptococcus pneumoniae, выявленный РИФ

33. Полимеразная цепная реакция (ПЦР) — экспериментальный метод молекулярной биологии, способ значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе). В основе метода ПЦР лежит многократное удвоение определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). В результате нарабатываются количества ДНК, достаточные для визуальной детекции. При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце.

Полимеразная цепная реакция Для проведения ПЦР в простейшем случае требуются следующие компоненты: ДНК матрица, содержащая тот участок ДНК, который требуется амплифицировать; • два праймера, комплементарные концам требуемого фрагмента; • термостабильная ДНК полимераза; • дезоксинуклеотидтрифосфаты (A, G, C, T); • ионы Mg 2+, необходимые для работы полимеразы; • буферный раствор. ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0, 1°C. Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Добавление специфичеких ферментов может увеличить выход ПЦР реакции.

Полимеразная цепная реакция Обычно при проведении ПЦР выполняется 20 35 циклов, каждый из которых состоит из трех стадий. Двухцепочечную ДНК матрицу нагревают до 94 96°C (или до 98°C, если используется особенно термостабильная полимераза) на 0, 5 2 минуты, чтобы цепи ДНК разошлись. Эта стадия называется денатурацией — разрушаются водородные связи между двумя цепями. Иногда перед первым циклом проводят предварительный прогрев реакционной смеси в течение 2 5 минут для полной денатурации матрицы и праймеров. Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от праймеров и обычно выбирается на 4 5°С ниже их температуры плавления. Время стадии — 0, 5 2 минут

Полимеразная цепная реакция ДНК полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Температура элонгации зависит от полимеразы. Часто используемые полимеразы наиболее активны при 72°C. Время элонгации зависит как от типа ДНК полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 10 15 мин.

Полимеразная цепная реакция Учёт реакции проводят с помощью электрофореза в агарозном геле. Отрицательно заряженные молекулы ДНК движутся в геле под действием электрического поля от катода к аноду, при этом длина пробега фрагментов ДНК за определенный промежуток времени зависит от их размера. ДНК в геле окрашивают бромидом этидия, что делает ее видимой в ультрафиолетовом свете. Если в исследуемой пробе в результате ПЦР накопились ампликоны (фрагменты ДНК одинакового размера), то они окажутся на одном расстоянии от старта и будут видны как полоса на гелевой дорожке. Если положение полосы на гелевой дорожке соответствует расчётной для использованной пары праймеров, т. е. находится на том же расстоянии от старта, что полоса положительного контроля, то это означает, что результат исследования положительный.

Полимеразная цепная реакция Как и в каждом эксперименте при учёте результатов ПЦР предусматривают контроли – положительный и отрицательный. Любая диагностическая тест система должна иметь утверждённый регламент, который включает наличие упомянутых контролей. • Положительный контроль – это образец с ДНК матрицей для накапливания специфического ампликона, соответствующего определяемому микроорганизму. • Отрицательный контроль вода, ДНК человека или ДНК микроорганизмов, близкородственных определяемому данной тест системой.

34. Реакция нейтрализации Реакции нейтрализации (РН) основаны на способности АТ связывать различные возбудители их метаболиты, лишая тем самым их возможности реализовать свои биологические свойства (иными словами, АТ нейтрализуют возбудителей). На практике РН применяют для выявления вирусов и различных токсинов. В определенной степени к ним же относят реакции торможения вирусиндуцированной гемагглютинации и иммобилизации. Реакция нейтрализации вирусов В сыворотки крови переболевших лиц циркулируют антитела, нейтрализующие вирусы. Их наличие выявляют смешиванием культуры возбудителей с сывороткой с последующим введение лабораторному животному или заражением культуры клеток. На эффективность нейтрализации указывает выживание животного либо отсутствие гибели клеток в культурах.

Реакция биологической нейтрализации (РБН)

35. Реакция торможения гемагглютинации Принцип реакции основан на способности АТ связывать различные вирусы и нейтрализовать их, лишая возможности агглютинировать эритроциты. Визуально этот эффект и проявляется в «торможении» гемагглютинации. РТГА применяют при диагностике вирусных инфекций для выявления специфических антигемагглютининов и идентификации различных вирусов по их гемагглютининам, проявляющим свойства Аг.

Реакция торможения гемагглютинации Типирование вируса проводят в реакции РТГА с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса типа А с антигенами H 0 N 1, H 1 N 1, H 2 N 2, H 3 N 2 и другие могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток. Результаты РТГА при типировании вируса гриппа Исследуемый материал содержит вирус гриппа тип А с антигеном H 3 N 2 Условные обозначения: - торможение гемагглютинации (пуговка) ; - гемагглютинация (зонтик).

Реакция торможения гемагглютинации Определение титра антител крови больного по РТГА Развернутая РТГА проводится в лунках пластмассовых пластин. В лунках готовят 2 х кратные разведения исследуемой сыворотки в объеме 0, 25 мл, добавляют по 0, 25 взвеси вируса в рабочем разведении и инкубируют 2 ч при температуре 37°С. Затем добавляют по 0, 5 мл 1% взвеси куриных эритроцитов, инкубируют еще 2 ч и оценивают результат по феномену гемагглютинации. При положительной РТГА образуется плотный осадок эритроцитов на дне лунки в виде диска или кольца с ровными краями. Титр антител определяют по последней лунке с положительной РТГА. Выводы: титр антител равен 1: 40

36. Радиоиммунный анализ • Аг или ат для РИА метят радиоизотопом. Чаще всего 125 I. Реакция РИА очень чувствительна, позволяет определить 1 2 нг и меньше исследуемого материала. • Чаще всего применяется радиофазная модификация РИА (суть такая же, как и ИФА). Применяют три метода твердофазной РИА: конкурентный, обратный и непрямой. • При конкурентном методе на поверхности сорбента сорбируют известные ат. Затем в лунки вносят исследуемый аг и спустя определенное время, достаточное для специфического взаимодействия, добавляют меченый радиоизотопом очищенный аг той же специфичности. • Если в исследуемом материале содержится аг, соответствующий иммобилизированым ат, чатсь активных центров последних блокируется. В таком случае внесенный в лунки меченый аг будет в меньшей степени (в сравнении с контролем) соединяться с ат, о чем можно судить по радиоактивной жидкой части реагирующей смеси.

36. Радиоиммунный анализ • При проведении РИА обратным методом на поверхности лунок сорбируют очищенный немеченый аг, гомологичный исследуемому аг. В отдельной пробирке соединяют антигенсодержащий материал с меченвми ат, специфичными с аг, иммобилизированными в лунках. Если в исслудемомо материале модержится аг, способный взаимодействовать и мечеными ат, активные центры последних полностью или частично блокируются. В таком случае при внесении в лунки с аг смеси, меченые ат буду не полностью взаимодействовать с аг, о чем можно судить по степени радиоактивности жидкости в сравнении с контролем.

36. Радиоиммунный анализ • Наиболее удобным является непрямой метод РИА с использованием антивидовых меченых ат. Метод может использован для идентификации неизвестных аг и ат. В обоих случаях применят антивидовую сыворотку, содержащих ат против соответствующих гамма глобулинов. • Для проведения этого метода на поверхности лунок сорбируют аг, а затем добавляют разведенную сыворотку больного. При наличии в ней соответствующих ат на поверхности лунок формируется комплекс ат аг. При последующем введении в лунку антивидовой меченой сыворотки ат, содержащиеся в ней, адсорбируются на образовавшемся комлексе. Чем больше в сыворотке больного ат, тем больше удет связанной с поверхностью лунок радиоактивной метки.

37. Иммуноферментный анализ или метод – выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом меткой. После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции – интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител. ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ инфекций, гепатита В и др. , а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале.
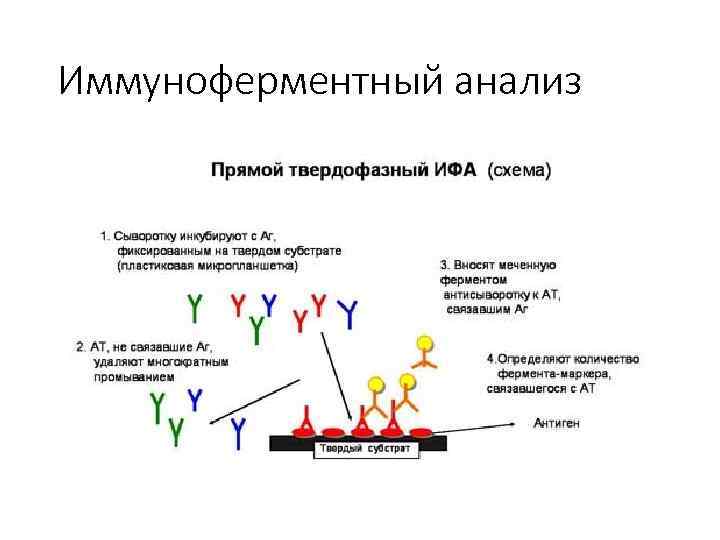
Иммуноферментный анализ

Иммуноферментный анализ Результат ИФА. Желтый цвет раствора в лунке является положительным результатом.

38. Реакция иммунного блоттинга • Первый этап – электрофорез белков сыворотки крови в геле • Затем на гель накладывают нитроцеллюлозную или нейлоновую мембрану и промокают (блоттинг) в специальной камере – материал переходит из геля на мембрану • Обработка мембраны антителами, добавление меченного конъюгата. • Проводят авторадиографию с использованием рентгеновской плёнки.
Prakticheskiy_ekzamen.pptx