149b61e3651553b9ac6482a8ec44b569.ppt
- Количество слайдов: 28
 Повторяющиеся последовательности генома и связанные с ними молекулярно-генетические и внутриклеточные события (у человека/эукариот) (в норме, при онкологических, других заболеваниях и в контексте гипотетических механизмов синтеза и распространения олигонуклеотидных последовательностей). «Повторяющиеся последовательности, занимающие бόльшую часть генома эукариот. . представляют особый интерес и до сих пор не до конца осмысленный продукт жизнедеятельности клетки и ее генома» (из работы «Повторы, нестабильность генома и онкогенез. Возможный биосинтез олигонуклеотидов вне генома» , 2015) ДЕЙЧМАН А. М Лаборатория экспериментальной диагностики и биотерапии опухолей НИИ ЭДИТО, ФГБУ РОНЦ им. Н. Н. Блохина РАМН
Повторяющиеся последовательности генома и связанные с ними молекулярно-генетические и внутриклеточные события (у человека/эукариот) (в норме, при онкологических, других заболеваниях и в контексте гипотетических механизмов синтеза и распространения олигонуклеотидных последовательностей). «Повторяющиеся последовательности, занимающие бόльшую часть генома эукариот. . представляют особый интерес и до сих пор не до конца осмысленный продукт жизнедеятельности клетки и ее генома» (из работы «Повторы, нестабильность генома и онкогенез. Возможный биосинтез олигонуклеотидов вне генома» , 2015) ДЕЙЧМАН А. М Лаборатория экспериментальной диагностики и биотерапии опухолей НИИ ЭДИТО, ФГБУ РОНЦ им. Н. Н. Блохина РАМН
 Три причины необходимости рассмотреть повторяющиеся последовательности (в контексте гипотетич. мех-мов): 1. Повторяющиеся последов-ти генома выполняют в клетке многие роли и регулируют / направляют многие нормальные и патологические процессы. 2. С повторяющ. послед-ми [их экспанс/сжат-ми, мутациями (точечн. ; сдвига рамки: поли-Gln-тракты-(CAG)n→поли-Ala-(GCA)n] часто ассоциированы: а) многие генетические, неврологические (в отношен тринукл-повт в генахразвития/др. ), онкологические (в генах репарации/др. ) и другие заболевания; б) социо-поведенческие/сексуальные/морфологические особенности. 3. Вероятно, гипотетич-в. ПОТ-механизм (отдельного белкового эпитопа), воспроизводит олигонуклеотидные (мини/микро-сател. -подобн. ) последовательности 2 -х типов: повторяющиеся и уникальные (олиго-НЭ). Повторы, скорее, могут быть наиболее многочисленными: в силу исходно заложенной вариабельности в. ПОТ-механизма (i); на это косвен указывает максимал представленность в геноме именно различного типа повторяющихся последовательностей (ii). Роль уникальных олиго-НЭ, однако, и подобно экзонам генов генома, может быть не менее значимой (iii). Условно (отчасти): Типы сателлитных повторов (по длине мономерной единицы): 1. микросателлитные (1 – 6/10 нуклеотидов); 2. минисателлитные (~ 6/10– 100/сотни нуклеотидов и более); 3. сателлитные (~ 100– 2000 нуклеотидов); 4. макросателлитные (> 2000 нуклеотидов).
Три причины необходимости рассмотреть повторяющиеся последовательности (в контексте гипотетич. мех-мов): 1. Повторяющиеся последов-ти генома выполняют в клетке многие роли и регулируют / направляют многие нормальные и патологические процессы. 2. С повторяющ. послед-ми [их экспанс/сжат-ми, мутациями (точечн. ; сдвига рамки: поли-Gln-тракты-(CAG)n→поли-Ala-(GCA)n] часто ассоциированы: а) многие генетические, неврологические (в отношен тринукл-повт в генахразвития/др. ), онкологические (в генах репарации/др. ) и другие заболевания; б) социо-поведенческие/сексуальные/морфологические особенности. 3. Вероятно, гипотетич-в. ПОТ-механизм (отдельного белкового эпитопа), воспроизводит олигонуклеотидные (мини/микро-сател. -подобн. ) последовательности 2 -х типов: повторяющиеся и уникальные (олиго-НЭ). Повторы, скорее, могут быть наиболее многочисленными: в силу исходно заложенной вариабельности в. ПОТ-механизма (i); на это косвен указывает максимал представленность в геноме именно различного типа повторяющихся последовательностей (ii). Роль уникальных олиго-НЭ, однако, и подобно экзонам генов генома, может быть не менее значимой (iii). Условно (отчасти): Типы сателлитных повторов (по длине мономерной единицы): 1. микросателлитные (1 – 6/10 нуклеотидов); 2. минисателлитные (~ 6/10– 100/сотни нуклеотидов и более); 3. сателлитные (~ 100– 2000 нуклеотидов); 4. макросателлитные (> 2000 нуклеотидов).
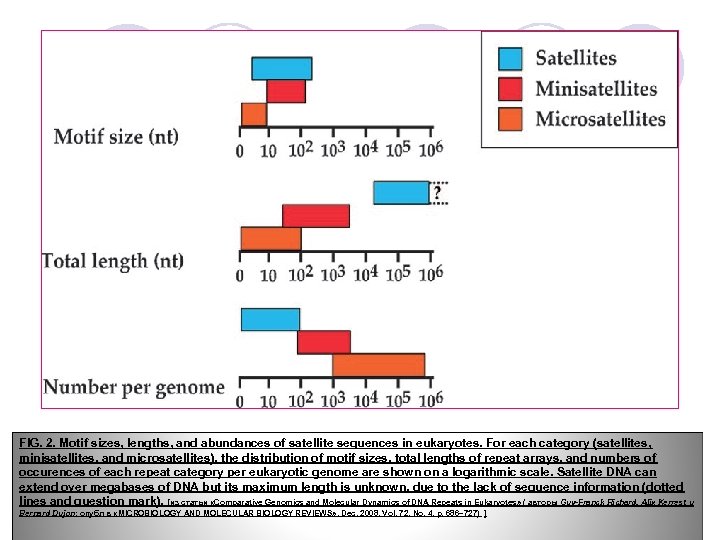 FIG. 2. Motif sizes, lengths, and abundances of satellite sequences in eukaryotes. For each category (satellites, minisatellites, and microsatellites), the distribution of motif sizes, total lengths of repeat arrays, and numbers of occurences of each repeat category per eukaryotic genome are shown on a logarithmic scale. Satellite DNA can extend over megabases of DNA but its maximum length is unknown, due to the lack of sequence information (dotted lines and question mark). [из статьи «Comparative Genomics and Molecular Dynamics of DNA Repeats in Eukaryotes» ( авторы Guy-Franck Richard, Alix Kerrest и Bernard Dujon; опубл в «MICROBIOLOGY AND MOLECULAR BIOLOGY REVIEWS» , Dec. 2008, Vol. 72, No. 4, p. 686– 727) ]
FIG. 2. Motif sizes, lengths, and abundances of satellite sequences in eukaryotes. For each category (satellites, minisatellites, and microsatellites), the distribution of motif sizes, total lengths of repeat arrays, and numbers of occurences of each repeat category per eukaryotic genome are shown on a logarithmic scale. Satellite DNA can extend over megabases of DNA but its maximum length is unknown, due to the lack of sequence information (dotted lines and question mark). [из статьи «Comparative Genomics and Molecular Dynamics of DNA Repeats in Eukaryotes» ( авторы Guy-Franck Richard, Alix Kerrest и Bernard Dujon; опубл в «MICROBIOLOGY AND MOLECULAR BIOLOGY REVIEWS» , Dec. 2008, Vol. 72, No. 4, p. 686– 727) ]
 Виды классификаций повторов (по: ориентац / частоте / расположен / составу «чистоте» ): 1. Прям-корот (голов-хвост; CR/SPIDR/SSR/TR; связ с делеции/дупликац/транслокац ДНК-посл-й) 2. Инвертир-корот/длин повт (голова-к-голове, раздел-спейсером; обычн вызыв: инверсии; транспозицию посл-й после узнаван-я транспозазой). 3. Палиндромн-корот/длин (= пара сближен-х, без спейсера между ними, инвертир-повторов; т. н. ловушки транспозонов). 4. Обращен-корот/длин (фланкир уникал часть; формир крестообразн-струк-ры, кот вызыв гомол-рекомбинац, транспозиц, кроссинговер, ген-конверсии, сверхспирализацию ДНК) (технол-ки: образ нанорешетки) 4. Рассеянные (диспергированные). 5. Тандемные (в виде массивов мономеров). 6. Центромерные (α-сател. и др. кор/длин/прям повт; при митозе/мейозе: приним участ в формир: ки-нетохор, центромер (дефектн-неоцентромер в опух-кл), конъюгац гомолхромомс, соедин сестр-хроматид, образ ге-терохром-на, экспрес-генов) / Перицентром-е (β/γсател. и др. ; участв в создан гетерохром) 7. Теломерные / перителомерные. 8. Совершенные / несовершенные. Повторами также являются: LTRs-содержащие: ретротранспозоны (иногда ретровирусы). LTRs-несодержащие ретроэлементы (длинные, LINEs, и короткие, SINEs, диспергированные ядерные элементы). ДНК-транспозоны. (В целом: транспозоны не мол. -паразиты, а геномные эндосимбионты эукариот; у прокариот их менее 1% генома). Генные семейства (паралоги). Сегменты ДНК (1 -2 раза – уникальные; более – повторяющ-ся). Целые геномы клеток в организме, и органелл (митохондрий; у растений – и хлоропластов) в клетке. Соотношение различных типов повторов у разных биологических видов – различное.
Виды классификаций повторов (по: ориентац / частоте / расположен / составу «чистоте» ): 1. Прям-корот (голов-хвост; CR/SPIDR/SSR/TR; связ с делеции/дупликац/транслокац ДНК-посл-й) 2. Инвертир-корот/длин повт (голова-к-голове, раздел-спейсером; обычн вызыв: инверсии; транспозицию посл-й после узнаван-я транспозазой). 3. Палиндромн-корот/длин (= пара сближен-х, без спейсера между ними, инвертир-повторов; т. н. ловушки транспозонов). 4. Обращен-корот/длин (фланкир уникал часть; формир крестообразн-струк-ры, кот вызыв гомол-рекомбинац, транспозиц, кроссинговер, ген-конверсии, сверхспирализацию ДНК) (технол-ки: образ нанорешетки) 4. Рассеянные (диспергированные). 5. Тандемные (в виде массивов мономеров). 6. Центромерные (α-сател. и др. кор/длин/прям повт; при митозе/мейозе: приним участ в формир: ки-нетохор, центромер (дефектн-неоцентромер в опух-кл), конъюгац гомолхромомс, соедин сестр-хроматид, образ ге-терохром-на, экспрес-генов) / Перицентром-е (β/γсател. и др. ; участв в создан гетерохром) 7. Теломерные / перителомерные. 8. Совершенные / несовершенные. Повторами также являются: LTRs-содержащие: ретротранспозоны (иногда ретровирусы). LTRs-несодержащие ретроэлементы (длинные, LINEs, и короткие, SINEs, диспергированные ядерные элементы). ДНК-транспозоны. (В целом: транспозоны не мол. -паразиты, а геномные эндосимбионты эукариот; у прокариот их менее 1% генома). Генные семейства (паралоги). Сегменты ДНК (1 -2 раза – уникальные; более – повторяющ-ся). Целые геномы клеток в организме, и органелл (митохондрий; у растений – и хлоропластов) в клетке. Соотношение различных типов повторов у разных биологических видов – различное.
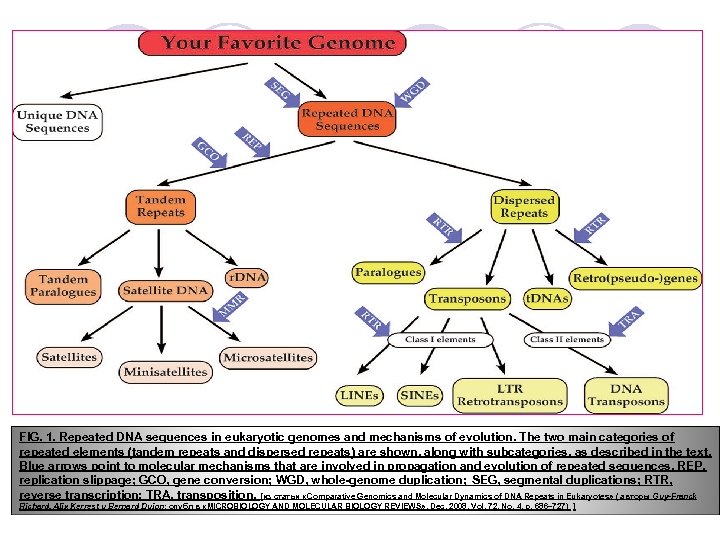 FIG. 1. Repeated DNA sequences in eukaryotic genomes and mechanisms of evolution. The two main categories of repeated elements (tandem repeats and dispersed repeats) are shown, along with subcategories, as described in the text. Blue arrows point to molecular mechanisms that are involved in propagation and evolution of repeated sequences. REP, replication slippage; GCO, gene conversion; WGD, whole-genome duplication; SEG, segmental duplications; RTR, reverse transcription; TRA, transposition. [из статьи «Comparative Genomics and Molecular Dynamics of DNA Repeats in Eukaryotes» ( авторы Guy-Franck Richard, Alix Kerrest и Bernard Dujon; опубл в «MICROBIOLOGY AND MOLECULAR BIOLOGY REVIEWS» , Dec. 2008, Vol. 72, No. 4, p. 686– 727) ]
FIG. 1. Repeated DNA sequences in eukaryotic genomes and mechanisms of evolution. The two main categories of repeated elements (tandem repeats and dispersed repeats) are shown, along with subcategories, as described in the text. Blue arrows point to molecular mechanisms that are involved in propagation and evolution of repeated sequences. REP, replication slippage; GCO, gene conversion; WGD, whole-genome duplication; SEG, segmental duplications; RTR, reverse transcription; TRA, transposition. [из статьи «Comparative Genomics and Molecular Dynamics of DNA Repeats in Eukaryotes» ( авторы Guy-Franck Richard, Alix Kerrest и Bernard Dujon; опубл в «MICROBIOLOGY AND MOLECULAR BIOLOGY REVIEWS» , Dec. 2008, Vol. 72, No. 4, p. 686– 727) ]
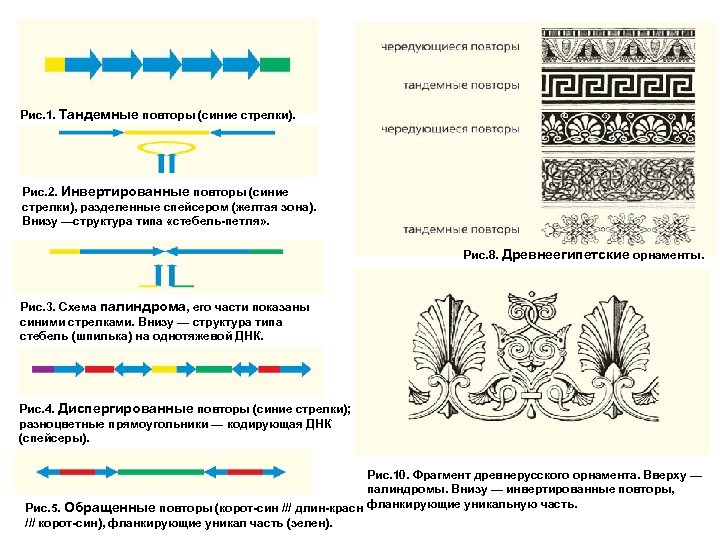 Рис. 1. Тандемные повторы (синие стрелки). Рис. 2. Инвертированные повторы (синие стрелки), разделенные спейсером (желтая зона). Внизу —структура типа «стебель-петля» . Рис. 8. Древнеегипетские орнаменты. Рис. 3. Схема палиндрома, его части показаны синими стрелками. Внизу — структура типа cтебель (шпилька) на однотяжевой ДНК. Рис. 4. Диспергированные повторы (синие стрелки); разноцветные прямоугольники — кодирующая ДНК (спейсеры). Рис. 10. Фрагмент древнерусского орнамента. Вверху — палиндромы. Внизу — инвертированные повторы, Рис. 5. Обращенные повторы (корот-син /// длин-красн фланкирующие уникальную часть. /// корот-син), фланкирующие уникал часть (зелен).
Рис. 1. Тандемные повторы (синие стрелки). Рис. 2. Инвертированные повторы (синие стрелки), разделенные спейсером (желтая зона). Внизу —структура типа «стебель-петля» . Рис. 8. Древнеегипетские орнаменты. Рис. 3. Схема палиндрома, его части показаны синими стрелками. Внизу — структура типа cтебель (шпилька) на однотяжевой ДНК. Рис. 4. Диспергированные повторы (синие стрелки); разноцветные прямоугольники — кодирующая ДНК (спейсеры). Рис. 10. Фрагмент древнерусского орнамента. Вверху — палиндромы. Внизу — инвертированные повторы, Рис. 5. Обращенные повторы (корот-син /// длин-красн фланкирующие уникальную часть. /// корот-син), фланкирующие уникал часть (зелен).
 Число копий и «доля» некоторых повторов (в геноме челов): Микросателлиты: до 106 коп, по всему геному (вместе с минисат форм VNTRs и состав 2 -3% генома челов; в интрон/фланках генов). Повыш мутабельны в генах и между ними. Минисателлиты: сотни/тысячи копий (предпоч содер-ся в субтеломер/перицентр обл; реже в генах). LINEs: сотни тысяч копий (мономер чел / мыш – 6000 -8000 п. н. ; ~20%). SINEs: до 1. 5 х106 коп (мономер: в десятки/сотни н. ; одни Alu заним. ~10%). LTR-ретровир - подобн / ретроэлем (4000 -12000 п. н. ) Все ретроэлементы (человека): ~42%). ДНК-транспозоны (челов): ~3%). Короткие микро-/минисателлитн. -последов-ти обнаруж-т в межген. -некодирующих и различ. участ кодирующ. (транслируемых/нетранслируемых) областях эукариот, – включая интроны, 5’-/3’-НТО, энхансеры, промоторы, экзоны генов белков (в случ. транскрипц. -факторов челов и поверхностных/адгезивных белков аскомицетов, это касалось, соответственно, микрои мини-сателлитов) и ориджны репликации. С повреж действ и преодолен «неудоб» вторич структур, образ корот/бол-длин-повтор; см. след. слайд) связыв такие генетич событ, как: I). 1. гомологичн/негомологичн рекомбинации; 2. репликац скольжения (см. слайд); 3. образов ломк-сайтов (т. н. «горячих точек» ); 4. транспозицию; 5. кроссинговер; 6. сестрин-хроматидн-обмен; 7. транслокац (одно/дву-направленные); 8. сегментндупликации; 9. амплификац-генов; 10. пострепликатив-репарацию; 11. конвергенц генов; 12. блок репликац/транскрипц/трансляции; 13. и др. Эти события встреч-ся при различ. генетич. /онкологич. /др. заболеваниях. II). не существует фундаментал. генетич. процесса, который так или иначе, не обеспеч-ся бы повторами; (акад. Г. Б. Смирнов: … «Сейчас мы твердо знаем, что . . . онтогенез и эволюционные изменения происходят благодаря повторам. . . опр-ся функциональный «портрет» генома на данный момент и на будущее. . . Характер геномных перестроек (потеря/приобретен генетич-материала, транслокац или инверсии сегмент-ДНК) зависят от наличия, размера, ориентации, типа и локализации в геноме повторяющихся элементов ДНК. То есть, события генетической изменчивости (стаб) неслучайны по типу, локализации в геноме и вероятности. Это означает, что программа возм изменений геномов определяется структурой самих геномов ( «Пн-выбор» явл отдел-м от ест. -отбора)» .
Число копий и «доля» некоторых повторов (в геноме челов): Микросателлиты: до 106 коп, по всему геному (вместе с минисат форм VNTRs и состав 2 -3% генома челов; в интрон/фланках генов). Повыш мутабельны в генах и между ними. Минисателлиты: сотни/тысячи копий (предпоч содер-ся в субтеломер/перицентр обл; реже в генах). LINEs: сотни тысяч копий (мономер чел / мыш – 6000 -8000 п. н. ; ~20%). SINEs: до 1. 5 х106 коп (мономер: в десятки/сотни н. ; одни Alu заним. ~10%). LTR-ретровир - подобн / ретроэлем (4000 -12000 п. н. ) Все ретроэлементы (человека): ~42%). ДНК-транспозоны (челов): ~3%). Короткие микро-/минисателлитн. -последов-ти обнаруж-т в межген. -некодирующих и различ. участ кодирующ. (транслируемых/нетранслируемых) областях эукариот, – включая интроны, 5’-/3’-НТО, энхансеры, промоторы, экзоны генов белков (в случ. транскрипц. -факторов челов и поверхностных/адгезивных белков аскомицетов, это касалось, соответственно, микрои мини-сателлитов) и ориджны репликации. С повреж действ и преодолен «неудоб» вторич структур, образ корот/бол-длин-повтор; см. след. слайд) связыв такие генетич событ, как: I). 1. гомологичн/негомологичн рекомбинации; 2. репликац скольжения (см. слайд); 3. образов ломк-сайтов (т. н. «горячих точек» ); 4. транспозицию; 5. кроссинговер; 6. сестрин-хроматидн-обмен; 7. транслокац (одно/дву-направленные); 8. сегментндупликации; 9. амплификац-генов; 10. пострепликатив-репарацию; 11. конвергенц генов; 12. блок репликац/транскрипц/трансляции; 13. и др. Эти события встреч-ся при различ. генетич. /онкологич. /др. заболеваниях. II). не существует фундаментал. генетич. процесса, который так или иначе, не обеспеч-ся бы повторами; (акад. Г. Б. Смирнов: … «Сейчас мы твердо знаем, что . . . онтогенез и эволюционные изменения происходят благодаря повторам. . . опр-ся функциональный «портрет» генома на данный момент и на будущее. . . Характер геномных перестроек (потеря/приобретен генетич-материала, транслокац или инверсии сегмент-ДНК) зависят от наличия, размера, ориентации, типа и локализации в геноме повторяющихся элементов ДНК. То есть, события генетической изменчивости (стаб) неслучайны по типу, локализации в геноме и вероятности. Это означает, что программа возм изменений геномов определяется структурой самих геномов ( «Пн-выбор» явл отдел-м от ест. -отбора)» .
 Рис. 5. Вторичные структуры образованы разными тринуклеотидными повторами. (А) CAG, CTG, и CCG образуют шпильки с нечетным числом повторяющихся единиц. Не спаривающиеся внутри стебля основания окрашены (красн/син/зел). (B), CAG, CTG, и CCG образ шпильки с четным числом повторяющ звеньев. Не спаривающиеся основания окрашены также (красн/син/зел). (С) Тройная спираль формируется (GAA)n-повторами. Уотсон-криковские пары образованы двойными связями, а хугстеновские – одиночными. (D) Тетраплексные структуры образованы (CGG)n-повторами. Цитозины и цитозиновые связи показаны красным.
Рис. 5. Вторичные структуры образованы разными тринуклеотидными повторами. (А) CAG, CTG, и CCG образуют шпильки с нечетным числом повторяющихся единиц. Не спаривающиеся внутри стебля основания окрашены (красн/син/зел). (B), CAG, CTG, и CCG образ шпильки с четным числом повторяющ звеньев. Не спаривающиеся основания окрашены также (красн/син/зел). (С) Тройная спираль формируется (GAA)n-повторами. Уотсон-криковские пары образованы двойными связями, а хугстеновские – одиночными. (D) Тетраплексные структуры образованы (CGG)n-повторами. Цитозины и цитозиновые связи показаны красным.
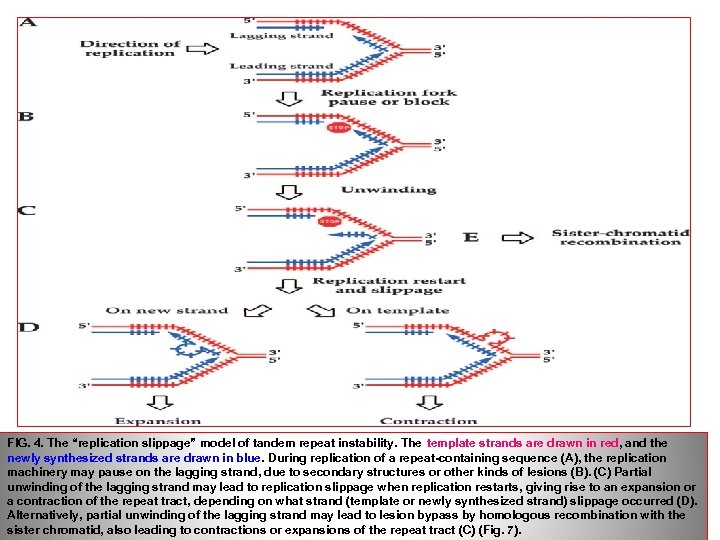 FIG. 4. The “replication slippage” model of tandem repeat instability. The template strands are drawn in red, and the newly synthesized strands are drawn in blue. During replication of a repeat-containing sequence (A), the replication machinery may pause on the lagging strand, due to secondary structures or other kinds of lesions (B). (C) Partial unwinding of the lagging strand may lead to replication slippage when replication restarts, giving rise to an expansion or a contraction of the repeat tract, depending on what strand (template or newly synthesized strand) slippage occurred (D). Alternatively, partial unwinding of the lagging strand may lead to lesion bypass by homologous recombination with the sister chromatid, also leading to contractions or expansions of the repeat tract (С) (Fig. 7).
FIG. 4. The “replication slippage” model of tandem repeat instability. The template strands are drawn in red, and the newly synthesized strands are drawn in blue. During replication of a repeat-containing sequence (A), the replication machinery may pause on the lagging strand, due to secondary structures or other kinds of lesions (B). (C) Partial unwinding of the lagging strand may lead to replication slippage when replication restarts, giving rise to an expansion or a contraction of the repeat tract, depending on what strand (template or newly synthesized strand) slippage occurred (D). Alternatively, partial unwinding of the lagging strand may lead to lesion bypass by homologous recombination with the sister chromatid, also leading to contractions or expansions of the repeat tract (С) (Fig. 7).
 челов и друг биол-видов): известно, что почему важны в. н. повторы (рассм на пример I). Микросат-/подоб повторы (гомологич условно-неповтор-ся микропосл-ти) окружают / фланкируют и способствуют размножению других повторов и последоват-й: 1. минисателлитных повторов [напр. : а) четырех тандем. -повторов в 33 п. н. в интроне гена миоглобина человека, фланкир-х прям-повторами в 9 п. н. {и (GGAT)165 (TG)n в др. генов}; Aluповторов (напр. , V-kappa-генов/псевдогенов); б) дрозофила/(→дрожжи): 36 -нуклеотидных и минисателлит-подобных 5 S-р. РНК послед-тей в ~120 п. н. ]; 2. ДНК-транспозонов [напр. , в рисе это – MITE (miniature inverted repeat transposable element) / (Micron)]; окружены микросат-подоб-посл-ми 3. РНК-транспозонов [напр. , L 1 и ретропозон-подобные 4. 5 SI-РНК человека фланкированы короткими прямыми повторами]; 4. сегментно/(целогеномно) дуплицированных областей генома (аскомицетов, человека, шимпанзе) с генами белков / т. РНК / р. РНК / др. 5. Микросателлитных же повторов: (TG)n=17 -мотива в интрон некоторых генов, фланкир-ся короткими прямыми повторами. n < 4 опр-т микро-, n > 4 - минисат мотив здесь. II). Минисател-/подоб повторы фланкир и способст размнож других повторов и последоват-й : 1. ДНК-транспозон (напр. , рыб Tetraodon nigroviridis), кот им свой-во интегр/фиксиров-ся вблизи центромер-минисат-в в 118 п. н. (гетерохром-сател-в, – т. н. «ловушек» редких транспозонов). 2. больших тандемно повторяющихся макросателлитов: т. н. RPS-областей (в ~2000 п. н. ), и еще много больших комплексных MRS-последовательностей (зд. нитчатых грибов Candida albicans); и это касалось, соответст, 7 -9 копий минисателлитных повторов в 16 п. н. ; и 6 -8 копий в 29 п. н. 3. самих себя (в случае минисателлита – MS 32 человека), других минисат. -повторов и расположенных между ними последовательностей. На данный момент: а) Распред и функции микро- и мини-сателлит в геномах эукар более-менее различимы (а в генах это, соотв, Транскр-Факт и адгезив-бел); б) а молекулярн механизмы изменения их размеров представляются очень схожими (или даже идентичными). Вывод: выходит, что практич любой механизм, запускающий синтез нуклеиновых кислот, ДНК/РНК (репликация, рекомбинация, репарация, транскрипция, и т. д. ), потенциал мож быть связ с измен-м размеров повтор (тандемн/др. ). Причем частота и степень таких измен-й мог завис от локализац, структур, длины и состав (чистот/совершен-ти) повтор в геноме, а
челов и друг биол-видов): известно, что почему важны в. н. повторы (рассм на пример I). Микросат-/подоб повторы (гомологич условно-неповтор-ся микропосл-ти) окружают / фланкируют и способствуют размножению других повторов и последоват-й: 1. минисателлитных повторов [напр. : а) четырех тандем. -повторов в 33 п. н. в интроне гена миоглобина человека, фланкир-х прям-повторами в 9 п. н. {и (GGAT)165 (TG)n в др. генов}; Aluповторов (напр. , V-kappa-генов/псевдогенов); б) дрозофила/(→дрожжи): 36 -нуклеотидных и минисателлит-подобных 5 S-р. РНК послед-тей в ~120 п. н. ]; 2. ДНК-транспозонов [напр. , в рисе это – MITE (miniature inverted repeat transposable element) / (Micron)]; окружены микросат-подоб-посл-ми 3. РНК-транспозонов [напр. , L 1 и ретропозон-подобные 4. 5 SI-РНК человека фланкированы короткими прямыми повторами]; 4. сегментно/(целогеномно) дуплицированных областей генома (аскомицетов, человека, шимпанзе) с генами белков / т. РНК / р. РНК / др. 5. Микросателлитных же повторов: (TG)n=17 -мотива в интрон некоторых генов, фланкир-ся короткими прямыми повторами. n < 4 опр-т микро-, n > 4 - минисат мотив здесь. II). Минисател-/подоб повторы фланкир и способст размнож других повторов и последоват-й : 1. ДНК-транспозон (напр. , рыб Tetraodon nigroviridis), кот им свой-во интегр/фиксиров-ся вблизи центромер-минисат-в в 118 п. н. (гетерохром-сател-в, – т. н. «ловушек» редких транспозонов). 2. больших тандемно повторяющихся макросателлитов: т. н. RPS-областей (в ~2000 п. н. ), и еще много больших комплексных MRS-последовательностей (зд. нитчатых грибов Candida albicans); и это касалось, соответст, 7 -9 копий минисателлитных повторов в 16 п. н. ; и 6 -8 копий в 29 п. н. 3. самих себя (в случае минисателлита – MS 32 человека), других минисат. -повторов и расположенных между ними последовательностей. На данный момент: а) Распред и функции микро- и мини-сателлит в геномах эукар более-менее различимы (а в генах это, соотв, Транскр-Факт и адгезив-бел); б) а молекулярн механизмы изменения их размеров представляются очень схожими (или даже идентичными). Вывод: выходит, что практич любой механизм, запускающий синтез нуклеиновых кислот, ДНК/РНК (репликация, рекомбинация, репарация, транскрипция, и т. д. ), потенциал мож быть связ с измен-м размеров повтор (тандемн/др. ). Причем частота и степень таких измен-й мог завис от локализац, структур, длины и состав (чистот/совершен-ти) повтор в геноме, а
 l Примеры онкогенных типов повреждений/перестановок в геноме, ассоциированных с мини/микро-сателлитн (п. п. 1 -3; 5, 6) (и др-повторами [п. 4] и видами нестаб. ): l l 1. а) При спорадическом неполипозном раке прямой кишки (спорад. HNPCC): набл выс. -частотн. ядерн. -микросат. -нестаб. (n. MSI), связ с точеч/др. мутац генов системы MMR-репарации (MSH 2/MSH 3/MSH 6/др). Уров микросател-мутаций в генах опух-кл – на неск. поряд выше, чем в не-раков клетках. MSI формир-сь (в др. генах): делец-ми в (A)10 - и встав-ми в (GT)3 -повторах TGFβIIR-гена; (G)8 -делец-ми – для IGFIIR (рецептора II инсул. -подобн. факт. роста), и (G)8 -делеции/вставки – в случае включенного в апоптоз BAX-гена]. l б) При наслед. -HNPCC-раке набл мутац MLH 1 гена-репар и мутаторн-фенот кл, кот были связ, во-перв, с MSI-мутац в генах (BAX, Caspase-5 и IGFIIR; но не MSH 3, MSH 6, TCF 4 и TGFBRII) и, во-втор, с нестаб-ю хромосом (CIN, также мб ассоц с фланкирповторами), причем в период прогрессии опухоли эти два вида нестаб-ти (MSI/CIN) им обратную завис-ть. Однако, набл-сь амбивалентность белков репарации, когда дефицит Msh 2 -белка вызывал уменьшение нестабильности (CAG)n но не других повторов (у мыши). l 2. [С концевыми (АТ)n-микросател-ми и АТ-богат. -минисат-ми] были связаны (а, б, в): l а) множественн миелома: транслокация t(14; 16) последов-тей; l б) рак молоч-железы, простаты: набл потерю гетерозиготности, LOH (обеими аллелями), т. е. потери опух-супрессирующ или, наобор, приобретен амплифицир-х онкоген-участков в одних и тех же ломких сайтах (зд. FRA 16 D / FRA 3 B)-. Отдельно: l в) раки ЖКТ, легких, молочной железы, др. : также в т. н. ломк-сайтах (см. ниже) соотв-х клеток набл-сь потери длинных посл-й в ~200 -600 тыс. п. н. (хромос. 3). l 3. митохондриальная MSI (mt. MSI): ассоциирована с частью в. н. онко. -забол. /раков [прям. -кишки; карциномы желудка (встав/делец в D-loop-смещения-нити для синтеза mt. DNA; транзиц. – в генах ND 1/ND 5/COXI); гепатокл. -карцин: в обл. D-loop обнар. (CA)n-повт. и гомо-C-тракты); раками поджелудочной железы, легких; молочной железы (число mt. MSI-мутац в D-loop повыш. в 216 раз); почки, яичника; пищевода (в D-loop); простаты; при лейкозе) и доброкач. -опух. (напр. , печени, но в мен. -степ. ; HBV-инфицир-ть усил мутац и процесс озлокач-я) - все это было связ одновременно и с мт. MSI=mt. MSI.
l Примеры онкогенных типов повреждений/перестановок в геноме, ассоциированных с мини/микро-сателлитн (п. п. 1 -3; 5, 6) (и др-повторами [п. 4] и видами нестаб. ): l l 1. а) При спорадическом неполипозном раке прямой кишки (спорад. HNPCC): набл выс. -частотн. ядерн. -микросат. -нестаб. (n. MSI), связ с точеч/др. мутац генов системы MMR-репарации (MSH 2/MSH 3/MSH 6/др). Уров микросател-мутаций в генах опух-кл – на неск. поряд выше, чем в не-раков клетках. MSI формир-сь (в др. генах): делец-ми в (A)10 - и встав-ми в (GT)3 -повторах TGFβIIR-гена; (G)8 -делец-ми – для IGFIIR (рецептора II инсул. -подобн. факт. роста), и (G)8 -делеции/вставки – в случае включенного в апоптоз BAX-гена]. l б) При наслед. -HNPCC-раке набл мутац MLH 1 гена-репар и мутаторн-фенот кл, кот были связ, во-перв, с MSI-мутац в генах (BAX, Caspase-5 и IGFIIR; но не MSH 3, MSH 6, TCF 4 и TGFBRII) и, во-втор, с нестаб-ю хромосом (CIN, также мб ассоц с фланкирповторами), причем в период прогрессии опухоли эти два вида нестаб-ти (MSI/CIN) им обратную завис-ть. Однако, набл-сь амбивалентность белков репарации, когда дефицит Msh 2 -белка вызывал уменьшение нестабильности (CAG)n но не других повторов (у мыши). l 2. [С концевыми (АТ)n-микросател-ми и АТ-богат. -минисат-ми] были связаны (а, б, в): l а) множественн миелома: транслокация t(14; 16) последов-тей; l б) рак молоч-железы, простаты: набл потерю гетерозиготности, LOH (обеими аллелями), т. е. потери опух-супрессирующ или, наобор, приобретен амплифицир-х онкоген-участков в одних и тех же ломких сайтах (зд. FRA 16 D / FRA 3 B)-. Отдельно: l в) раки ЖКТ, легких, молочной железы, др. : также в т. н. ломк-сайтах (см. ниже) соотв-х клеток набл-сь потери длинных посл-й в ~200 -600 тыс. п. н. (хромос. 3). l 3. митохондриальная MSI (mt. MSI): ассоциирована с частью в. н. онко. -забол. /раков [прям. -кишки; карциномы желудка (встав/делец в D-loop-смещения-нити для синтеза mt. DNA; транзиц. – в генах ND 1/ND 5/COXI); гепатокл. -карцин: в обл. D-loop обнар. (CA)n-повт. и гомо-C-тракты); раками поджелудочной железы, легких; молочной железы (число mt. MSI-мутац в D-loop повыш. в 216 раз); почки, яичника; пищевода (в D-loop); простаты; при лейкозе) и доброкач. -опух. (напр. , печени, но в мен. -степ. ; HBV-инфицир-ть усил мутац и процесс озлокач-я) - все это было связ одновременно и с мт. MSI=mt. MSI.
 l 4. Ломкие сайты l l (ЛС; образ-т перетяжки/повреждения хроматид), обыч связ с диспергир / тандемными повт-ми (в кот им-ся DSBs ключевых генов: клет-цикла / репарации). ЛС имеются в соматич / полов кл-х и содержат по кр мер три типа тандем или дисперг повторов (микросателлиты, минисателлиты, а также ДНК/РНКтранспозоны, т. ДНК) и, реже, АТ-богатые области. В целом, ЛС ассоциир-ся не тол с онкологич, но и друг заболев-ми: неврологич-ми (их ~20: болезнь Хантингтона, наследуемая умственная задержка, атаксия Фридриха, атаксия/телеангиоэктазия, спиноцеребральные атаксии, синдром Вернера, миотонические дистрофии, др. ; превалир тринукл-повторы; т. н. «динамич мутац» с 1991 года), болезнями развития и заболев-ми, связ с необх-ю быстр адаптац к окруж-услов и модуляц-ми морфологич / социо-поведенч-х признаков (выкармлив и вылизыв детеныш самками мышей)). 5. CLL (хр. л-л) ассоц (в том числе) с минисат-подоб/SINE Alu-повт: Транслокация t(14 q 32; 19 q 13) меж участками хромосом 14 (где локал-н Ig. H-ген) и хр. -19 (где локал-н потенц. -протоонког BCL 3), и при участ 5‘-обл S alpha 1 переключат региона, иниц-сь Alu-повт-ми (кот фланкир обл-повреж-я хр. -19). Сам Alu содер минисат-под встав (в 25 н. ) ========================================================== l 6. Хромотрипсис, т. е. (упрощ. ) множествен. фрагментация и последующ. воссоединен. , амплификац. , делец. , инверсии десятков/сотен относит. корот и оч длин. -фрагментов генома одной, реже 2 -6, хромосом, связан с различ типами рака (медуллобластомой, миелоидным лейкозом, меланомой, не-/мелкоклеточным раком легких, мочевого пузыря, глиомой, синовиальной саркомой, толстого кишечника, гепатоклеточной карциномой, почки, щитовидной железой, ретинобластомой; острым миелоидным лейкозом, хроническ лимфолейкозом, др. гематологическими опухолями; и т. д. ). Хромотрипсис касается не менее 2− 3% (иногда много более) почти каждого типа первичных опухолей и их клеточных культур (но, также, некоторых доброкачественных опухолей, генетических заболеваний и эмбриональных патологий). В больш-ве случаев сильн. беспорядочн. движен фиксируемых в хромосом(е/ах) фрагментов ассоциировано с микро-гомологичными (до 6 п. н. ) участками, фланкирующими в. н. фрагменты. Природа появления и способ манипуляции микрогомологичными участками могут быть связаны с дисбалансом воспроиз-ва олиго. НЭ (продуктом в. ПОТ-механизмом).
l 4. Ломкие сайты l l (ЛС; образ-т перетяжки/повреждения хроматид), обыч связ с диспергир / тандемными повт-ми (в кот им-ся DSBs ключевых генов: клет-цикла / репарации). ЛС имеются в соматич / полов кл-х и содержат по кр мер три типа тандем или дисперг повторов (микросателлиты, минисателлиты, а также ДНК/РНКтранспозоны, т. ДНК) и, реже, АТ-богатые области. В целом, ЛС ассоциир-ся не тол с онкологич, но и друг заболев-ми: неврологич-ми (их ~20: болезнь Хантингтона, наследуемая умственная задержка, атаксия Фридриха, атаксия/телеангиоэктазия, спиноцеребральные атаксии, синдром Вернера, миотонические дистрофии, др. ; превалир тринукл-повторы; т. н. «динамич мутац» с 1991 года), болезнями развития и заболев-ми, связ с необх-ю быстр адаптац к окруж-услов и модуляц-ми морфологич / социо-поведенч-х признаков (выкармлив и вылизыв детеныш самками мышей)). 5. CLL (хр. л-л) ассоц (в том числе) с минисат-подоб/SINE Alu-повт: Транслокация t(14 q 32; 19 q 13) меж участками хромосом 14 (где локал-н Ig. H-ген) и хр. -19 (где локал-н потенц. -протоонког BCL 3), и при участ 5‘-обл S alpha 1 переключат региона, иниц-сь Alu-повт-ми (кот фланкир обл-повреж-я хр. -19). Сам Alu содер минисат-под встав (в 25 н. ) ========================================================== l 6. Хромотрипсис, т. е. (упрощ. ) множествен. фрагментация и последующ. воссоединен. , амплификац. , делец. , инверсии десятков/сотен относит. корот и оч длин. -фрагментов генома одной, реже 2 -6, хромосом, связан с различ типами рака (медуллобластомой, миелоидным лейкозом, меланомой, не-/мелкоклеточным раком легких, мочевого пузыря, глиомой, синовиальной саркомой, толстого кишечника, гепатоклеточной карциномой, почки, щитовидной железой, ретинобластомой; острым миелоидным лейкозом, хроническ лимфолейкозом, др. гематологическими опухолями; и т. д. ). Хромотрипсис касается не менее 2− 3% (иногда много более) почти каждого типа первичных опухолей и их клеточных культур (но, также, некоторых доброкачественных опухолей, генетических заболеваний и эмбриональных патологий). В больш-ве случаев сильн. беспорядочн. движен фиксируемых в хромосом(е/ах) фрагментов ассоциировано с микро-гомологичными (до 6 п. н. ) участками, фланкирующими в. н. фрагменты. Природа появления и способ манипуляции микрогомологичными участками могут быть связаны с дисбалансом воспроиз-ва олиго. НЭ (продуктом в. ПОТ-механизмом).
 l (в целом, в связи с повторами/генами есть 2 взаимосвяз-вопроса): l 1. «Ясно» : Размножение / перенос повторов (концевых) при рекомбинац-х событиях – как бы понятны: l а). стабилизация тандемн. -массива и пороговая оптимизация повторов достигается прерыванием их экспансий / сжатий; l б). Допускают, что точ. -мутац. еще могут формировать моно-/ди-/тринуклеотидные дупликации, но «маловероят, чтобы цел длинн микросателл / минисателл появляются за счет последовательных точечных мутаций» ; (м работ др мех-м) l 2. не ясно откуда появляются (для прокариот/эукариот ): а) первые единичн. /один-два совершен. и несовершен. повторы (в нов. -сайте генома, и вне рекомбинац-процессов); для объяснения феномена одних точеч. -мутаций недостаточно); l б) (схож-тема): сами гены (бактерий/эукариот): «…общепризн-м. и эффект-м в эволюц. -отнош. явл. дупликации и событ-горизонтпереноса генов. Однако ни то, ни другое событие не образует гены «de novo» , а оперирует на уже существующих генах. Значимость дупликац/переносов не снижается, но вопрос о происхожд генов остаётся нерешённым…(как образуются гены de novo, мы даже представить себе не можем). . . Так же не ясно, почему и у l бактерий разных видов существует множество генов, которые не встречаются в микробах другого вида, т. е. являются видоспецифическими…; . . . вот уже более 20 (Г. Б. Смирнов). лет не хватает ключевой концепции»
l (в целом, в связи с повторами/генами есть 2 взаимосвяз-вопроса): l 1. «Ясно» : Размножение / перенос повторов (концевых) при рекомбинац-х событиях – как бы понятны: l а). стабилизация тандемн. -массива и пороговая оптимизация повторов достигается прерыванием их экспансий / сжатий; l б). Допускают, что точ. -мутац. еще могут формировать моно-/ди-/тринуклеотидные дупликации, но «маловероят, чтобы цел длинн микросателл / минисателл появляются за счет последовательных точечных мутаций» ; (м работ др мех-м) l 2. не ясно откуда появляются (для прокариот/эукариот ): а) первые единичн. /один-два совершен. и несовершен. повторы (в нов. -сайте генома, и вне рекомбинац-процессов); для объяснения феномена одних точеч. -мутаций недостаточно); l б) (схож-тема): сами гены (бактерий/эукариот): «…общепризн-м. и эффект-м в эволюц. -отнош. явл. дупликации и событ-горизонтпереноса генов. Однако ни то, ни другое событие не образует гены «de novo» , а оперирует на уже существующих генах. Значимость дупликац/переносов не снижается, но вопрос о происхожд генов остаётся нерешённым…(как образуются гены de novo, мы даже представить себе не можем). . . Так же не ясно, почему и у l бактерий разных видов существует множество генов, которые не встречаются в микробах другого вида, т. е. являются видоспецифическими…; . . . вот уже более 20 (Г. Б. Смирнов). лет не хватает ключевой концепции»
 Отдельные свойства повторов, тезисно (биоинформатика + мол-генетика): 1. Пунктуация естеств геномов повторами (обеспечение специфичности разных геномов и их отдельных участков; напр. , динуклеотидные повторы встречаются в среднем каждые 2 тыс. п. н). Между 2 нитями ДНК существ симметрия по повторам (три/тетранукл-м и др. ) и предпол-ся непрерыв. обмен инвертир. -нукл. посл-ми межд обеими нитям ДНК. 2. Пунктуац. отсут у «псевдослучайных-ДНК» (in silico), получ методом «случайн генератора» . 3. Это не «эгоистическая» ДНК. 4. «Повторы, одновременно, служат как сигналами, включающими механизмы геномных перестроек, так и структурными элементами, на которых эти механизмы оперируют» (Г. Б. С. ). При этом они связываются с спец-повтор-связыв-ми белками и модулир-ся метилазами и бел-ми модификации и нуклеосом и гистонов. 5. Повторы, фланкируя больш/мал-фрагм-ДНК, способствуют их движ-ю как внутри Яд/Мт/(Хп), так и переносу этих фр-в между ДНК-содержащими клеточными органеллами. Корот. повторы нередко присутств: а) внутри длин. повтор, и фланкир их; б) меж генами; в) в разл участ генов (экзон псевдог); не редк кодир АК (Ала/Глу/Глн/Асп/Асн/Тре/Сер/Про/др. ) 6. 7. Отмеч тенденции: а) преобразов-й повторов в те же самые и в другие повторы (в том числе в сложно-состав- «матрешки» , с подобием фрактал-организации; б) мож функ-ть принцип «малое движ большим» ; в) в повторах м происх «вызрев-е» фрагм-в кодир послед-й. (напр. , сущ тысячи линио-спец видов Alu-повт: танд/рассеян/соверш/несовер, им разн возр/длин). 8. Повторы: а) обеспеч избыточ-ть эукар-ДНК; б) одноврем участв в процес компактизации генома эукариот/ /прокариот. 9. Повторы неоднородны по GC/AT-составу и пурин/пиримидиновой обогащ-ти. Показаны 2 вида асимметрии: межгеномной (Мт/Ядро) и межнитевой (лидирующая/отстающая нити). GCобогащенность мт. ДНК человека составляет 44%, причем тяжелая (H) нить обогащена Gs (где расположены 28 из 37 генов мт. ДНК чел. ), а легкая – Cs (здесь 9 генов). В хромат ядра общ доля (G+C) состав ~41% [но в разных хромос этот показатель колебл (38%-44%)]. (все это потенц свидел движения) 10. У бакт. (корот) повторы: а) фланкир вставочные IS-элементы (др. МГЭ) и острова патогенности (с генами/кассетами-генов адаптации, вирулентности, патогенности); входят в состав т. РНК-генов и разл функц -сайтов генома; б) одиночн. -инвертир. -повт входят в состав генов репарац, рекомбинац, рестрикцмодификации, репликации (и адаптац. = ГСР, гены стресс. -реакц, в кот присут прямые CR-повторы) [это касает минис. -подоб DUS-част повторов в 11 п. н. (кот способ DNA uptake sequences, ) и явл. сайтами интеграции фрагм-в ДНК (трансформирующ, др. ) (необх для выжив-я отд-х попул-й)] – но не др. генов; а межгенно эти повторы образ-т тандемы (т. е. идет преобраз-е повторов в кодир. /некодир. частях ДНК).
Отдельные свойства повторов, тезисно (биоинформатика + мол-генетика): 1. Пунктуация естеств геномов повторами (обеспечение специфичности разных геномов и их отдельных участков; напр. , динуклеотидные повторы встречаются в среднем каждые 2 тыс. п. н). Между 2 нитями ДНК существ симметрия по повторам (три/тетранукл-м и др. ) и предпол-ся непрерыв. обмен инвертир. -нукл. посл-ми межд обеими нитям ДНК. 2. Пунктуац. отсут у «псевдослучайных-ДНК» (in silico), получ методом «случайн генератора» . 3. Это не «эгоистическая» ДНК. 4. «Повторы, одновременно, служат как сигналами, включающими механизмы геномных перестроек, так и структурными элементами, на которых эти механизмы оперируют» (Г. Б. С. ). При этом они связываются с спец-повтор-связыв-ми белками и модулир-ся метилазами и бел-ми модификации и нуклеосом и гистонов. 5. Повторы, фланкируя больш/мал-фрагм-ДНК, способствуют их движ-ю как внутри Яд/Мт/(Хп), так и переносу этих фр-в между ДНК-содержащими клеточными органеллами. Корот. повторы нередко присутств: а) внутри длин. повтор, и фланкир их; б) меж генами; в) в разл участ генов (экзон псевдог); не редк кодир АК (Ала/Глу/Глн/Асп/Асн/Тре/Сер/Про/др. ) 6. 7. Отмеч тенденции: а) преобразов-й повторов в те же самые и в другие повторы (в том числе в сложно-состав- «матрешки» , с подобием фрактал-организации; б) мож функ-ть принцип «малое движ большим» ; в) в повторах м происх «вызрев-е» фрагм-в кодир послед-й. (напр. , сущ тысячи линио-спец видов Alu-повт: танд/рассеян/соверш/несовер, им разн возр/длин). 8. Повторы: а) обеспеч избыточ-ть эукар-ДНК; б) одноврем участв в процес компактизации генома эукариот/ /прокариот. 9. Повторы неоднородны по GC/AT-составу и пурин/пиримидиновой обогащ-ти. Показаны 2 вида асимметрии: межгеномной (Мт/Ядро) и межнитевой (лидирующая/отстающая нити). GCобогащенность мт. ДНК человека составляет 44%, причем тяжелая (H) нить обогащена Gs (где расположены 28 из 37 генов мт. ДНК чел. ), а легкая – Cs (здесь 9 генов). В хромат ядра общ доля (G+C) состав ~41% [но в разных хромос этот показатель колебл (38%-44%)]. (все это потенц свидел движения) 10. У бакт. (корот) повторы: а) фланкир вставочные IS-элементы (др. МГЭ) и острова патогенности (с генами/кассетами-генов адаптации, вирулентности, патогенности); входят в состав т. РНК-генов и разл функц -сайтов генома; б) одиночн. -инвертир. -повт входят в состав генов репарац, рекомбинац, рестрикцмодификации, репликации (и адаптац. = ГСР, гены стресс. -реакц, в кот присут прямые CR-повторы) [это касает минис. -подоб DUS-част повторов в 11 п. н. (кот способ DNA uptake sequences, ) и явл. сайтами интеграции фрагм-в ДНК (трансформирующ, др. ) (необх для выжив-я отд-х попул-й)] – но не др. генов; а межгенно эти повторы образ-т тандемы (т. е. идет преобраз-е повторов в кодир. /некодир. частях ДНК).
 11. Повторы, напр. Alu, содерж-ся в разл. функц. -сайтах, – промоторн (РНК-полимеразы III), энхансерн, "затравок" обрат-танскрипции (необх. для транспозиции); др. Сложносоставн Alu (в ~280 п. н. ) имеют 2 части (кажд в ~120 п. н. ; с разл. степ. консерв-ти/эвол. истор. ) и разделительн части (в неск. /20/100/бол. п. н. ), – возможно, подверженные мини(реже-микро)-сател-регуляции. 12. Нек повторы, напр. , α-сател-чел (сод-ся, в частн, в 5′/3′-НТО повтор- комплементарных областей генов транскрипц-активных зон ранне-эмбр-тканей некоторых позвоночных), содерж уч-ки для вз-я с короткими РНК (si. RNAs, или повтор-ассоциир rasi. RNAs), с котор они вз-т и интерферируют; это ведет к 2 -м вид негативн-регул: а) подавл экспрессии специфич/(сосед) генов; б) стимуляц образов гетерохроматина (мозаике тандемн. -сателитов + дисперг. траспозонов). α-сател. могут формир «новые» и вытеснять «старые» слои αповторов в одной хром [соответ, с разным содерж-ем транспозонов (и уч-ми для микро/мини-сателл-окружения)], и переноситься между разнхромосомами]. 13. Одни повторы могут провоцир размнож-е друг (за эвол. знач. срок): коротк прям повторы → способ размнож-ю центромер-α-сателлитов, а эти, в свою очередь, – причастны к изменениям перицентромер-повторов: а) «взрывам» β-сателлитов (BSRs приматов в ~100 п. н. ; и 100+68≈170 п. н. в стыках дуплицированных сегментов ДНК); б) а также GCбогатых γ-сателлитов (220 п. н. ), кот огранич распростр-е гетерохро-матина за пределы перицентромер-пространства [за счет анти-сайленсингового эффекта интактных Ikaros-связывающих сайтов, содержащих 5'-GGGAA-3’ пентануклеотидный мотив]. (конститутивн. доля гетер-хром всего ~6% генома) 14. Минисат-подобн повторы бактер/архебакт (cr. RNAs/уник. -спейсер. ) обеспеч антифагов/плазмидн «имм-защиту» (CRISPR-локуса, Clustered Regularly Interspaced Short Palindromic Repeats) за счет вз с коротк фраг-ми чужеродн. -ДНК в ~30 п. н. (с участ. процессир. cas-бел-в). Избыточ-е кол-во тех или иных повторов содерж-ся в трех типах генов: реакции на стресс ГСР (а), ответственные за перенос/приобретение генетической информации (б), и некот важные для «обслуживания» генома (в). 15. Часть супер-упрощен схемы преобраз-й повторов (и в контексте гипот. -механ-в возм-го регуляторн/пластич контроля генов/генома [ex tempora и за эволюц. -значим срок]) повтор-подобн-олиго-НЭ → межген-повтор (микро-/минисат. . . →. . . др. повтор) → генн-повторы: интр/энх/промот/др. (+экзоны) → экзоны.
11. Повторы, напр. Alu, содерж-ся в разл. функц. -сайтах, – промоторн (РНК-полимеразы III), энхансерн, "затравок" обрат-танскрипции (необх. для транспозиции); др. Сложносоставн Alu (в ~280 п. н. ) имеют 2 части (кажд в ~120 п. н. ; с разл. степ. консерв-ти/эвол. истор. ) и разделительн части (в неск. /20/100/бол. п. н. ), – возможно, подверженные мини(реже-микро)-сател-регуляции. 12. Нек повторы, напр. , α-сател-чел (сод-ся, в частн, в 5′/3′-НТО повтор- комплементарных областей генов транскрипц-активных зон ранне-эмбр-тканей некоторых позвоночных), содерж уч-ки для вз-я с короткими РНК (si. RNAs, или повтор-ассоциир rasi. RNAs), с котор они вз-т и интерферируют; это ведет к 2 -м вид негативн-регул: а) подавл экспрессии специфич/(сосед) генов; б) стимуляц образов гетерохроматина (мозаике тандемн. -сателитов + дисперг. траспозонов). α-сател. могут формир «новые» и вытеснять «старые» слои αповторов в одной хром [соответ, с разным содерж-ем транспозонов (и уч-ми для микро/мини-сателл-окружения)], и переноситься между разнхромосомами]. 13. Одни повторы могут провоцир размнож-е друг (за эвол. знач. срок): коротк прям повторы → способ размнож-ю центромер-α-сателлитов, а эти, в свою очередь, – причастны к изменениям перицентромер-повторов: а) «взрывам» β-сателлитов (BSRs приматов в ~100 п. н. ; и 100+68≈170 п. н. в стыках дуплицированных сегментов ДНК); б) а также GCбогатых γ-сателлитов (220 п. н. ), кот огранич распростр-е гетерохро-матина за пределы перицентромер-пространства [за счет анти-сайленсингового эффекта интактных Ikaros-связывающих сайтов, содержащих 5'-GGGAA-3’ пентануклеотидный мотив]. (конститутивн. доля гетер-хром всего ~6% генома) 14. Минисат-подобн повторы бактер/архебакт (cr. RNAs/уник. -спейсер. ) обеспеч антифагов/плазмидн «имм-защиту» (CRISPR-локуса, Clustered Regularly Interspaced Short Palindromic Repeats) за счет вз с коротк фраг-ми чужеродн. -ДНК в ~30 п. н. (с участ. процессир. cas-бел-в). Избыточ-е кол-во тех или иных повторов содерж-ся в трех типах генов: реакции на стресс ГСР (а), ответственные за перенос/приобретение генетической информации (б), и некот важные для «обслуживания» генома (в). 15. Часть супер-упрощен схемы преобраз-й повторов (и в контексте гипот. -механ-в возм-го регуляторн/пластич контроля генов/генома [ex tempora и за эволюц. -значим срок]) повтор-подобн-олиго-НЭ → межген-повтор (микро-/минисат. . . →. . . др. повтор) → генн-повторы: интр/энх/промот/др. (+экзоны) → экзоны.
 l Вторичные структуры ДНК-повторов: в конце концов, метаболизм и преодоление «неудобн» вторич ДНК-структур (шпилек с/без петель, дуплексн, триплексн, тетраплексн, крестообразн, проч. ) ферм-ми различ «строительн» комплексов (репликационного, праймосомного, трансляционного, транскрипцго, сплаймосомного, др. ) и фер-ми репарации, связ с тем/иным видом синтеза ДНК (РНК), и опр-т прежд всег процесы расширен/сжат/преобр-я микро/минисатели (косвен и др. ) повторов в обеих нитях ДНК. l Отстающая нить: Однако наиб-мощным преобразов-м подверг-ся повторы (которых здесь в разы/порядки больш) и сама отстающая нить, синтез кот программируемо замедлен, фрагментарен и более специфичен/сложен даже в норме (здесь дольше экспонируется он. ДНК; см. след слайд). Вполне вероятно, что синтез и примирование отстающей нити (олиго-РНК/ДНК-праймером в 4 -60 нукл. ) сформирован природой так, чтобы была возможность, при необходимости, скорректировать ( «подправить» ) каждый из фрагментов отстающей нити ядерной ДНК (фрагмент-Оказаки и прилегающие к нему участки). Кр того, в Мт-х отстающ. ДНК-нит обнаруж повыш (в разы/порядки) число одиноч/очажков рибонукл-х вставок (в Яд эта тенденц такж им-ся). Олигонукл посл-ти (включ гип олиго-НЭ) мог вмеш-ся в проц примиров-я отстающей нити (внедрен/удален праймеров) и репликации ДНК (Яд/Мт). Интер-но, что функц-е здесь т. н. TLS-полимеразы (им-ся у всех биол-видов и испол-ся для репликативной репарации) способ вставлять как отдел нукл-ды, так и небол-олигонукл фрагменты (в. ПОТ/олиго-НЭ). (В этом случ скорость/синхронизации деления кл-к оказ-ся важнее, чем точност этог процесса ). l Предположение: Гипотетич вариабел Поэпитоп Обратн Трансляц отдел эпитопа (в. ПОТ-механизм) воспроизв олигонуклеотид посл-ти (олиго-НЭ), среди котор есть уникал и повторяющ (прежд всего, микро-/минисателлит-подобн), кот способ взаим-ть с различ повтор-ся участ-ми генов/генома и, тем самым, при необход, позитив/негативн влиять на люб процессы синтеза ДНК (различн видами репликац, репликац «скольжения» , репарац, рекомбинац, и др. ) на основе сопряженности самоорганизующихся (включая гипотетическую супрамолекулярную «ретранслосому» ) структур.
l Вторичные структуры ДНК-повторов: в конце концов, метаболизм и преодоление «неудобн» вторич ДНК-структур (шпилек с/без петель, дуплексн, триплексн, тетраплексн, крестообразн, проч. ) ферм-ми различ «строительн» комплексов (репликационного, праймосомного, трансляционного, транскрипцго, сплаймосомного, др. ) и фер-ми репарации, связ с тем/иным видом синтеза ДНК (РНК), и опр-т прежд всег процесы расширен/сжат/преобр-я микро/минисатели (косвен и др. ) повторов в обеих нитях ДНК. l Отстающая нить: Однако наиб-мощным преобразов-м подверг-ся повторы (которых здесь в разы/порядки больш) и сама отстающая нить, синтез кот программируемо замедлен, фрагментарен и более специфичен/сложен даже в норме (здесь дольше экспонируется он. ДНК; см. след слайд). Вполне вероятно, что синтез и примирование отстающей нити (олиго-РНК/ДНК-праймером в 4 -60 нукл. ) сформирован природой так, чтобы была возможность, при необходимости, скорректировать ( «подправить» ) каждый из фрагментов отстающей нити ядерной ДНК (фрагмент-Оказаки и прилегающие к нему участки). Кр того, в Мт-х отстающ. ДНК-нит обнаруж повыш (в разы/порядки) число одиноч/очажков рибонукл-х вставок (в Яд эта тенденц такж им-ся). Олигонукл посл-ти (включ гип олиго-НЭ) мог вмеш-ся в проц примиров-я отстающей нити (внедрен/удален праймеров) и репликации ДНК (Яд/Мт). Интер-но, что функц-е здесь т. н. TLS-полимеразы (им-ся у всех биол-видов и испол-ся для репликативной репарации) способ вставлять как отдел нукл-ды, так и небол-олигонукл фрагменты (в. ПОТ/олиго-НЭ). (В этом случ скорость/синхронизации деления кл-к оказ-ся важнее, чем точност этог процесса ). l Предположение: Гипотетич вариабел Поэпитоп Обратн Трансляц отдел эпитопа (в. ПОТ-механизм) воспроизв олигонуклеотид посл-ти (олиго-НЭ), среди котор есть уникал и повторяющ (прежд всего, микро-/минисателлит-подобн), кот способ взаим-ть с различ повтор-ся участ-ми генов/генома и, тем самым, при необход, позитив/негативн влиять на люб процессы синтеза ДНК (различн видами репликац, репликац «скольжения» , репарац, рекомбинац, и др. ) на основе сопряженности самоорганизующихся (включая гипотетическую супрамолекулярную «ретранслосому» ) структур.
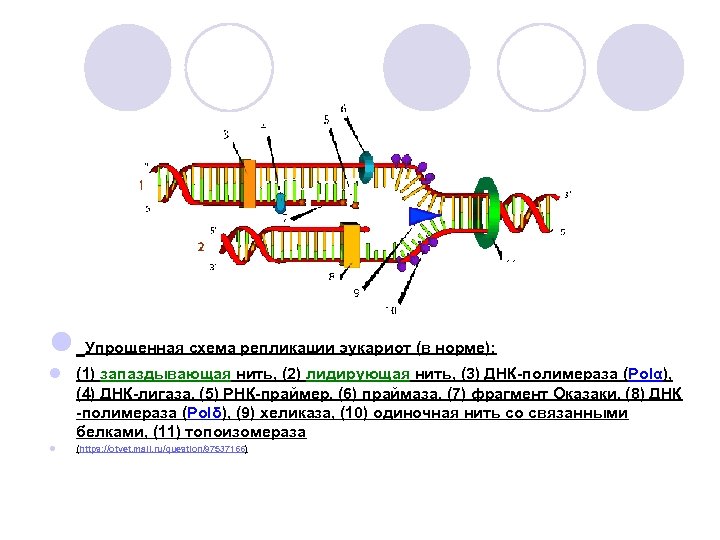 l Упрощенная схема репликации эукариот (в норме): l (1) запаздывающая нить, (2) лидирующая нить, (3) ДНК-полимераза (Polα), (4) ДНК-лигаза, (5) РНК-праймер, (6) праймаза, (7) фрагмент Оказаки, (8) ДНК -полимераза (Polδ), (9) хеликаза, (10) одиночная нить со связанными белками, (11) топоизомераза l (https: //otvet. mail. ru/question/97537166)
l Упрощенная схема репликации эукариот (в норме): l (1) запаздывающая нить, (2) лидирующая нить, (3) ДНК-полимераза (Polα), (4) ДНК-лигаза, (5) РНК-праймер, (6) праймаза, (7) фрагмент Оказаки, (8) ДНК -полимераза (Polδ), (9) хеликаза, (10) одиночная нить со связанными белками, (11) топоизомераза l (https: //otvet. mail. ru/question/97537166)
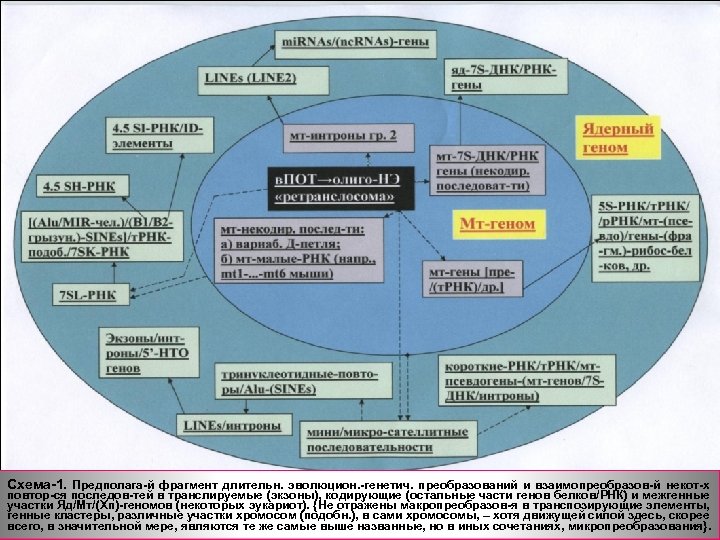 Схема-1. Предполага-й фрагмент длительн. эволюцион. -генетич. преобразований и взаимопреобразов-й некот-х повтор-ся последов-тей в транслируемые (экзоны), кодирующие (остальные части генов белков/РНК) и межгенные участки Яд/Мт/(Хп)-геномов (некоторых эукариот). {Не отражены макропреобразов-я в транспозирующие элементы, генные кластеры, различные участки хромосом (подобн. ), в сами хромосомы, – хотя движущей силой здесь, скорее всего, в значительной мере, являются те же самые выше названные, но в иных сочетаниях, микропреобразования}.
Схема-1. Предполага-й фрагмент длительн. эволюцион. -генетич. преобразований и взаимопреобразов-й некот-х повтор-ся последов-тей в транслируемые (экзоны), кодирующие (остальные части генов белков/РНК) и межгенные участки Яд/Мт/(Хп)-геномов (некоторых эукариот). {Не отражены макропреобразов-я в транспозирующие элементы, генные кластеры, различные участки хромосом (подобн. ), в сами хромосомы, – хотя движущей силой здесь, скорее всего, в значительной мере, являются те же самые выше названные, но в иных сочетаниях, микропреобразования}.
 В геноме/генах клет присут множест повтор-ся реальн/потенц-актив-олигонукл- сайтов i) (отдел-/перекрыв-ся, возник-х постоян/динамич), ассоц-х с соответств бел (и новосин-РНК), кот могут взаимть с избытком же олигон-посл-й различ-природы (1. продук незав-транскрип/проц-га, 2. «олиго-НЭ» ) 1. Рестрикции (тысячи); 2. «Ломк сайты» / «Горячие точки» (много); 3. Сайты модификации: метилирование: ДНК (по-Cp. G), гистонов, нуклеосом-белков (+ их ацетилир, фосфорилир, убиквитин-е (оч-много); 4. Мутац-сайты (много); 5. Начала репликации Яд / Мт-ДНК (ориджны=ori: их, соотв, тысячи/несколько); 6. Транскрипц-актив сайты генов (промотор, энхансерн, экзонн / интронн, 5’/3’-НТОобл-й, др. ) (много); 7. Часть мини/микро-сат-сайтов им-ся в кодир обл; а в некод-обл. такие сайты (в том числ) распол сред отд/класт-генов: а) микро-РНК (≈2 тыс. ); б) класт-pi. RNAs (кот синтез в длин транскрипт; ≈50 тыс. ); Яд/Цит; не им хар-х мотив/втор-стр {распол сред транспоз-в и по всем геному}), вз и обесп подав-е транспозон в Цит и сайленсинг в Яд; они м им множ-е эффты; (опр-ся при раке); 8. Рекомбинации (гомологич/негомологич; др. ); 9. Негатив-регуляции трансляции (в м. РНК) ; 10. Интерференции РНК (микро. РНК / м. РНК-мишень); 11. Редактир-я РНК (вкл экзон/интрон дуплексы); 12. Сплайсинга м. РНК / РНК-(др. ); 13. Транспозиц / Ретротранспозиц (за счет вз-я с концев-повтор-посл-ми); 14. Посадки праймеров начала репликации (яд. ДНК / мт. ДНК); 15. Посадки праймеров фрагм-Оказаки (десятки миллионов) реплицир-ДНК; 16. Теломерн / субтеломерн, центромерн / субцентромерн, эухроматинов / гетерохроматин, кодирующ / некодирующ, нуклеосомн / межнуклеосом областей; 17. Релаксации / Скручивания / Суперскручивания ДНК; 19. др.
В геноме/генах клет присут множест повтор-ся реальн/потенц-актив-олигонукл- сайтов i) (отдел-/перекрыв-ся, возник-х постоян/динамич), ассоц-х с соответств бел (и новосин-РНК), кот могут взаимть с избытком же олигон-посл-й различ-природы (1. продук незав-транскрип/проц-га, 2. «олиго-НЭ» ) 1. Рестрикции (тысячи); 2. «Ломк сайты» / «Горячие точки» (много); 3. Сайты модификации: метилирование: ДНК (по-Cp. G), гистонов, нуклеосом-белков (+ их ацетилир, фосфорилир, убиквитин-е (оч-много); 4. Мутац-сайты (много); 5. Начала репликации Яд / Мт-ДНК (ориджны=ori: их, соотв, тысячи/несколько); 6. Транскрипц-актив сайты генов (промотор, энхансерн, экзонн / интронн, 5’/3’-НТОобл-й, др. ) (много); 7. Часть мини/микро-сат-сайтов им-ся в кодир обл; а в некод-обл. такие сайты (в том числ) распол сред отд/класт-генов: а) микро-РНК (≈2 тыс. ); б) класт-pi. RNAs (кот синтез в длин транскрипт; ≈50 тыс. ); Яд/Цит; не им хар-х мотив/втор-стр {распол сред транспоз-в и по всем геному}), вз и обесп подав-е транспозон в Цит и сайленсинг в Яд; они м им множ-е эффты; (опр-ся при раке); 8. Рекомбинации (гомологич/негомологич; др. ); 9. Негатив-регуляции трансляции (в м. РНК) ; 10. Интерференции РНК (микро. РНК / м. РНК-мишень); 11. Редактир-я РНК (вкл экзон/интрон дуплексы); 12. Сплайсинга м. РНК / РНК-(др. ); 13. Транспозиц / Ретротранспозиц (за счет вз-я с концев-повтор-посл-ми); 14. Посадки праймеров начала репликации (яд. ДНК / мт. ДНК); 15. Посадки праймеров фрагм-Оказаки (десятки миллионов) реплицир-ДНК; 16. Теломерн / субтеломерн, центромерн / субцентромерн, эухроматинов / гетерохроматин, кодирующ / некодирующ, нуклеосомн / межнуклеосом областей; 17. Релаксации / Скручивания / Суперскручивания ДНК; 19. др.
 ii). Это может активировать / модифицировать (количественно / / качественно) следующие механизмы: 1. эндонуклеазный надрез; 2. Различ-виды рекомбинации (гомологичной/негомологичной; др. ); 3. Транспозицию / ретротранспозицию; 4. различ виды мутаций (транзиции/трансверсии/делеции/вставки; ) 5. Репликацию-/скольжения (кот мож приостан по кажд фрагм Оказаки отстающ нити); 6. репарацию (MMR, др. ); 7. транскрипцию; 8. трансляцию; 9. расширен / сжатие повтор-послед-й, ; 10. эксперессию генов / генома; 11. синтез лидирующей / отстающей нитей ДНК (Яд / Мт); 12. взаимодействие с вирусами (РНК / ДНК); 13. взаимодействие с бактер / внутрикл патогенами (их поверхностн / др. белками, ДНК / РНК); 14. интерференцию РНК; 15. редактирование РНК; 16. точечн / блочн мутацию ДНК; 17. соотношение гетеро- / эухроматиновых областей; 18. обмен нуклеиновыми последовательностями между клетками; 19. др.
ii). Это может активировать / модифицировать (количественно / / качественно) следующие механизмы: 1. эндонуклеазный надрез; 2. Различ-виды рекомбинации (гомологичной/негомологичной; др. ); 3. Транспозицию / ретротранспозицию; 4. различ виды мутаций (транзиции/трансверсии/делеции/вставки; ) 5. Репликацию-/скольжения (кот мож приостан по кажд фрагм Оказаки отстающ нити); 6. репарацию (MMR, др. ); 7. транскрипцию; 8. трансляцию; 9. расширен / сжатие повтор-послед-й, ; 10. эксперессию генов / генома; 11. синтез лидирующей / отстающей нитей ДНК (Яд / Мт); 12. взаимодействие с вирусами (РНК / ДНК); 13. взаимодействие с бактер / внутрикл патогенами (их поверхностн / др. белками, ДНК / РНК); 14. интерференцию РНК; 15. редактирование РНК; 16. точечн / блочн мутацию ДНК; 17. соотношение гетеро- / эухроматиновых областей; 18. обмен нуклеиновыми последовательностями между клетками; 19. др.
 iii) При онкологии такими активирован / модифицирован могут оказаться некотор из в. н. и дополнительн процессы: 1. усиления пролиферации; 2. усиления / ослабления, соответ: а) экспрессии онкогенов / антионкоген; б) гипо / гипер-метилирования ДНК по Cp. G-сайтам внутри / вблизи / отдаленно по отнош к генам-мишеням; 3. инициация / усиление репрограммир-я генома (в том числ проц-в метастазир-я, инвазив-ти, др. опух-хар-к); 4. Рекомбинации / репарации / мутации/ др. процессы; 5. Транспозиции - за счет pi. RNAs, кот наход в Яд/Цит (в том числ при раке), не им-т хар-х мотив/втор-стр {среди корот-повт/транспоз и по всем геному}), обесп-т подав-е транспон в Цитоплаз и сайленсинг в Яд; им множ-е эфф-ты; 6. усиления нестаб-ти в яд. ДНК: микро-(в-осн-3 -нукл) / минисателл и (ретро)транспозон (в отнош транскрипц-факт-в, белк / фермент / их-компл-в при репликац, репарац, др. ). Касает раков: прямой / толст кишк, жедуд, молочжелез, легк, мочев пузыря, простат, яичник, почк; нек менингиом, лейкозов, миелом, др. ; 7. усил-я микро-/минисател нестаб-ти мт. ДНК. Касается раков: прямой кишки, желудка, печени, поджелудочной железы, легких, молочной железы, почки, яичника, пищевода, простаты, лейкоза, др. . 8. изменение соотношения и активности гетеро- / эухроматина; 9. LOH и т. д.
iii) При онкологии такими активирован / модифицирован могут оказаться некотор из в. н. и дополнительн процессы: 1. усиления пролиферации; 2. усиления / ослабления, соответ: а) экспрессии онкогенов / антионкоген; б) гипо / гипер-метилирования ДНК по Cp. G-сайтам внутри / вблизи / отдаленно по отнош к генам-мишеням; 3. инициация / усиление репрограммир-я генома (в том числ проц-в метастазир-я, инвазив-ти, др. опух-хар-к); 4. Рекомбинации / репарации / мутации/ др. процессы; 5. Транспозиции - за счет pi. RNAs, кот наход в Яд/Цит (в том числ при раке), не им-т хар-х мотив/втор-стр {среди корот-повт/транспоз и по всем геному}), обесп-т подав-е транспон в Цитоплаз и сайленсинг в Яд; им множ-е эфф-ты; 6. усиления нестаб-ти в яд. ДНК: микро-(в-осн-3 -нукл) / минисателл и (ретро)транспозон (в отнош транскрипц-факт-в, белк / фермент / их-компл-в при репликац, репарац, др. ). Касает раков: прямой / толст кишк, жедуд, молочжелез, легк, мочев пузыря, простат, яичник, почк; нек менингиом, лейкозов, миелом, др. ; 7. усил-я микро-/минисател нестаб-ти мт. ДНК. Касается раков: прямой кишки, желудка, печени, поджелудочной железы, легких, молочной железы, почки, яичника, пищевода, простаты, лейкоза, др. . 8. изменение соотношения и активности гетеро- / эухроматина; 9. LOH и т. д.
 {Далее следующие рисунки / схемы касаются темы/доклада «горизонтальный перенос генов. . . » как в изложенном, так и в более широком / биосферном контесте (на основе работ сайта: www. amdeich-var-reverse-translation. ru)} – из др доклада: Рис. 1 и 2 – два из 3 -х авторских вариантов в. ПОТ-механизма. Следующий слайд – экспериментальные этапы и схематический вариант «обратной трасляции» (r. T-mechanism) по M. Nashimoto (2001). Рис. 3 – горизонтальный перенос между клетками иммунной системы (имеется выше ). Схема 1 – формирование универсального генетического кода (УГК) в хлоропластах/ /тилакодах, Хп/Тлк. Схема 2 – связь редактирования РНК, полиморфизмов ДНК/РНК с гипотетическим в. ПОТ-механизмом. Схема 3 – связь различных механизмов регуляции/эволюции генома с гипотетическим в. ПОТ-механизмом. Схема 4 – функционирование системы Генетической Челночной Обратной Связи (ГЧОС-системы) между разными организмами сообщества / группы-сообществ.
{Далее следующие рисунки / схемы касаются темы/доклада «горизонтальный перенос генов. . . » как в изложенном, так и в более широком / биосферном контесте (на основе работ сайта: www. amdeich-var-reverse-translation. ru)} – из др доклада: Рис. 1 и 2 – два из 3 -х авторских вариантов в. ПОТ-механизма. Следующий слайд – экспериментальные этапы и схематический вариант «обратной трасляции» (r. T-mechanism) по M. Nashimoto (2001). Рис. 3 – горизонтальный перенос между клетками иммунной системы (имеется выше ). Схема 1 – формирование универсального генетического кода (УГК) в хлоропластах/ /тилакодах, Хп/Тлк. Схема 2 – связь редактирования РНК, полиморфизмов ДНК/РНК с гипотетическим в. ПОТ-механизмом. Схема 3 – связь различных механизмов регуляции/эволюции генома с гипотетическим в. ПОТ-механизмом. Схема 4 – функционирование системы Генетической Челночной Обратной Связи (ГЧОС-системы) между разными организмами сообщества / группы-сообществ.
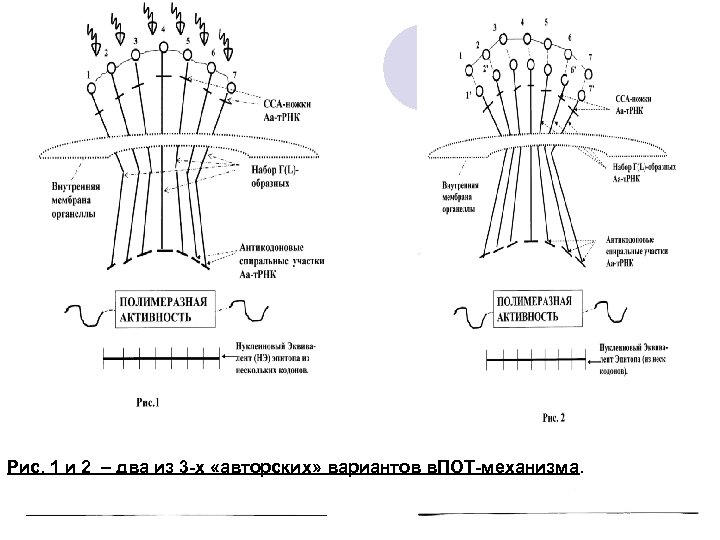 Рис. 1 и 2 – два из 3 -х «авторских» вариантов в. ПОТ-механизма.
Рис. 1 и 2 – два из 3 -х «авторских» вариантов в. ПОТ-механизма.
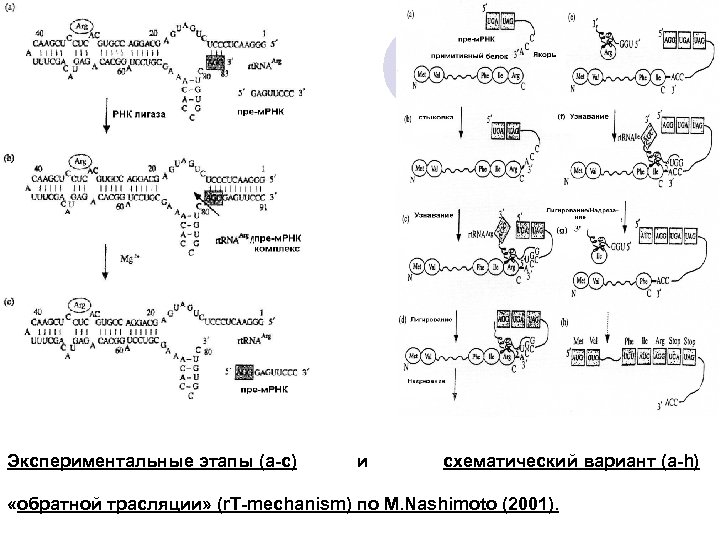 Экспериментальные этапы (a-c) и схематический вариант (a-h) «обратной трасляции» (r. T-mechanism) по M. Nashimoto (2001).
Экспериментальные этапы (a-c) и схематический вариант (a-h) «обратной трасляции» (r. T-mechanism) по M. Nashimoto (2001).
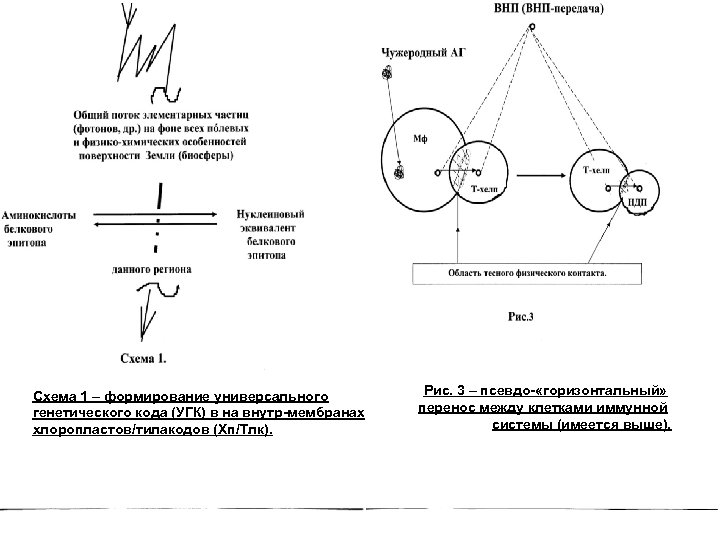 Схема 1 – формирование универсального генетического кода (УГК) в на внутр-мембранах хлоропластов/тилакодов (Хп/Тлк). Рис. 3 – псевдо- «горизонтальный» перенос между клетками иммунной системы (имеется выше).
Схема 1 – формирование универсального генетического кода (УГК) в на внутр-мембранах хлоропластов/тилакодов (Хп/Тлк). Рис. 3 – псевдо- «горизонтальный» перенос между клетками иммунной системы (имеется выше).
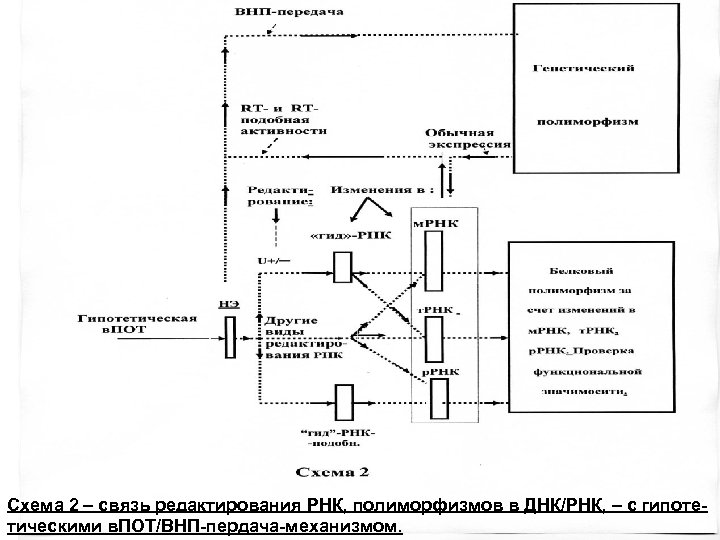 Схема 2 – связь редактирования РНК, полиморфизмов в ДНК/РНК, – с гипотетическими в. ПОТ/ВНП-пердача-механизмом.
Схема 2 – связь редактирования РНК, полиморфизмов в ДНК/РНК, – с гипотетическими в. ПОТ/ВНП-пердача-механизмом.
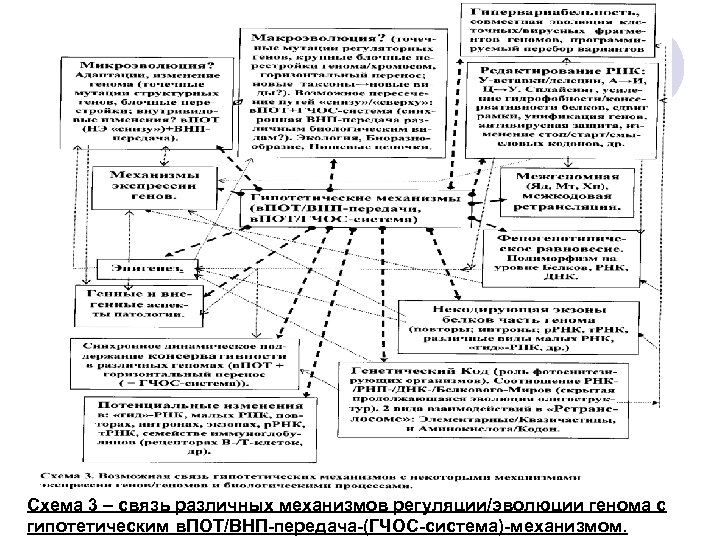 Схема 3 – связь различных механизмов регуляции/эволюции генома с гипотетическим в. ПОТ/ВНП-передача-(ГЧОС-система)-механизмом.
Схема 3 – связь различных механизмов регуляции/эволюции генома с гипотетическим в. ПОТ/ВНП-передача-(ГЧОС-система)-механизмом.
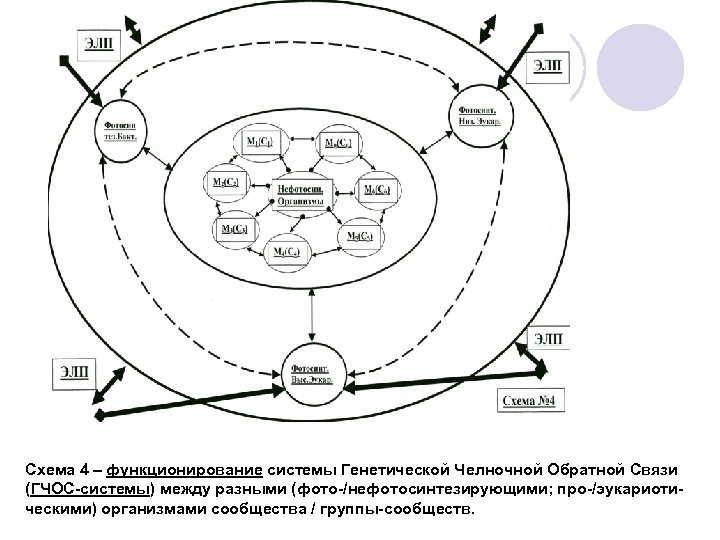 Схема 4 – функционирование системы Генетической Челночной Обратной Связи (ГЧОС-системы) между разными (фото-/нефотосинтезирующими; про-/эукариотическими) организмами сообщества / группы-сообществ.
Схема 4 – функционирование системы Генетической Челночной Обратной Связи (ГЧОС-системы) между разными (фото-/нефотосинтезирующими; про-/эукариотическими) организмами сообщества / группы-сообществ.


