 Повторение. Химические свойства соединений химических элементов Урок 2
Повторение. Химические свойства соединений химических элементов Урок 2
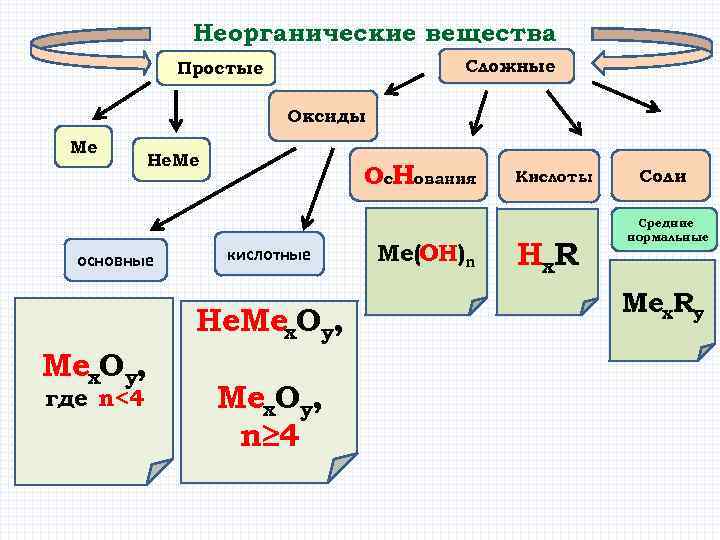 Неорганические вещества Сложные Простые Оксиды Me He. Me основные Ос. Нования кислотные He. Mex. Oy, где n<4 Mex. Oy, n≥ 4 Me(OH)n Кислоты Hx. R Соли Средние нормальные Mex. Ry
Неорганические вещества Сложные Простые Оксиды Me He. Me основные Ос. Нования кислотные He. Mex. Oy, где n<4 Mex. Oy, n≥ 4 Me(OH)n Кислоты Hx. R Соли Средние нормальные Mex. Ry
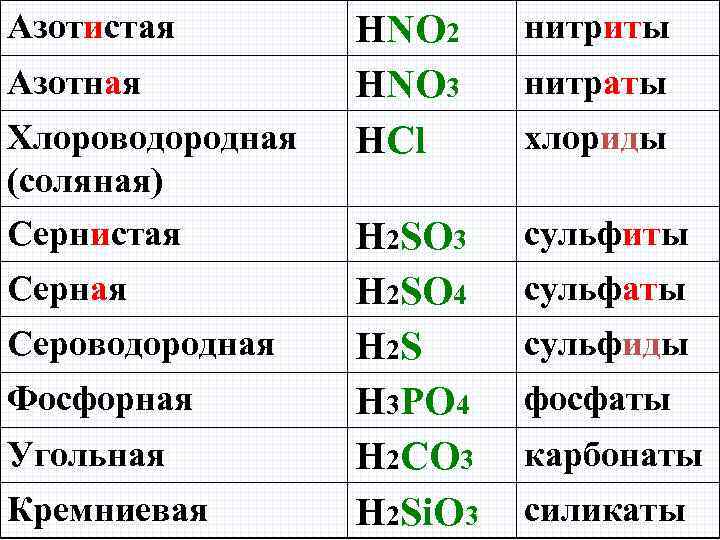 Азотистая Азотная Хлороводородная (соляная) Сернистая Серная Сероводородная Фосфорная Угольная Кремниевая HNO 2 HNO 3 HCl нитриты H 2 SO 3 H 2 SO 4 H 2 S H 3 PO 4 H 2 CO 3 H 2 Si. O 3 сульфиты нитраты хлориды сульфаты сульфиды фосфаты карбонаты силикаты
Азотистая Азотная Хлороводородная (соляная) Сернистая Серная Сероводородная Фосфорная Угольная Кремниевая HNO 2 HNO 3 HCl нитриты H 2 SO 3 H 2 SO 4 H 2 S H 3 PO 4 H 2 CO 3 H 2 Si. O 3 сульфиты нитраты хлориды сульфаты сульфиды фосфаты карбонаты силикаты
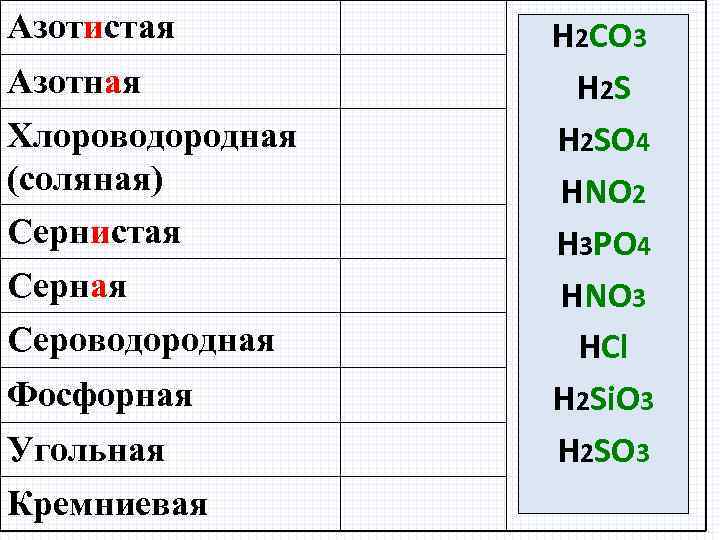 Азотистая Азотная Хлороводородная (соляная) Сернистая Серная Сероводородная Фосфорная Угольная Кремниевая H 2 CO 3 H 2 SO 4 HNO 2 H 3 PO 4 HNO 3 HCl H 2 Si. O 3 H 2 SO 3
Азотистая Азотная Хлороводородная (соляная) Сернистая Серная Сероводородная Фосфорная Угольная Кремниевая H 2 CO 3 H 2 SO 4 HNO 2 H 3 PO 4 HNO 3 HCl H 2 Si. O 3 H 2 SO 3
 2. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей, дайте им названия. H 2 SO 3, Na 2 O, Ag 2 SO 4, Fe(OH)2, N 2 O 3 HNO 2, Hg(NO 3)2, Pb. Cl 2, Li. OH
2. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей, дайте им названия. H 2 SO 3, Na 2 O, Ag 2 SO 4, Fe(OH)2, N 2 O 3 HNO 2, Hg(NO 3)2, Pb. Cl 2, Li. OH
 Запишите уравнения возможных реакций в молекулярном и ионном виде. Назовите продукты реакций, укажите типы реакций. а) Al 2 O 3 + H 2 O б) Li 2 SO 4 + Ba(NO 3)2 в) KNO 3 + Cu. SO 4 г) Hg + HCl д) Сu(ОН)2 + HNO 3 е) Fe + Mg. Cl → 2
Запишите уравнения возможных реакций в молекулярном и ионном виде. Назовите продукты реакций, укажите типы реакций. а) Al 2 O 3 + H 2 O б) Li 2 SO 4 + Ba(NO 3)2 в) KNO 3 + Cu. SO 4 г) Hg + HCl д) Сu(ОН)2 + HNO 3 е) Fe + Mg. Cl → 2
 1/ Вычислите массу осадка, образующегосяпри сливании 200 г 30% ногорастворагидроксида натрия с раствором сульфата меди ( II). 2/Вычислитемассу соли, полученной при взаимодействии гидроксида каль ция с 300 г раствора соляной кислоты, массовая доля вещества в котором составляет 15 %.
1/ Вычислите массу осадка, образующегосяпри сливании 200 г 30% ногорастворагидроксида натрия с раствором сульфата меди ( II). 2/Вычислитемассу соли, полученной при взаимодействии гидроксида каль ция с 300 г раствора соляной кислоты, массовая доля вещества в котором составляет 15 %.
 3/ При взаимодействии 92 г раствора карбоната калия с азотной кислотой выделилось1, 12 л газа (н. у. ). Определите массовую долю соли в исходном растворе. 4/ 10 г смеси меди и алюминияобработали солянойкислотой, при этомвыделилось 6, 72 л водорода. Определите состав смеси (в%).
3/ При взаимодействии 92 г раствора карбоната калия с азотной кислотой выделилось1, 12 л газа (н. у. ). Определите массовую долю соли в исходном растворе. 4/ 10 г смеси меди и алюминияобработали солянойкислотой, при этомвыделилось 6, 72 л водорода. Определите состав смеси (в%).
 Записать уравнения возможных реакций между веществами: Fe, Mg(NO )2, KCl, Na 2 CO 3, Li. OH, 3 H 2 SO 4(р р)
Записать уравнения возможных реакций между веществами: Fe, Mg(NO )2, KCl, Na 2 CO 3, Li. OH, 3 H 2 SO 4(р р)