 Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом. Ф. Энгельс
Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом. Ф. Энгельс
 Слово белок появилось в русском языке задолго до того, как была выяснена химическая природа этого вещества. Этот термин представляет собой производное от прилагательного «белый» и служит характеристикой различий двух разных по цвету основных компонентов куриного яйца (белка и желтка). Синонимом белка является слово «протеин» (англ. protein), которое используется во всей научной (и не только научной) литературе и происходит от греческого слова prwto – прото (первый, главный, важнейший), чем с давних времен подчеркивалась его исключительная роль. А латинское слово белок – albumen (или albuminis), альбумин используется для целой группы уже давно известных белков. Первая гипотеза о строении молекулы белка была предложена в 70 -х годах XIX в. Это была уреидная теория строения белка. В 1903 г. немецкий ученый Э. Г. Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO. Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. русским ученым А. Я. Данилевским. Эта теория получила подтверждение в последующих работах. Согласно полипептидной теории белки имеют определенную структуру.
Слово белок появилось в русском языке задолго до того, как была выяснена химическая природа этого вещества. Этот термин представляет собой производное от прилагательного «белый» и служит характеристикой различий двух разных по цвету основных компонентов куриного яйца (белка и желтка). Синонимом белка является слово «протеин» (англ. protein), которое используется во всей научной (и не только научной) литературе и происходит от греческого слова prwto – прото (первый, главный, важнейший), чем с давних времен подчеркивалась его исключительная роль. А латинское слово белок – albumen (или albuminis), альбумин используется для целой группы уже давно известных белков. Первая гипотеза о строении молекулы белка была предложена в 70 -х годах XIX в. Это была уреидная теория строения белка. В 1903 г. немецкий ученый Э. Г. Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO. Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. русским ученым А. Я. Данилевским. Эта теория получила подтверждение в последующих работах. Согласно полипептидной теории белки имеют определенную структуру.
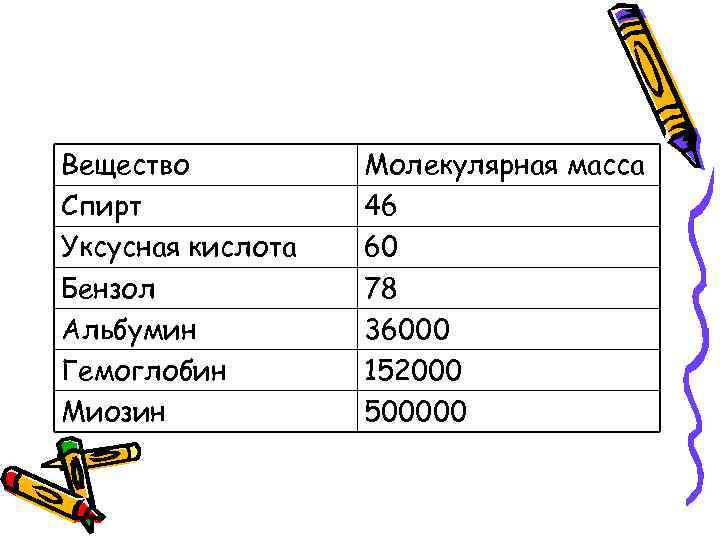 Вещество Спирт Уксусная кислота Бензол Альбумин Гемоглобин Миозин Молекулярная масса 46 60 78 36000 152000 500000
Вещество Спирт Уксусная кислота Бензол Альбумин Гемоглобин Миозин Молекулярная масса 46 60 78 36000 152000 500000
 СТРОЕНИЕ БЕЛКОВ. В живых организмах открыто несколько сотен различных аминокислотных структур, и все они могут быть охарактеризованы одной общей химической формулой в двух вариантах: Во всех аминокислотах имеются аминная –NH 3+ (N-конец) и карбоксильная –COO– (С-конец) группы, которые определяют соответственно основные и кислотные проявления этих веществ, в результате чего они обладают амфотерными (как щелочными, так и кислотными) свойствами. Из приведенных формул также видно, что все эти вещества различаются лишь радикалами R. В образовании белков участвует 20 так называемых стандартных аминокислот, т. е. 20 различных радикалов R.
СТРОЕНИЕ БЕЛКОВ. В живых организмах открыто несколько сотен различных аминокислотных структур, и все они могут быть охарактеризованы одной общей химической формулой в двух вариантах: Во всех аминокислотах имеются аминная –NH 3+ (N-конец) и карбоксильная –COO– (С-конец) группы, которые определяют соответственно основные и кислотные проявления этих веществ, в результате чего они обладают амфотерными (как щелочными, так и кислотными) свойствами. Из приведенных формул также видно, что все эти вещества различаются лишь радикалами R. В образовании белков участвует 20 так называемых стандартных аминокислот, т. е. 20 различных радикалов R.

 ПЕРВООТКРЫВАТЕЛИ АМИНОКИСЛОТ Первой аминокислотой, открытой в живой природе, оказался не самый простой по химической структуре – глицин, а аспарагин (N). Его в 1806 г. выделили Луи Никола Воклен (1763– 1829) и Пьер Жан Робике (1780– 1840) во Франции. Попутно заметим, что открытие всех 20 стандартных аминокислот длилось больше века и завершилось лишь в 1937 г. открытием треонина (Т). Первым ученым, внесшим весомый вклад в установление химической природы белков, был выдающийся немецкий химик-органик Герман Эмиль Фишер (1852– 1919), который в 1902 г. открыл то, что аминокислоты в белках соединены пептидными связями. А первую химическую формулу простейшего природного олигопептида (дипептида карнозина) в 1900 г. определили наш соотечественник, профессор Московского университета В. С. Гулевич (1867– 1933).
ПЕРВООТКРЫВАТЕЛИ АМИНОКИСЛОТ Первой аминокислотой, открытой в живой природе, оказался не самый простой по химической структуре – глицин, а аспарагин (N). Его в 1806 г. выделили Луи Никола Воклен (1763– 1829) и Пьер Жан Робике (1780– 1840) во Франции. Попутно заметим, что открытие всех 20 стандартных аминокислот длилось больше века и завершилось лишь в 1937 г. открытием треонина (Т). Первым ученым, внесшим весомый вклад в установление химической природы белков, был выдающийся немецкий химик-органик Герман Эмиль Фишер (1852– 1919), который в 1902 г. открыл то, что аминокислоты в белках соединены пептидными связями. А первую химическую формулу простейшего природного олигопептида (дипептида карнозина) в 1900 г. определили наш соотечественник, профессор Московского университета В. С. Гулевич (1867– 1933).
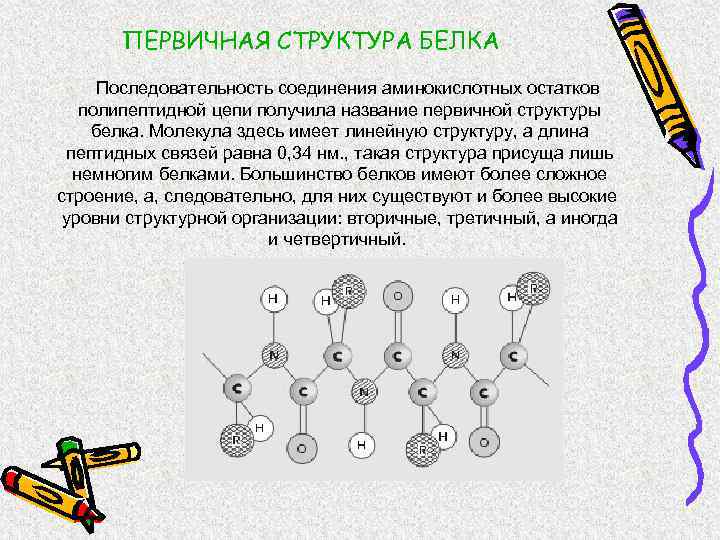 ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА Последовательность соединения аминокислотных остатков полипептидной цепи получила название первичной структуры белка. Молекула здесь имеет линейную структуру, а длина пептидных связей равна 0, 34 нм. , такая структура присуща лишь немногим белками. Большинство белков имеют более сложное строение, а, следовательно, для них существуют и более высокие уровни структурной организации: вторичные, третичный, а иногда и четвертичный.
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА Последовательность соединения аминокислотных остатков полипептидной цепи получила название первичной структуры белка. Молекула здесь имеет линейную структуру, а длина пептидных связей равна 0, 34 нм. , такая структура присуща лишь немногим белками. Большинство белков имеют более сложное строение, а, следовательно, для них существуют и более высокие уровни структурной организации: вторичные, третичный, а иногда и четвертичный.
 ВТОРИЧНАЯ СТРУКТУРА БЕЛКА Вторичная структура – форма полипептидной цепи в Пространстве в а-спираль или в-слой(основные элементы вторичной структуры) Такая структура существует благодаря внутримолекулярным водородным связям (CO. . . NH), которые возникают между отдельными участками цепи. Вторичной структурой обладает большая часть белков, правда, не всегда на всём протяжении полипептидной цепи.
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА Вторичная структура – форма полипептидной цепи в Пространстве в а-спираль или в-слой(основные элементы вторичной структуры) Такая структура существует благодаря внутримолекулярным водородным связям (CO. . . NH), которые возникают между отдельными участками цепи. Вторичной структурой обладает большая часть белков, правда, не всегда на всём протяжении полипептидной цепи.
 ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи) В формировании этой структуры играют большую роль полное гидрофобное взаимодействие и дисульфидные связи. По характеру "упаковки" белковой молекулы различают глобулярные и фибриллярные белки. Для глобулярных белков более характерна а-спиральная структура спирали изогнуты, "свёрнуты". Макромолекула имеет сферическую форму. Такие белки хорошо растворяются в воде. Для фибриллярных белков более характерна нитевидная структура. Они, как правило, не растворяются в воде.
ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи) В формировании этой структуры играют большую роль полное гидрофобное взаимодействие и дисульфидные связи. По характеру "упаковки" белковой молекулы различают глобулярные и фибриллярные белки. Для глобулярных белков более характерна а-спиральная структура спирали изогнуты, "свёрнуты". Макромолекула имеет сферическую форму. Такие белки хорошо растворяются в воде. Для фибриллярных белков более характерна нитевидная структура. Они, как правило, не растворяются в воде.
 ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА Четвертичная структура –белки с более высоким уровнем организации. Она представляет собой функциональное объединение нескольких (двух, трёх и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА Четвертичная структура –белки с более высоким уровнем организации. Она представляет собой функциональное объединение нескольких (двух, трёх и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин.
 Белками, или белковыми веществами, называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, соединённых амидной (пептидной) связью.
Белками, или белковыми веществами, называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, соединённых амидной (пептидной) связью.
 Денатурация белков (от де. . . и лат. natura — природные свойства, сущность), характерное для белковых веществ изменение их строения и естественных свойств при изменении физических и химических условий среды: при повышении температуры, изменении кислотности раствора и др. Обратный процесс называется ренатурацией. Денатурация проявляется в понижении растворимости белков, изменении их электрохимических, химических и биологических свойств (ферментативных, антигенных и др. ). Денатурация имеет большое значение для многих физиологических процессов и промышленной переработке белкового сырья.
Денатурация белков (от де. . . и лат. natura — природные свойства, сущность), характерное для белковых веществ изменение их строения и естественных свойств при изменении физических и химических условий среды: при повышении температуры, изменении кислотности раствора и др. Обратный процесс называется ренатурацией. Денатурация проявляется в понижении растворимости белков, изменении их электрохимических, химических и биологических свойств (ферментативных, антигенных и др. ). Денатурация имеет большое значение для многих физиологических процессов и промышленной переработке белкового сырья.
 Превращения белков в организме
Превращения белков в организме

 Искусство С древних времен, когда еще ничего не было известно о белках как особых веществах, они (например, белки куриного яйца) использовались в качестве эффективного клея при строительстве архитектурных сооружений (например, церквей), а также в изобразительном искусстве приготовлении прочных красок. В то же время богатейшее многообразие молекулярных белковых форм может служить сытной пищей для художников, скульпторов и архитекторов. И иногда даже уже служит. Так, скульптурная композиция, изображающая изящную пространственную структуру калиевого комплекса пептида валиномицина, украшает лужайку перед главным входом в Институт биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова Российской Академии наук в Москве.
Искусство С древних времен, когда еще ничего не было известно о белках как особых веществах, они (например, белки куриного яйца) использовались в качестве эффективного клея при строительстве архитектурных сооружений (например, церквей), а также в изобразительном искусстве приготовлении прочных красок. В то же время богатейшее многообразие молекулярных белковых форм может служить сытной пищей для художников, скульпторов и архитекторов. И иногда даже уже служит. Так, скульптурная композиция, изображающая изящную пространственную структуру калиевого комплекса пептида валиномицина, украшает лужайку перед главным входом в Институт биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова Российской Академии наук в Москве.


