Povrezhdenie_kletki_ZAO_32_sl.ppt
- Количество слайдов: 32
 Повреждение клетки
Повреждение клетки
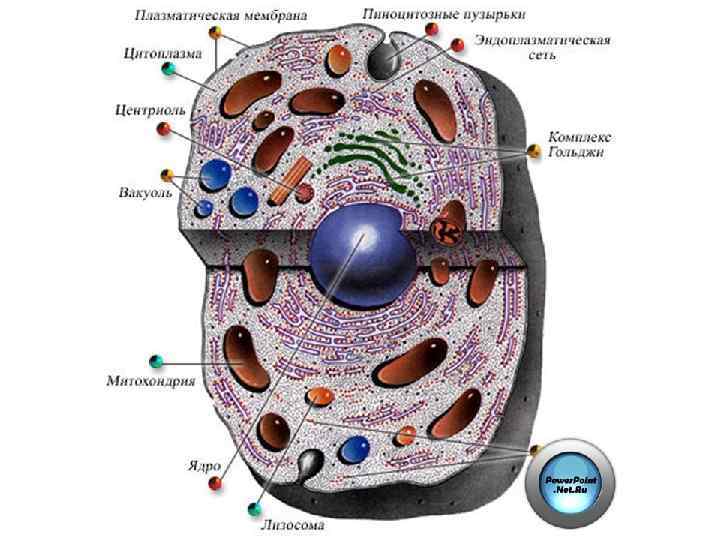
 ПОВРЕЖДЕНИЕ КЛЕТКИ – нарушение ее жизнедеятельности в результате влияния патогенного агента. Главные причины клеточных повреждений: - гипоксия, - ацидоз, - активация АФК, - денатурация белка, - повышение проницаемости клеточных мембран, - дисбаланс ионов и воды.
ПОВРЕЖДЕНИЕ КЛЕТКИ – нарушение ее жизнедеятельности в результате влияния патогенного агента. Главные причины клеточных повреждений: - гипоксия, - ацидоз, - активация АФК, - денатурация белка, - повышение проницаемости клеточных мембран, - дисбаланс ионов и воды.
 • В основе повреждения лежит разрушение части структурных элементов клетки, вследствие чего клетка в целом хуже выполняет свои функции. • Повреждение клетки может быть частичным либо полным, обратимым либо необратимым. • Необратимое повреждение может привести к прогрессирующей деструкции клетки и ее гибели.
• В основе повреждения лежит разрушение части структурных элементов клетки, вследствие чего клетка в целом хуже выполняет свои функции. • Повреждение клетки может быть частичным либо полным, обратимым либо необратимым. • Необратимое повреждение может привести к прогрессирующей деструкции клетки и ее гибели.
 Общие механизмы клеточной альтерации: - повреждение мембран с активацией свободнорадикальных процессов и активацией ферментов (гидролаз мембранных, лизосомальных, цитоплазматических), - нарушение ионных каналов и насосов ионного состава клеток и набухание клетки и митохондрий с нарушением синтеза АТФ, - нарушение мембранного потенциала клетки - все они ведут к нарушению всех специфичных функций клеток, - активации лизосомальных ферментов, ацидозу и лизису клеток.
Общие механизмы клеточной альтерации: - повреждение мембран с активацией свободнорадикальных процессов и активацией ферментов (гидролаз мембранных, лизосомальных, цитоплазматических), - нарушение ионных каналов и насосов ионного состава клеток и набухание клетки и митохондрий с нарушением синтеза АТФ, - нарушение мембранного потенциала клетки - все они ведут к нарушению всех специфичных функций клеток, - активации лизосомальных ферментов, ацидозу и лизису клеток.
 • Любая живая клетка подвержена влиянию нервных, гормональных, метаболических, энергетических и других воздействий со стороны целого организма, нарушение ее функций связано в конечном счете с изменениями химического состава раствора в ее непосредственном окружении: концентрацией ионов, метаболитов и т. д. • Все эти изменения могут рассматриваться как факторы, оказывающие воздействие на функционирование клетки. • Эти факторы могут в принципе либо улучшать, либо ухудшать условия жизнедеятельности клетки; • в последнем случае их называют неблагоприятными. • Следует различать прямое действие неблагоприятного фактора на данную клетку и косвенное его влияние, опосредованное воздействием на другие клетки, органы, ткани и организм в целом.
• Любая живая клетка подвержена влиянию нервных, гормональных, метаболических, энергетических и других воздействий со стороны целого организма, нарушение ее функций связано в конечном счете с изменениями химического состава раствора в ее непосредственном окружении: концентрацией ионов, метаболитов и т. д. • Все эти изменения могут рассматриваться как факторы, оказывающие воздействие на функционирование клетки. • Эти факторы могут в принципе либо улучшать, либо ухудшать условия жизнедеятельности клетки; • в последнем случае их называют неблагоприятными. • Следует различать прямое действие неблагоприятного фактора на данную клетку и косвенное его влияние, опосредованное воздействием на другие клетки, органы, ткани и организм в целом.
 • Прямое нарушение жизнедеятельности клетки и ее повреждение могут быть вызваны отсутствием кислорода, чрезмерно низким значением р. Н, низким осмотическим давлением в окружающей среде, недостатком ионов кальция, действием ультрафиолетовой или ионизирующей радиации и т. д. • В условиях целостного организма первичное действие повреждающего фактора на клеткимишени (т. е. клетки, повреждаемые непосредственно) сопровождается изменениями и в других клетках. • Эти изменения опосредованы нарушением функционирования клеток-мишеней и поэтому могут быть названы вторичными.
• Прямое нарушение жизнедеятельности клетки и ее повреждение могут быть вызваны отсутствием кислорода, чрезмерно низким значением р. Н, низким осмотическим давлением в окружающей среде, недостатком ионов кальция, действием ультрафиолетовой или ионизирующей радиации и т. д. • В условиях целостного организма первичное действие повреждающего фактора на клеткимишени (т. е. клетки, повреждаемые непосредственно) сопровождается изменениями и в других клетках. • Эти изменения опосредованы нарушением функционирования клеток-мишеней и поэтому могут быть названы вторичными.
 • Всякое повреждение клетки выражается в определенном нарушении ее структуры и функций. • При этом различные повреждающие факторы вызывают неодинаковые специфические первичные нарушения в клеточных структурах.
• Всякое повреждение клетки выражается в определенном нарушении ее структуры и функций. • При этом различные повреждающие факторы вызывают неодинаковые специфические первичные нарушения в клеточных структурах.
 • При механическом повреждении происходит нарушение целостности структуры ткани, клеток, межклеточных и субклеточных структур. • Термическое повреждение связано с денатурацией белков и белково-липидных комплексов клетки, а также с изменением вторичной структуры нуклеиновых кислот. • При действии ионизирующей и ультрафиолетовой радиации первичным является разрушение молекул, поглотивших энергию, с образованием свободных радикалов, что приводит к поражению многих внутриклеточных структур. • При химическом (токсическом) повреждении первичным является торможение (ингибирование) отдельных клеточных ферментов или их комплексов, например подавление активности цитохромоксидазы цианидами, торможение сукцинатдегидрогеназы солями малоновой кислоты, угнетение холинэстеразы диизопропилфторфосфатом (нервный яд) или другими фосфорорганическими ингибиторами.
• При механическом повреждении происходит нарушение целостности структуры ткани, клеток, межклеточных и субклеточных структур. • Термическое повреждение связано с денатурацией белков и белково-липидных комплексов клетки, а также с изменением вторичной структуры нуклеиновых кислот. • При действии ионизирующей и ультрафиолетовой радиации первичным является разрушение молекул, поглотивших энергию, с образованием свободных радикалов, что приводит к поражению многих внутриклеточных структур. • При химическом (токсическом) повреждении первичным является торможение (ингибирование) отдельных клеточных ферментов или их комплексов, например подавление активности цитохромоксидазы цианидами, торможение сукцинатдегидрогеназы солями малоновой кислоты, угнетение холинэстеразы диизопропилфторфосфатом (нервный яд) или другими фосфорорганическими ингибиторами.
 • Первичное, специфическое воздействие повреждающего фактора направлено на совершенно конкретные молекулярные структуры клетки. • Нарушение этих структур вызывает целый каскад событий, заканчивающихся общим ответом клетки как целого. • При этом можно различить несколько стадий ответа клеток на внешнее неблагоприятное воздействие.
• Первичное, специфическое воздействие повреждающего фактора направлено на совершенно конкретные молекулярные структуры клетки. • Нарушение этих структур вызывает целый каскад событий, заканчивающихся общим ответом клетки как целого. • При этом можно различить несколько стадий ответа клеток на внешнее неблагоприятное воздействие.
 Специфические механизмы повреждения клеток (примеры): - изменение осмотического давления с гипергидратацией (осмотический гемолиз); - разобщители окисления и фосфорилирования – динитрофенол снижает синтез АТФ одновременно увеличивая дыхание клеток.
Специфические механизмы повреждения клеток (примеры): - изменение осмотического давления с гипергидратацией (осмотический гемолиз); - разобщители окисления и фосфорилирования – динитрофенол снижает синтез АТФ одновременно увеличивая дыхание клеток.
 • Вначале, как правило, имеет место неспецифическая реакция, характерная для всякого раздражения. • В случае электровозбудимых клеток - это генерация мембранного потенциала действия, свойственная нервным клеткам и волокнам, мышечным клеткам и даже фагоцитам. • Практически у всех клеток при действии повреждающих агентов наблюдается резкое увеличение проницаемости клеточных мембран для ионов, в частности для ионов кальция, с последующей активацией различных внутриклеточных систем: протеинкиназ, фосфолипаз, систем биосинтеза белков, фосфодиэстеразы циклических нуклеотидов, аденилатциклазы, сократительного аппарата клетки и т. д. • Эта первая, обратимая стадия в определенной степени направлена на компенсацию нарушений, вызываемых повреждающим агентом, будь то компенсация на уровне данной клетки или на уровне целого организма.
• Вначале, как правило, имеет место неспецифическая реакция, характерная для всякого раздражения. • В случае электровозбудимых клеток - это генерация мембранного потенциала действия, свойственная нервным клеткам и волокнам, мышечным клеткам и даже фагоцитам. • Практически у всех клеток при действии повреждающих агентов наблюдается резкое увеличение проницаемости клеточных мембран для ионов, в частности для ионов кальция, с последующей активацией различных внутриклеточных систем: протеинкиназ, фосфолипаз, систем биосинтеза белков, фосфодиэстеразы циклических нуклеотидов, аденилатциклазы, сократительного аппарата клетки и т. д. • Эта первая, обратимая стадия в определенной степени направлена на компенсацию нарушений, вызываемых повреждающим агентом, будь то компенсация на уровне данной клетки или на уровне целого организма.
 • При более сильном или более длительном воздействии повреждающего фактора имеет место также нарушение функций клеток, которое приводит к ухудшению функционирования ткани и органа в целом. • Изменения, наблюдаемые при этом в клетке, напоминают изменения в погибших клетках, но они обратимы. • Такое состояние клеток называется паранекрозом. • Внешне паранекроз проявляется в помутнении цитоплазмы, вакуолизации, появлении грубодисперсных осадков, увеличении проникновения в клетку различных красителей.
• При более сильном или более длительном воздействии повреждающего фактора имеет место также нарушение функций клеток, которое приводит к ухудшению функционирования ткани и органа в целом. • Изменения, наблюдаемые при этом в клетке, напоминают изменения в погибших клетках, но они обратимы. • Такое состояние клеток называется паранекрозом. • Внешне паранекроз проявляется в помутнении цитоплазмы, вакуолизации, появлении грубодисперсных осадков, увеличении проникновения в клетку различных красителей.
 • Если часть клеток в ткани погибла окончательно, а другие продолжают функционировать, то такое состояние "между жизнью и смертью" называют некробиозом. • Наконец, гибель клеток, т. е. такое их повреждение, которое в условиях организма необратимо, называют некрозом. • Некроз сопровождается активацией ряда лизосомальных ферментов (например, фосфолипаз и протеаз), разрушением других клеточных структур. • Этот процесс называется аутолизом. • Аутолиз необходим для удаления мертвых клеток и замены их новыми клетками или элементами соединительной ткани.
• Если часть клеток в ткани погибла окончательно, а другие продолжают функционировать, то такое состояние "между жизнью и смертью" называют некробиозом. • Наконец, гибель клеток, т. е. такое их повреждение, которое в условиях организма необратимо, называют некрозом. • Некроз сопровождается активацией ряда лизосомальных ферментов (например, фосфолипаз и протеаз), разрушением других клеточных структур. • Этот процесс называется аутолизом. • Аутолиз необходим для удаления мертвых клеток и замены их новыми клетками или элементами соединительной ткани.
 Феноменологические (внешние) проявления повреждения клеток Неспецифическая реакция клеток на повреждение заключается в нарушении барьерной функции клеточной и внутриклеточных мембран, а также выключение ионных насосов. Это сопровождается нарушением распределения веществ (компартментализации) внутри клетки и между клеткой и окружающей средой, дезорганизацией внутриклеточного метаболизма и нарушением системы энергообеспечения.
Феноменологические (внешние) проявления повреждения клеток Неспецифическая реакция клеток на повреждение заключается в нарушении барьерной функции клеточной и внутриклеточных мембран, а также выключение ионных насосов. Это сопровождается нарушением распределения веществ (компартментализации) внутри клетки и между клеткой и окружающей средой, дезорганизацией внутриклеточного метаболизма и нарушением системы энергообеспечения.
 • В неспецифической реакции клеток на повреждение значительную роль играет необратимая инактивация (денатурация) белков, связанная с нарушением структуры (конформации) белковой молекулы. • Одним из первых результатов всякого повреждения клетки является увеличение проницаемости цитоплазматической мембраны и нарушение клеточной энергетики. • Ионы кальция начинают просачиваться внутрь клетки, в результате чего происходит увеличение концентрации кальция от 10 -8 -10 -7 моль/л (в норме) до 10 -6 -10 -5 моль/л. • Это приводит к нарушениям в цитоскелете, активации сократительных структур, образованию нерастворимых включений кальция в матриксе митохондрий, повреждению внутриклеточных мембран и общей дезорганизации метаболизма.
• В неспецифической реакции клеток на повреждение значительную роль играет необратимая инактивация (денатурация) белков, связанная с нарушением структуры (конформации) белковой молекулы. • Одним из первых результатов всякого повреждения клетки является увеличение проницаемости цитоплазматической мембраны и нарушение клеточной энергетики. • Ионы кальция начинают просачиваться внутрь клетки, в результате чего происходит увеличение концентрации кальция от 10 -8 -10 -7 моль/л (в норме) до 10 -6 -10 -5 моль/л. • Это приводит к нарушениям в цитоскелете, активации сократительных структур, образованию нерастворимых включений кальция в матриксе митохондрий, повреждению внутриклеточных мембран и общей дезорганизации метаболизма.
 В результате изменений ионного состава цитоплазмы, р. Н, концентрации субстратов, кофакторов и регуляторов нарушаются внутриклеточные барьеры, что ведет к изменению активности ферментов и к дальнейшему развитию нарушений, полной дезорганизации обмена веществ.
В результате изменений ионного состава цитоплазмы, р. Н, концентрации субстратов, кофакторов и регуляторов нарушаются внутриклеточные барьеры, что ведет к изменению активности ферментов и к дальнейшему развитию нарушений, полной дезорганизации обмена веществ.
 Большую роль в развитии повреждения играет нарушение мембранных структур клетки, ответственных за неспецифическую (т. е. характерную для всех клеток) реакцию на повреждающее воздействие.
Большую роль в развитии повреждения играет нарушение мембранных структур клетки, ответственных за неспецифическую (т. е. характерную для всех клеток) реакцию на повреждающее воздействие.
 • Любое повреждение клетки сопровождается ацидозом ее цитоплазмы (р. Н падает до 6 и ниже). • Первичный ацидоз повреждения клеток следует отличать от вторичного ацидоза в воспаленной ткани, который возникает значительно позднее (через несколько часов) после нанесения повреждения. • Первичный ацидоз повреждения - следствие накопления недоокисленных продуктов метаболизма, в частности продуктов гликолиза в поврежденной клетке. • Первичный ацидоз в поврежденной ткани возникает независимо от вида повреждающего агента - механического, химического (например, горчичное масло), бактериального (дизентерийная палочка, гемолитический стафилококк).
• Любое повреждение клетки сопровождается ацидозом ее цитоплазмы (р. Н падает до 6 и ниже). • Первичный ацидоз повреждения клеток следует отличать от вторичного ацидоза в воспаленной ткани, который возникает значительно позднее (через несколько часов) после нанесения повреждения. • Первичный ацидоз повреждения - следствие накопления недоокисленных продуктов метаболизма, в частности продуктов гликолиза в поврежденной клетке. • Первичный ацидоз в поврежденной ткани возникает независимо от вида повреждающего агента - механического, химического (например, горчичное масло), бактериального (дизентерийная палочка, гемолитический стафилококк).
 • Увеличение объема клеток - один из наиболее ранних признаков ее повреждения, который проявляется, например, при недостатке кислорода в ткани - тканевой гипоксии. • Сохранение нормальной формы и объема клеток связано с состоянием цитоскелета и поддержанием определенного соотношения между осмотическим давлением белков и электролитов внутри и вне клетки. • Форма клетки определяется цитоскелетом, тогда как объем клетки - поддержанием осмотического баланса.
• Увеличение объема клеток - один из наиболее ранних признаков ее повреждения, который проявляется, например, при недостатке кислорода в ткани - тканевой гипоксии. • Сохранение нормальной формы и объема клеток связано с состоянием цитоскелета и поддержанием определенного соотношения между осмотическим давлением белков и электролитов внутри и вне клетки. • Форма клетки определяется цитоскелетом, тогда как объем клетки - поддержанием осмотического баланса.
 • Набухание клеток - процесс, далеко не безразличный для функционирования клеток и ткани в целом. • Первым результатом этого оказывается сдавливание кровеносных сосудов и затруднение кровообращения. • Так, при ишемии происходит набухание клеток и последующее общее возобновление кровообращения не сразу и не всегда приводит к восстановлению жизнедеятельности, потому что кровь не проникает в мелкие кровеносные сосуды, сдавленные набухшими клетками.
• Набухание клеток - процесс, далеко не безразличный для функционирования клеток и ткани в целом. • Первым результатом этого оказывается сдавливание кровеносных сосудов и затруднение кровообращения. • Так, при ишемии происходит набухание клеток и последующее общее возобновление кровообращения не сразу и не всегда приводит к восстановлению жизнедеятельности, потому что кровь не проникает в мелкие кровеносные сосуды, сдавленные набухшими клетками.
 • Одним из важных показателей повреждения клеток является нарушение строения и функций эндоплазматического ретикулума, митохондрий, лизосом, рибосом. • Различные болезнетворные факторы (инфекции, интоксикации) вызывают повреждения эндоплазматического ретикулума. • Они выражаются в набухании ретикулума, изменении формы его мембран.
• Одним из важных показателей повреждения клеток является нарушение строения и функций эндоплазматического ретикулума, митохондрий, лизосом, рибосом. • Различные болезнетворные факторы (инфекции, интоксикации) вызывают повреждения эндоплазматического ретикулума. • Они выражаются в набухании ретикулума, изменении формы его мембран.
 • Набухание митохондрий наблюдается, например, в клетках миокарда при недостаточности сердца, а также при многих инфекционных, гипоксических, токсических и других патологических процессах. • Различные повреждающие агенты, например, эндотоксины бактерий кишечно-тифозной группы, а также мелкие неорганические частицы (двуокись кремния, двуокись титана, алмазная пыль), попадая в лизосомы, разрушают их. • Ферменты лизосом освобождаются в цитоплазму клетки и вызывают повреждение субклеточных структур и ферментов цитоплазмы. • Повреждение лизосом может привести клетку к гибели.
• Набухание митохондрий наблюдается, например, в клетках миокарда при недостаточности сердца, а также при многих инфекционных, гипоксических, токсических и других патологических процессах. • Различные повреждающие агенты, например, эндотоксины бактерий кишечно-тифозной группы, а также мелкие неорганические частицы (двуокись кремния, двуокись титана, алмазная пыль), попадая в лизосомы, разрушают их. • Ферменты лизосом освобождаются в цитоплазму клетки и вызывают повреждение субклеточных структур и ферментов цитоплазмы. • Повреждение лизосом может привести клетку к гибели.
 Общими для всех поврежденных клеток являются увеличение внутриклеточного содержания кальция и нарушение биоэнергетических функций митохондрий. Эти два события лежат в основе нарушения функций поврежденных клеток и могут рассматриваться как главные звенья в цепи событий, приводящих к развитию неспецифической реакции клеток на повреждение.
Общими для всех поврежденных клеток являются увеличение внутриклеточного содержания кальция и нарушение биоэнергетических функций митохондрий. Эти два события лежат в основе нарушения функций поврежденных клеток и могут рассматриваться как главные звенья в цепи событий, приводящих к развитию неспецифической реакции клеток на повреждение.
 • Разобщение окислительного фосфорилирования и снижение кальцийаккумулирующей способности при повреждении митохондрий имеют самые драматические последствия для клетки. • Снижение уровня АТФ в клетке в результате разобщения окисления и фосфорилирования приводит к выключению ионных насосов, входу в клетку Са 2+, Na+ и воды, выходу K+, нарушению всех биохимических процессов, требующих затраты энергии АТФ. • Согласно современным представлениям, именно повреждение митохондрий является ключевым моментом, после которого изменения в клетке, вызванные повреждающим агентом, становятся необратимыми и клетка погибает.
• Разобщение окислительного фосфорилирования и снижение кальцийаккумулирующей способности при повреждении митохондрий имеют самые драматические последствия для клетки. • Снижение уровня АТФ в клетке в результате разобщения окисления и фосфорилирования приводит к выключению ионных насосов, входу в клетку Са 2+, Na+ и воды, выходу K+, нарушению всех биохимических процессов, требующих затраты энергии АТФ. • Согласно современным представлениям, именно повреждение митохондрий является ключевым моментом, после которого изменения в клетке, вызванные повреждающим агентом, становятся необратимыми и клетка погибает.
 • • МОРФОЛОГИЯ ПОВРЕЖДЕНИЯ КЛЕТОК В классической морфологии нелетальное повреждение клеток называется дистрофией. В большинстве случаев дистрофия относится к обратимым повреждениям. Некроз, наряду с апоптозом, является одним из двух морфологических выражений смерти клетки. Апоптоз ответствен за многочисленные физиологические и патологические процессы, происходящие в организме.
• • МОРФОЛОГИЯ ПОВРЕЖДЕНИЯ КЛЕТОК В классической морфологии нелетальное повреждение клеток называется дистрофией. В большинстве случаев дистрофия относится к обратимым повреждениям. Некроз, наряду с апоптозом, является одним из двух морфологических выражений смерти клетки. Апоптоз ответствен за многочисленные физиологические и патологические процессы, происходящие в организме.
 • Апоптоз является разновидностью смерти клетки, для которой характерна конденсация и фрагментация ДНК. • Апоптоз обеспечивает уничтожение клеток при нормальном развитии, тканевом росте, органогенезе и в органах иммунной системы.
• Апоптоз является разновидностью смерти клетки, для которой характерна конденсация и фрагментация ДНК. • Апоптоз обеспечивает уничтожение клеток при нормальном развитии, тканевом росте, органогенезе и в органах иммунной системы.
 Главные механизмы апоптоза: • активация эндонуклеаз ядра расщепляющих ДНК, • снижение мембранного потенциала митохондрий, Все это ведет к энергетическому голоду клетки (один, оба механизма).
Главные механизмы апоптоза: • активация эндонуклеаз ядра расщепляющих ДНК, • снижение мембранного потенциала митохондрий, Все это ведет к энергетическому голоду клетки (один, оба механизма).
 ЗАБОЛЕВАНИЯ НАРУШЕНИЯ АПОПТОЗА: • • • СНИЖЕНИЕ АПОПТОЗА: ведет к опухолям, аутоиммунным заболеваниям, частым вирусным инфекциям, нейропролиферативным заболеваниям. ПОВЫШЕНИЕ АПОПТОЗА: нейродегенеративных заболеваниях (болезнь Альцгеймера, миотрофии); болезни крови (апластическая анемия, миелодиспластический синдром); ишемия (инфаркт, инсульт, реперфузионные поражения); токсические повреждения печени и почек, СПИД.
ЗАБОЛЕВАНИЯ НАРУШЕНИЯ АПОПТОЗА: • • • СНИЖЕНИЕ АПОПТОЗА: ведет к опухолям, аутоиммунным заболеваниям, частым вирусным инфекциям, нейропролиферативным заболеваниям. ПОВЫШЕНИЕ АПОПТОЗА: нейродегенеративных заболеваниях (болезнь Альцгеймера, миотрофии); болезни крови (апластическая анемия, миелодиспластический синдром); ишемия (инфаркт, инсульт, реперфузионные поражения); токсические повреждения печени и почек, СПИД.
 МЕХАНИЗМЫ АДАПТАЦИИ КЛЕТКИ К ПОВРЕЖДЕНИЮ - Компенсация энергетических повреждений: переход на гликолитический синтез АТФ, активация ферментов транспорта энергии в клетке, повышение к. п. д. АТФаз; - Снижение функциональной активности и пластических процессов клетки. - Защита мембран и ферментов: активация антиоксидантной системы, буферных систем (снижение внутриклеточного ацидоза в т. ч. транспорт Н+ в митохондрии, саркоплазматический ретикулум и из клетки); - Повышение активности ферментов микросом (окисление, восстановление, деметилирование и пр. патогенных агентов); активация репарации мембранных структур клеток (белковый синтез репарации). - Нормализация водно-ионного баланса клетки: активация ионных насосов (мембран клеток и саркоплазматического ретикулума, меньше митохондрий), активация буферный систем. - Репарация генетических дефектов - ферменты репарации ДНК. - Компенсация процессов регуляции клетки: - изменение числа рецепторов клеток, их чувствительности (аффинности), - внутриклеточных посредников (G-белки, ц. АМФ, кальмодулин, Са 2+). - Активация всех типов обратных связей ведет к аутоадаптации метаболизма.
МЕХАНИЗМЫ АДАПТАЦИИ КЛЕТКИ К ПОВРЕЖДЕНИЮ - Компенсация энергетических повреждений: переход на гликолитический синтез АТФ, активация ферментов транспорта энергии в клетке, повышение к. п. д. АТФаз; - Снижение функциональной активности и пластических процессов клетки. - Защита мембран и ферментов: активация антиоксидантной системы, буферных систем (снижение внутриклеточного ацидоза в т. ч. транспорт Н+ в митохондрии, саркоплазматический ретикулум и из клетки); - Повышение активности ферментов микросом (окисление, восстановление, деметилирование и пр. патогенных агентов); активация репарации мембранных структур клеток (белковый синтез репарации). - Нормализация водно-ионного баланса клетки: активация ионных насосов (мембран клеток и саркоплазматического ретикулума, меньше митохондрий), активация буферный систем. - Репарация генетических дефектов - ферменты репарации ДНК. - Компенсация процессов регуляции клетки: - изменение числа рецепторов клеток, их чувствительности (аффинности), - внутриклеточных посредников (G-белки, ц. АМФ, кальмодулин, Са 2+). - Активация всех типов обратных связей ведет к аутоадаптации метаболизма.
 Стереотипные приспособления клетки: - гипертрофия, - гиперплазия, - дисплазия, - метаплазия (предрак), - белки теплового шока: • при гипертермии, гипоксии, интоксикациях, вирусном повреждении и пр. – защита клетки от самых различных стрессов и патогенов. Межклеточная адаптация: • нервные, эндокринные, цитокинные влияния, обмен метаболитами, ионами и пр. ; • изменение периферического кровообращения и лимфотока.
Стереотипные приспособления клетки: - гипертрофия, - гиперплазия, - дисплазия, - метаплазия (предрак), - белки теплового шока: • при гипертермии, гипоксии, интоксикациях, вирусном повреждении и пр. – защита клетки от самых различных стрессов и патогенов. Межклеточная адаптация: • нервные, эндокринные, цитокинные влияния, обмен метаболитами, ионами и пр. ; • изменение периферического кровообращения и лимфотока.
 ТИПОВЫЕ ФОРМЫ КЛЕТОЧНОЙ ПАТОЛОГИИ: • ДИСТРОФИИ (нарушения обмена) • БОЛЕЗНИ НАКОПЛЕНИЯ: ферментопатии обычно аутосомно-рецессивного типа: липидозы, гликогенозы, муколипозы, мукополисахаридозы, а также лизосомные и пероксисомного болезни. • ДИСПЛАЗИИ: нарушения дифференцировки клеток с изменением их структуры, метаболизма и функции, ведущие к нарушениям жизнедеятельности.
ТИПОВЫЕ ФОРМЫ КЛЕТОЧНОЙ ПАТОЛОГИИ: • ДИСТРОФИИ (нарушения обмена) • БОЛЕЗНИ НАКОПЛЕНИЯ: ферментопатии обычно аутосомно-рецессивного типа: липидозы, гликогенозы, муколипозы, мукополисахаридозы, а также лизосомные и пероксисомного болезни. • ДИСПЛАЗИИ: нарушения дифференцировки клеток с изменением их структуры, метаболизма и функции, ведущие к нарушениям жизнедеятельности.


