Адсорбция.pptx
- Количество слайдов: 57

ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ Адсорбцией называется самопроизвольное изменение концентрации компонентов в поверхностном слое по сравнению с его концентрацией в объёме фазы. Более плотную фазу (определяющую форму поверхности) принято называть адсорбентом, вещество, молекулы которого могут адсорбироваться – адсорбтивом, уже адсорбированное вещество – адсорбатом. Процесс, обратный адсорбции, называется десорбцией.

• • Адсорбция, абсорбция, сорбция Адсорбент, адсорбтив Хемосорбция Элюция

ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ Поверхностное натяжение – σ Результирующая сила Р (внутреннее давление).

Поверхностное натяжение (σ) равно обратимой изотермической работе, которую надо совершить, чтобы увеличить площадь межфазной поверхности на единицу. Т = const, 1, 2, [σ] = Дж/м 2 = Н/м, где — обратимая изотермическая работа образования площади поверхности d. S 1, 2, так как < 0 (над системой совершается работа), то в формулу вводится знак « » .

В условиях постоянства V, Т, состава системы = d. F: В условиях постоянства Т, Р, состава системы - = d. G: Поверхностное натяжение – основная термодинамическая характеристика поверхностного слоя жидкости на границе с газовой фазой или другой жидкостью. Поверхностное натяжение различных жидкостей на границе с собственным паром изменяется в широких пределах.
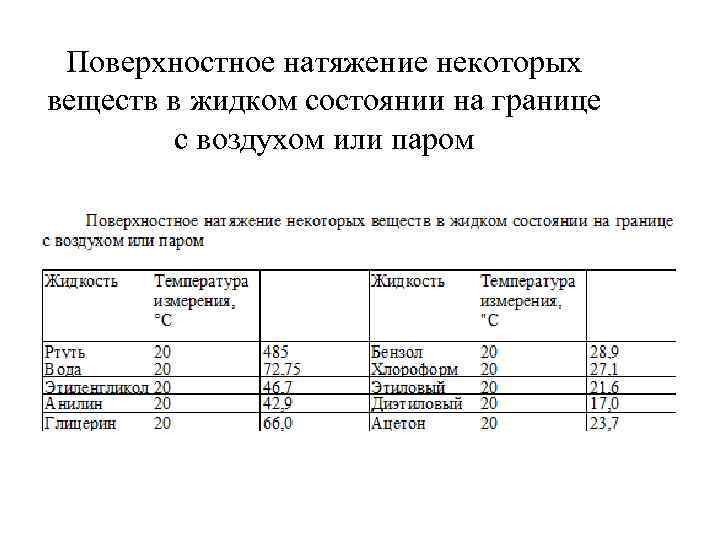
Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром

σ = σ 0 - а·(Т Т 0), где σ и σ0 — поверхностное натяжение при температурах Т и Т 0 соответственно; а = 0, 1 м. Дж/м 2 К — температурный коэффициент поверхностного натяжения.

АДСОРБЦИЯ НА ГРАНИЦЕ ЖИДКИЙ РАСТВОР - ГАЗ Для таких систем характерны следующие особенности. 1. Поверхность жидкости равноценна для адсорбции, так как однородна. 2. Молекулы растворенного вещества не закреплены на определенных участках поверхности и могут свободно передвигаться. 3. Силы взаимодействия между молекулами газа малы и ими можно пренебречь.

Уравнение Гиббса: Г= -с/RT · d /dc (1) где Г, моль/м 2 избыточная адсорбция, которая показывает на сколько 1 м 2 поверхностного слоя содержит больше (меньше) молей растворённого вещества, чем такой же слой в объёме фазы; с, моль/дм 3 молярная концентрация раствора; σ, Дж/м 2 поверхностное натяжение раствора; R = 8, 314 Дж/моль. К универсальная газовая постоянная; Т, К абсолютная температура.

Из уравнения Гиббса следует, что если d /dc < 0, т. е. при увеличении концентрации раствора происходит уменьшение поверхностного натяжения, то Г > 0. Растворенные вещества, способные снижать поверхностное натяжение растворов, называют поверхностно-активными веществами (ПАВ). Дифильное строение, т. е. полярная часть (функциональная группа) и неполярная часть (углеводородный радикал). Молекулы ПАВ изображают так:

Из уравнения Гиббса следует, что при dσ/dc > 0, т. если при увеличении концентрации раствора происходит увеличение поверхностного натяжения, Г < 0. Вещества, повышающие поверхностное натяжение, называют поверхностноинактивными веществами (ПИВ). Вещества, растворение которых не приводит к изменению поверхностного натяжения, называются поверхностнонеактивными веществами (ПНВ).
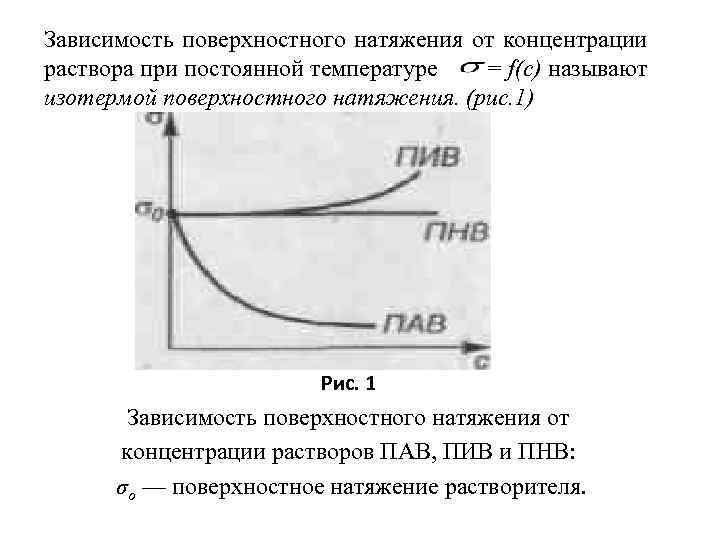
Зависимость поверхностного натяжения от концентрации раствора при постоянной температуре = f(c) называют изотермой поверхностного натяжения. (рис. 1) Рис. 1 Зависимость поверхностного натяжения от концентрации растворов ПАВ, ПИВ и ПНВ: σo — поверхностное натяжение растворителя.

Для того чтобы рассчитать избыточную адсорбцию по уравнению Гиббса, надо знать производную dσ/dc, которая имеет различные численные значения при различных концентрациях раствора. Чтобы было удобнее сравнивать влияние различных ПАВ на данную поверхность раздела, сравнивают производные (-d /dc) при с → 0. Величина (-d /dc)c→ 0 называется поверхностной активностью ПАВ, которая обозначается g (в честь Дж. Гиббса) и измеряется в Дж·м·моль 1.
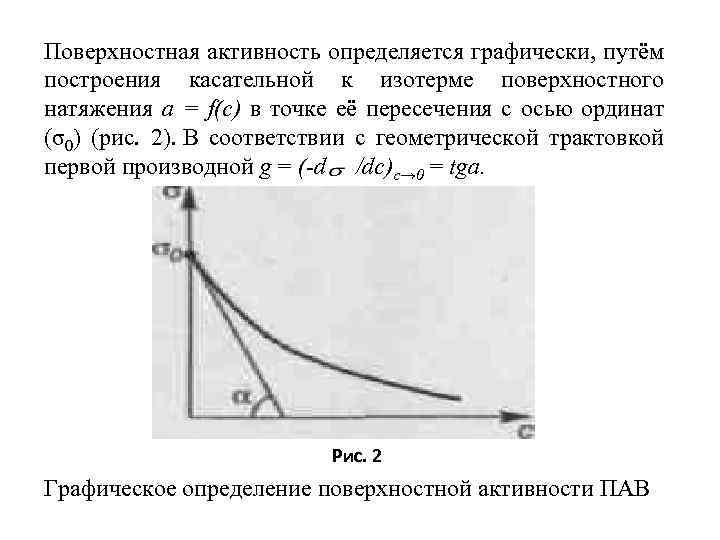
Поверхностная активность определяется графически, путём построения касательной к изотерме поверхностного натяжения а = f(c) в точке её пересечения с осью ординат (σ0) (рис. 2). В соответствии с геометрической трактовкой первой производной g = (-d /dc)c→ 0 = tga. Рис. 2 Графическое определение поверхностной активности ПАВ

Величина поверхностной активности зависит от длины углеводородного радикала. Об этом говорит эмпирическое правило Дюкло-Траубе: Поверхностная активность ПАВ на границе их водных растворов с газом увеличивается в 3 - 3, 5 раза при увеличении углеводородной цепи на одну группу -СН 2. Графически это правило продемонстрируем на примере гомологического ряда спиртов (рис. 3).

Рис. 3 Изотермы поверхностного натяжения: 1 — для изопропилового спирта C 3 H 7 OH; 2 — для бутилового спирта С 4 Н 90 Н; 3 — для гексилового спирта Ce. H 13 OH.

Из рис. 3 видно, что чем круче кривая, тем больше поверхностная активность: g (С 3 Н 7 ОН) < g (C 4 H 9 OH) < < g (C 6 H 13 OH). Если известна кривая σ = f(с), можно вычислить избыточную адсорбцию Г; для нескольких значений концентрации сi и построить изотерму адсорбции Г = f(c). Для этого необходимо провести касательные к точкам (сi, σi) на кривой σ(с), определить tgαi = -d I/dci и рассчитать Гi по уравнению Гиббса.
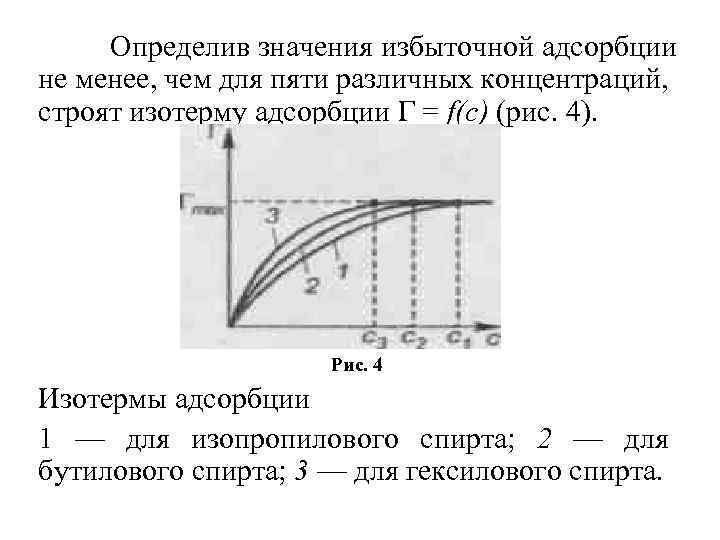
Определив значения избыточной адсорбции не менее, чем для пяти различных концентраций, строят изотерму адсорбции Г = f(c) (рис. 4). Рис. 4 Изотермы адсорбции 1 — для изопропилового спирта; 2 — для бутилового спирта; 3 — для гексилового спирта.

Из рис. 4 видно, что по мере увеличения концентрации адсорбция возрастает вначале резко, затем все медленнее, приближаясь к некоторой величине, называемой предельной адсорбцией Гmax. Из рис. 4 видно также, что Гmax (С 6 Н 13 ОН) = Гmax (С 4 Н 9 ОН) = Гmax (С 3 Н 7 ОН), но эти значения предельных адсорбций достигаются при разных концентрациях с (С 6 Н 13 ОН) < с (С 4 Н 9 ОН) < с (С 3 Н 7 ОН).

Рис. 5 Ориентация молекул ПАВ на поверхности раствор газ: а — в разбавленных растворах; б — в концентрированных растворах.

Предельная избыточная адсорбция ПАВ равна: Гmax= νsmax/S 1, 2 (2) где νsmax количество ПАВ в насыщенном поверхностном слое; S 1, 2, м 2 площадь межфазной поверхности. Так как поверхность полностью заполнена молекулами ПАВ, S 1, 2 = S 0 · νsmax · NA, (3) где S 0, м 2 — площадь поперечного сечения одной молекулы, NA = 6, 02 · 1023 молекул — постоянная Авогадро. или (4)

Зависимость величины адсорбции ПАВ от концентрации раствора Г = f(c) хорошо описывается уравнением Ленгмюра: (5) где Гmах, моль/м 2 — константа, значение которой соответствует максимальной адсорбции ПАВ поверхностным слоем; К, м 3/моль — константа, величина которой зависит от длины углеводородного радикала молекулы ПАВ; Г, моль/м 2 — равновесная избыточная адсорбция ПАВ из раствора с концентрацией с, моль/дм 3.

Константы Гmах и К в уравнении Ленгмюра определяют графически, приводя это уравнение к линейному виду. Для этого правую и левую части уравнения надо «перевернуть» : 1/Г = 1/Гmax + 1/Гmax. Кс (6) Умножим обе части уравнения на с: с/Г = с/Гmax + 1/Гmax К (7)
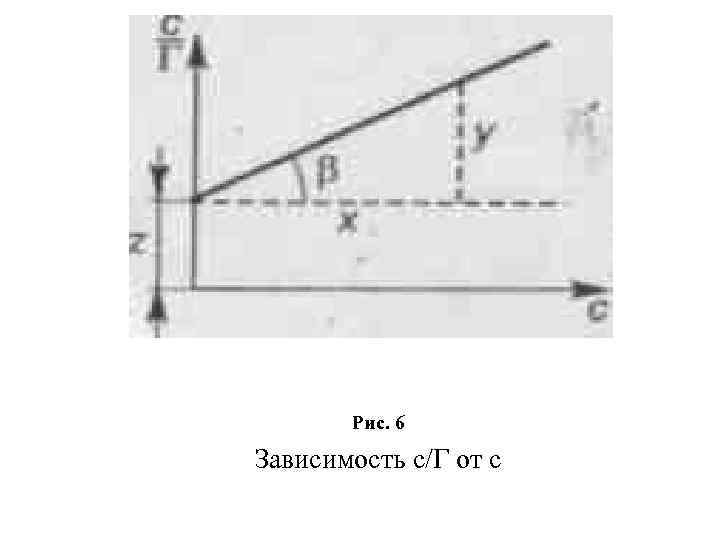
Рис. 6 Зависимость с/Г от с

рис. 6 показан график с/Г = f(c). Тангенс угла наклона β прямой к оси абсцисс tgβ = 1/Гmах = у/х; Гmах = х/у. Отрезок, отсекаемый прямой на оси ординат: z = 1/(Гmax · К); К = 1/(z · Гmax) = y/(xz) Решая совместно уравнения Гиббса и Ленгмюра, можно получить уравнение Шишковского, найденное эмпирически: σ = σ 0 В 1 п(1 + Кс), (8) где σ0 — поверхностное натяжение растворителя; σ — поверхностное натяжение раствора; В, Дж/м 2 — константа для данного гомологического ряда, не зависящая от длины углеводородного радикала.

3. АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО - ЖИДКИЙ РАСТВОР (9) где а — количество адсорбированного вещества одним грам мом адсорбента, моль/г; т — масса адсорбента, г; с0 — начальная концентрация раствора, моль/дм 3; cs — равновесная концентрация раствора после адсорбции, моль/дм 3; V — объём раствора адсорбтива, дм 3.

Уравнение Фрейндлиха: а = cs (10) где 1/п — эмпирические константы, зависящие от природы адсорбента и адсорбтива, значения которых находят экспериментально. Для того чтобы определить значения β и 1/п, уравнение Фрейндлиха логарифмируют, что приводит его к линейному виду: lga = lgβ + 1/n · lgcs, Тогда, построив график зависимости Iga = f(lgcs), получают прямую линию, которая отсекает на оси ординат отрезок, равный lgβ, а тангенс угла β равен 1/п (рис. 7)

Рис. 7 Зависимость Iga = f(lgcs)

Уравнение Ленгмюра: (11)

Правило Шилова: чем лучше растворитель растворяет вещество, тем хуже вещество адсорбируется из раствора. Правило уравнивания полярностей Рибиндера: процесс адсорбции протекает в сторону уравнивания полярности фаз и тем сильнее, чем больше первоначальная разность полярностей.

Лиотропные ряды или ряды Гофмейстера: Li+ < Na+ < К+ < Rb+ < Cs+; Mg 2+ < Ca 2+ < Sr 2+ < Ba 2+; CI < Br < NО 3 < I < NCS Адсорбционная способность возрастает К+ << Са 2+ << Al 3+ << Th 4+ Усиление адсорбции

Правило Панета-Фаянса: на кристаллической поверхности адсорбируются те ионы, которые способны достроить кристаллическую решетку и образуют труднорастворимые соединения с ионами, входящими в кристалл.

ХРОМАТОГРАФИЯ Хроматографией называется метод разделения, анализа и физико химического исследования веществ, основанный на распределении вещества между двумя фазами — неподвижной (сорбент) и подвижной (элюент). Газовая и жидкостная хроматография. Колоночная и плоскослойная хроматография. Фронтальная хроматография Элютивная хроматография.

Хроматограф. Основные узлы хроматографа: хроматографическая колонка (К), детектор (Д), а также устройство для ввода пробы. (рис. 8 а). Коэффициент распределения k хроматографируемых компонентов. (k. A < k. В < k. C). Полученная хроматограмма (рис. 8 б) отражает расположение хроматографических зон на слое сорбента.
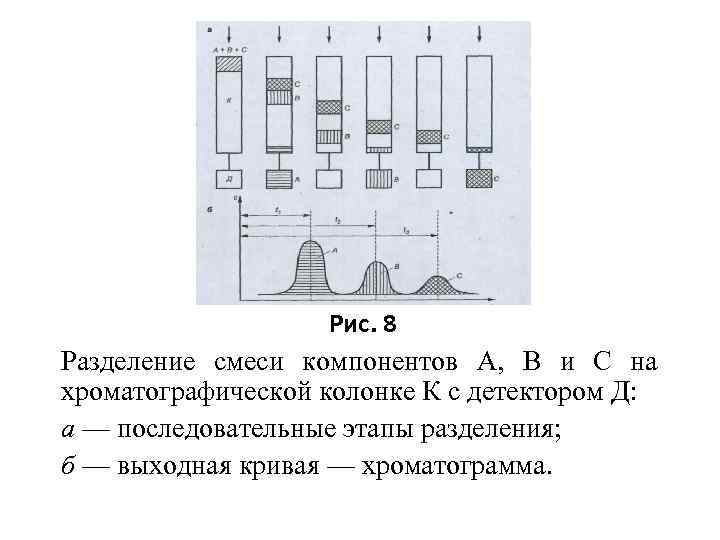
Рис. 8 Разделение смеси компонентов А, В и С на хроматографической колонке К с детектором Д: а — последовательные этапы разделения; б — выходная кривая — хроматограмма.

К плоскостной хроматографии относятся хроматография на бумаге и тонкослойная хроматография. 4. 1. Хроматография на бумаге. 4. 2. Хроматография в тонких слоях.

АДГЕЗИЯ И СМАЧИВАНИЕ Адгезив, Субстрат. Работа адгезии (Аад): Аад = G (12) Работа адгезии — это работа обратимого разрыва адгезионной связи, отнесенная к единице площади, Дж/м 2. Полная работа адгезии, приходящаяся на всю площадь S контакта тел, равна:
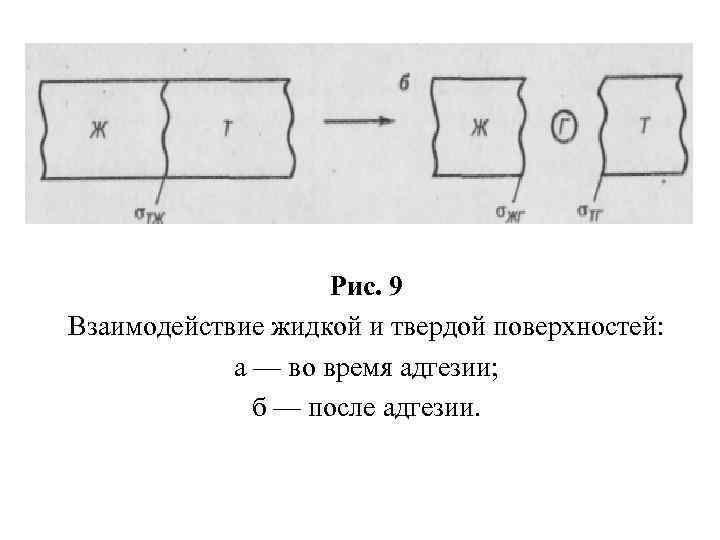
Рис. 9 Взаимодействие жидкой и твердой поверхностей: а — во время адгезии; б — после адгезии.

Уравнение Дюпре: Aад = σ тг + σжг σтж, (14) где σтг — поверхностное натяжение твёрдого тела на границе с газовой средой; σжг — поверхностное натяжение жидкости на границе с газовой средой; σтж — поверхностное натяжение на границе твёрдое тело жидкость. Значения σтг и σтж (поверхностные натяжения твердого тела) экспериментально определить не представляется возможным, а σжг измерить довольно просто. Краевой углом смачивания θ.
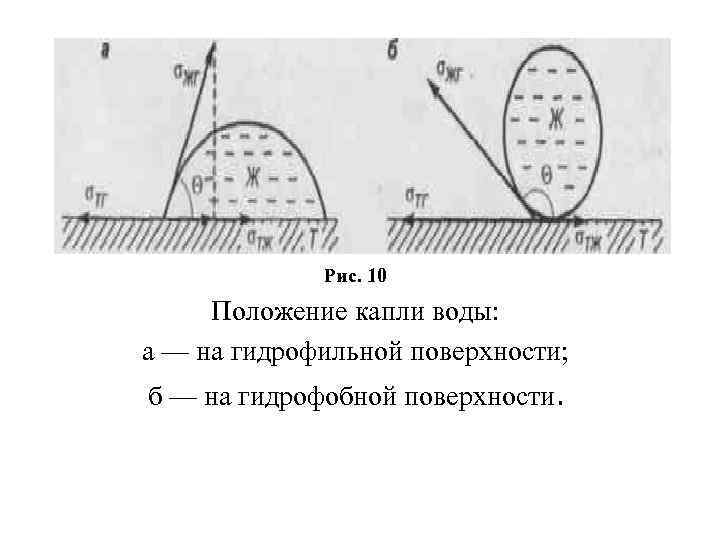
Рис. 10 Положение капли воды: а — на гидрофильной поверхности; б — на гидрофобной поверхности.

Если капля воды на твёрдой поверхности образует угол θ < 90°, такую поверхность называют гидрофильной, если θ > 90° — гидрофобной. Уравнение Юнга (15) Тогда: σжг · cosθ = σтг σтж, (16) σтг = σтж + σжг · cosθ. (17) Подставляя значение σтг в уравнение Дюпре, получим: Аaд = σжг (1 + cos ) (18) По значениям σжг и измеренному краевому углу рассчитывают работу адгезии.

ЛИОФИЛЬНЫЕ СИСТЕМЫ • Большинство дисперсных систем являются лиофобными. • Для них характерны: • • гетерогенность, наличие четко выраженной межфазной границы; • • высокая степень раздробленности дисперсной фазы; • • процесс диспергирования является несамопроизвольным, требует затраты энергии; • • наличие избытка свободной поверхностной энергии, что обусловливает стремление к коагуляции.

• Свойства лиофильных систем принципиально отличаются от свойств лиофобных систем: • • образование этих систем происходит самопроизвольно, часто с выделением энергии; • • имеет место сильное межмолекулярное взаимодействие между частицами дисперсной фазы и дисперсионной средой. Межфазовое поверхностное натяжение очень мало, а межфазовая граница размыта; • • системы являются термодинамически устойчивыми, что означает постоянство во времени концентрации и размеров частиц.

• К лиофильным системам относятся: • • коллоидные поверхностно – активные вещества (ПАВ); • • растворы высокомолекулярных соединений (ВМС).

1. КОЛЛОИДНЫЕ ПОВЕРХНОСТНО– АКТИВНЫЕ ВЕЩЕСТВА • ПАВ – это вещества, добавление которых в гетерогенную систему уменьшает поверхностное натяжение на границе раздела фаз. При этом во всем интервале концентраций вплоть до насыщенного раствора ПАВ находятся в молекулярно дисперсном состоянии, т. е. системы являются гомогенными.

• При удлинении углеводородной цепи до 8– 10 атомов углерода возникает новое свойство – способность молекул ПАВ объединяться в агрегаты, содержащие десятки молекул и называемые мицеллами. При малых концентрациях эти ПАВ образуют истинные растворы. При увеличении концентрации раствора до определенной величины, называемой критической концентрацией мицеллообразования (ККМ), в растворе наряду с молекулами ПАВ присутствуют мицеллы, т. е. появляется новая фаза. Такие системы характеризуются двумя свойствами: высокой дисперсностью и гетерогенностью, т. е. обладают свойствами коллоидных растворов.

• Коллоидные ПАВ – это вещества, которые не только снижают поверхностное натяжение на границе раздела фаз, но при определенных концентрациях способны к самопроизвольному мицеллообразованию, т. е, к образованию новой фазы. • Отличие коллоидных ПАВ от обычных заключается только в длине углеводородного радикала.

2. КЛАССИФИКАЦИЯ КОЛЛОИДНЫХ ПАВ • Коллоидные ПАВ: • неиногенные ПАВ, ионогенные ПАВ • Ионогенные ПАВ анионные ПАВ, катионные ПАВ, амфолитные ПАВ • Анионные ПАВ – ПАВ, которые диссоциируют в воде с образованием поверхностно–активного аниона.

• Анионные ПАВ составляют большую часть мирового производства всех ПАВ. К ним относятся: • а) карбоновые кислоты (RCOOH) и их соли (мыла) (RCOOM, где М – металл); например, • C 17 H 33 COONa – олеат натрия; C 17 H 35 COONa – стеарат натрия; C 15 H 3 ICOONa – пальмитат натрия; • б) алкилсульфаты ROSO 2 OM; • в) алкиларилсульфонаты RAr. SO 2 OM; • г) вещества, содержащие другие типы поверхностно активных анионов, например фосфаты, тиосульфаты.

• Катионные ПАВ – это ПАВ, которые в водном растворе диссоциируют с образованием поверхностно активного катиона, • К катионным ПАВ относятся: • а) соли первичных, вторичных и третичных алифатических и ароматических аминов; • б) соли алкилзамещенных аммониевых оснований: [(CH 3)2 NR R 2]+Cl ; • в) пиридиновые соединения.

• Амфолитные ПАВ – это ПАВ, содержащие две функциональные группы, одна из которых имеет кислотный характер, а другая основной. • В зависимости от среды такое соединение может диссоциировать и как кислота, и как основание. Например, аминокислоты; • +ОН - +Н+ • RNH(CH 2)n. COO - ↔ RNH(CH 2)n. COOH ↔ • Анионоактивные свойства • RNH 2(CH 2+)n. COOH • Катионоактивные свойства •

• Неионогенные ПАВ – ПАВ, которые, в растворах не распадаются на ионы, это соединения, полученные на основе окиси этилена СН 2 – СН 2 О • Путём присоединения её к спиртам, карбоновым кислотам, аминам и др. • Например, • RОH + n. СН 2 – СН 2 → RО(ОСН 2) n Н Полиоксиэтиленовая цепочка •

• В молекулах неионогенных ПАВ углеводородный радикал может содержать от 6 до 18 углеродных атомов, а n может изменяться от нескольких единиц до 100. • Неионогенные ПАВ являются смесью гомологов с различной длиной полиоксиэтиленовой цепи. Полиоксиэтиленовая цепь определяет гидрофильные свойства неионогенных ПАВ.

3. СВОЙСТВА ВОДНЫХ РАСТВОРОВ ПАВ • 1. Способность значительно снижать поверхностное натяжение на границе раздела фаз. • 2. Способность к самопроизвольному мицеллообразованию. • 3. Солюбилизация.

3. 1. Способность ПАВ снижать поверхностное натяжение на границе раздела фаз • Эта способность обусловлена высокой поверхностной • активностью ПАВ: g = , которая зависит, главным образом, от длины углеводородного радикала; с ее увеличением поверхностная активность возрастает. Как мы уже отмечали, правило Дюкло–Траубе гласит: увеличение длины углеводородного радикала на одну группу -СН 2 - приводит к возрастанию поверхностной активности в 3– 3, 5 раза.

для неионогенных ПАВ: g ; для ионогенных ПАВ: g ; где поверхностное натяжение воды; – поверхностное натяжение раствора ПАВ при критической концентрации мицеллообразования; • ККМ–критическая концентрация мицеллообразования ПАВ; • v–число ионов, образующихся при диссоциации одной молекулы ПАВ. • •

Адсорбция.pptx