лекция 15-2012 Потенциометрия-Полярография.ppt
- Количество слайдов: 44
 Потенциометрический анализ
Потенциометрический анализ
 Потенциометрический метод анализа Аналитическим сигналом в потенциометрии является электродный потенциал. Вальтер Нернст в 1889 г. - зависимость потенциала электрода от состава раствора (уравнение Нернста)
Потенциометрический метод анализа Аналитическим сигналом в потенциометрии является электродный потенциал. Вальтер Нернст в 1889 г. - зависимость потенциала электрода от состава раствора (уравнение Нернста)
 Если в растворе находится лишь окисленная форма вещества (восстановленную представляет металлический электрод): E = E 0' + k lg. C E 0' – формальный (реальный) электродный потенциал k = 0, 059/z ( при 25 °С )
Если в растворе находится лишь окисленная форма вещества (восстановленную представляет металлический электрод): E = E 0' + k lg. C E 0' – формальный (реальный) электродный потенциал k = 0, 059/z ( при 25 °С )
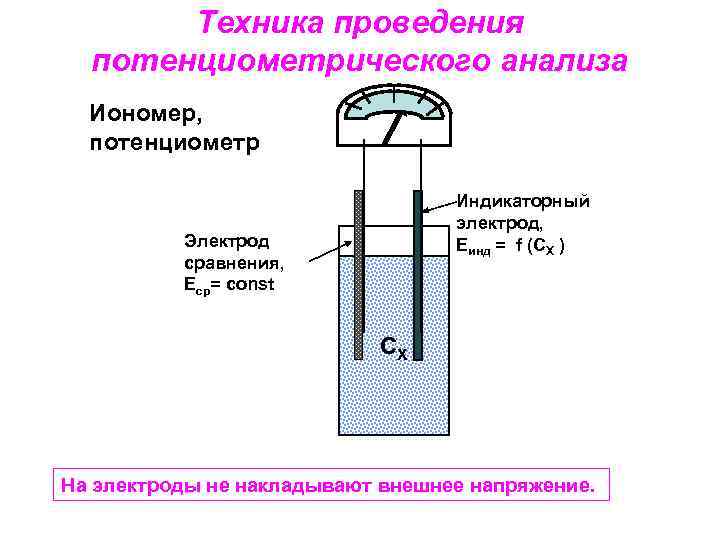 Техника проведения потенциометрического анализа Иономер, потенциометр Индикаторный электрод, Еинд = f (CX ) Электрод сравнения, Еср= const СХ На электроды не накладывают внешнее напряжение.
Техника проведения потенциометрического анализа Иономер, потенциометр Индикаторный электрод, Еинд = f (CX ) Электрод сравнения, Еср= const СХ На электроды не накладывают внешнее напряжение.
 Классификация электродов По назначению - электроды сравнения - индикаторные электроды По механизму возникновения электродного потенциала - металлические - мембранные Металлические электроды: - электроды 1 рода - электроды 2 рода - ред-окс (индифферентные) электроды
Классификация электродов По назначению - электроды сравнения - индикаторные электроды По механизму возникновения электродного потенциала - металлические - мембранные Металлические электроды: - электроды 1 рода - электроды 2 рода - ред-окс (индифферентные) электроды
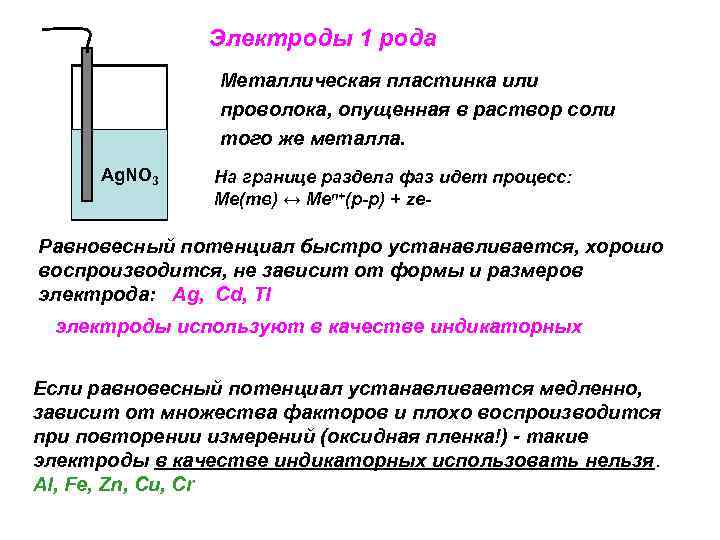 Электроды 1 рода Металлическая пластинка или проволока, опущенная в раствор соли того же металла. Ag. NO 3 На границе раздела фаз идет процесс: Ме(тв) ↔ Меn+(р-р) + ze- Равновесный потенциал быстро устанавливается, хорошо воспроизводится, не зависит от формы и размеров электрода: Ag, Cd, Tl электроды используют в качестве индикаторных Если равновесный потенциал устанавливается медленно, зависит от множества факторов и плохо воспроизводится при повторении измерений (оксидная пленка!) - такие электроды в качестве индикаторных использовать нельзя. Al, Fe, Zn, Cu, Cr
Электроды 1 рода Металлическая пластинка или проволока, опущенная в раствор соли того же металла. Ag. NO 3 На границе раздела фаз идет процесс: Ме(тв) ↔ Меn+(р-р) + ze- Равновесный потенциал быстро устанавливается, хорошо воспроизводится, не зависит от формы и размеров электрода: Ag, Cd, Tl электроды используют в качестве индикаторных Если равновесный потенциал устанавливается медленно, зависит от множества факторов и плохо воспроизводится при повторении измерений (оксидная пленка!) - такие электроды в качестве индикаторных использовать нельзя. Al, Fe, Zn, Cu, Cr
 Электроды 2 рода Металлическая проволока, покрытая малорастворимой солью металла и погруженная в раствор хорошо растворимой соли, содержащей тот же анион. Хлоридсеребряный электрод 1 - Ag-проволока, покрытая слоем Ag. Cl 2 - раствор KCl Ag | Ag. Cl | KCl На границе раздела фаз идет процесс: Ag. Cl(ТВ) + e– = Ag + Cl– а. Ag+ = ПРAg. Cl / а. Cl– ЕAg. Cl/Ag = E 0 Ag – 0, 059 p. ПР – 0, 059 lgа. Cl– Электроды 2 -го рода: каломельный, меркурсульфатный Их используют в качестве электродов сравнения.
Электроды 2 рода Металлическая проволока, покрытая малорастворимой солью металла и погруженная в раствор хорошо растворимой соли, содержащей тот же анион. Хлоридсеребряный электрод 1 - Ag-проволока, покрытая слоем Ag. Cl 2 - раствор KCl Ag | Ag. Cl | KCl На границе раздела фаз идет процесс: Ag. Cl(ТВ) + e– = Ag + Cl– а. Ag+ = ПРAg. Cl / а. Cl– ЕAg. Cl/Ag = E 0 Ag – 0, 059 p. ПР – 0, 059 lgа. Cl– Электроды 2 -го рода: каломельный, меркурсульфатный Их используют в качестве электродов сравнения.
 Редокс–электроды (индифферентные) электроды Изготавливают из Pt, Au, Ir и других малоактивных металлов. Потенциал такого электрода определяет соотношение концентраций окисленной и восстановленной форм некоторой редокс-системы, присутствующей в растворе. используют в качестве индикаторных Пример: Вычислить потенциал Рt-электрода, опущенного в раствор, где: С(Fe 2+) = 0, 05 M C (Fe 3+) = 0, 1 M
Редокс–электроды (индифферентные) электроды Изготавливают из Pt, Au, Ir и других малоактивных металлов. Потенциал такого электрода определяет соотношение концентраций окисленной и восстановленной форм некоторой редокс-системы, присутствующей в растворе. используют в качестве индикаторных Пример: Вычислить потенциал Рt-электрода, опущенного в раствор, где: С(Fe 2+) = 0, 05 M C (Fe 3+) = 0, 1 M
 Мембранные ионселективные электроды – электроды, чувствительные только к одному виду ионов Внутр Н+ Евнутр= Е/ + 0, 059 lg[Н+]внутр = const Евнешн= Е 0+ 0, 059 lg[Н+]внешн Еэл-да = Е внутр – Е внешн Внешн Н+ Н+ Стеклянный электрод 1 - серебряная проволока 2 - 0, 1 М р-р НСl 3 – стеклянная мембрана Е= Е 0/+ 0, 059 р. Н
Мембранные ионселективные электроды – электроды, чувствительные только к одному виду ионов Внутр Н+ Евнутр= Е/ + 0, 059 lg[Н+]внутр = const Евнешн= Е 0+ 0, 059 lg[Н+]внешн Еэл-да = Е внутр – Е внешн Внешн Н+ Н+ Стеклянный электрод 1 - серебряная проволока 2 - 0, 1 М р-р НСl 3 – стеклянная мембрана Е= Е 0/+ 0, 059 р. Н
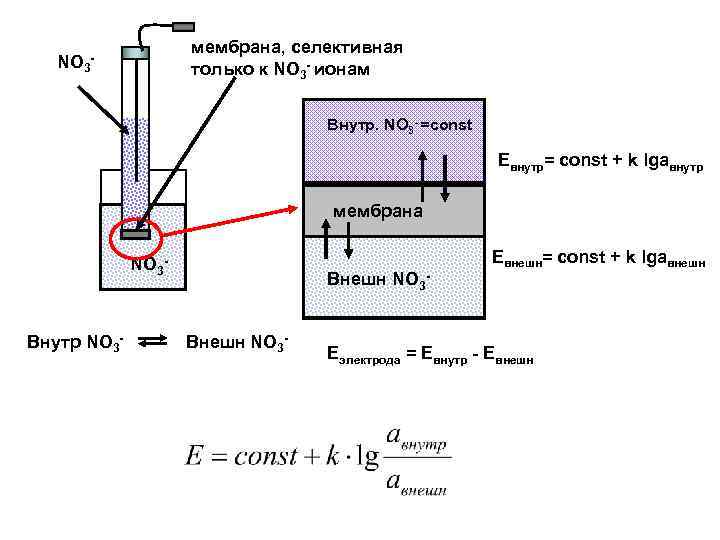 мембрана, селективная только к NO 3 - ионам NO 3 - Внутр. NO 3 - =const Евнутр= const + k lgaвнутр мембрана NO 3 - Внутр NO 3 - Внешн NO 3 - Евнешн= const + k lgaвнешн Еэлектрода = Евнутр - Евнешн
мембрана, селективная только к NO 3 - ионам NO 3 - Внутр. NO 3 - =const Евнутр= const + k lgaвнутр мембрана NO 3 - Внутр NO 3 - Внешн NO 3 - Евнешн= const + k lgaвнешн Еэлектрода = Евнутр - Евнешн
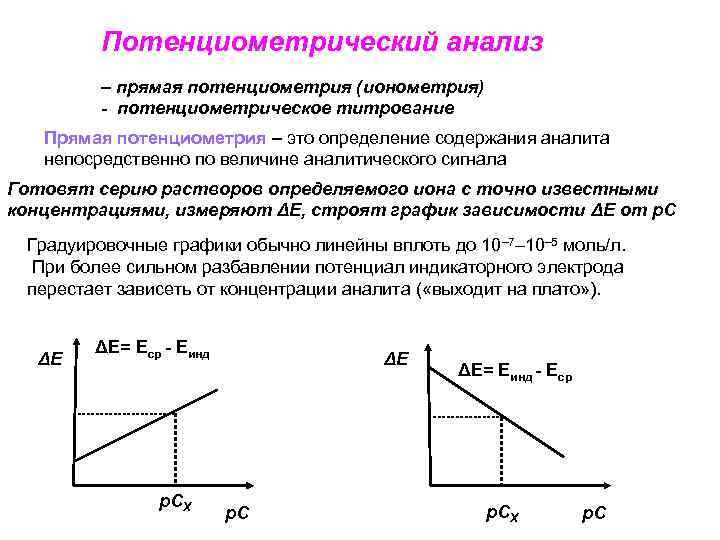 Потенциометрический анализ – прямая потенциометрия (ионометрия) - потенциометрическое титрование Прямая потенциометрия – это определение содержания аналита непосредственно по величине аналитического сигнала Готовят серию растворов определяемого иона с точно известными концентрациями, измеряют ΔЕ, строят график зависимости ΔЕ от р. С Градуировочные графики обычно линейны вплоть до 10– 7– 10– 5 моль/л. При более сильном разбавлении потенциал индикаторного электрода перестает зависеть от концентрации аналита ( «выходит на плато» ). ΔЕ ΔЕ= Еср - Еинд р. СХ ΔЕ р. С ΔЕ= Еинд - Еср р. СХ р. С
Потенциометрический анализ – прямая потенциометрия (ионометрия) - потенциометрическое титрование Прямая потенциометрия – это определение содержания аналита непосредственно по величине аналитического сигнала Готовят серию растворов определяемого иона с точно известными концентрациями, измеряют ΔЕ, строят график зависимости ΔЕ от р. С Градуировочные графики обычно линейны вплоть до 10– 7– 10– 5 моль/л. При более сильном разбавлении потенциал индикаторного электрода перестает зависеть от концентрации аналита ( «выходит на плато» ). ΔЕ ΔЕ= Еср - Еинд р. СХ ΔЕ р. С ΔЕ= Еинд - Еср р. СХ р. С
 Достоинства: - селективный - экспрессный - не деструктивный - легко автоматизируемый -не требует дорогой и сложной аппаратуры Недостатки - сравнительно невысокая точность (20 -25%отн. ) - необходимость иметь большой набор ион-селективных электродов Применяют -при исследовании состава природных и сточных вод, почв, технологических растворов; -в анализе пищевых продуктов, биологических жидкостей и т. п. - для определения растворенного в воде кислорода, -фторидов и цианидов в сточных водах, -нитратов в почвах и пищевых продуктах, -Для определения некоторых органических веществ. Особое значение – измерение р. Н природная вода, технические растворы, биологические жидкости, продукты питания, косметические средства, Фармпрепаракты и т. д. и. т. п.
Достоинства: - селективный - экспрессный - не деструктивный - легко автоматизируемый -не требует дорогой и сложной аппаратуры Недостатки - сравнительно невысокая точность (20 -25%отн. ) - необходимость иметь большой набор ион-селективных электродов Применяют -при исследовании состава природных и сточных вод, почв, технологических растворов; -в анализе пищевых продуктов, биологических жидкостей и т. п. - для определения растворенного в воде кислорода, -фторидов и цианидов в сточных водах, -нитратов в почвах и пищевых продуктах, -Для определения некоторых органических веществ. Особое значение – измерение р. Н природная вода, технические растворы, биологические жидкости, продукты питания, косметические средства, Фармпрепаракты и т. д. и. т. п.
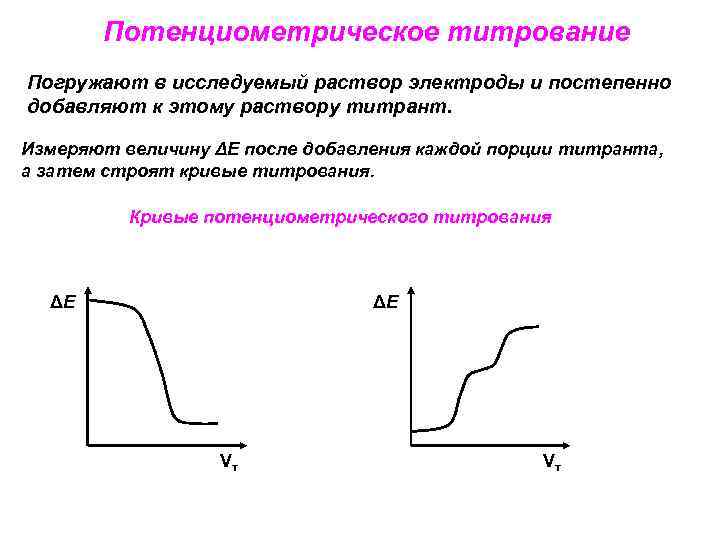 Потенциометрическое титрование Погружают в исследуемый раствор электроды и постепенно добавляют к этому раствору титрант. Измеряют величину ΔЕ после добавления каждой порции титранта, а затем строят кривые титрования. Кривые потенциометрического титрования ΔЕ ΔЕ Vт Vт
Потенциометрическое титрование Погружают в исследуемый раствор электроды и постепенно добавляют к этому раствору титрант. Измеряют величину ΔЕ после добавления каждой порции титранта, а затем строят кривые титрования. Кривые потенциометрического титрования ΔЕ ΔЕ Vт Vт
 Нахождение точки эквивалентности По дифференциальной кривой титрования ( 1 производная) Метод трех касательных ΔЕ ΔЕ/ΔV Т. э. Vт ΔV/ΔЕ Т. э. Метод Грана Т. э. Vт Vт
Нахождение точки эквивалентности По дифференциальной кривой титрования ( 1 производная) Метод трех касательных ΔЕ ΔЕ/ΔV Т. э. Vт ΔV/ΔЕ Т. э. Метод Грана Т. э. Vт Vт
 Достоинства потенциометрического титрования По сравнению с классическим титрованием можно: -анализировать разбавленные растворы, вплоть до 10 -6 М -анализировать смеси сложного состава -титровать мутные и окрашенные растворы -автоматизировать процесс -нет индикаторной ошибки По сравнению с прямой потенциометрией: - не требуется высокая точность измерения потенциалов - можно использовать упрощенные приборы - более высокая точность ( до 0, 1 % отн. ) -более широкий круг определяемых веществ
Достоинства потенциометрического титрования По сравнению с классическим титрованием можно: -анализировать разбавленные растворы, вплоть до 10 -6 М -анализировать смеси сложного состава -титровать мутные и окрашенные растворы -автоматизировать процесс -нет индикаторной ошибки По сравнению с прямой потенциометрией: - не требуется высокая точность измерения потенциалов - можно использовать упрощенные приборы - более высокая точность ( до 0, 1 % отн. ) -более широкий круг определяемых веществ
 Выбор индикаторного электрода Его потенциал должен быть линейно связан с lg C титруемого вещества или титранта. Для кислотно-основного титрования - стеклянный электрод, в аргентометрии – серебряный, в редоксметрических методах – индифферентные электроды (Рt), в комплексонометрии – ионселективные электроды. Электрод сравнения - электрод 2 -го рода – хлорсеребряный или каломельный. Применяют потенциометрическое титрование: -при определении серы и ее соединений в нефтепродуктах -в анализе горных пород, - технологических растворов, -объектов окружающей среды, -лекарственных препаратов -биообъектов
Выбор индикаторного электрода Его потенциал должен быть линейно связан с lg C титруемого вещества или титранта. Для кислотно-основного титрования - стеклянный электрод, в аргентометрии – серебряный, в редоксметрических методах – индифферентные электроды (Рt), в комплексонометрии – ионселективные электроды. Электрод сравнения - электрод 2 -го рода – хлорсеребряный или каломельный. Применяют потенциометрическое титрование: -при определении серы и ее соединений в нефтепродуктах -в анализе горных пород, - технологических растворов, -объектов окружающей среды, -лекарственных препаратов -биообъектов
 Вольтамперометрические методы анализа
Вольтамперометрические методы анализа
 Электрохимические методы, использующие зависимость силы тока, протекающего через раствор, от величины приложенного к электродам напряжения, называют вольтамперометрическими. Полярография - метод, в котором рабочим является ртутный капающий электрод (РКЭ). Полярография была создана в 1922 г. чешским ученым Ярославом Гейровским Я. Гейровский в 1959 г. был удостоен Нобелевской премии.
Электрохимические методы, использующие зависимость силы тока, протекающего через раствор, от величины приложенного к электродам напряжения, называют вольтамперометрическими. Полярография - метод, в котором рабочим является ртутный капающий электрод (РКЭ). Полярография была создана в 1922 г. чешским ученым Ярославом Гейровским Я. Гейровский в 1959 г. был удостоен Нобелевской премии.
 Классическая полярография. Аппаратура и принцип метода Г - + 1 ΔЕ R + Внешний источник напряжения 1 - РКЭ (катод) 2 - донная ртуть (анод) 2 Поляризация электродов при наложении ΔЕ: Поляризация анода – не происходит ( из-за большой поверхности плотность тока практически не меняется), Еа = const Поляризация катода – происходит ( из-за малой поверхности плотность тока меняется очень сильно) Потенциал катода можно определить по величине ΔЕ = Ea -Eк Деполяризатор – частица, способная восстанавливаться на катоде
Классическая полярография. Аппаратура и принцип метода Г - + 1 ΔЕ R + Внешний источник напряжения 1 - РКЭ (катод) 2 - донная ртуть (анод) 2 Поляризация электродов при наложении ΔЕ: Поляризация анода – не происходит ( из-за большой поверхности плотность тока практически не меняется), Еа = const Поляризация катода – происходит ( из-за малой поверхности плотность тока меняется очень сильно) Потенциал катода можно определить по величине ΔЕ = Ea -Eк Деполяризатор – частица, способная восстанавливаться на катоде
 М+n - деполяризатор Вольтамперная кривая (полярографическая волна) - I Е М+n М+n М+n+n М + М+n М+n М+n С М+n D М+n М+n В А М+n АВ – остаточный ток ВС – ток восстановление деполяризатора СD – предельный диффузионный ток Е
М+n - деполяризатор Вольтамперная кривая (полярографическая волна) - I Е М+n М+n М+n+n М + М+n М+n М+n С М+n D М+n М+n В А М+n АВ – остаточный ток ВС – ток восстановление деполяризатора СD – предельный диффузионный ток Е
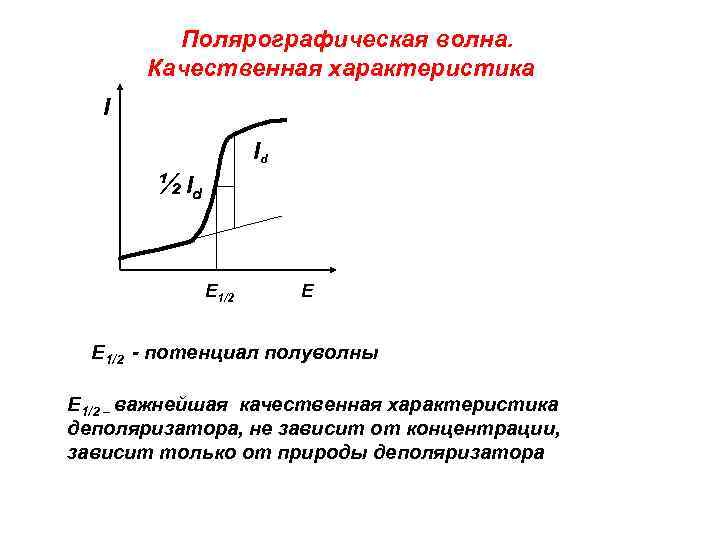 Полярографическая волна. Качественная характеристика I Id ½ I d Е 1/2 Е E 1/2 - потенциал полуволны E 1/2 – важнейшая качественная характеристика деполяризатора, не зависит от концентрации, зависит только от природы деполяризатора
Полярографическая волна. Качественная характеристика I Id ½ I d Е 1/2 Е E 1/2 - потенциал полуволны E 1/2 – важнейшая качественная характеристика деполяризатора, не зависит от концентрации, зависит только от природы деполяризатора
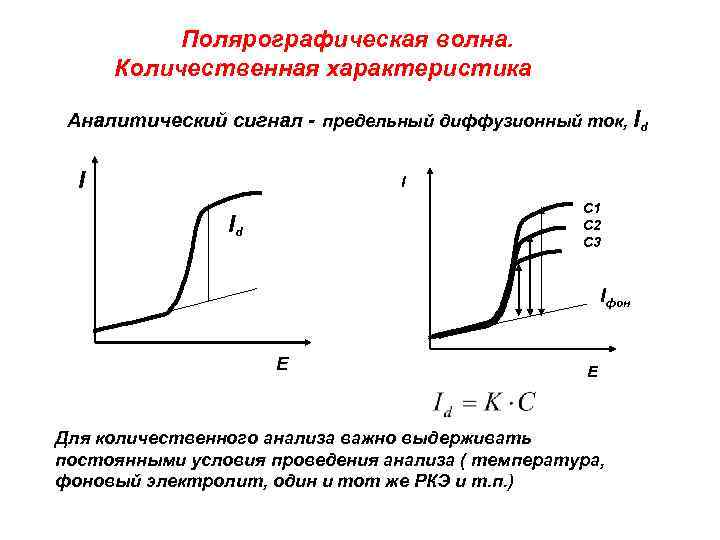 Полярографическая волна. Количественная характеристика Аналитический сигнал - предельный диффузионный ток, Id I I С 1 С 2 С 3 Id Iфон Е Е Для количественного анализа важно выдерживать постоянными условия проведения анализа ( температура, фоновый электролит, один и тот же РКЭ и т. п. )
Полярографическая волна. Количественная характеристика Аналитический сигнал - предельный диффузионный ток, Id I I С 1 С 2 С 3 Id Iфон Е Е Для количественного анализа важно выдерживать постоянными условия проведения анализа ( температура, фоновый электролит, один и тот же РКЭ и т. п. )
 Характеристика полярографического метода анализа Достоинства - Несложная аппаратура -Очень хорошая воспроизводимость, Sr порядка 0, 01 -0, 02 -Селективность, можно одновременно определять несколько металлов, до 10 -5 М Недостатки -Токсичность ртути -РКЭ можно использовать в области потенциалов +0, 3 В до -2, 0 В Выше +0, 3 В – идет анодное растворение ртути Ниже -2, 0 В – выделение Н 2 -Не до конца устраняемое влияние О 2 может мешать определению малых концентраций
Характеристика полярографического метода анализа Достоинства - Несложная аппаратура -Очень хорошая воспроизводимость, Sr порядка 0, 01 -0, 02 -Селективность, можно одновременно определять несколько металлов, до 10 -5 М Недостатки -Токсичность ртути -РКЭ можно использовать в области потенциалов +0, 3 В до -2, 0 В Выше +0, 3 В – идет анодное растворение ртути Ниже -2, 0 В – выделение Н 2 -Не до конца устраняемое влияние О 2 может мешать определению малых концентраций
 Электроды Твердые микроэлектроды из платины, золота, графита – работают в области Е>+0, 3 В Обновление поверхности твердых электродов: Механическая или химическая чистка Вибрационные, вращающиеся платиновые электроды Электроды сравнения – хлорсеребряный, каломельный
Электроды Твердые микроэлектроды из платины, золота, графита – работают в области Е>+0, 3 В Обновление поверхности твердых электродов: Механическая или химическая чистка Вибрационные, вращающиеся платиновые электроды Электроды сравнения – хлорсеребряный, каломельный
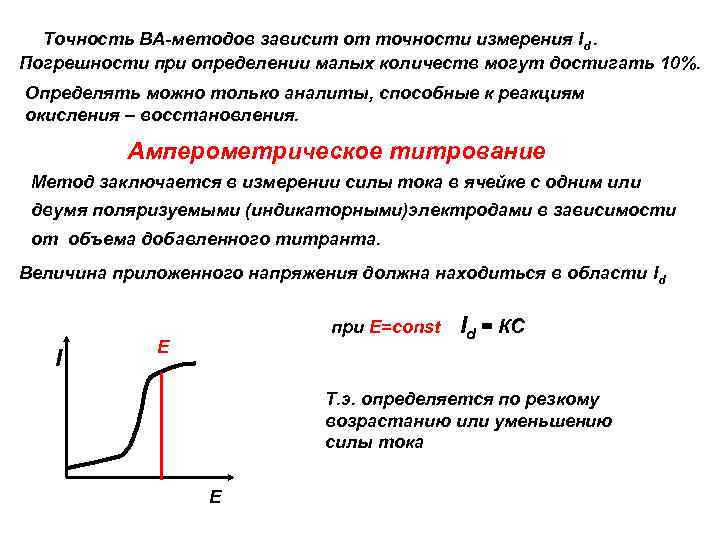 Точность ВА-методов зависит от точности измерения Id. Погрешности при определении малых количеств могут достигать 10%. Определять можно только аналиты, способные к реакциям окисления – восстановления. Амперометрическое титрование Метод заключается в измерении силы тока в ячейке с одним или двумя поляризуемыми (индикаторными)электродами в зависимости от объема добавленного титранта. Величина приложенного напряжения должна находиться в области Id при Е=const I Е Id = КС Т. э. определяется по резкому возрастанию или уменьшению силы тока Е
Точность ВА-методов зависит от точности измерения Id. Погрешности при определении малых количеств могут достигать 10%. Определять можно только аналиты, способные к реакциям окисления – восстановления. Амперометрическое титрование Метод заключается в измерении силы тока в ячейке с одним или двумя поляризуемыми (индикаторными)электродами в зависимости от объема добавленного титранта. Величина приложенного напряжения должна находиться в области Id при Е=const I Е Id = КС Т. э. определяется по резкому возрастанию или уменьшению силы тока Е
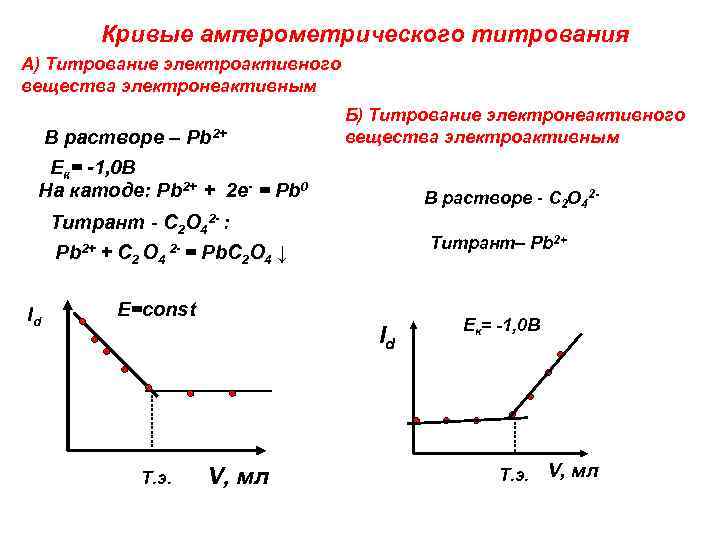 Кривые амперометрического титрования А) Титрование электроактивного вещества электронеактивным Б) Титрование электронеактивного вещества электроактивным В растворе – Pb 2+ Eк= -1, 0 B На катоде: Pb 2+ + 2 е- = Pb 0 В растворе - C 2 O 42 - Титрант - C 2 O 42 - : Pb 2+ + C Id 2 O 4 2 - = Pb. C 2 O 4 Титрант– Pb 2+ ↓ Е=const Id Т. э. V, мл Eк= -1, 0 B Т. э. V, мл
Кривые амперометрического титрования А) Титрование электроактивного вещества электронеактивным Б) Титрование электронеактивного вещества электроактивным В растворе – Pb 2+ Eк= -1, 0 B На катоде: Pb 2+ + 2 е- = Pb 0 В растворе - C 2 O 42 - Титрант - C 2 O 42 - : Pb 2+ + C Id 2 O 4 2 - = Pb. C 2 O 4 Титрант– Pb 2+ ↓ Е=const Id Т. э. V, мл Eк= -1, 0 B Т. э. V, мл
 В) Титрование электроактивного вещества электроактивным В растворе – Pb 2+ Титрант - Cr. O 42 - Eк= -1, 0 B Г) Электроактивным является продукт реакции титрования Fe+3 + e- = Fe+2 На катоде: Pb 2+ + 2 е- = Pb 0 Eк= 0, 06 B Cr. O 4 2 - + 6 е- + 14 H+= Cr 3+ + 7 H 2 O В ходе титрования: Pb 2+ + Cr. O 4 2 - = Pb. Cr. O 4 Id Id Т. э. V, мл Т. э. V, мл
В) Титрование электроактивного вещества электроактивным В растворе – Pb 2+ Титрант - Cr. O 42 - Eк= -1, 0 B Г) Электроактивным является продукт реакции титрования Fe+3 + e- = Fe+2 На катоде: Pb 2+ + 2 е- = Pb 0 Eк= 0, 06 B Cr. O 4 2 - + 6 е- + 14 H+= Cr 3+ + 7 H 2 O В ходе титрования: Pb 2+ + Cr. O 4 2 - = Pb. Cr. O 4 Id Id Т. э. V, мл Т. э. V, мл
 Достоинства амперометрического титрования 1. Применим для многих реакций: о-в, осаждения, комплексообразования. 2. Можно определять электронеактивные вещества. 3. Аппаратура – проще, чем в полярографии. 4. Точность – выше ( как в титриметрии, до 3% отн. ). Результат не зависит от характеристики электрода. 5. Титровать можно в мутных, окрашенных растворах. 6. Чувствительность – до 10 -6 М.
Достоинства амперометрического титрования 1. Применим для многих реакций: о-в, осаждения, комплексообразования. 2. Можно определять электронеактивные вещества. 3. Аппаратура – проще, чем в полярографии. 4. Точность – выше ( как в титриметрии, до 3% отн. ). Результат не зависит от характеристики электрода. 5. Титровать можно в мутных, окрашенных растворах. 6. Чувствительность – до 10 -6 М.
 Кулонометрия В кулонометрии измеряют точно количество электричества, израсходованное на электрохимическую реакцию. Прямая кулонометрия - анализируемое вещество окисляется (восстанавливается) на электродах -в прямой кулонометрии на электродах возможно протекание любой электрохимической реакции, не обязательно с образованием осадка. -можно определять содержание микрокомпонентов Кулонометрическое титрование – анализируемое вещество реагирует с титрантом, который образуется в ходе протекания электрохимической реакции на электроде.
Кулонометрия В кулонометрии измеряют точно количество электричества, израсходованное на электрохимическую реакцию. Прямая кулонометрия - анализируемое вещество окисляется (восстанавливается) на электродах -в прямой кулонометрии на электродах возможно протекание любой электрохимической реакции, не обязательно с образованием осадка. -можно определять содержание микрокомпонентов Кулонометрическое титрование – анализируемое вещество реагирует с титрантом, который образуется в ходе протекания электрохимической реакции на электроде.
 Законы электролиза. Майкл Фарадей 1834 г. 1 закон. Масса продукта электролиза прямо пропорциональна количеству электричества, прошедшего через электролизер: m –масса выделившегося вещества (г) Q – количество электричества (кул) Э – электрохимический эквивалент вещества, Э = М/(кол-во е-) F- постоянная Фарадея, 96500 кул 2 закон. При пропускании одинакового количества электричества массы продуктов электролиза прямо пропорциональны химическим эквивалентам этих продуктов При Q =const:
Законы электролиза. Майкл Фарадей 1834 г. 1 закон. Масса продукта электролиза прямо пропорциональна количеству электричества, прошедшего через электролизер: m –масса выделившегося вещества (г) Q – количество электричества (кул) Э – электрохимический эквивалент вещества, Э = М/(кол-во е-) F- постоянная Фарадея, 96500 кул 2 закон. При пропускании одинакового количества электричества массы продуктов электролиза прямо пропорциональны химическим эквивалентам этих продуктов При Q =const:
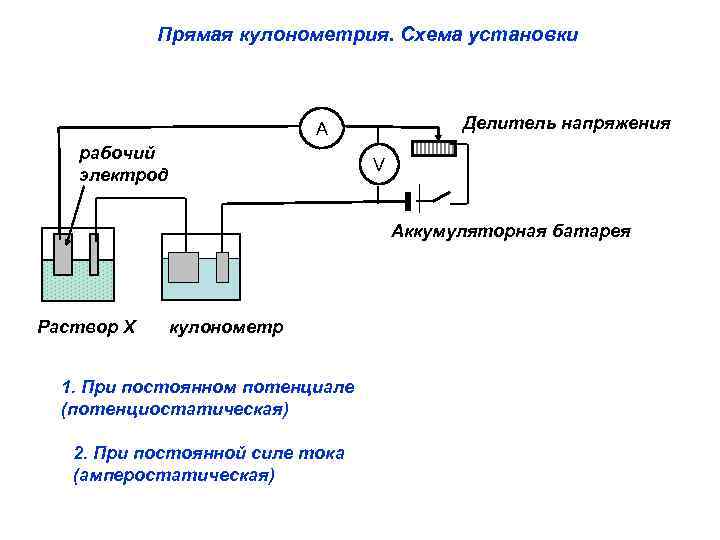 Прямая кулонометрия. Схема установки Делитель напряжения A рабочий электрод V Аккумуляторная батарея Раствор Х кулонометр 1. При постоянном потенциале (потенциостатическая) 2. При постоянной силе тока (амперостатическая)
Прямая кулонометрия. Схема установки Делитель напряжения A рабочий электрод V Аккумуляторная батарея Раствор Х кулонометр 1. При постоянном потенциале (потенциостатическая) 2. При постоянной силе тока (амперостатическая)
 1. Кулонометрия при постоянном потенциале (потенциостатическая) 1. Устанавливают потенциал рабочего электрода 2. В ячейку помещают анализируемый раствор Х 3. Последовательно присоединяют кулонометр 4. Замыкают цепь, и следят за изменением силы тока 5. По мере протекания электрохимической I реакции сила тока будет уменьшаться : 6. Процесс прекращают, когда I достигнет некоторого заранее определенного значения, например, 0, 001 Iнач t, мин 7. Вычисляют Q 8. Вычисляют m. Х
1. Кулонометрия при постоянном потенциале (потенциостатическая) 1. Устанавливают потенциал рабочего электрода 2. В ячейку помещают анализируемый раствор Х 3. Последовательно присоединяют кулонометр 4. Замыкают цепь, и следят за изменением силы тока 5. По мере протекания электрохимической I реакции сила тока будет уменьшаться : 6. Процесс прекращают, когда I достигнет некоторого заранее определенного значения, например, 0, 001 Iнач t, мин 7. Вычисляют Q 8. Вычисляют m. Х
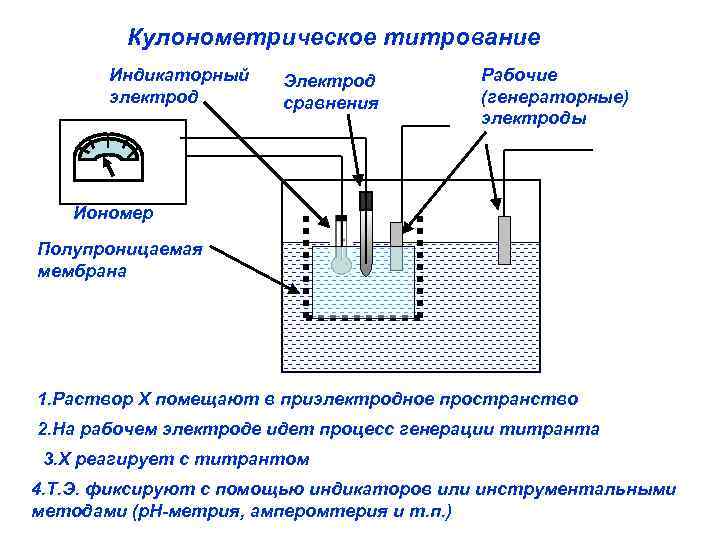 Кулонометрическое титрование Индикаторный электрод Электрод сравнения Рабочие (генераторные) электроды Иономер Полупроницаемая мембрана 1. Раствор Х помещают в приэлектродное пространство 2. На рабочем электроде идет процесс генерации титранта 3. Х реагирует с титрантом 4. Т. Э. фиксируют с помощью индикаторов или инструментальными методами (р. Н-метрия, амперомтерия и т. п. )
Кулонометрическое титрование Индикаторный электрод Электрод сравнения Рабочие (генераторные) электроды Иономер Полупроницаемая мембрана 1. Раствор Х помещают в приэлектродное пространство 2. На рабочем электроде идет процесс генерации титранта 3. Х реагирует с титрантом 4. Т. Э. фиксируют с помощью индикаторов или инструментальными методами (р. Н-метрия, амперомтерия и т. п. )
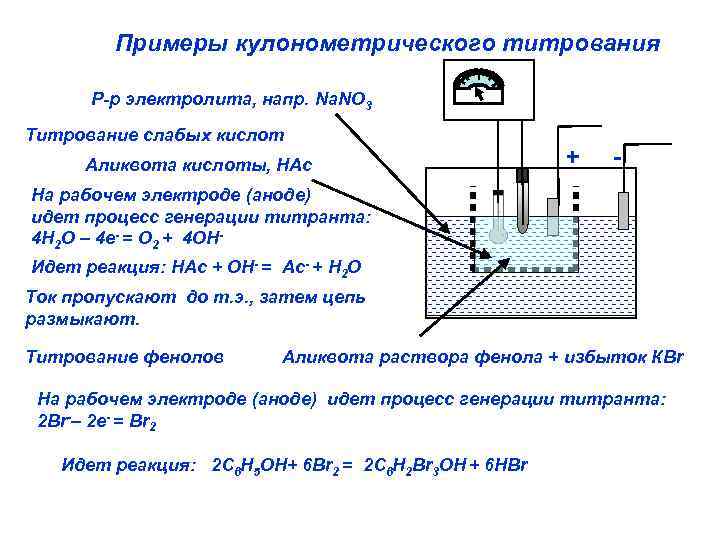 Примеры кулонометрического титрования Р-р электролита, напр. Na. NO 3 Титрование слабых кислот Аликвота кислоты, НАс + - На рабочем электроде (аноде) идет процесс генерации титранта: 4 Н 2 О – 4 е- = О 2 + 4 ОНИдет реакция: НАс + ОН- = Ас- + Н 2 О Ток пропускают до т. э. , затем цепь размыкают. Титрование фенолов Аликвота раствора фенола + избыток КBr На рабочем электроде (аноде) идет процесс генерации титранта: 2 Br-– 2 е- = Br 2 Идет реакция: 2 C 6 H 5 OH+ 6 Br 2 = 2 C 6 H 2 Br 3 OH + 6 НBr
Примеры кулонометрического титрования Р-р электролита, напр. Na. NO 3 Титрование слабых кислот Аликвота кислоты, НАс + - На рабочем электроде (аноде) идет процесс генерации титранта: 4 Н 2 О – 4 е- = О 2 + 4 ОНИдет реакция: НАс + ОН- = Ас- + Н 2 О Ток пропускают до т. э. , затем цепь размыкают. Титрование фенолов Аликвота раствора фенола + избыток КBr На рабочем электроде (аноде) идет процесс генерации титранта: 2 Br-– 2 е- = Br 2 Идет реакция: 2 C 6 H 5 OH+ 6 Br 2 = 2 C 6 H 2 Br 3 OH + 6 НBr
 Титранты получают: 1. из растворителя. 2. из специально введенных реагентов. 3. из материала электрода. Например, V (V)из ванадия Применяют : – внутреннюю генерацию титранта - внешнюю генерацию, когда титрант генерируют в отдельном устройстве, затем вводят в ячейку
Титранты получают: 1. из растворителя. 2. из специально введенных реагентов. 3. из материала электрода. Например, V (V)из ванадия Применяют : – внутреннюю генерацию титранта - внешнюю генерацию, когда титрант генерируют в отдельном устройстве, затем вводят в ячейку
 Кулонометрическое титрование ведут при I = const Меняя силу тока, можно регулировать процесс образования титранта. Точно измерив силу тока и время до достижения т. э. , вычисляют Q, затем - количество титранта, затем – количество Х Достоинства кулонометрического титрования 1. Нет необходимости в приготовлении и стандартизации растворов титранта. Это позволяет использовать малоустойчивые соединения. 2. Определять можно электронеактивные вещества. 3. Высокая чувствительность.
Кулонометрическое титрование ведут при I = const Меняя силу тока, можно регулировать процесс образования титранта. Точно измерив силу тока и время до достижения т. э. , вычисляют Q, затем - количество титранта, затем – количество Х Достоинства кулонометрического титрования 1. Нет необходимости в приготовлении и стандартизации растворов титранта. Это позволяет использовать малоустойчивые соединения. 2. Определять можно электронеактивные вещества. 3. Высокая чувствительность.
 Кондуктометрические методы анализа основаны на измерении электропроводности растворов. Электропроводность (W) – способность растворов веществ проводить ток под действием внешнего напряжения. W = 1/R Единица измерения - Oм-1, или сименс, См R – сопротивление раствора l – расстояние между электродами, см S – площадь поверхности электрода, см 2 ρ – удельное сопротивление –сопротивление 1 см 3 раствора (при l=1 см, S=1 см 2) Удельная электропроводность: = 1/ρ
Кондуктометрические методы анализа основаны на измерении электропроводности растворов. Электропроводность (W) – способность растворов веществ проводить ток под действием внешнего напряжения. W = 1/R Единица измерения - Oм-1, или сименс, См R – сопротивление раствора l – расстояние между электродами, см S – площадь поверхности электрода, см 2 ρ – удельное сопротивление –сопротивление 1 см 3 раствора (при l=1 см, S=1 см 2) Удельная электропроводность: = 1/ρ
 Электропроводность разбавленных растворов электролитов зависит: 1. от концентрации электролита; 2. от заряда иона; 3. от скорости движения ионов к электродам под действием тока (природы ионов) 4. от температуры раствора 5. от расстояния между электродами и площади электродов 1 2 HCl В анализе используют 1 -ую область, т. е. область разбавленных и умеренно концентрированных р-ров HAc с
Электропроводность разбавленных растворов электролитов зависит: 1. от концентрации электролита; 2. от заряда иона; 3. от скорости движения ионов к электродам под действием тока (природы ионов) 4. от температуры раствора 5. от расстояния между электродами и площади электродов 1 2 HCl В анализе используют 1 -ую область, т. е. область разбавленных и умеренно концентрированных р-ров HAc с
 ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТЬ – проводимость раствора, содержащего 1 моль-экв вещества и находящегося между электродами, расстояние между которыми 1 см. Связь удельной и эквивалентной электропроводности: = 1000 / С С – концентрация, моль-экв/л -предельная эквивалентная электропроводность электролита при бесконечном разбавлении, подвижность В справочниках приведены подвижности катионов и анионов:
ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТЬ – проводимость раствора, содержащего 1 моль-экв вещества и находящегося между электродами, расстояние между которыми 1 см. Связь удельной и эквивалентной электропроводности: = 1000 / С С – концентрация, моль-экв/л -предельная эквивалентная электропроводность электролита при бесконечном разбавлении, подвижность В справочниках приведены подвижности катионов и анионов:
 Аппаратура для проведения кондуктометрического анализа Мостик Уитстона Магазин сопротивлений RМ Измерительная ячейка RХ ~ Источник переменного тока
Аппаратура для проведения кондуктометрического анализа Мостик Уитстона Магазин сопротивлений RМ Измерительная ячейка RХ ~ Источник переменного тока
 Классификация кондуктометрических методов 1. Прямая кондуктометрия 2. Кондуктометрическое титрование 1. Прямая кондуктометрия В области разбавленных и умеренно концентрированных растворов электропроводность растет с ростом концентрации. Для нахождения концентраций предварительно строят градуировочные графики зависимости электропроводности от концентрации. Метод неселективен, поэтому находят общую концентрацию всех электролитов. Кондуктометрические датчики. Используют для оценки качества воды.
Классификация кондуктометрических методов 1. Прямая кондуктометрия 2. Кондуктометрическое титрование 1. Прямая кондуктометрия В области разбавленных и умеренно концентрированных растворов электропроводность растет с ростом концентрации. Для нахождения концентраций предварительно строят градуировочные графики зависимости электропроводности от концентрации. Метод неселективен, поэтому находят общую концентрацию всех электролитов. Кондуктометрические датчики. Используют для оценки качества воды.
 2. Кондуктометрическое титрование Ведут титрование и следят за изменением электропроводности титруемого раствора. Строят зависимости в координатах: - Vтитранта Построение кривых кондуктометрического титрования H+ + Cl- + Na+ + OH- = Na+ + Cl- + H 2 O HAc + Na+ + OH- = Na+ + Ac- + H 2 O OH- OHH+ Ac. Na+ Cl. Т. э. Vтитранта H+ Т. э. Vтитранта
2. Кондуктометрическое титрование Ведут титрование и следят за изменением электропроводности титруемого раствора. Строят зависимости в координатах: - Vтитранта Построение кривых кондуктометрического титрования H+ + Cl- + Na+ + OH- = Na+ + Cl- + H 2 O HAc + Na+ + OH- = Na+ + Ac- + H 2 O OH- OHH+ Ac. Na+ Cl. Т. э. Vтитранта H+ Т. э. Vтитранта
 Смесь Na. OH, NH 3 , Na. Ac титрант - HCl 1. OH- + H+ = H 2 O 2. NH 3 + H+ = NH 4+ 3. Ac- + H+ = HAc H+ Cl- OH- NH 4+ Ac 1 Т. э. 2 Т. э. Na+ 3 Т. э. Vтитранта
Смесь Na. OH, NH 3 , Na. Ac титрант - HCl 1. OH- + H+ = H 2 O 2. NH 3 + H+ = NH 4+ 3. Ac- + H+ = HAc H+ Cl- OH- NH 4+ Ac 1 Т. э. 2 Т. э. Na+ 3 Т. э. Vтитранта
 Достоинства кондуктометрического титрования 1. Возможность титрования очень слабых электролитов 2. Возможность титрования сложных смесей 3. Низкий предел обнаружения 4. Титровать можно мутные и окрашенные растворы 5. Возможность автоматизации Особенности: С титранта в 10 -100 раз больше СХ При комплексонометрическом титровании желательно не использовать буферные растворы
Достоинства кондуктометрического титрования 1. Возможность титрования очень слабых электролитов 2. Возможность титрования сложных смесей 3. Низкий предел обнаружения 4. Титровать можно мутные и окрашенные растворы 5. Возможность автоматизации Особенности: С титранта в 10 -100 раз больше СХ При комплексонометрическом титровании желательно не использовать буферные растворы


