
Постулаты Н. Бора
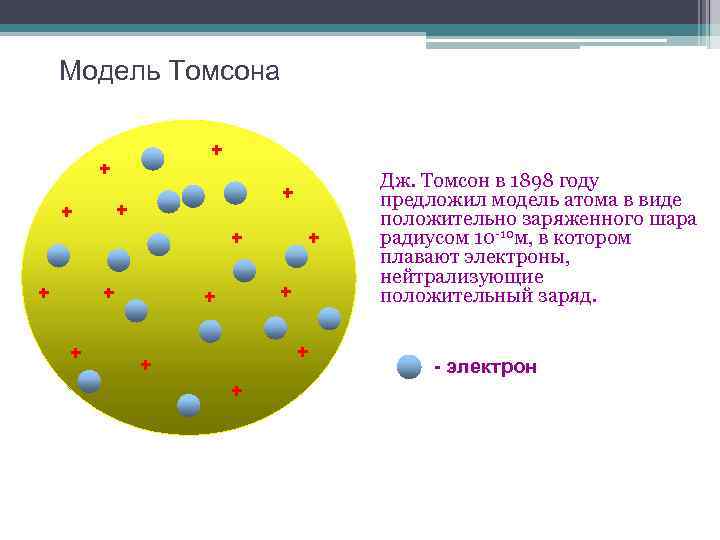
Модель Томсона + + + + Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара радиусом 10 -10 м, в котором плавают электроны, нейтрализующие положительный заряд. - электрон
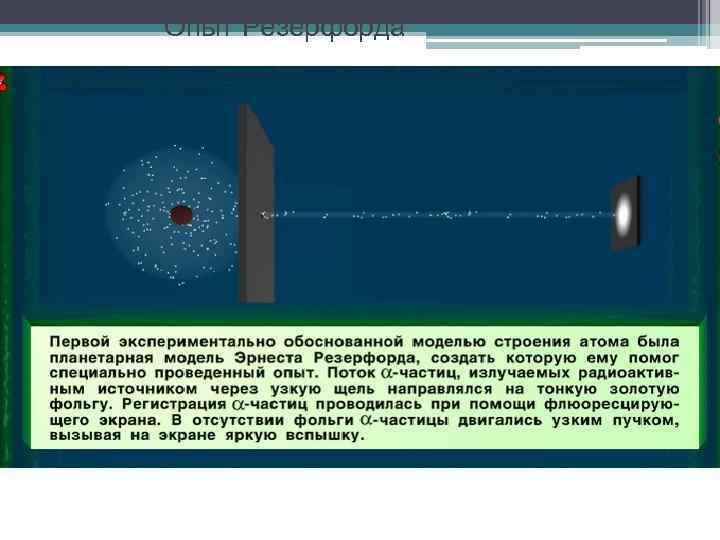
Опыт Резерфорда
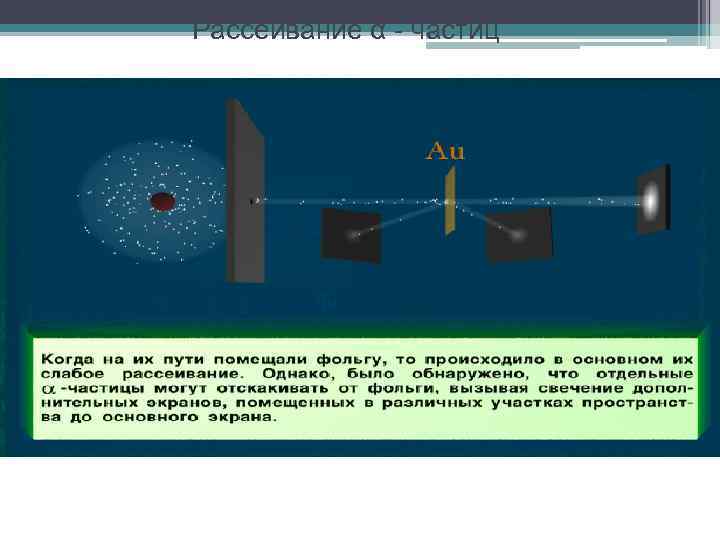
Рассеивание α - частиц

Схема опыта Резерфорда K – свинцовый контейнер с радиоактивным веществом Ф – золотая фольга Э – экран, покрытый сернистым цинком M – микроскоп

Рассеяние α-частицы в атоме Томсона и в атоме Резерфорда Атом Томсона 1. Атом Резерфорда Большинство альфа - частиц отклоняются от прямолинейного пути на углы не более 1 - 20 2. Небольшая часть альфа – частиц испытывала отклонение на значительно большие углы 3. В среднем одна из 8000 альфа- частиц рассеивается в направлении, обратном направлению первоначального движения

Планетарная модель атома Резерфорда. электронные орбиты + ядро электрон 10 -10 м 10 -15 м

Модели атомов водорода Водород (H) Дейтерий (D) Тритий (T) Атомы одного элемента, имеющие одинаковое число протонов, но разное число нейтронов, называются изотопами. Химические свойства таких атомов одинаковы, но они различны по некоторым физическим свойствам. В 1961 году изотоп 12 С был выбран в качестве международного стандарта атомной массы.

ТЕСТ № 1

1. Принятая в настоящий момент в науке модель структуры атома обоснована опытами по. . . a. растворению и плавлению твердых тел b. ионизации газа c. химическому получению новых веществ d. рассеянию a-частиц

2. В опыте Резерфорда альфа частицы рассеиваются. . . a. электростатическим полем ядра атом b. электронной оболочкой атомов мишени c. гравитационным полем ядра атома d. поверхностью мишени
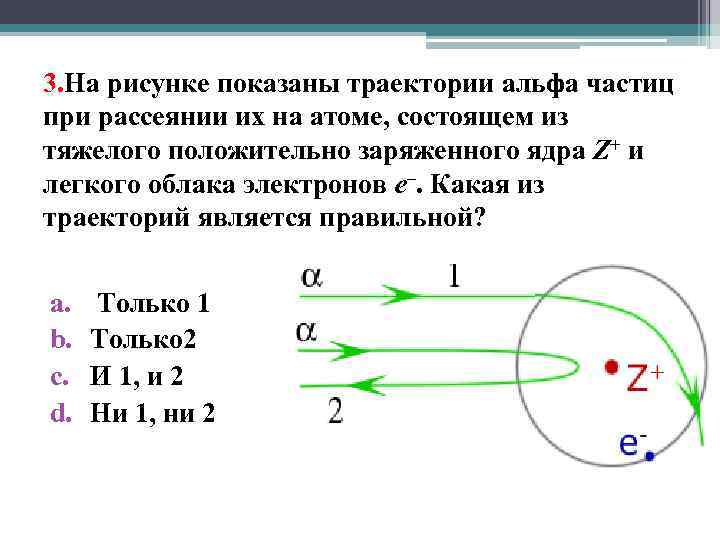
3. На рисунке показаны траектории aльфа частиц при рассеянии их на атоме, состоящем из тяжелого положительно заряженного ядра Z+ и легкого облака электронов е–. Какая из траекторий является правильной? a. b. c. d. Только 1 Только 2 И 1, и 2 Ни 1, ни 2

4. Какое утверждение соответствует планетарной модели атома?
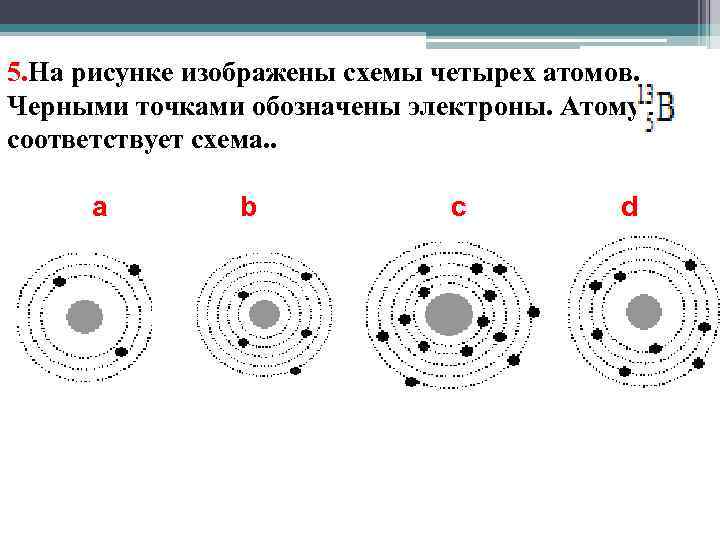
5. На рисунке изображены схемы четырех атомов. Черными точками обозначены электроны. Атому соответствует схема. . a b c d

6. Сравните массы частиц, фигурирующих в объяснении опыта Резерфорда: масса альфа частицы – Мa, масса ядра атома золота МAu, масса электрона – Ме A B МAu » Мa >> Ме МAu > Мa >> Ме C МAu >> Мa >> Ме D МAu » Мa < Ме

Датский физик Нильс Бор (1885 --1962).
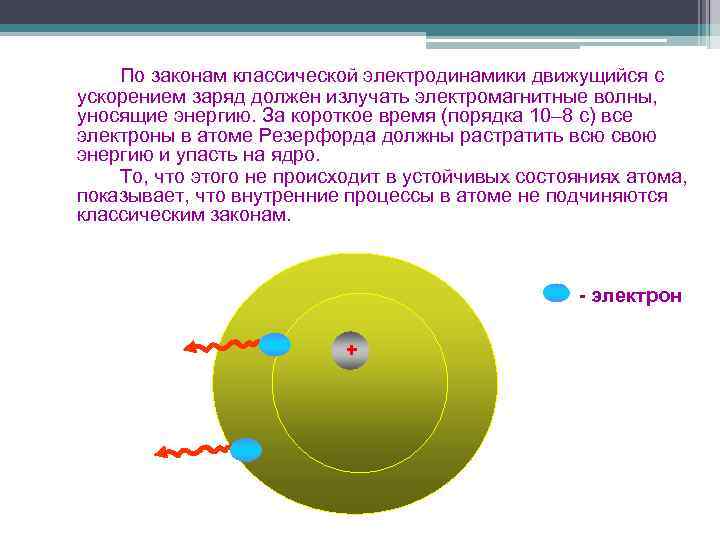
По законам классической электродинамики движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10– 8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам. - электрон +

I ПОСТУЛАТ БОРА Атомная система может находится только в особых стационарных квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает. - +
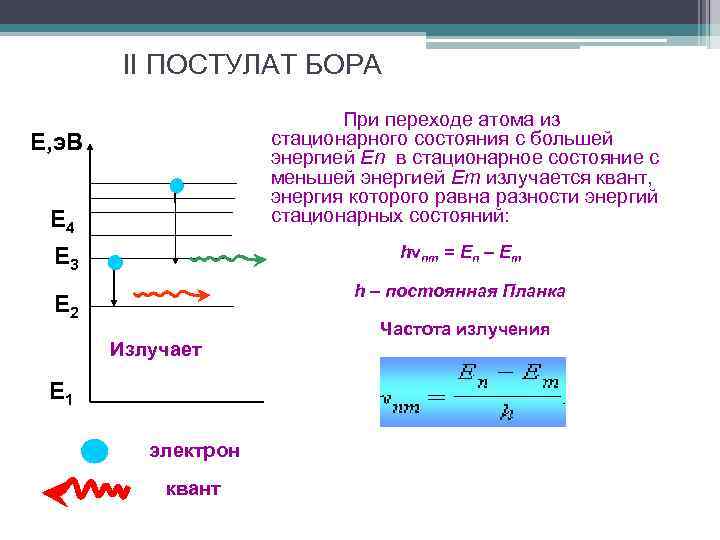
II ПОСТУЛАТ БОРА При переходе атома из стационарного состояния с большей энергией En в стационарное состояние с меньшей энергией Em излучается квант, энергия которого равна разности энергий стационарных состояний: Е, э. В Е 4 hνnm = En – Em Е 3 h – постоянная Планка Е 2 Излучает Е 1 электрон квант Частота излучения

II ПОСТУЛАТ БОРА При переходе атома из стационарного состояния с меньшей энергией En в стационарное состояние с большей энергией Em поглощается квант, энергия которого равна разности энергий стационарных состояний: Е, э. В Е 4 hνnm = En – Em Е 3 h – постоянная Планка Е 2 Частота излучения Поглощает Е 1 электрон квант
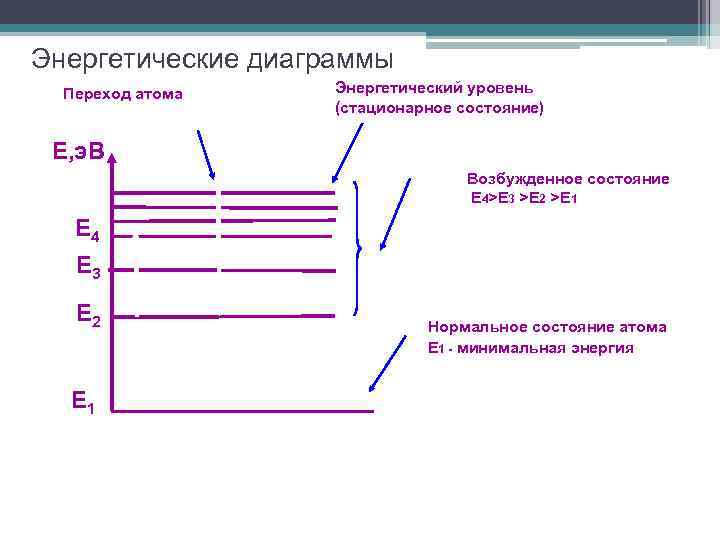
Энергетические диаграммы Переход атома Энергетический уровень (стационарное состояние) Е, э. В Возбужденное состояние Е 4>Е 3 >Е 2 >Е 1 Е 4 Е 3 Е 2 Е 1 Нормальное состояние атома Е 1 - минимальная энергия

Правило квантования Бора В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса me - масса электрона, υ – скорость электрона rn – радиус стационарной круговой орбиты Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий

Серии излучения атома водорода серия Пащена серия Бальмера серия Лаймена

Модель атома водорода по Бору позволила рассчитать:

1. Какие затруднения вызвала модель Резерфорда для объяснения процессов излучения энергии атомами? Ядерная модель Резерфорда просто обосновывала экспериментальные данные, но не позволяла объяснить устройство атома исходя из классических законов физики.

2. Сформулируйте первый постулат Бора Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает энергию, при этом электроны в атомах движутся с ускорением.

3. Сформулируйте второй постулат Бора. Излучение света происходит при переходе атома из стационарного состояния с большей энергией E k в стационарное состояние с меньшей энергией En. Энергия излучённого фотона равна разности энергий стационарных состояний

4. В чём заключаются противоречия между постулатами Бора и законами классической механики классической электродинамики? Как следует из постулатов, вопреки классической электродинамике электроны движутся по замкнутым орбитам и электромагнитные волны при этом не излучают.

5. При каком условии происходит излучение, а при каком условии происходит поглощение энергии атомом? При поглощении света, атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. При излучении атом переходит из стационарного состояния с большей энергией, в стационарное состояние с меньшей энергией.

6. Какого значение теории Бора в развитии физической науки? I. Явилась важным этапом в развитии квантовых представлений о строении атома. II. Позволила определить радиусы орбит энергию стационарных состояний частоты излучения

6. На рисунке 12. 4, стр278 изображена диаграмма энергетических уровней атома водорода. Энергия ионизации атома равна: а)0; б)3. 4 э. В; в)0. 54 э. В; г)13. 6 э. В ОТВЕТ 13. 6 э. В. Энергия ионизации - энергия, которую нужно затратить для перевода электрона из основного состояния в состояние с нулевой энергией. Исходя из диаграммы , в основном состоянии электрон имеет энергию Е = -13. 6 э. В. )

7. Сколько квантов ( с различной энергией) может испускать атом водорода, если электрон находится на третьем возбужденном уровне. ) (рис12. 4, стр278) ОТВЕТ Атом водорода может испускать кванты с тремя различными энергиями. Возможные переходы : n=3 --- n=1, n=2 --- n=1, n=3 --- n=2.

ТЕСТ № 2

1. Электрон, связанный с атомом, при переходе с более удалённой орбиты на менее удалённую от атома орбиту в момент перехода……

2. С ростом главного квантового числа n (энергитического уровня атома) энергия стационарного состояния атома……

3. Электрон в атоме водорода перешёл с первого энергетического уровня на третий. Как при этом изменилась энергия атом?

4. Диаграмма свидетельствует о том, что атом a. только поглощал фотоны. b. только испускал фотоны c. и поглощал, и испускал фотоны d. ни поглощал, ни испускал фотоны

5. На рисунке представлена диаграмма энергетических уровней атома. Какой из переходов в спектре поглощения атома соответствует наименьшей частоте?

6. Длина волны для фотона, излучаемого атомом при переходе из возбужденного состояния с энергией Е 1 в основное состояние с энергией E 0, равна. . . (с скорость света, h - постоянная Планка) 1. 2. 3. 4. (E 0 -E 1)/h (E 1 -E 0)/h ch/(E 1 -E 0) ch/(E 0 -E 1)

7. Электрон внешней оболочки атома сначала переходит из стационарного состояния с энергией Е 1 в стационарное состояние с энергией Е 2, поглощая фотон частотой ν 1. Затем он переходит из состояния Е 2 в стационарное состояние с энергией E 3, поглощая фотон частотой ν 2 > ν 1. Что происходит при переходе электрона из состояния E 3 в состояние Е 1? 1. излучение света частотой ν 2 – ν 1 2. поглощение света частотой ν 2 – ν 1 3. излучение света частотой ν 2 + ν 1 4. поглощение света частотой ν 2 + ν 1