Презентация (нуклеиновые кислоты продолжение).ppt
- Количество слайдов: 35
 ПОСТТРАНСКРИПЦИОННЫЕ МОДИФИКАЦИИ пре. РНК
ПОСТТРАНСКРИПЦИОННЫЕ МОДИФИКАЦИИ пре. РНК
 Молекулы РНК, которые синтезируются РНКполимеразами, функционально неактивны и являются молекулами-предшественниками - пре-РНК. Они превращаются в зрелые молекулы только после соответствующих посттранскрипционных модификаций – созревания молекул РНК.
Молекулы РНК, которые синтезируются РНКполимеразами, функционально неактивны и являются молекулами-предшественниками - пре-РНК. Они превращаются в зрелые молекулы только после соответствующих посттранскрипционных модификаций – созревания молекул РНК.
 Образование зрелых молекул м. РНК начинается еще в процессе синтеза молекулы РНКполимеразой II на стадии элонгации. К 5’-концу растущей нити РНК присоединяется 5’-концом молекула ГТФ и отщепляется ортофосфат. Затем основание – гуанин в составе ГТФ – метилируется с образованием 7 -метил-ГТФ. Эту группу в составе м. РНК называют «кэп» (колпачок или шапочка). Кэп защищает 5’-конец м. РНК от действия нуклеаз и обеспечивает инициацию трансляции.
Образование зрелых молекул м. РНК начинается еще в процессе синтеза молекулы РНКполимеразой II на стадии элонгации. К 5’-концу растущей нити РНК присоединяется 5’-концом молекула ГТФ и отщепляется ортофосфат. Затем основание – гуанин в составе ГТФ – метилируется с образованием 7 -метил-ГТФ. Эту группу в составе м. РНК называют «кэп» (колпачок или шапочка). Кэп защищает 5’-конец м. РНК от действия нуклеаз и обеспечивает инициацию трансляции.
 После того как пре-м. РНК освобождается от РНКполимеразы II поли(А)-полимераза последовательно удлиняет 3’-конец молекулы, присоединяя от 150 до 200 остатков АМФ. Субстратом является АТФ. В результате на 3’конце пре-м. РНК образуется поли (А)- «хвост» , который также защищает м. РНК от расщепления РНКазами.
После того как пре-м. РНК освобождается от РНКполимеразы II поли(А)-полимераза последовательно удлиняет 3’-конец молекулы, присоединяя от 150 до 200 остатков АМФ. Субстратом является АТФ. В результате на 3’конце пре-м. РНК образуется поли (А)- «хвост» , который также защищает м. РНК от расщепления РНКазами.
 Эукариотические ДНК состоят из участков, кодирующих последовательность аминокислот в отдельных доменах молекулы белка – экзонов и участков, не содержащих информацию о строении белка – интронов. В ходе транскрипции получаются пре-РНК, содержащие участки, комплеменарные экзонам и интронам. В процессе созревания м. РНК интроны удаляются, а экзоны соединяются между собой с высокой точностью при помощи комплексов из малых ядерных рибонуклеопротеинов (мя. РНП) – сплайсосом. Этот процесс получил название сплайсинга.
Эукариотические ДНК состоят из участков, кодирующих последовательность аминокислот в отдельных доменах молекулы белка – экзонов и участков, не содержащих информацию о строении белка – интронов. В ходе транскрипции получаются пре-РНК, содержащие участки, комплеменарные экзонам и интронам. В процессе созревания м. РНК интроны удаляются, а экзоны соединяются между собой с высокой точностью при помощи комплексов из малых ядерных рибонуклеопротеинов (мя. РНП) – сплайсосом. Этот процесс получил название сплайсинга.
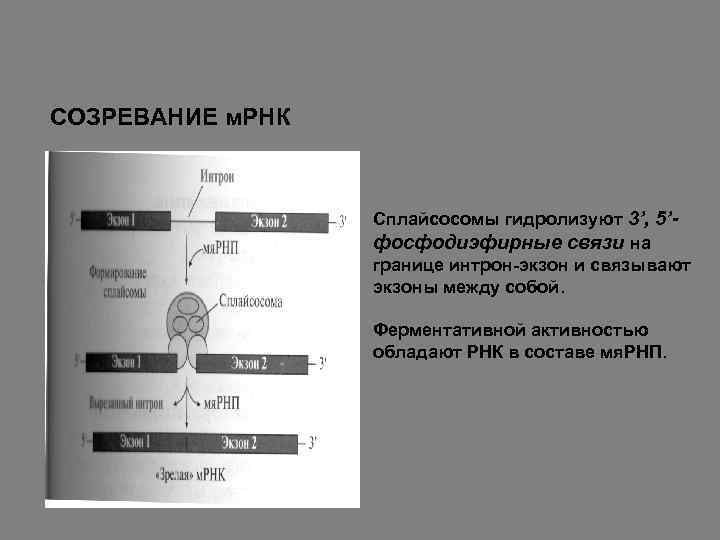 СОЗРЕВАНИЕ м. РНК Сплайсосомы гидролизуют 3’, 5’фосфодиэфирные связи на границе интрон-экзон и связывают экзоны между собой. Ферментативной активностью обладают РНК в составе мя. РНП.
СОЗРЕВАНИЕ м. РНК Сплайсосомы гидролизуют 3’, 5’фосфодиэфирные связи на границе интрон-экзон и связывают экзоны между собой. Ферментативной активностью обладают РНК в составе мя. РНП.
 Посттранскрипционные модификации т. РНК В клетках синтезируется около 20 семейств т. РНК, молекулы которых содержат примерно 100 нуклеотидов. Представители каждого семейства способны связываться только с одной из 20 аминокислот, входящих в состав белков.
Посттранскрипционные модификации т. РНК В клетках синтезируется около 20 семейств т. РНК, молекулы которых содержат примерно 100 нуклеотидов. Представители каждого семейства способны связываться только с одной из 20 аминокислот, входящих в состав белков.
 В ядре при формировании пространственной конформации т. РНК молекулы укорачиваются с 5’-и 3’концов с помощью специфических РНКаз и удаляется интрон. 10 -15% азотистых оснований в молекулах модифицируется к 3’концу всех т. РНК с помощью нуклеотидилтрансферазы последовательно один за другим присоединяется триплет нуклеотидов ССА, который необходим для связывания аминокислот, участвующих в синтезе белков.
В ядре при формировании пространственной конформации т. РНК молекулы укорачиваются с 5’-и 3’концов с помощью специфических РНКаз и удаляется интрон. 10 -15% азотистых оснований в молекулах модифицируется к 3’концу всех т. РНК с помощью нуклеотидилтрансферазы последовательно один за другим присоединяется триплет нуклеотидов ССА, который необходим для связывания аминокислот, участвующих в синтезе белков.
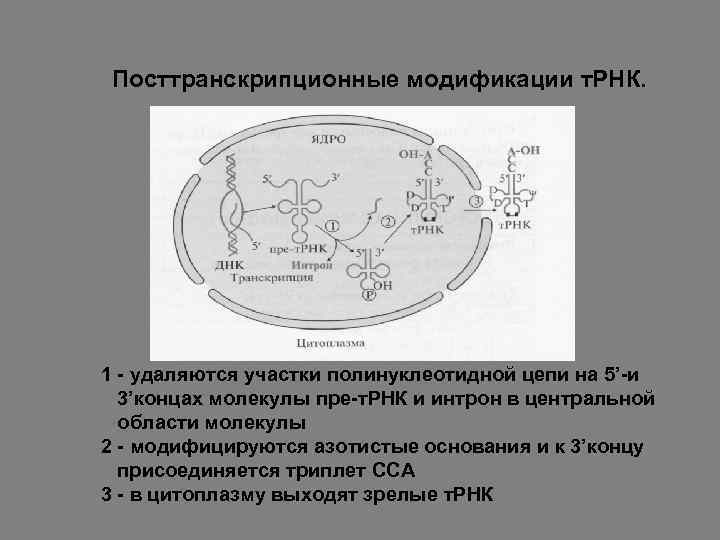 Посттранскрипционные модификации т. РНК. 1 - удаляются участки полинуклеотидной цепи на 5’-и 3’концах молекулы пре-т. РНК и интрон в центральной области молекулы 2 - модифицируются азотистые основания и к 3’концу присоединяется триплет ССА 3 - в цитоплазму выходят зрелые т. РНК
Посттранскрипционные модификации т. РНК. 1 - удаляются участки полинуклеотидной цепи на 5’-и 3’концах молекулы пре-т. РНК и интрон в центральной области молекулы 2 - модифицируются азотистые основания и к 3’концу присоединяется триплет ССА 3 - в цитоплазму выходят зрелые т. РНК
 Посттранскрипционные модификации прер. РНК. Пре-р. РНК освобождается из комплекса с ДНК в виде крупного транскрипта 45 S. 1 -2% нуклеотидов этой молекулы метилируется по 2’-гидроксильной группе рибозы. Метильные группы служат маркерами для последующего расщепления пре-р. РНК на молекулы 18 S, 28 S и 5, 8 S. Самая короткая, 5 S р. РНК кодируется отдельным геном и включается в рибонуклеопротеиновые частицы, содержащие 28 S и 5, 8 S РНК, образуя большую субъединицу рибосомы. 18 S РНК формирует малую 40 S субъединицу рибосомы.
Посттранскрипционные модификации прер. РНК. Пре-р. РНК освобождается из комплекса с ДНК в виде крупного транскрипта 45 S. 1 -2% нуклеотидов этой молекулы метилируется по 2’-гидроксильной группе рибозы. Метильные группы служат маркерами для последующего расщепления пре-р. РНК на молекулы 18 S, 28 S и 5, 8 S. Самая короткая, 5 S р. РНК кодируется отдельным геном и включается в рибонуклеопротеиновые частицы, содержащие 28 S и 5, 8 S РНК, образуя большую субъединицу рибосомы. 18 S РНК формирует малую 40 S субъединицу рибосомы.
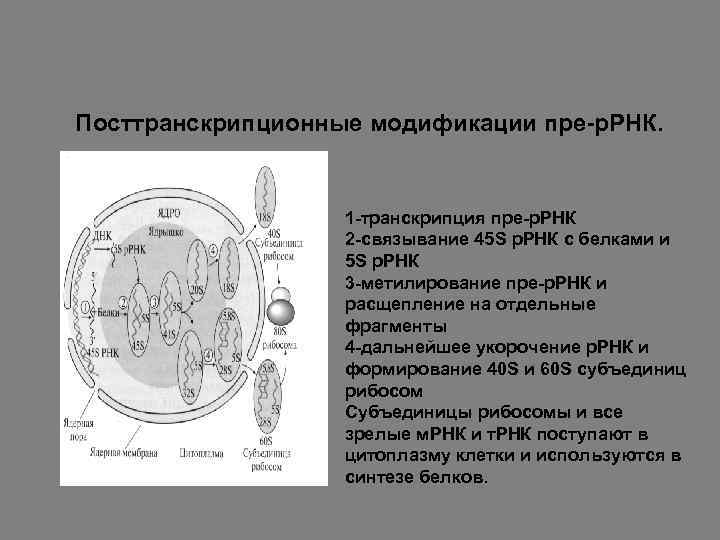 Посттранскрипционные модификации пре-р. РНК. 1 -транскрипция пре-р. РНК 2 -связывание 45 S р. РНК с белками и 5 S р. РНК 3 -метилирование пре-р. РНК и расщепление на отдельные фрагменты 4 -дальнейшее укорочение р. РНК и формирование 40 S и 60 S субъединиц рибосом Субъединицы рибосомы и все зрелые м. РНК и т. РНК поступают в цитоплазму клетки и используются в синтезе белков.
Посттранскрипционные модификации пре-р. РНК. 1 -транскрипция пре-р. РНК 2 -связывание 45 S р. РНК с белками и 5 S р. РНК 3 -метилирование пре-р. РНК и расщепление на отдельные фрагменты 4 -дальнейшее укорочение р. РНК и формирование 40 S и 60 S субъединиц рибосом Субъединицы рибосомы и все зрелые м. РНК и т. РНК поступают в цитоплазму клетки и используются в синтезе белков.
 ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ
ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ
 Нуклеиновые кислоты в организме постоянно обновляются. В норме синтез и распад находятся в состоянии динамического равновесия. Катаболизм нуклеиновых кислот начинается с гидролиза 3’, 5’- фосфодиэфирной связи под действием ферментов нуклеаз: • ДНКазы – расщепляют ДНК • РНКазы – расщепляют РНК Среди ДНКаз и РНКаз различают: • Экзонуклеазы (5’ и 3’) отщепляют концевые мононуклеотиды 3’- экзонуклеазы – отщепляют мононуклеотид с 3’-конца молекулы 5’- экзонуклеазы – отщепляют 5’- концевой мононуклеотид
Нуклеиновые кислоты в организме постоянно обновляются. В норме синтез и распад находятся в состоянии динамического равновесия. Катаболизм нуклеиновых кислот начинается с гидролиза 3’, 5’- фосфодиэфирной связи под действием ферментов нуклеаз: • ДНКазы – расщепляют ДНК • РНКазы – расщепляют РНК Среди ДНКаз и РНКаз различают: • Экзонуклеазы (5’ и 3’) отщепляют концевые мононуклеотиды 3’- экзонуклеазы – отщепляют мононуклеотид с 3’-конца молекулы 5’- экзонуклеазы – отщепляют 5’- концевой мононуклеотид
 Экзонуклеазы расщепляют внутренние 3’, 5’фосфодиэфирные связи, специфичны к мононуклеотидной последовательности, есть высокоспецифичные: рестриктазы – которые используются в генной инженерии. Далее происходит отщепление фосфата от мононуклеотида с участием нуклеотидаз и образованием нуклеозидов.
Экзонуклеазы расщепляют внутренние 3’, 5’фосфодиэфирные связи, специфичны к мононуклеотидной последовательности, есть высокоспецифичные: рестриктазы – которые используются в генной инженерии. Далее происходит отщепление фосфата от мононуклеотида с участием нуклеотидаз и образованием нуклеозидов.
 Нуклеозид может расщепляться путем гидролиза под действием нуклеозидазы на азотистое основание и пентозу, но чаще происходит фосфоролиз – нуклеозид расщепляется на азотистое основание и фосфорибозу. Пищеварительные и лизосомальные нуклеазы низкоспецифичны, имеют упрощенное строение активного центра.
Нуклеозид может расщепляться путем гидролиза под действием нуклеозидазы на азотистое основание и пентозу, но чаще происходит фосфоролиз – нуклеозид расщепляется на азотистое основание и фосфорибозу. Пищеварительные и лизосомальные нуклеазы низкоспецифичны, имеют упрощенное строение активного центра.
 У высокоспецифичных нуклеаз (рестриктазы) сложное строение активного центра. Они способны «узнавать» целую последовательность нуклеотидов из 4 -10 пар и расщеплять одну единственную связь и строго определенном месте. Пентозы, образующиеся в ходе катаболизма нуклеиновых кислот, утилизируются. Азотистые основания в зависимости от их типа подвергаются катаболизму по – разному. Синтез мононуклеотидов de novo происходит с затратой АТФ из СО 2, рибозо-5 -фосфата и заменимых аминокислот.
У высокоспецифичных нуклеаз (рестриктазы) сложное строение активного центра. Они способны «узнавать» целую последовательность нуклеотидов из 4 -10 пар и расщеплять одну единственную связь и строго определенном месте. Пентозы, образующиеся в ходе катаболизма нуклеиновых кислот, утилизируются. Азотистые основания в зависимости от их типа подвергаются катаболизму по – разному. Синтез мононуклеотидов de novo происходит с затратой АТФ из СО 2, рибозо-5 -фосфата и заменимых аминокислот.
 РОЛЬ АМИНОКИСЛОТ В СИНТЕЗЕ МОНОНУКЛЕОТИДОВ Аспарагин – донор амидной группы Аспарагиновая кислота • донор аминокислоты • участвует в синтезе всей молекулой Глицин • Донор активного углерода • Участвует в синтезе всей молекулой • Может видоизменяться в серин – донор активного углерода
РОЛЬ АМИНОКИСЛОТ В СИНТЕЗЕ МОНОНУКЛЕОТИДОВ Аспарагин – донор амидной группы Аспарагиновая кислота • донор аминокислоты • участвует в синтезе всей молекулой Глицин • Донор активного углерода • Участвует в синтезе всей молекулой • Может видоизменяться в серин – донор активного углерода
 ИНГИБИТОРЫ МАТРИЧНЫХ БИОСИНТЕЗОВ
ИНГИБИТОРЫ МАТРИЧНЫХ БИОСИНТЕЗОВ
 Существует большая группа веществ, ингибирующая синтез ДНК, РНК или белков. Некоторые из них нашли применение в медицине лечения инфекционных болезней и опухолевых новообразований, а другие для человека оказались токсинами. Действие ингибиторов матричных биосинтезов как лекарственных препаратов основано на модификации матриц: ДНК, РНК, рибосом или на активации ферментов. Остановка любого из матричных синтезов опасна для клеток и может вызвать их гибель.
Существует большая группа веществ, ингибирующая синтез ДНК, РНК или белков. Некоторые из них нашли применение в медицине лечения инфекционных болезней и опухолевых новообразований, а другие для человека оказались токсинами. Действие ингибиторов матричных биосинтезов как лекарственных препаратов основано на модификации матриц: ДНК, РНК, рибосом или на активации ферментов. Остановка любого из матричных синтезов опасна для клеток и может вызвать их гибель.
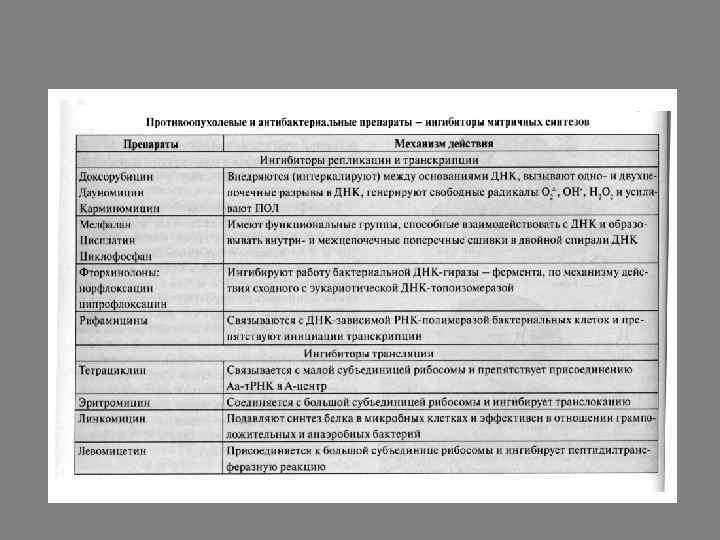
 Наиболее широко используются антибиотики, образующиеся в процессе жизнедеятельности микроорганизмов и способные оказывать избирательное токсическое действие на синтез ДНК, РНК и белка. Антибиотики, взаимодействующие с ДНК, нарушают ее матричную функцию и вызывают подавление процессов репликации и транскрипции. Их используют для лечения злокачественных новообразований и называют противоопухолевыми препаратами.
Наиболее широко используются антибиотики, образующиеся в процессе жизнедеятельности микроорганизмов и способные оказывать избирательное токсическое действие на синтез ДНК, РНК и белка. Антибиотики, взаимодействующие с ДНК, нарушают ее матричную функцию и вызывают подавление процессов репликации и транскрипции. Их используют для лечения злокачественных новообразований и называют противоопухолевыми препаратами.
 Антибиотики дауномицин, доксорубицин содержат циклическую структуру, которая встраивается (интеркалирует) между комплементарными основаниями, изменяет структуру ДНК и ингибирует репликацию и транскрипцию. Избирательность их действия невелика и базируется на том, что опухолевые клетки, как правило, часто делятся и их мембрана более проницаема, чем у клеток нормальных тканей. В то же время эти препараты токсичны для нормальных быстро делящихся клеток организма, таких, как стволовые клетки кроветворной системы, клетки слизистой оболочки желудка и кишечника.
Антибиотики дауномицин, доксорубицин содержат циклическую структуру, которая встраивается (интеркалирует) между комплементарными основаниями, изменяет структуру ДНК и ингибирует репликацию и транскрипцию. Избирательность их действия невелика и базируется на том, что опухолевые клетки, как правило, часто делятся и их мембрана более проницаема, чем у клеток нормальных тканей. В то же время эти препараты токсичны для нормальных быстро делящихся клеток организма, таких, как стволовые клетки кроветворной системы, клетки слизистой оболочки желудка и кишечника.
 В лечении онкологических заболеваний используют мелфалан, цисплантин, циклофосфамид, которые взаимодействуют с азотистыми основаниями ДНК, образуют внутри- и межцепочечные сшивки в молекуле и нарушают репликацию.
В лечении онкологических заболеваний используют мелфалан, цисплантин, циклофосфамид, которые взаимодействуют с азотистыми основаниями ДНК, образуют внутри- и межцепочечные сшивки в молекуле и нарушают репликацию.
 К ингибиторам матричных синтезов, оказывающим противобактериальное действие, относят вещества, блокирующие синтез РНК или белка. В эту группу входит широко применяемый в клинике рифампицин, получаемый на основе природного антибиотика рифамицина. Антибиотики из семейства рифамицинов ингибируют только бактериальную РНК-полимеразу и препятствуют инициации транскрипции. Их применяют для лечения туберкулеза, т. к. эти препараты не влияют на работу ядерных РНК-полимераз эукариотических клеток.
К ингибиторам матричных синтезов, оказывающим противобактериальное действие, относят вещества, блокирующие синтез РНК или белка. В эту группу входит широко применяемый в клинике рифампицин, получаемый на основе природного антибиотика рифамицина. Антибиотики из семейства рифамицинов ингибируют только бактериальную РНК-полимеразу и препятствуют инициации транскрипции. Их применяют для лечения туберкулеза, т. к. эти препараты не влияют на работу ядерных РНК-полимераз эукариотических клеток.
 Антибиотики из семейства фторхинолонов: норфлоксацин, ципрофлоксацин. Они являются мощными ингибиторами бактериальной ДНК –гиразы, которая раскручивает кольцевую спираль бактериальной ДНК и начинает репликацию. На подавление работы прокариотической белоксинтезирующей системы направлено действие большой группы антибиотиков, являющихся ингибиторами трансляции.
Антибиотики из семейства фторхинолонов: норфлоксацин, ципрофлоксацин. Они являются мощными ингибиторами бактериальной ДНК –гиразы, которая раскручивает кольцевую спираль бактериальной ДНК и начинает репликацию. На подавление работы прокариотической белоксинтезирующей системы направлено действие большой группы антибиотиков, являющихся ингибиторами трансляции.
 Стрептомицин ингибирует инициацию синтеза белка в клетках патогенной микрофлоры и вызывает ошибки в прочтении информации, закодированной в м. РНК. Тетрациклины связываются с 30 S субъединицей и препятствует присоединению аа-т. РНК в А центр рибосомы, нарушая процесс элонгации. Левомицетин присоединяется к 50 S субъединице рибосомы и подавляет пептидилтрасферазную реакцию. Эритромицин также присоединяется к 50 S субъединице рибосомы и ингибирует траслокацию.
Стрептомицин ингибирует инициацию синтеза белка в клетках патогенной микрофлоры и вызывает ошибки в прочтении информации, закодированной в м. РНК. Тетрациклины связываются с 30 S субъединицей и препятствует присоединению аа-т. РНК в А центр рибосомы, нарушая процесс элонгации. Левомицетин присоединяется к 50 S субъединице рибосомы и подавляет пептидилтрасферазную реакцию. Эритромицин также присоединяется к 50 S субъединице рибосомы и ингибирует траслокацию.
 Течение многих вирусных инфекций сопровождается гибелью зараженных клеток. Установлено, что вирусы, попадая в эукариотические клетки, прекращают синтез нуклеиновых кислот и белков, характерных для данного организма, и переключают ферментные системы и энергетические ресурсы на воспроизведение вирусных частиц.
Течение многих вирусных инфекций сопровождается гибелью зараженных клеток. Установлено, что вирусы, попадая в эукариотические клетки, прекращают синтез нуклеиновых кислот и белков, характерных для данного организма, и переключают ферментные системы и энергетические ресурсы на воспроизведение вирусных частиц.
 Интерфероны – небольшие белки – гликопротеины, секретирующиеся клетками макрофагов, фибробластов, В и Т- лимфоцитов в ответ на вирусную инфекцию. Эти белки, связываясь с рецепторами на плазматической мембране зараженных клеток, индуцируют синтез белков и ферментов, способных разрушать м. РНК вирусов и прекращать синтез белков на рибосомах.
Интерфероны – небольшие белки – гликопротеины, секретирующиеся клетками макрофагов, фибробластов, В и Т- лимфоцитов в ответ на вирусную инфекцию. Эти белки, связываясь с рецепторами на плазматической мембране зараженных клеток, индуцируют синтез белков и ферментов, способных разрушать м. РНК вирусов и прекращать синтез белков на рибосомах.
 РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКОВ У ЭУКАРИОТ В организме человека имеется более 200 различных типов клеток, существенно различающихся по структуре и функциям, хотя количество и структура ДНК в них практически одинаковы. Разный набор и количество белков в дифференцированных клетках разных типов возникает благодаря существованию: 1. механизмов, которые сохраняют стабильную репрессию транскрипции одних генов и чтение (экспрессию) других на протяжении всей жизни клетки и даже многих ее регенераций, причем в разных тканях стабильной репрессии подвергаются разные гены. 2. адаптивной регуляции, обеспечивающей приспособление организма к меняющимся условиям внутренней и внешней среды.
РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКОВ У ЭУКАРИОТ В организме человека имеется более 200 различных типов клеток, существенно различающихся по структуре и функциям, хотя количество и структура ДНК в них практически одинаковы. Разный набор и количество белков в дифференцированных клетках разных типов возникает благодаря существованию: 1. механизмов, которые сохраняют стабильную репрессию транскрипции одних генов и чтение (экспрессию) других на протяжении всей жизни клетки и даже многих ее регенераций, причем в разных тканях стабильной репрессии подвергаются разные гены. 2. адаптивной регуляции, обеспечивающей приспособление организма к меняющимся условиям внутренней и внешней среды.
 На определенных стадиях дифференцировки от гамет до взрослого состояния все гены молекулы ДНК в разные периоды времени и в определенной последовательности экспрессируются. Однако в ядрах дифференцированных клеток хроматин приобретает такую укладку, что остается небольшое число генов способных транскрибироваться. Различают гетерохроматин, в котором ДНК не доступна для транскрипции и эухроматин, имеющий более рыхлую укладку и способный связывать РНКполимеразу. В области эухроматина на ДНК расположены транскрибируемые гены.
На определенных стадиях дифференцировки от гамет до взрослого состояния все гены молекулы ДНК в разные периоды времени и в определенной последовательности экспрессируются. Однако в ядрах дифференцированных клеток хроматин приобретает такую укладку, что остается небольшое число генов способных транскрибироваться. Различают гетерохроматин, в котором ДНК не доступна для транскрипции и эухроматин, имеющий более рыхлую укладку и способный связывать РНКполимеразу. В области эухроматина на ДНК расположены транскрибируемые гены.
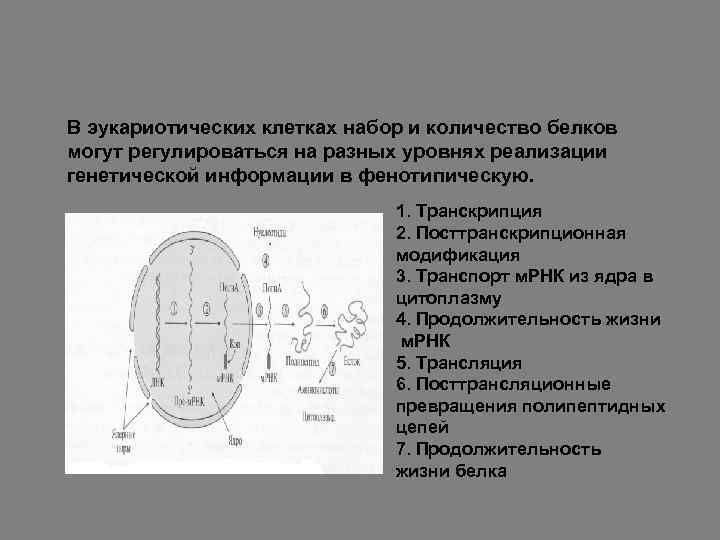 В эукариотических клетках набор и количество белков могут регулироваться на разных уровнях реализации генетической информации в фенотипическую. 1. Транскрипция 2. Посттранскрипционная модификация 3. Транспорт м. РНК из ядра в цитоплазму 4. Продолжительность жизни м. РНК 5. Трансляция 6. Посттрансляционные превращения полипептидных цепей 7. Продолжительность жизни белка
В эукариотических клетках набор и количество белков могут регулироваться на разных уровнях реализации генетической информации в фенотипическую. 1. Транскрипция 2. Посттранскрипционная модификация 3. Транспорт м. РНК из ядра в цитоплазму 4. Продолжительность жизни м. РНК 5. Трансляция 6. Посттрансляционные превращения полипептидных цепей 7. Продолжительность жизни белка
 Важнейшим этапом, определяющим набор и количество белков в клетке, является транскрипция. У эукариот большинство транскрибируемых генов кодируют белки, которые обеспечивают жизнеспособность клеток. Такие гены участвуют в биологическом окислении, синтезе АТФ, построении мембран и нуклеиновых кислот. На ДНК имеются короткие специфические последовательности, которые обеспечивают регуляцию экспрессии генов, именно к ним и присоединяются регуляторные белки.
Важнейшим этапом, определяющим набор и количество белков в клетке, является транскрипция. У эукариот большинство транскрибируемых генов кодируют белки, которые обеспечивают жизнеспособность клеток. Такие гены участвуют в биологическом окислении, синтезе АТФ, построении мембран и нуклеиновых кислот. На ДНК имеются короткие специфические последовательности, которые обеспечивают регуляцию экспрессии генов, именно к ним и присоединяются регуляторные белки.
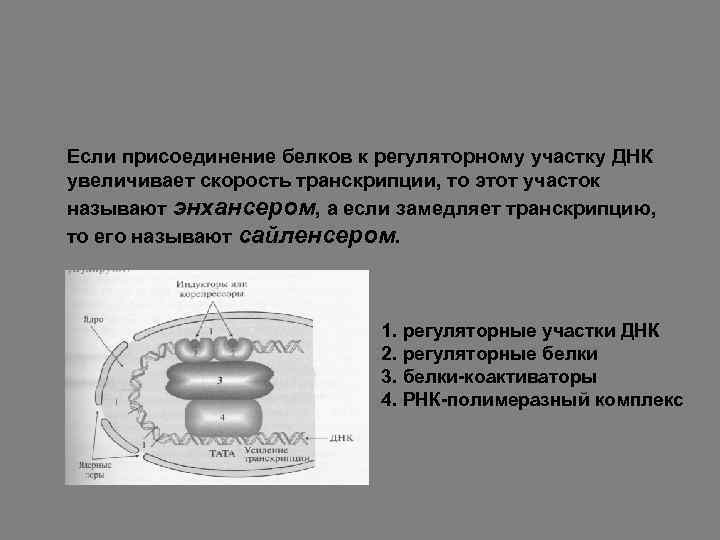 Если присоединение белков к регуляторному участку ДНК увеличивает скорость транскрипции, то этот участок называют энхансером, а если замедляет транскрипцию, то его называют сайленсером. 1. регуляторные участки ДНК 2. регуляторные белки 3. белки-коактиваторы 4. РНК-полимеразный комплекс
Если присоединение белков к регуляторному участку ДНК увеличивает скорость транскрипции, то этот участок называют энхансером, а если замедляет транскрипцию, то его называют сайленсером. 1. регуляторные участки ДНК 2. регуляторные белки 3. белки-коактиваторы 4. РНК-полимеразный комплекс
 Индукторами или корепрессорами, стимулирующими присоединение регуляторных белков к ДНК, могут быть гормоны, ионы металлов, субстраты или продукты метаболических путей. У белков-регуляторов имеется 3 важнейших участка: Участок, по которому белки взаимодействуют с энхансерами или сайленсерами Участок, к которому присоединяются индукторы или корепрессоры Участок, взаимодействующий с белками-посредниками или транскрипционными факторами и изменяющий сродство промотора к РНК-полимеразе.
Индукторами или корепрессорами, стимулирующими присоединение регуляторных белков к ДНК, могут быть гормоны, ионы металлов, субстраты или продукты метаболических путей. У белков-регуляторов имеется 3 важнейших участка: Участок, по которому белки взаимодействуют с энхансерами или сайленсерами Участок, к которому присоединяются индукторы или корепрессоры Участок, взаимодействующий с белками-посредниками или транскрипционными факторами и изменяющий сродство промотора к РНК-полимеразе.
 Пример: стероидные гормоны кортизол, альдостерон легко проходят плазматическую мембрану и в цитозоле клеток-мишеней присоединяются к белку-рецептору. Образуется комплекс, который проходит ядерную мембрану и связывается с регуляторным участком определенного гена. При присоединении к энхансеру, изменение конформаци ДНК вызывает индукцию транскрипции.
Пример: стероидные гормоны кортизол, альдостерон легко проходят плазматическую мембрану и в цитозоле клеток-мишеней присоединяются к белку-рецептору. Образуется комплекс, который проходит ядерную мембрану и связывается с регуляторным участком определенного гена. При присоединении к энхансеру, изменение конформаци ДНК вызывает индукцию транскрипции.


