Обмен белков5.ppt
- Количество слайдов: 36

Пострибосомальный период «созревания» белковой молекулы 2 типа рибосом у эукариотов – «свободные» , обнаруживаемые в цитоплазме клеток, и связанные с ЭПР. Белки, синтезируемые свободными рибосомами, содержат специфичные аминокислотные последовательности (сигнальные последовательности) на своих N-концевых отделах. Они обеспечивают встраивание белка в мембраны, выполняют роль сигналов, которые способствуют точному и целенаправленному переносу белка к месту его функционирования. Nконцевая последовательность удаляется во время этого транспорта. Важную роль в механизме переноса таких белков принадлежит белкам шаперонам. Белки при взаимодействии с шаперонами остаются развернутыми и доставляются к участку на мембране органеллы. Наиболее хорошо изученные шапероны - члены семейства белков " теплового шока"(HSP). Они классифицируются по молекулярной массе. Различают семейства HSP 70, HSP 60 и т. д.
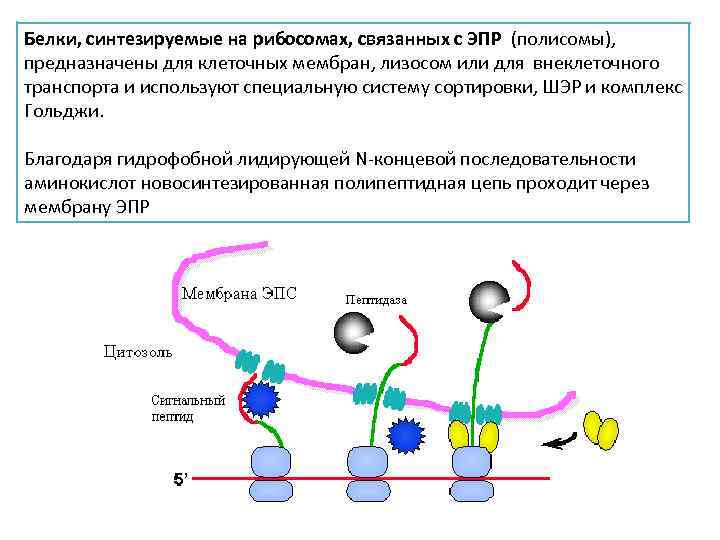
Белки, синтезируемые на рибосомах, связанных с ЭПР (полисомы), предназначены для клеточных мембран, лизосом или для внеклеточного транспорта и используют специальную систему сортировки, ШЭР и комплекс Гольджи. Благодаря гидрофобной лидирующей N-концевой последовательности аминокислот новосинтезированная полипептидная цепь проходит через мембрану ЭПР

В ЭПР происходит фолдинг полипептидных цепей после посттрансляционной их модификации. В чем она заключается? 1. Частичный протеолиз. Удаление инициирующего метионина, сигнальных пептидов, образование акт. форм ферментов и гормонов 2. Присоединение углеводов – гликозилирование 3. Ацилирование помогает белкам встраиваться в мембраны (доноры этой модификации – ацетил-Ко. А и миристоил-Ко. А), пример - гистоны 4. Метилирование аминокислотных остатков в белках - встречается редко 5. Реакции фосфорилирования белков составляют часть механизмов регуляции биологической активности белка и являются обратимыми. Другие формы ковалентной модификации (гидроксилирование ПРО и ЛИЗ (коллаген), иодирование ТИР (тиреоглобулин), карбоксилирование ГЛУ (факторы свертывания крови) 6. Остатки тирозина в некоторых белках могут сульфатироваться (фибриноген, гастрин). Донором сульфата является 3 '-фосфоаденозил-5 '-фосфосульфат (ФАФС). 7. Присоединение 15 углеродной фарнезильной или 20 углеродной геранильной групп к акцепторным белкам – пренилирование (для заякоривания в мембране, G-белки).

lac-оперон Глюкоза + Лактоза -

8. Объединение протомеров и формирование четвертичной структуры белков 9. Образование внутри- и межцепочечных S—S –связей 10. Ковалентное присоединение кофакторов (пиридоксальфосфат, биотин)

lac-оперон

lac-оперон Глюкоза + Лактоза + В присутствии индуктора (лактозы) репрессор меняет свою конформацию и отсоединяется от ДНК. Однако если в этот момент в среде имеется глюкоза (более доступный источник энергии), транскрипция не идет.
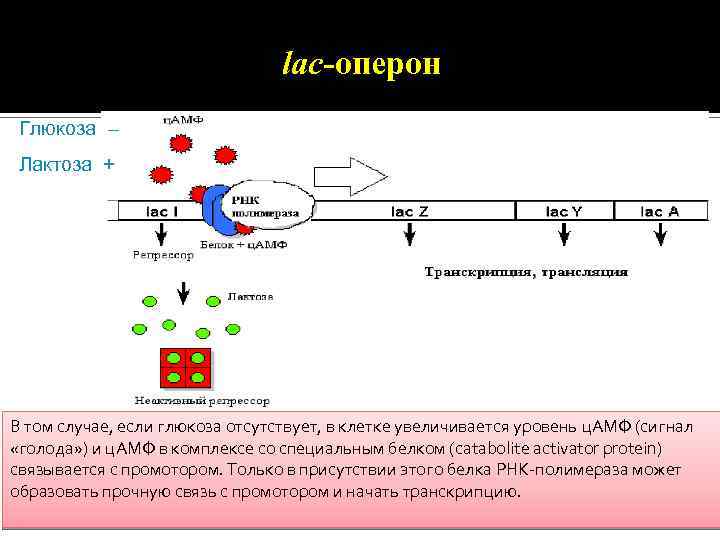
lac-оперон Глюкоза – Лактоза + В том случае, если глюкоза отсутствует, в клетке увеличивается уровень ц. АМФ (сигнал «голода» ) и ц. АМФ в комплексе со специальным белком (catabolite activator protein) связывается с промотором. Только в присутствии этого белка РНК-полимераза может образовать прочную связь с промотором и начать транскрипцию.
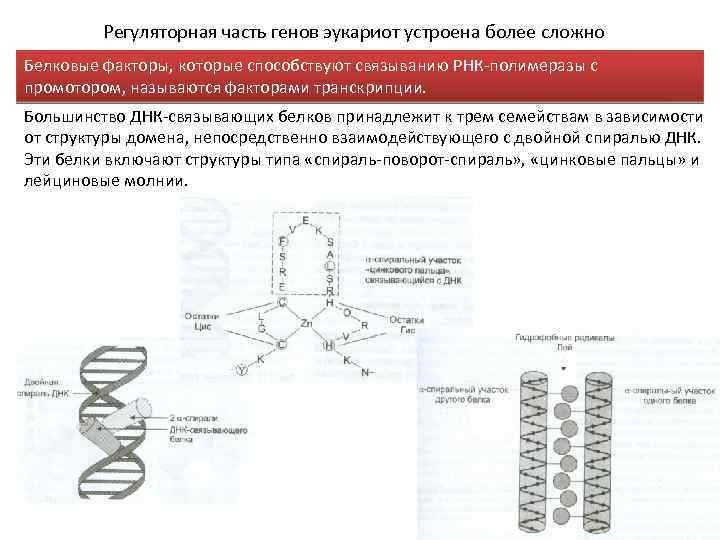
Регуляторная часть генов эукариот устроена более сложно Белковые факторы, которые способствуют связыванию РНК-полимеразы с промотором, называются факторами транскрипции. Большинство ДНК-связывающих белков принадлежит к трем семействам в зависимости от структуры домена, непосредственно взаимодействующего с двойной спиралью ДНК. Эти белки включают структуры типа «спираль-поворот-спираль» , «цинковые пальцы» и лейциновые молнии.
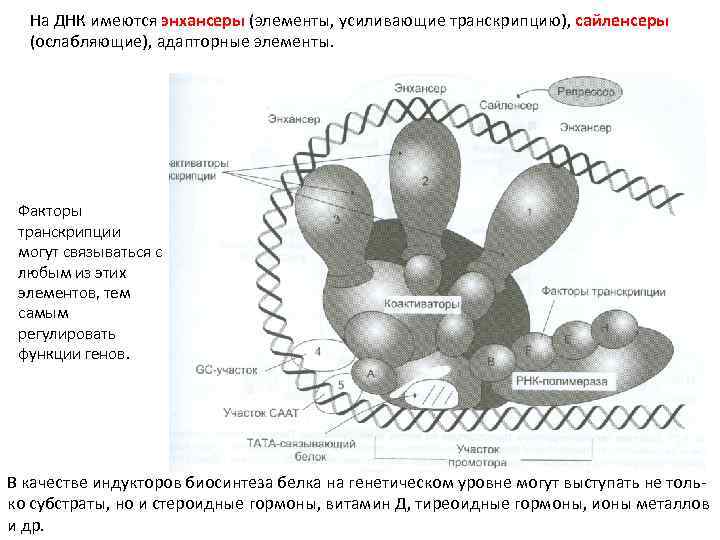
На ДНК имеются энхансеры (элементы, усиливающие транскрипцию), сайленсеры (ослабляющие), адапторные элементы. Факторы транскрипции могут связываться с любым из этих элементов, тем самым регулировать функции генов. В качестве индукторов биосинтеза белка на генетическом уровне могут выступать не только субстраты, но и стероидные гормоны, витамин Д, тиреоидные гормоны, ионы металлов и др.

Антибиотики – ингибиторы матричных биосинтезов как лекарственные препараты Антибиотики Механизм действия Ингибиторы репликации Дауномицин, Доксорубицин, Актиномицин D Внедряются ( «интеркалируют» ) между парами оснований ДНК и нарушают репликацию и транскрипцию Ингибиторы транскрипции Рифамицины Связываются с бактериальной РНК-полимеразой и препятствуют началу транскрипции Ингибиторы трансляции Тетрациклины Левомицетин Эритромицин Стрептомицин Ингибируют элонгацию: связываются с 30 S субъединицей рибосомы и блокируют присоединение аа-т. РНК в А-центр Присоединяется к 50 S-субъединице рибосомы и ингибирует пептидилтрансферазную активность Присоединяется к 50 S субъединице рибосомы и ингибирует транслокацию Ингибирует инициацию трансляции. Связывается с 30 S субъединицей рибосомы, вызывает ошибки в прочтении информации, закодированной в м. РНК

Дифтерийный токсин Под действием протеолитических ферментов клеток хозяина белок распадается на два фрагмента. Один фрагмент представляет собой фермент АДФ-рибозилтрансферазу, катализирующий модификацию фактора элонгации EF 2. Такой фактор элонгации теряет способность участвовать в транслокации рибосомы, и трансляция прекращается. Рицин Смертельный растительный лектин. Найден в касторовом семени, катализирует распад р. РНК большой субъединицы рибосом эукариот -аманитин Токсичное начало бледной поганки. Блокирует синтез м. РНК, осуществляемый РНК-полимеразой II, но не влияет на синтез РНК у прокариот. Интерфероны Индуцируют синтез фермента, который синтезирует олигонуклеотид, последний активирует РНК-азу, которая разрушает м. РНК

Современные методы молекулярной биологии

Ферменты – главный «инструмент» в работе молекулярного биолога • ДНК-полимеразы • ДНК-лигазы • Рестриктазы Рестрикционные эндонуклеазы или рестриктазы - это ферменты, которые узнают специфические последовательности нуклеотидов в двухцепочечной ДНК (в области палиндромов), связываются с ними и катализируют гидролиз фосфодиэфирных связей, соединяющих эти нуклеотиды. 5’ -----GAATTC------3’ 3’------CTTAAG------5’ Рестриктаза Eco. RI
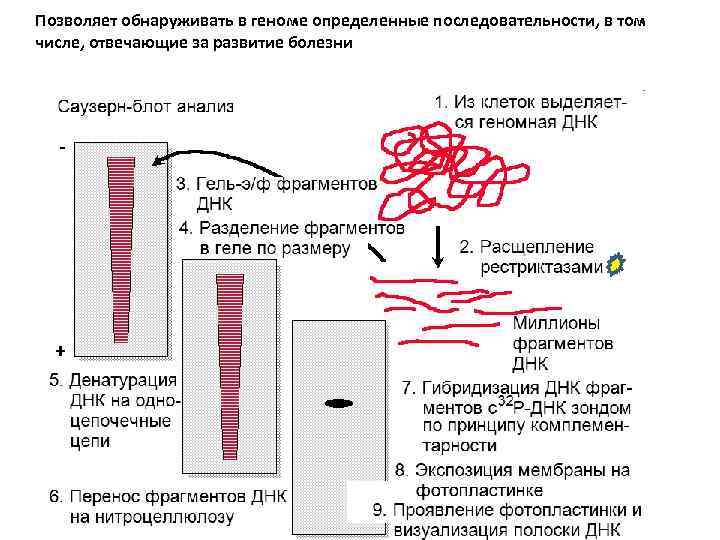
Позволяет обнаруживать в геноме определенные последовательности, в том числе, отвечающие за развитие болезни

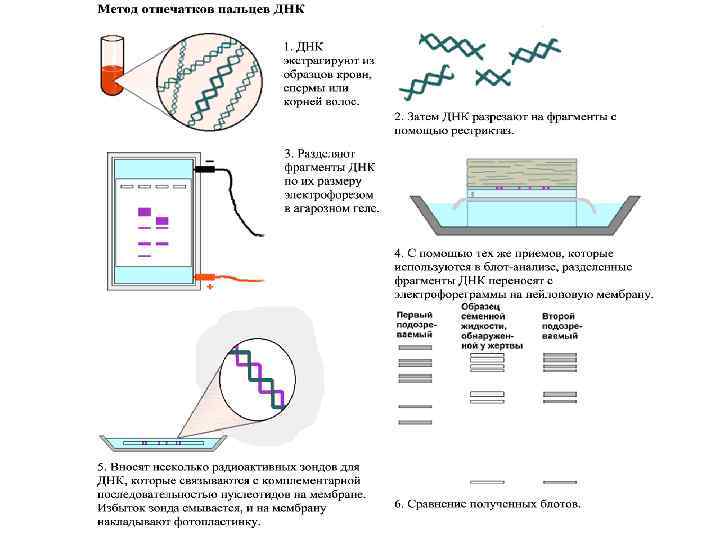
Если взять не один, а несколько зондов, - геномная дактилоскопия или метод отпечатков пальцев (применение) § Комплексная диагностика ряда наследственных заболеваний § Поиск участков в ДНК, ответственных за развитие определенной патологии § Идентификация личности § Судебно-медицинская практика
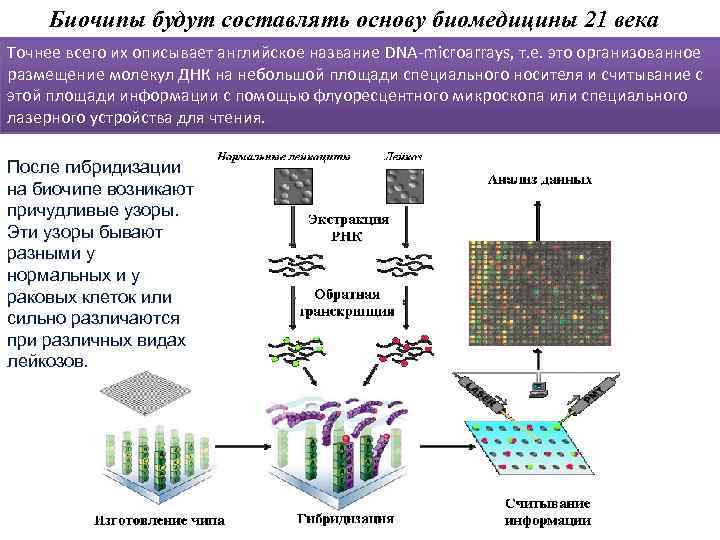
Биочипы будут составлять основу биомедицины 21 века Точнее всего их описывает английское название DNA-microarrays, т. е. это организованное размещение молекул ДНК на небольшой площади специального носителя и считывание с этой площади информации с помощью флуоресцентного микроскопа или специального лазерного устройства для чтения. После гибридизации на биочипе возникают причудливые узоры. Эти узоры бывают разными у нормальных и у раковых клеток или сильно различаются при различных видах лейкозов.

ПЦР (полимеразная цепная реакция) Керри Муллис, род. 1944 г. , выдающийся американский биохимик. В 1993 г. награжден Нобелевской премией в области химии за открытие полимеразной реакции

ПЦР – полимеразная цепная реакция Применение: • Диагностика бактериальных и вирусных инфекций • Генетическое типирование (определение носительства мутантных генов) Три этапа полимеразной реакции проводятся в одном и том же сосуде. (1) Вначале двойную спираль ДНК разделяют на две цепи (90 -950 С в течение 30 сек). Праймер не может связываться при такой высокой температуре с цепями ДНК. (2) Поэтому сосуд охлаждают до 550 С ( «отжиг» праймера). Процедура занимает около 20 сек. (3) Затем в дело вступает Taq полимераза. Ее температурный оптимум +750 С. 1. Интересующий участок ДНК 2. ДНК денатурирована 3. Праймеры присоединены к каждой цепи 4. За праймером на каждой цепи синтезируется новая цепь ДНК 5. В следующем цикле происходит денатурация вновь образованных молекул ДНК. Затем присоединяются праймеры, и количество цепей ДНК опять удваивается.

PCR-SSCP анализ генов нормального и серповидно-клеточного -глобина
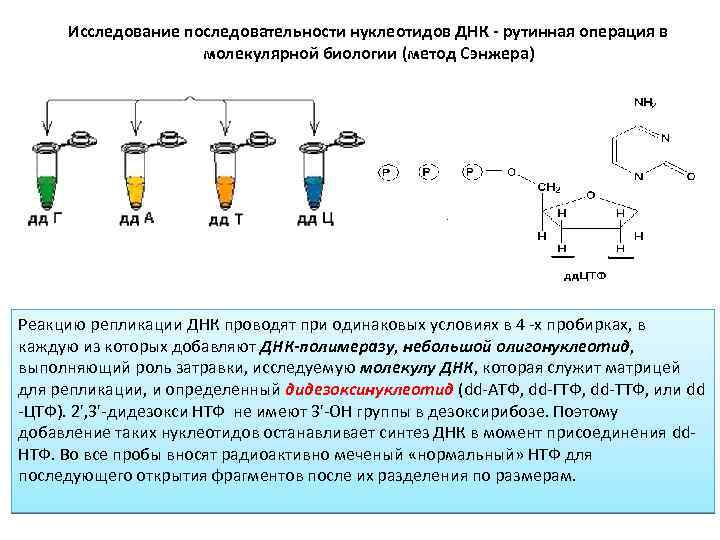
Исследование последовательности нуклеотидов ДНК - рутинная операция в молекулярной биологии (метод Сэнжера) Реакцию репликации ДНК проводят при одинаковых условиях в 4 -х пробирках, в каждую из которых добавляют ДНК-полимеразу, небольшой олигонуклеотид, выполняющий роль затравки, исследуемую молекулу ДНК, которая служит матрицей для репликации, и определенный дидезоксинуклеотид (dd-АТФ, dd-ГТФ, dd-ТТФ, или dd -ЦТФ). 2', 3'-дидезокси НТФ не имеют 3'-ОН группы в дезоксирибозе. Поэтому добавление таких нуклеотидов останавливает синтез ДНК в момент присоединения dd. НТФ. Во все пробы вносят радиоактивно меченый «нормальный» НТФ для последующего открытия фрагментов после их разделения по размерам.
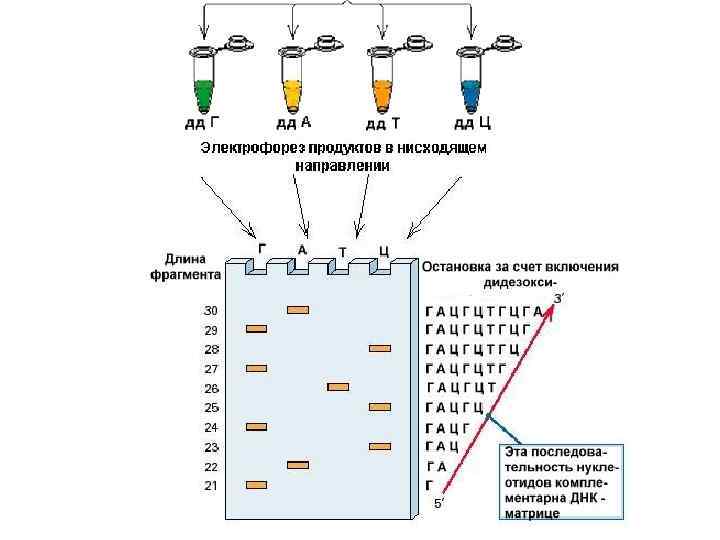

Клонирование - способ получения больших количеств идентичных молекул нуклеиновых кислот или их фрагментов, клеток и организмов – потомков одного предка Клонирование отдельных генов (применение) Ø Клонирование бактеральных и вирусных генов – создание вакцин Ø Клонирование генов человека – 1. Получение лекарственных препаратов белковой природы. Уже получены: эритропоэтин, инсулин, соматотропин, интерфероны, VIII фактор свертывания крови, тканевый активатор плазминогена, факторы роста 2. Генная терапия

Вектор – носитель, в который встраивается чужеродная ДНК с целью клонирования Известны несколько основных классов векторов, позволяющих встраивать исследуемый нуклеотидный фрагмент в геном клетки хозяина. К ним относятся плазмиды, ламбда бактериофаги, хромосомы дрожжей или бактерий. Выбор определяется размерами переносимого фрагмента. Плазмиды могут переносить фрагменты менее 10000 пар оснований, бактериофаги –до 25000. Для переноса более крупных фрагментов используют векторы - химеры (плазмида-ламбда вектор), называемые космидами. Еще более крупные фрагменты, необходимые для работы с геномом человека, переносят с использованием хромосомы дрожжей.
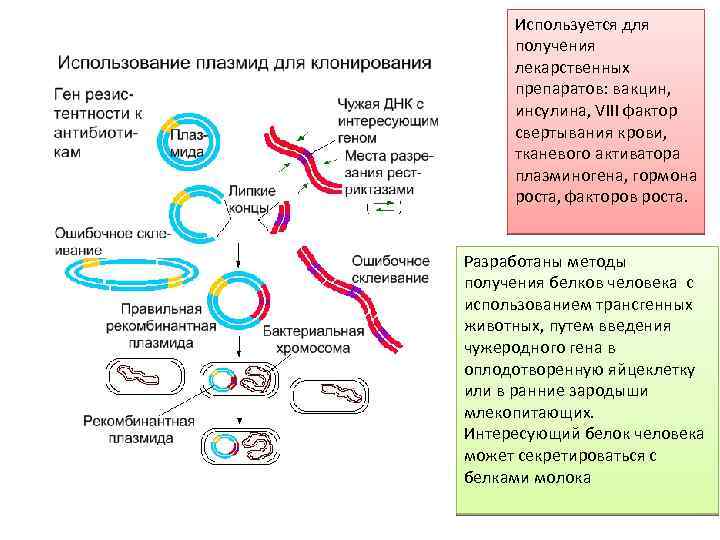
Используется для получения лекарственных препаратов: вакцин, инсулина, VIII фактор свертывания крови, тканевого активатора плазминогена, гормона роста, факторов роста. Разработаны методы получения белков человека с использованием трансгенных животных, путем введения чужеродного гена в оплодотворенную яйцеклетку или в ранние зародыши млекопитающих. Интересующий белок человека может секретироваться с белками молока

Генная терапия q. Лечение наследственных и инфекционных заболеваний путем введения в соматические клетки пациентов генов, которые обеспечивают исправление генных дефектов или придают клеткам новые функции. q. Первый клинический опыт в 1990 г. В г. Бетесда (США) на 4 -хлетней девочке, страдавшей наследственным иммунодефицитом, вызванным мутацией в гене аденозиндезаминазы. q. Две задачи для успешного результата: • обеспечить эффективную доставку чужеродного гена в клетки-мишени • создать условия длительной экспрессии гена в этих клетках q. В геном пациента чужеродная ДНК может вводиться либо в культуре клеток (ex vivo), либо непосредственно в организм больного (in vivo) q. Современный уровень знаний не позволяет проводить коррекцию генных дефектов на уровне половых клеток и клеток ранних доимплантационных зародышей человека в связи с опасностью засорения генофонда

Клинические испытания генотерапевтических препаратов. • Зарегистрировано 636 клинических протоколов генной терапии • 3496 пациента имеют в своем организме генетически модифицированные клетки

Клинические испытания генотерапевтических препаратов. • 63, 4 % протоколов и 68, 4 % пациентов - генная терапия злокачественных новообразований (цитокины и суицидные гены) • 12, 3 % и 8, 8% - генная терапия моногенных наследственных болезней • 6, 4% и 11, 7% - генная терапия инфекционных заболеваний •
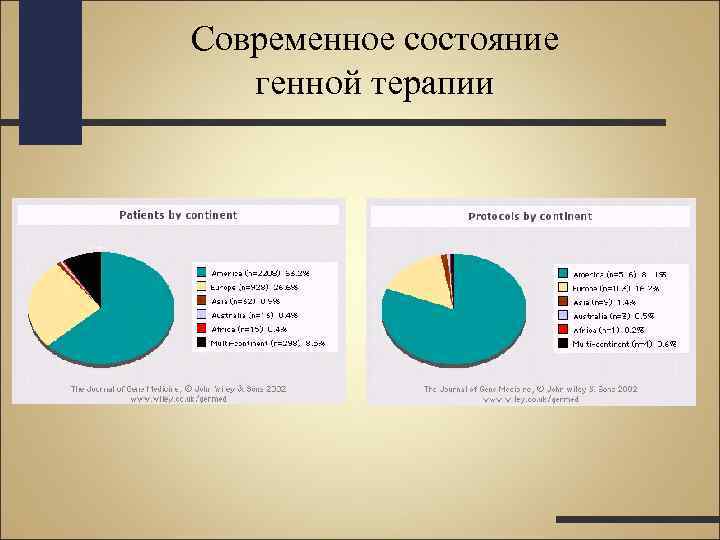
Современное состояние генной терапии

III фаза клинических испытаний Генная терапия глиобластомы головного мозга. После резекции в ложе опухоли вносятся мышиные клетки РА 317, продуцирующие ретровирусный вектор, экспрессирующий ген тимидинкиназы вируса простого герпеса. Через неделю больным вводится препарат ганцикловир, который после фосфорилирования in situ обрывает синтез ДНК в быстроделящихся клетках. Genetic Therapy, Inc. /Novartis

III фаза клинических испытаний Генная терапия остеосаркомы (ESCCHN) (2 протокола) Частота встречаемости - 40 000 случаев в год (США) Предпосылки - более 50% пациентов, имеют повышенный уровень экспрессии мутантной формы р53 Генотерапевтический агент - фактор супрессии опухоли (к. ДНК р53) Вектор – аденовирус тип 5 Способ введения - прямая инъекция в опухоль Увеличение выживаемости в 2 раза

Новые подходы к коррекции генных дефектов: • Химеропластика (коррекция ДНК в клетке) Химеропласты - ДНК/РНК гибриды (около 25 нуклеотидов) шпилечной структуры с комплементарными мишени плечами. В гибрид вводится нужная нуклеотидная замена. В ядре клетки происходит гомологичная рекомбинация с исправлением дефекта последовательности. Успешная конверсия в 25 -40% клеток.

Новые подходы к коррекции генных дефектов: • «Exon-skipping» метод (метод выбрасывания экзона) Введение в клетку коротких антисмысловых последовательностей РНК, комплементарных местам сплайсинга первичного РНКтранскрипта. Проскальзывание петли сплайсинга, захват и выбрасывание из м. РНК экзона, несущего мутацию.

Выводы: Генная терапия пригодна для лечения широкого спектра заболеваний. Генная терапия имеет низкий уровень риска осложнений. Эффективность генной терапии на сегодняшний день близка к нулю.
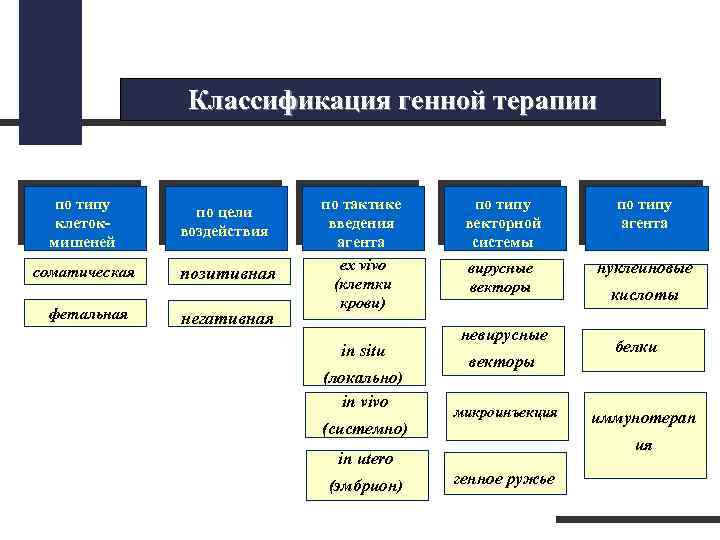
Классификация генной терапии по типу клетокмишеней по цели воздействия соматическая позитивная фетальная негативная по тактике введения агента ex vivo (клетки крови) in situ (локально) in vivo (системно) по типу векторной системы по типу агента вирусные векторы нуклеиновые невирусные векторы микроинъекция белки иммунотерап ия in utero (эмбрион) кислоты генное ружье
Обмен белков5.ppt