Москаленко.ppt
- Количество слайдов: 29

Портфоліо “Будова речовини” Підготуала Учениця 7 -м класу Черкаської спеціалізованої Школи І-ІІІ ступенів № 17 Москаленко Світлана

Атом А том (від грец. άτομοσ — неподільний) — найменша частинка хімічного елемента, яка зберігає всі його хімічні властивості. Атом складається з щільного ядра з позитивно заряджених протонів та електрично нейтральних нейтронів, яке оточене набагато більшою хмарою негативно заряджених електронів.

Розміри атома

Порівняння розмірів тіл
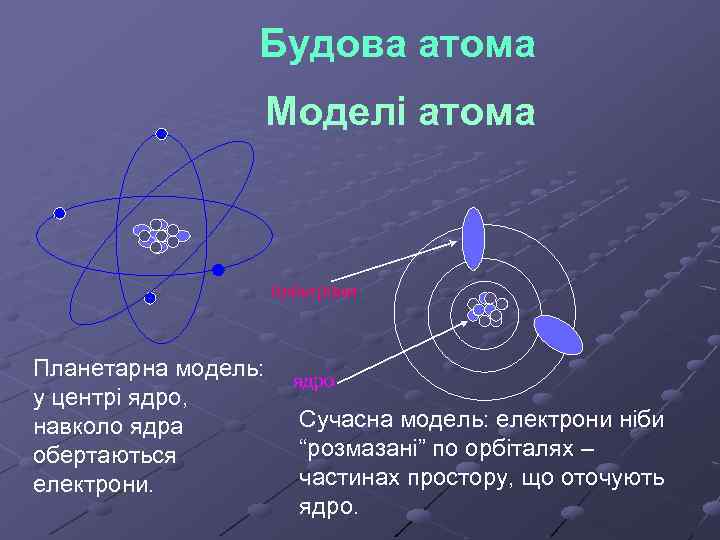
Будова атома Моделі атома електрони Планетарна модель: у центрі ядро, навколо ядра обертаються електрони. ядро Сучасна модель: електрони ніби “розмазані” по орбіталях – частинах простору, що оточують ядро.

Молекула Моле кула (новолат. molecula, зменшувально від лат. moles — маса) — здатна до самостійного існування частинка простої або складної речовини, що має її основні хімічні властивості, які визначаються її складом та будовою.

Молекула складається з атомів, а якщо точніше, то з атомних ядер, оточених певним числом внутрішніх електронів, та зовнішніх валентних електронів, які утворюють хімічні зв'язки. Внутрішні електрони атомів, зазвичай, не беруть участі в утворенні хімічних зв'язків. Склад та будова молекул речовини не залежать від способу її отримання. У випадку одноатомних молекул (наприклад, інертних газів) поняття молекули й атома збігаються.

Атоми об'єднуються в молекулі в більшості випадків за допомогою хімічних зв'язків. Як правило, такий зв'язок утворюється однією, двома або трьома парами електронів, які перебувають у спільному володінні двох атомів. Молекула може мати позитивно та негативно заряджені атоми (йони). Склад молекули передається хімічними формулами. Емпірична формула встановлюється на основі атомного співвідношення елементів речовини та молекулярної маси.
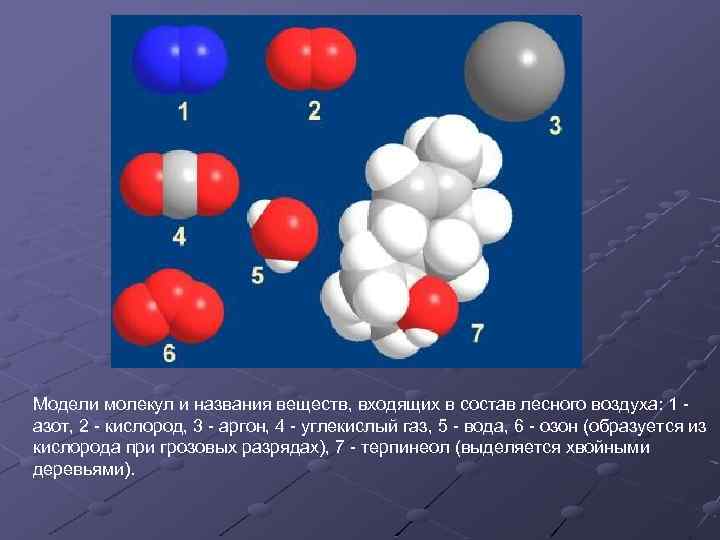
Модели молекул и названия веществ, входящих в состав лесного воздуха: 1 азот, 2 - кислород, 3 - аргон, 4 - углекислый газ, 5 - вода, 6 - озон (образуется из кислорода при грозовых разрядах), 7 - терпинеол (выделяется хвойными деревьями).

Броунівський Рух Броунівський рух — невпорядкований, хаотичний рух дрібних частинок речовини в розчинах. Названий на честь ботаніка Роберта Брауна, який спостерігав це явище під мікроскопом у 1827 р. . Теорію броунівського руху побудував у 1905 р. Альберт Ейнштейн. Відкриття й пояснення броунівського руху мало велике значення для фізики, оскільки було свідченням теплового руху молекул. Браун 1827 року відкрив хаотичний рух спор плауна у воді. Рух завислих частинок відбувався внаслідок руху молекул. Таким же чином рухаються частинки фарби у воді, пилинки в променях світла тощо. Молекули рідини зіштовхуються з завислими у ній частинками, а отже передають їм імпульс.

Броунівський Рух
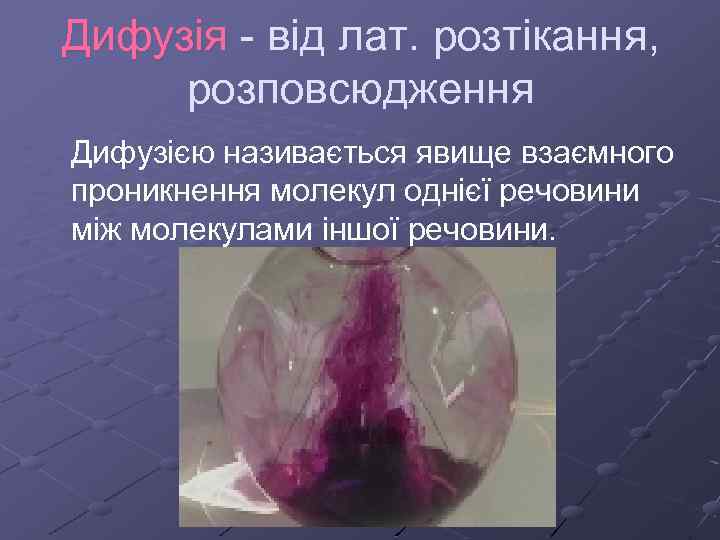
Дифузія - від лат. розтікання, розповсюдження Дифузією називається явище взаємного проникнення молекул однієї речовини між молекулами іншої речовини.
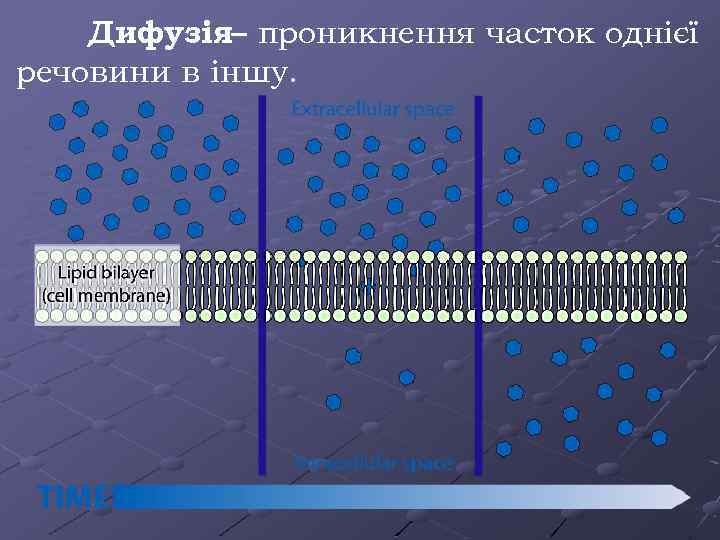
Дифузія– проникнення часток однієї речовини в іншу.


Агрегатний стан — термодинамічний стан речовини, сильно відмінний за своїми фізичними властивостями від інших станів цієї ж речовини. Переходи між агрегатними станами однієї і тої ж речовини супроводжуються стрибкоподібними змінами вільної енергії, ентропії, густини і інших фізичних властивостей. Як правило, серед агрегатних станів виділяють тверде тіло, рідину, газ та плазму. Відрізняються вони, в першу чергу, характером руху молекул та порядком симетрії.

Газ Газоподібний стан характерний тим, що не зберігає ні форму, ні об'єм. Він заповнює весь доступний об'єм і проникає в будь-які його закутки. Це стан, властивий речовинам із малою густиною. Більшість речовин переходять у газоподібний стан з рідкого або твердого при підвищенні температури. Перехід із рідкого в газоподібний стан називають випаровуванням, а протилежний йому перехід із газоподібного стану в рідкий — конденсацією. Перехід із твердого стану в газоподібний, минаючи рідкий, називають сублімацією. Деякі речовини не мають газоподібного стану. Це речовини зі складною хімічною будовою, які при підвищенні температури розпадаються внаслідок хімічних реакцій раніше, ніж стають газом.

Рідина В рідкому стані речовина зберігає об'єм, але не тримає форму. Це означає, що рідина може займати тільки частину об'єму посудини, але вільно перетікати й проникати, перетікати, у всі її закутки. Рідина, на відміну від газу має добре визначену поверхню. Для більшості речовин рідина — проміжний стан між газом і твердим тілом. Речовина переходить у рідкий стан із твердого в результаті процесу, який називається плавленням.

Твердий В твердому стані речовина зберігає як форму, так і об'єм. При низьких температурах майже всі речовини замерзають - перетворюються в тверді тіла. У твердому стані речовини можуть мати багато фаз, які відрізняються упорядкуванням атомів або іншими характеристиками, такими як упорядкування спінів у феромагнетиках.

За типом упорядкування атомів розрізняють кристалічні і аморфні тверді тіла. Кристали характеризуються наявністю просторової періодичності в розміщенні рівноважних положень коливань атомів, тобто наявністю кристалічної гратки. Атоми аморфних твердих тіл коливаються поблизу невпорядковано розміщених точок.
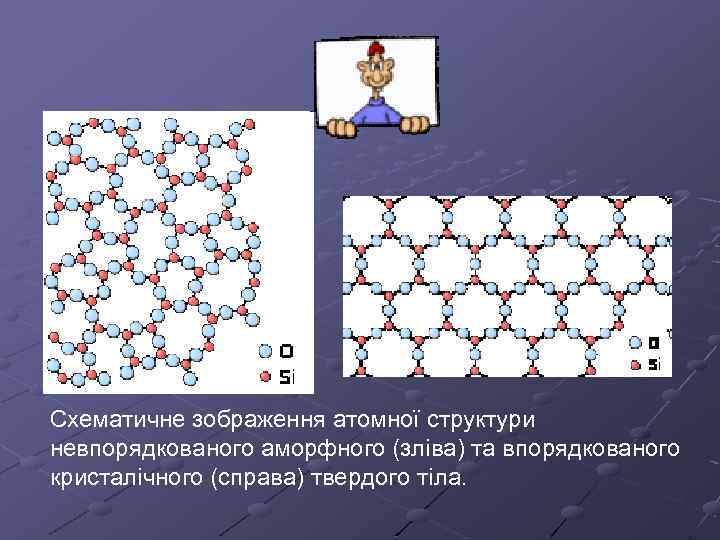
Схематичне зображення атомної структури невпорядкованого аморфного (зліва) та впорядкованого кристалічного (справа) твердого тіла.

Плазма (грец. πλάσμα, «зображення, вигадка» ) — у фізиці та хімії іонізований, електрично квазінейтральний стан речовини. Плазма вважається четвертим (після твердого, рідкого і газоподібного) агрегатним станом речовини. Слово «іонізований» означає, що від значної частини атомів або молекул відокремлений принаймні один електрон

Блискавка є прикладом природної плазми. Зазвичай, блискавка досягає проходження заряду у 30, 000 ампер і потенціалу до 100 мільйонів вольт. Блискавки випромінюють світло, радіохвилі, рентгенівські та гама-промені

Теплове розширення Теплове розши рення — властивість речовин змінювати свій об'єм при зміні температури. Ця властивість характерна для всіх речовин. Коли речовина нагрівається, її частинки починають інтенсивніше рухатися, що приводить до збільшення середніх відстаней між ними. Більшість тіл збільшують свій об'єм в результаті зростання температури, однак відомо декілька винятків. Найбільш відомими прикладами відхилення від правила є вода, яка в діапазоні від 0 °C до 4 °C зменшує свій об'єм при зростанні температури або чистий кремній при температурах між -255 і -153 °C.

Галузь метрології, що вивчає властивості та методи вимірювання теплового розширення має назву дилатометрія, а прилад для визначення параметрів теплового розширення дилатометр.

Теплове розширення

Інвар — матеріал з низьким коефіцієнтом теплового лінійного розширення (α = 10 -6 град-1), лінійні розміри виробу виготовленого з інвару майже не змінюються при зміні температури до 100 °С. Застосовується для виготовлення точних вимірювальних приладів, мір довжини, регуляторів температури, у виробництві електровакуумних приладів, годинників та інших приладів точної механіки.

Інвар винайшов у 1896 році швейцарський фізик, лауреат Нобелівської премії з фізики 1920 Гільйом Шарль Едуард (фр. Charles Édouard Guillaume). Нобелівська премія була присуджена Ш. Ґійому за вклад, який він вніс у точність вимірювань у фізиці завдяки відкриттю аномалій у сплавах нікелю і сталі. Ш. Ґійом відкрив і дослідив сплави з аномальною поведінкою коефіцієнту теплового розширення — інвар

Посилання на відео http: //www. youtube. com/watch? v= 6 wn. Oa. TNlxyk&feature=related http: //www. youtube. com/watch? v= OCInhp 3 w. Hd. I&NR=1 http: //www. youtube. com/watch? v= NP 9 x 3 Tiu 3 RE http: //www. youtube. com/watch? N R=1&v=TAO 81 im. Qs. T 8 http: //www. youtube. com/watch? v= HU-e. LOQUp. O 8&feature=related

Дякую за увагу
Москаленко.ppt