геохимия_2.ppt
- Количество слайдов: 38

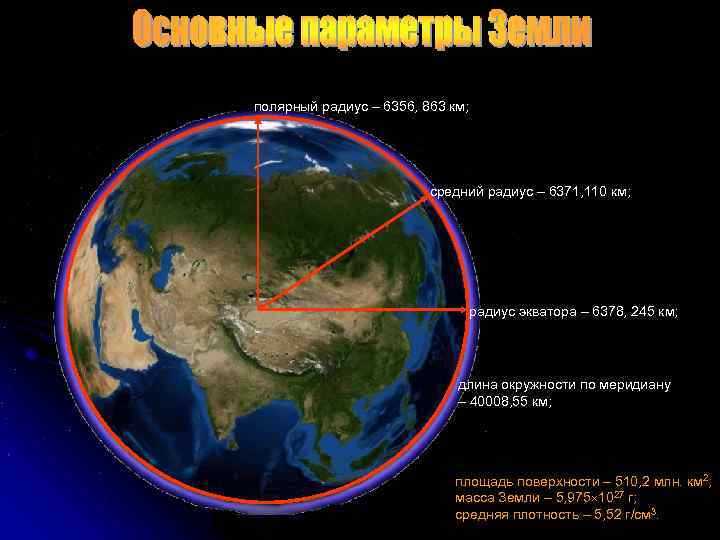 полярный радиус – 6356, 863 км; средний радиус – 6371, 110 км; радиус экватора – 6378, 245 км; длина окружности по меридиану – 40008, 55 км; площадь поверхности – 510, 2 млн. км 2; масса Земли – 5, 975 1027 г; средняя плотность – 5, 52 г/см 3.
полярный радиус – 6356, 863 км; средний радиус – 6371, 110 км; радиус экватора – 6378, 245 км; длина окружности по меридиану – 40008, 55 км; площадь поверхности – 510, 2 млн. км 2; масса Земли – 5, 975 1027 г; средняя плотность – 5, 52 г/см 3.
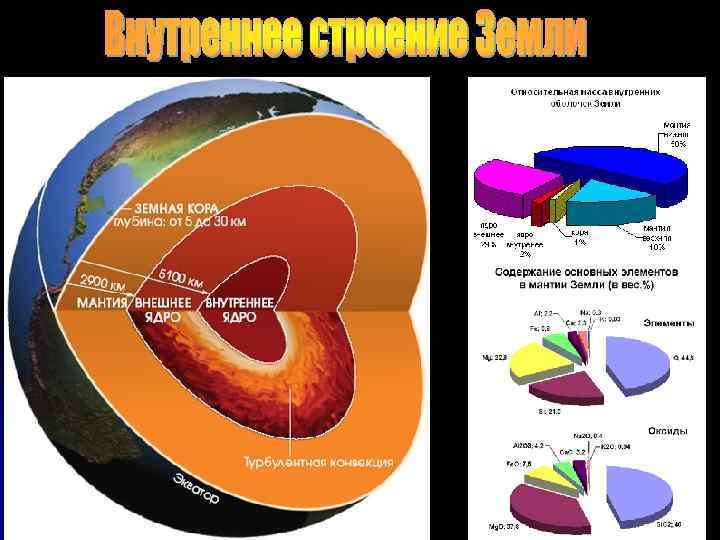
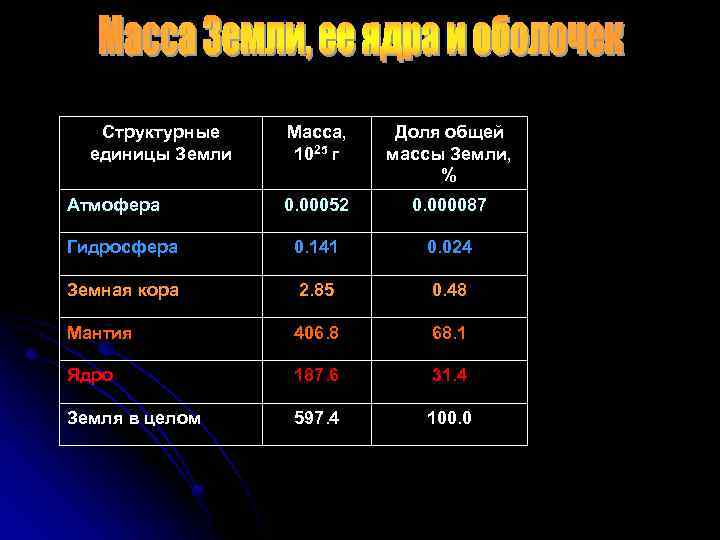 Структурные единицы Земли Масса, 1025 г Доля общей массы Земли, % 0. 00052 0. 000087 Гидросфера 0. 141 0. 024 Земная кора 2. 85 0. 48 Мантия 406. 8 68. 1 Ядро 187. 6 31. 4 Земля в целом 597. 4 100. 0 Атмофера
Структурные единицы Земли Масса, 1025 г Доля общей массы Земли, % 0. 00052 0. 000087 Гидросфера 0. 141 0. 024 Земная кора 2. 85 0. 48 Мантия 406. 8 68. 1 Ядро 187. 6 31. 4 Земля в целом 597. 4 100. 0 Атмофера
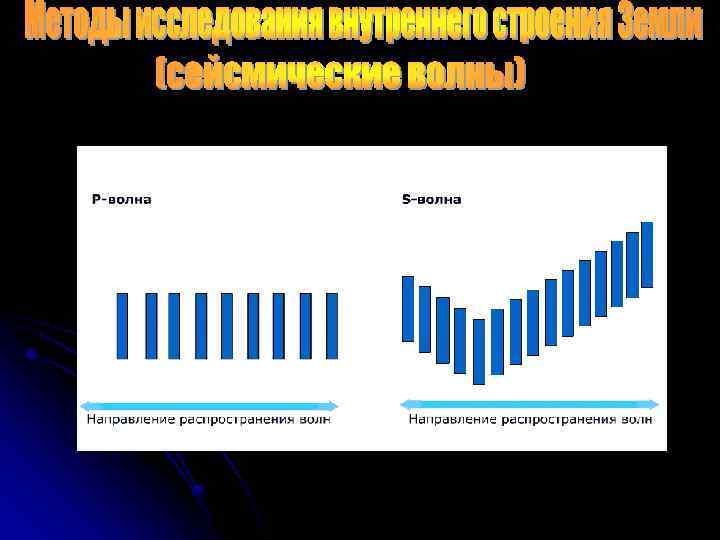
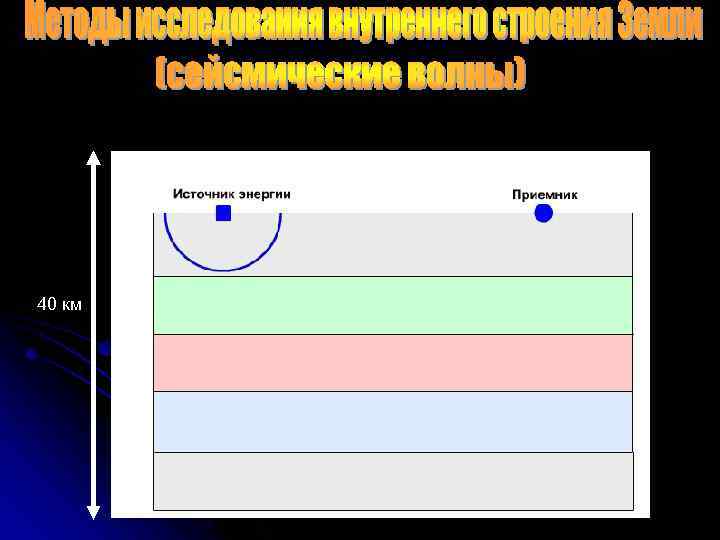 40 км
40 км
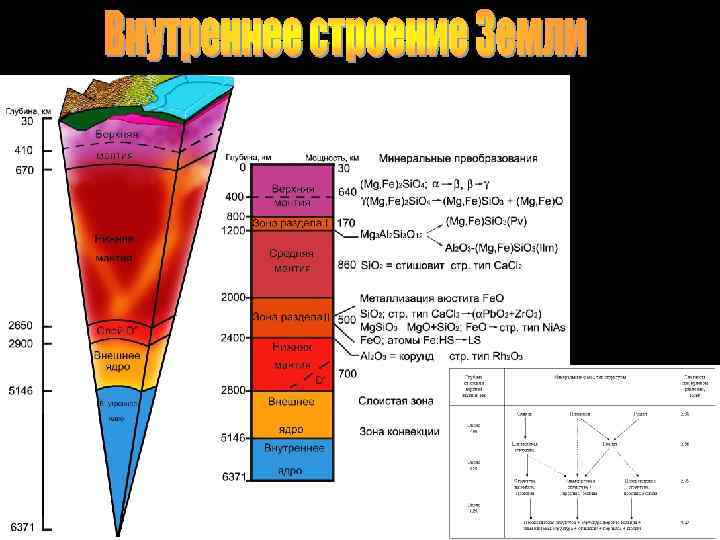
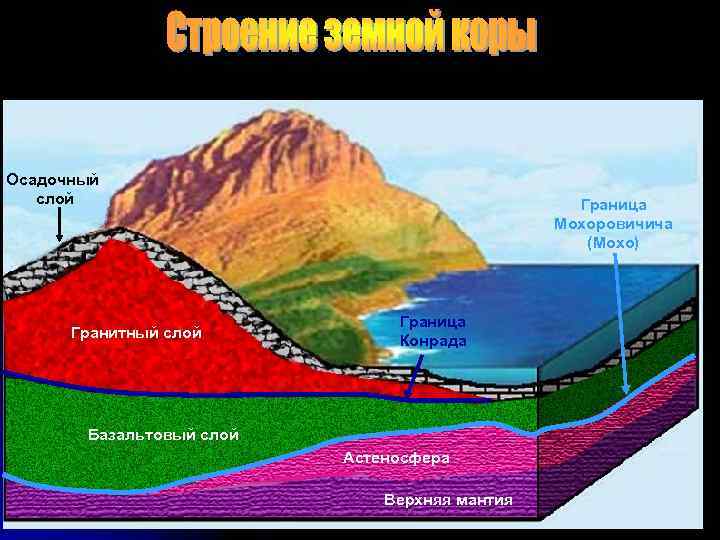 Осадочный слой Гранитный слой Граница Мохоровичича (Мохо) Граница Конрада Базальтовый слой Астеносфера Верхняя мантия
Осадочный слой Гранитный слой Граница Мохоровичича (Мохо) Граница Конрада Базальтовый слой Астеносфера Верхняя мантия
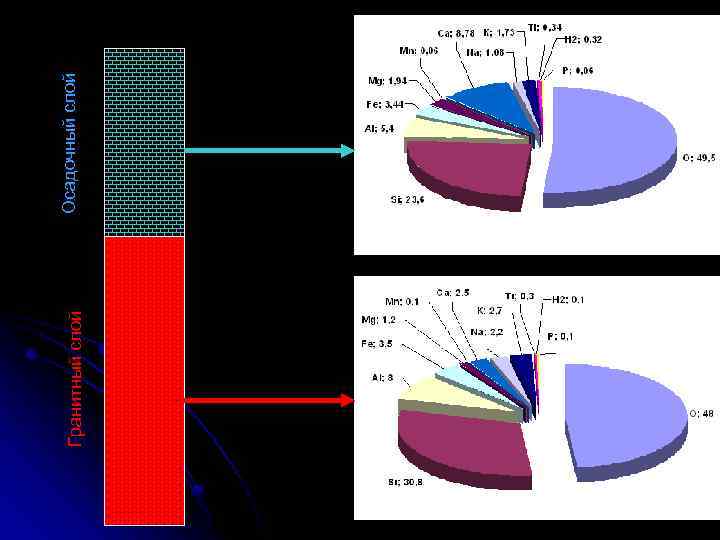 Гранитный слой Осадочный слой
Гранитный слой Осадочный слой
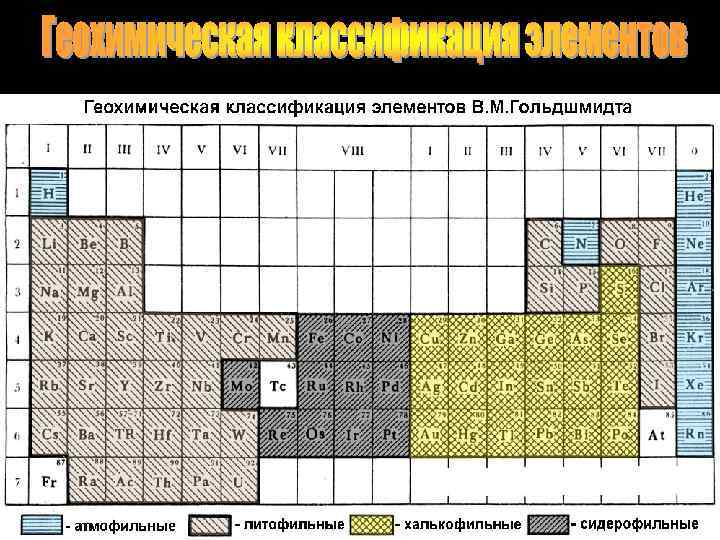
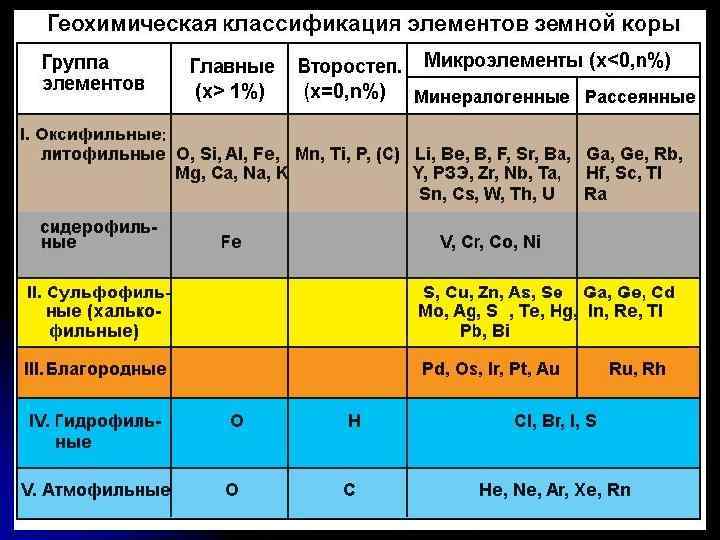
 8 простых веществ, составляющих земную атмосферу, относятся к атмофильным элементам (водород, азот, кислород и бгородные газы). Их атомы или ионы содержат на внешней оболочке 2 или 8 электронов 54 элемента относятся к литофильными, дословно «камнелюбивые» . Они составляют основу большинства горных пород и легко образуют кислородсодержащие минералы. Они имеют характерный общий признак: на внешней электронной оболочке их ионов содержится 8 электронов. Около 95% земной коры состоит из соединений литофильных элементов. К ним относятся щелочные и щелочноземельные металлы, галогены, алюминий, кремний, углерод, титан, редкоземельные элементы, торий, уран и др. Группа халькофильных элементов - «меднолюбивых» . Их 19, свое название они получили в связи с определенными свойствами меди, на которую они похожи по геохимии. Эти элементы проявляют склонность образовывать природные соединения с серой и ее аналогами по группе -селеном и теллуром. На внешней оболочке катионов халькофильных элементов содержится -18 электронов. К халькофилам принадлежат такие элементы, как медь, серебро, золото, -цинк, ртуть, германий, свинец, сера. Сидерофильных (или «железолюбивых» ) элементов 11. Многие из них встречаются в самородном состоянии. Это элементы VIII группы: семейство железа и семейство платиновых металлов, а также молибден и рений. На внешней оболочке их ионов содержится от 9 до 17 электронов.
8 простых веществ, составляющих земную атмосферу, относятся к атмофильным элементам (водород, азот, кислород и бгородные газы). Их атомы или ионы содержат на внешней оболочке 2 или 8 электронов 54 элемента относятся к литофильными, дословно «камнелюбивые» . Они составляют основу большинства горных пород и легко образуют кислородсодержащие минералы. Они имеют характерный общий признак: на внешней электронной оболочке их ионов содержится 8 электронов. Около 95% земной коры состоит из соединений литофильных элементов. К ним относятся щелочные и щелочноземельные металлы, галогены, алюминий, кремний, углерод, титан, редкоземельные элементы, торий, уран и др. Группа халькофильных элементов - «меднолюбивых» . Их 19, свое название они получили в связи с определенными свойствами меди, на которую они похожи по геохимии. Эти элементы проявляют склонность образовывать природные соединения с серой и ее аналогами по группе -селеном и теллуром. На внешней оболочке катионов халькофильных элементов содержится -18 электронов. К халькофилам принадлежат такие элементы, как медь, серебро, золото, -цинк, ртуть, германий, свинец, сера. Сидерофильных (или «железолюбивых» ) элементов 11. Многие из них встречаются в самородном состоянии. Это элементы VIII группы: семейство железа и семейство платиновых металлов, а также молибден и рений. На внешней оболочке их ионов содержится от 9 до 17 электронов.
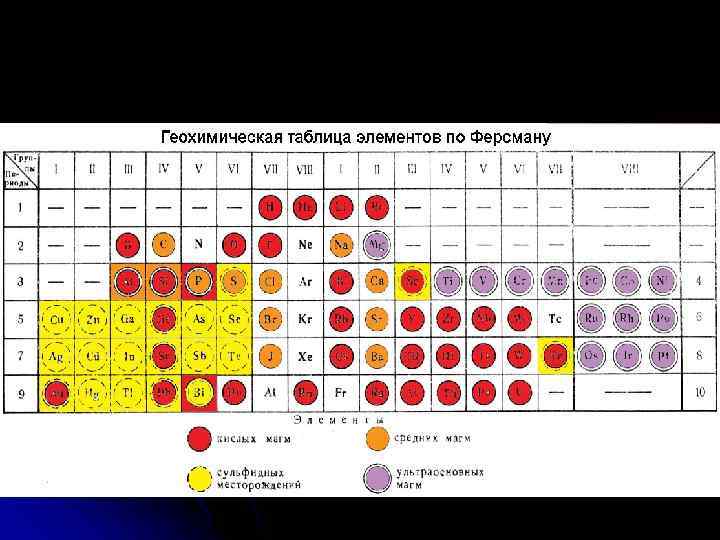
 Геохимическая классификация химических элементов А. Н. Заварицкого
Геохимическая классификация химических элементов А. Н. Заварицкого
 Кларки элементов - числовые оценки средних содержаний химических элементов в земной коре, гидросфере, атмосфере, Земле в целом, различных типах горных пород, космических объектах и др. Кларк может быть выражен в единицах массы (%, г/т и др. ) либо в атомных %. Термин «кларк» введен А. Е. Ферсманом и назван по имени Ф. У. Кларка. Кларк концентрации – это отношение содержания элемента в данной системе (горной породе, руде, минерале, почве, растении) к его кларку в земной коре: КК = Сi / К > 1 Эта величина всегда больше 0. Если КК = 1, то содержание элемента в объекте равно его содержанию в литосфере. Если КК элемента меньше 1, то для большей контрастности показателя целесообразно рассчитывать обратную величину – кларк рассеяния (КР) – отношение кларка элемента в литосфере к его содержанию в данной системе: КР = К / Сi > 1 Таким образом, кларки концентрации и кларки рассеяния – показатели, характеризующие относительную распространенность химических элементов в природе и позволяющие судить о концентрации или рассеянии химического элемента в исследуемой системе относительно литосферы. При этом КК показывает, во сколько раз содержание элемента в природном объекте больше его кларка, а КР – во сколько раз кларк больше содержания в данном объекте.
Кларки элементов - числовые оценки средних содержаний химических элементов в земной коре, гидросфере, атмосфере, Земле в целом, различных типах горных пород, космических объектах и др. Кларк может быть выражен в единицах массы (%, г/т и др. ) либо в атомных %. Термин «кларк» введен А. Е. Ферсманом и назван по имени Ф. У. Кларка. Кларк концентрации – это отношение содержания элемента в данной системе (горной породе, руде, минерале, почве, растении) к его кларку в земной коре: КК = Сi / К > 1 Эта величина всегда больше 0. Если КК = 1, то содержание элемента в объекте равно его содержанию в литосфере. Если КК элемента меньше 1, то для большей контрастности показателя целесообразно рассчитывать обратную величину – кларк рассеяния (КР) – отношение кларка элемента в литосфере к его содержанию в данной системе: КР = К / Сi > 1 Таким образом, кларки концентрации и кларки рассеяния – показатели, характеризующие относительную распространенность химических элементов в природе и позволяющие судить о концентрации или рассеянии химического элемента в исследуемой системе относительно литосферы. При этом КК показывает, во сколько раз содержание элемента в природном объекте больше его кларка, а КР – во сколько раз кларк больше содержания в данном объекте.
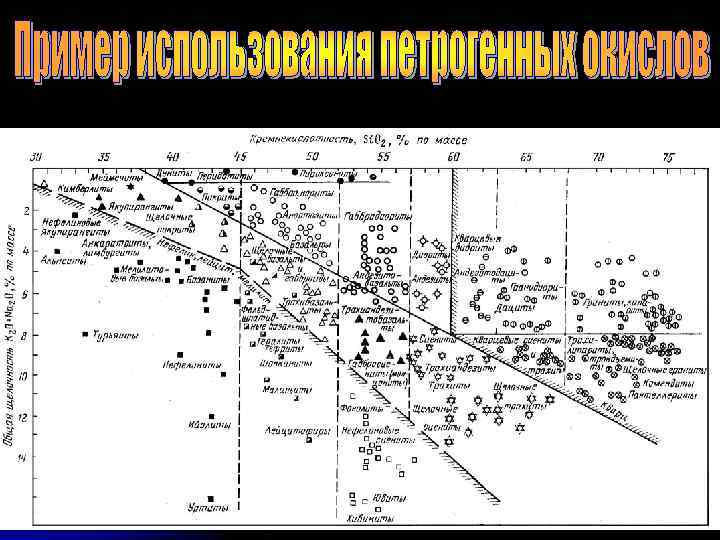
 Для практических целей выделяют четыре главные группы элементов: - главные элементы (петрогенные), - элементы-примеси (редкие и рассеянные элементы), - радиогенные изотопы, - стабильные изотопы. В природе встречаются 98 элементов из периодической таблицы Менделеева. Однако в метеоритах, на Земле и планетах земной группы в подавляющем большинстве случаев породы и минералы на 99% сложены 12 элементами, называемыми петрогенными (петро - порода, ген - происхождение): O, Si, Ti, Al, Mg, Fe, Ca, Na, K, P, H, C, или в окисной форме: Si. O 2, Ti. O 2, A 12 O 3, Fe. O, Mn. O, Mg. O, Ca. O, Na 2 O, K 2 O, Р 2 О 5. Летучие компоненты, такие как Н 2 О, СО 2, S, обычно включают в состав группы главных элементов при анализе пород.
Для практических целей выделяют четыре главные группы элементов: - главные элементы (петрогенные), - элементы-примеси (редкие и рассеянные элементы), - радиогенные изотопы, - стабильные изотопы. В природе встречаются 98 элементов из периодической таблицы Менделеева. Однако в метеоритах, на Земле и планетах земной группы в подавляющем большинстве случаев породы и минералы на 99% сложены 12 элементами, называемыми петрогенными (петро - порода, ген - происхождение): O, Si, Ti, Al, Mg, Fe, Ca, Na, K, P, H, C, или в окисной форме: Si. O 2, Ti. O 2, A 12 O 3, Fe. O, Mn. O, Mg. O, Ca. O, Na 2 O, K 2 O, Р 2 О 5. Летучие компоненты, такие как Н 2 О, СО 2, S, обычно включают в состав группы главных элементов при анализе пород.
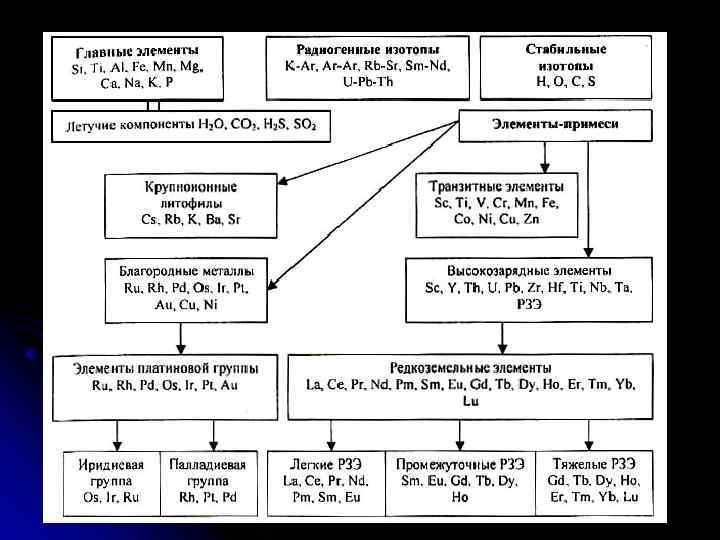
 Элементы-примеси - это элементы, которые присутствуют в количестве < 0, 1 %, и их концентрации выражаются в граммах на тонну (г/т, в англ. варианте ррт), реже в граммах на тысячу тонн (мг/т или ppb). Принципиальная разница между петрогенными и редкими элементами заключается в том, что петрогенные элементы определяют фазовый (минеральный) состав системы, в то время как редкие элементы входят в эти фазы в виде примесей и пассивно распределяются между существующими фазами, но не влияют на их содержание и устойчивость. В свою очередь среди элементов примесей выделяют: - Транзитные элементы, - Крупноионные литофилы, - Высокозарядные элементы, - Редкоземельные элементы (РЗЭ, REE), - Платиноиды (ЭПГ, PGE) или благородные металлы (ЭПГ + Au и Ag)
Элементы-примеси - это элементы, которые присутствуют в количестве < 0, 1 %, и их концентрации выражаются в граммах на тонну (г/т, в англ. варианте ррт), реже в граммах на тысячу тонн (мг/т или ppb). Принципиальная разница между петрогенными и редкими элементами заключается в том, что петрогенные элементы определяют фазовый (минеральный) состав системы, в то время как редкие элементы входят в эти фазы в виде примесей и пассивно распределяются между существующими фазами, но не влияют на их содержание и устойчивость. В свою очередь среди элементов примесей выделяют: - Транзитные элементы, - Крупноионные литофилы, - Высокозарядные элементы, - Редкоземельные элементы (РЗЭ, REE), - Платиноиды (ЭПГ, PGE) или благородные металлы (ЭПГ + Au и Ag)
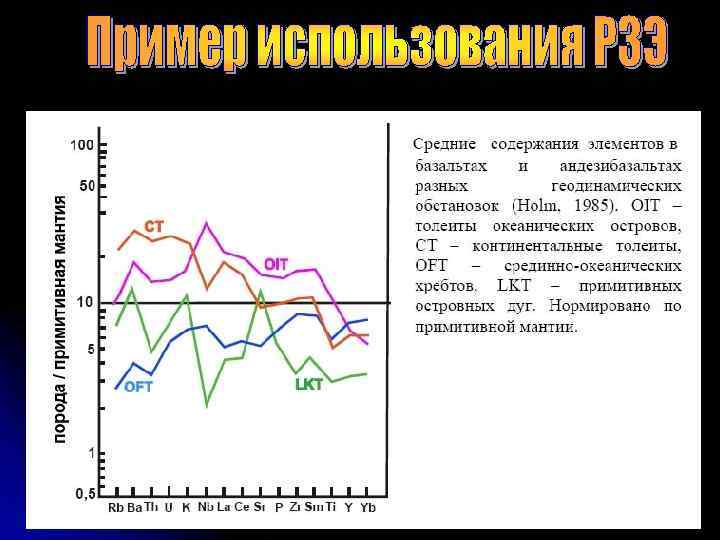
 К крупноионным литофилам относятся Cs, Rb, К, Ва. К ним добавляются также Sr, двухвалентные Eu, Pb. Эти элементы характеризуются большим ионным радиусом, низким зарядом (валентность 1, реже 2) и наибольшей подвижностью в разнообразных геологических процессах. Группа высокозарядных элементов (HFS) наиболее многочисленна и включает такие элементы как Sc, Y, Th, U, Pb, Zr, Hf, Ti, Nb, Та. Высокозарядные элементы являются наименее подвижными при различных наложенных процессах, а их распределение позволяет судить о природе различных магматических пород. Группа редкоземельных элементов La, Се, Рг, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu. РЗЭ являются наиболее важными среди элементов-примесей для изучения геохимических процессов. Обычно элементы этой подгруппы подразделяются на легкие с низким атомным номером (La, Се, Pr, Nd, Pm, Sm, Eu) и тяжелые (Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu). Иногда отдельно рассматривается группа промежуточных РЗЭ (Sm, Eu, Gd, Tb, Dy, Ho). Группа платиноидов Ru, Rh, Pd, Os, Ir, Pt используется для характеристики глубинных процессов (плавление мантии). Часто их группируют по температуре плавления: - Os, Ir, Ru – тугоплавкие; Pt, Pd, Ru - легкоплавкие Группа транзитных элементов включает: Sc, Ti, V, Cr, Mn, Fe» Co, Ni, Cu, Zn, эти элементы являются более подвижными при различных геологических процессах по сравнению с высокозарядными.
К крупноионным литофилам относятся Cs, Rb, К, Ва. К ним добавляются также Sr, двухвалентные Eu, Pb. Эти элементы характеризуются большим ионным радиусом, низким зарядом (валентность 1, реже 2) и наибольшей подвижностью в разнообразных геологических процессах. Группа высокозарядных элементов (HFS) наиболее многочисленна и включает такие элементы как Sc, Y, Th, U, Pb, Zr, Hf, Ti, Nb, Та. Высокозарядные элементы являются наименее подвижными при различных наложенных процессах, а их распределение позволяет судить о природе различных магматических пород. Группа редкоземельных элементов La, Се, Рг, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu. РЗЭ являются наиболее важными среди элементов-примесей для изучения геохимических процессов. Обычно элементы этой подгруппы подразделяются на легкие с низким атомным номером (La, Се, Pr, Nd, Pm, Sm, Eu) и тяжелые (Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu). Иногда отдельно рассматривается группа промежуточных РЗЭ (Sm, Eu, Gd, Tb, Dy, Ho). Группа платиноидов Ru, Rh, Pd, Os, Ir, Pt используется для характеристики глубинных процессов (плавление мантии). Часто их группируют по температуре плавления: - Os, Ir, Ru – тугоплавкие; Pt, Pd, Ru - легкоплавкие Группа транзитных элементов включает: Sc, Ti, V, Cr, Mn, Fe» Co, Ni, Cu, Zn, эти элементы являются более подвижными при различных геологических процессах по сравнению с высокозарядными.

 Минералы – это природные химические соединения или самородные элементы, возникшие в результате разнообразных физико-химических и термодинамических процессов, происходящих в земной коре и на ее поверхности. Минералы в природе находятся преимущественно в твердом cостоянии, реже встречаются жидкие (ртуть, вода), и газообразные (горючие газы, углекислый газ). В настоящее время известно более 4000 минералов (включая разновидности), но лишь очень немногие из них имеют широкое распространение в составе горных пород. Они называются породообразующими.
Минералы – это природные химические соединения или самородные элементы, возникшие в результате разнообразных физико-химических и термодинамических процессов, происходящих в земной коре и на ее поверхности. Минералы в природе находятся преимущественно в твердом cостоянии, реже встречаются жидкие (ртуть, вода), и газообразные (горючие газы, углекислый газ). В настоящее время известно более 4000 минералов (включая разновидности), но лишь очень немногие из них имеют широкое распространение в составе горных пород. Они называются породообразующими.
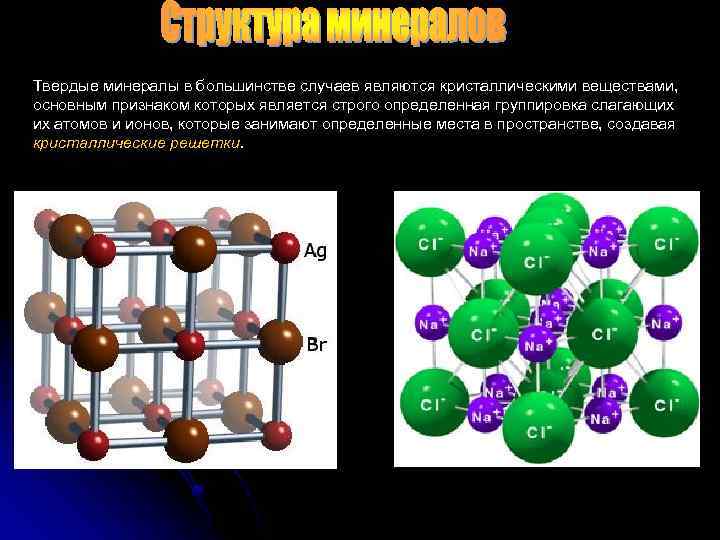 Твердые минералы в большинстве случаев являются кристаллическими веществами, основным признаком которых является строго определенная группировка слагающих их атомов и ионов, которые занимают определенные места в пространстве, создавая кристаллические решетки.
Твердые минералы в большинстве случаев являются кристаллическими веществами, основным признаком которых является строго определенная группировка слагающих их атомов и ионов, которые занимают определенные места в пространстве, создавая кристаллические решетки.
 Кристаллическая решетка геометрически может быть представлена в виде плотно пригнанных друг к другу многогранников (кубов, параллелепипедов, призм, ромбоэдров и т. д. ), в вершинах, центрах или серединах граней которых на строго определенном расстоянии друг от друга располагаются атомы или ионы. Кристаллические структуры очень разнообразны и определенным образом отображаются во внешнем оформлении кристалла. Они зависят от химического состава минерала, т. е. определенным минералам свойственны и определенные кристаллические формы. Различают структуры: атомные, когда в узлах решетки находятся атомы; ионные, когда в узлах располагаются атомы, лишенные части наружных электронов – ионы; радикальные – при расположении в узлах радикалов, т. е групп ионов, например, радикала СО 3 в случае солей угольной кислоты.
Кристаллическая решетка геометрически может быть представлена в виде плотно пригнанных друг к другу многогранников (кубов, параллелепипедов, призм, ромбоэдров и т. д. ), в вершинах, центрах или серединах граней которых на строго определенном расстоянии друг от друга располагаются атомы или ионы. Кристаллические структуры очень разнообразны и определенным образом отображаются во внешнем оформлении кристалла. Они зависят от химического состава минерала, т. е. определенным минералам свойственны и определенные кристаллические формы. Различают структуры: атомные, когда в узлах решетки находятся атомы; ионные, когда в узлах располагаются атомы, лишенные части наружных электронов – ионы; радикальные – при расположении в узлах радикалов, т. е групп ионов, например, радикала СО 3 в случае солей угольной кислоты.


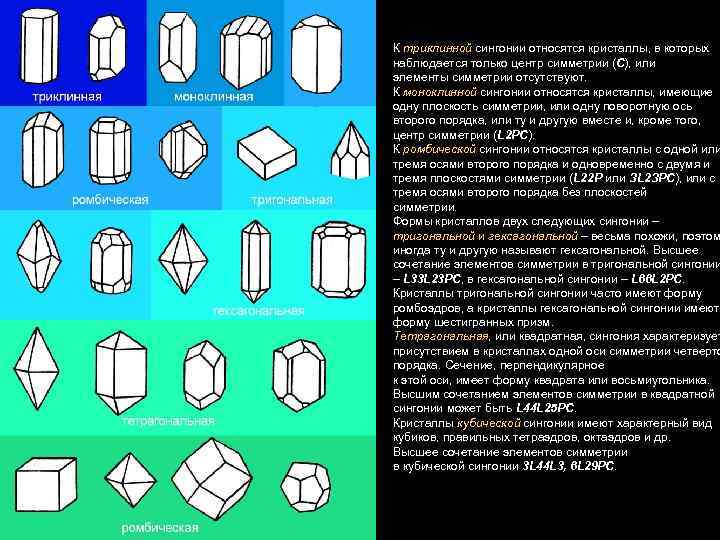 К триклинной сингонии относятся кристаллы, в которых наблюдается только центр симметрии (С), или элементы симметрии отсутствуют. К моноклинной сингонии относятся кристаллы, имеющие одну плоскость симметрии, или одну поворотную ось второго порядка, или ту и другую вместе и, кроме того, центр симметрии (L 2 РС). К ромбической сингонии относятся кристаллы с одной или тремя осями второго порядка и одновременно с двумя и тремя плоскостями симметрии (L 22 Р или ЗL 2 ЗРС), или с тремя осями второго порядка без плоскостей симметрии. Формы кристаллов двух следующих сингонии – тригональной и гексагональной – весьма похожи, поэтом иногда ту и другую называют гексагональной. Высшее сочетание элементов симметрии в тригональной сингонии – L 33 L 23 PC, в гексагональной сингонии – L 66 L 2 PC. Кристаллы тригональной сингонии часто имеют форму ромбоэдров, а кристаллы гексагональной сингонии имеют форму шестигранных призм. Тетрагональная, или квадратная, сингония характеризует присутствием в кристаллах одной оси симметрии четверто порядка. Сечение, перпендикулярное к этой оси, имеет форму квадрата или восьмиугольника. Высшим сочетанием элементов симметрии в квадратной сингонии может быть L 44 L 25 PC. Кристаллы кубической сингонии имеют характерный вид кубиков, правильных тетраэдров, октаэдров и др. Высшее сочетание элементов симметрии в кубической сингонии 3 L 44 L 3, 6 L 29 PC.
К триклинной сингонии относятся кристаллы, в которых наблюдается только центр симметрии (С), или элементы симметрии отсутствуют. К моноклинной сингонии относятся кристаллы, имеющие одну плоскость симметрии, или одну поворотную ось второго порядка, или ту и другую вместе и, кроме того, центр симметрии (L 2 РС). К ромбической сингонии относятся кристаллы с одной или тремя осями второго порядка и одновременно с двумя и тремя плоскостями симметрии (L 22 Р или ЗL 2 ЗРС), или с тремя осями второго порядка без плоскостей симметрии. Формы кристаллов двух следующих сингонии – тригональной и гексагональной – весьма похожи, поэтом иногда ту и другую называют гексагональной. Высшее сочетание элементов симметрии в тригональной сингонии – L 33 L 23 PC, в гексагональной сингонии – L 66 L 2 PC. Кристаллы тригональной сингонии часто имеют форму ромбоэдров, а кристаллы гексагональной сингонии имеют форму шестигранных призм. Тетрагональная, или квадратная, сингония характеризует присутствием в кристаллах одной оси симметрии четверто порядка. Сечение, перпендикулярное к этой оси, имеет форму квадрата или восьмиугольника. Высшим сочетанием элементов симметрии в квадратной сингонии может быть L 44 L 25 PC. Кристаллы кубической сингонии имеют характерный вид кубиков, правильных тетраэдров, октаэдров и др. Высшее сочетание элементов симметрии в кубической сингонии 3 L 44 L 3, 6 L 29 PC.
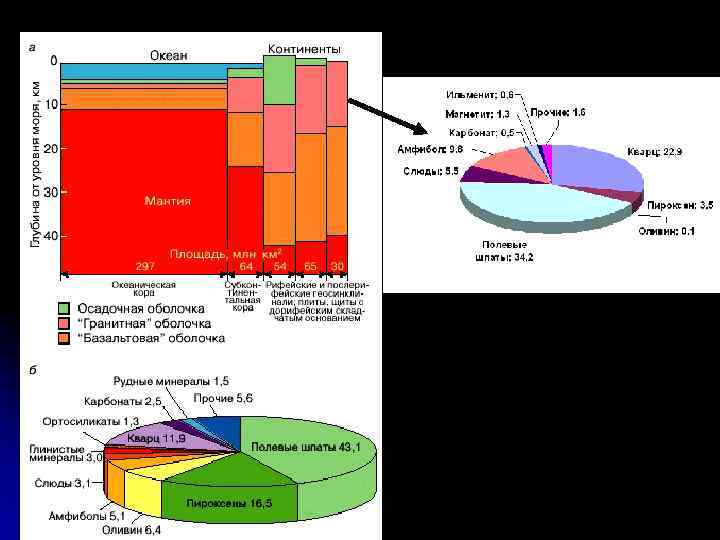
 Самородные, сплавы, интерметаллиды 95 Сульфиды, селениды, теллуриды 285 Сульфосоли 254 Арсениды, антимониды, висмутиды 70 Оксиды 272 Гидроксиды 200 Силикаты 1135 Бораты 140 Карбонаты 206 Сульфаты 297 Фосфаты 408 Арсениты, арсенаты 265 Ванадаты 86 Молибдаты 26 Вольфраматы 13 Хроматы 12 Нитраты 17 Селениты, селенаты 22 Теллуриты, теллураты 53 Иодаты 11 Фториды 52 Хлориды 80 Бромиды 7 Иодиды 7 Карбиды 7 Нитриды 10 Фосфиды 7 Силициды 5 Органические соединения 41 Общее число минералов 4083 Количество минералов по классам на 2003 год
Самородные, сплавы, интерметаллиды 95 Сульфиды, селениды, теллуриды 285 Сульфосоли 254 Арсениды, антимониды, висмутиды 70 Оксиды 272 Гидроксиды 200 Силикаты 1135 Бораты 140 Карбонаты 206 Сульфаты 297 Фосфаты 408 Арсениты, арсенаты 265 Ванадаты 86 Молибдаты 26 Вольфраматы 13 Хроматы 12 Нитраты 17 Селениты, селенаты 22 Теллуриты, теллураты 53 Иодаты 11 Фториды 52 Хлориды 80 Бромиды 7 Иодиды 7 Карбиды 7 Нитриды 10 Фосфиды 7 Силициды 5 Органические соединения 41 Общее число минералов 4083 Количество минералов по классам на 2003 год
 Способность некоторых минералов образовывать различные кристаллические формы при одном и том же химическом составе носит название полиморфизма С углерод
Способность некоторых минералов образовывать различные кристаллические формы при одном и том же химическом составе носит название полиморфизма С углерод
 Если в процессе изменения какого-либо вещества допускается замена одних ионов (Mg) ионами другого состава (Fe 2+) без изменения основной формы кристаллической решетки, то это называется изоморфизмом
Если в процессе изменения какого-либо вещества допускается замена одних ионов (Mg) ионами другого состава (Fe 2+) без изменения основной формы кристаллической решетки, то это называется изоморфизмом
 l l l Радиусы ионов и атомов различаются не более чем на 15%; Химическая индифферентность элементов; Одинаковые поляризационные свойства атомов; Ионы одного знака; Сходная природа межатомной связи;
l l l Радиусы ионов и атомов различаются не более чем на 15%; Химическая индифферентность элементов; Одинаковые поляризационные свойства атомов; Ионы одного знака; Сходная природа межатомной связи;
 Одинаковые поляризационные свойства атомов Изоморфизма нет между: - Na+1 (0, 97 А) и Cu+1 (0, 96 А) - Si и P Валентная компенсация Сa 5(PO 4)3(F, Cl, OH) – апатит Сa+2 изоморфно замещается ТR+3 Одновременно F-1 изоморфно замещается O-2 Сa 5(PO 4)3 F ТR 5(PO 4)3 O Сходная природа межатомной связи Na. Cl – галит и Pb. S – галенит У обоих минералов кубические кристаллические решетки Ионные радиусы близки у Na (0, 98 нм) и Pb(1, 3 нм) Cl (1, 81 нм) S (1, 74 нм ), но связь Na. Cl ионная, а Pb. S ковалентная
Одинаковые поляризационные свойства атомов Изоморфизма нет между: - Na+1 (0, 97 А) и Cu+1 (0, 96 А) - Si и P Валентная компенсация Сa 5(PO 4)3(F, Cl, OH) – апатит Сa+2 изоморфно замещается ТR+3 Одновременно F-1 изоморфно замещается O-2 Сa 5(PO 4)3 F ТR 5(PO 4)3 O Сходная природа межатомной связи Na. Cl – галит и Pb. S – галенит У обоих минералов кубические кристаллические решетки Ионные радиусы близки у Na (0, 98 нм) и Pb(1, 3 нм) Cl (1, 81 нм) S (1, 74 нм ), но связь Na. Cl ионная, а Pb. S ковалентная
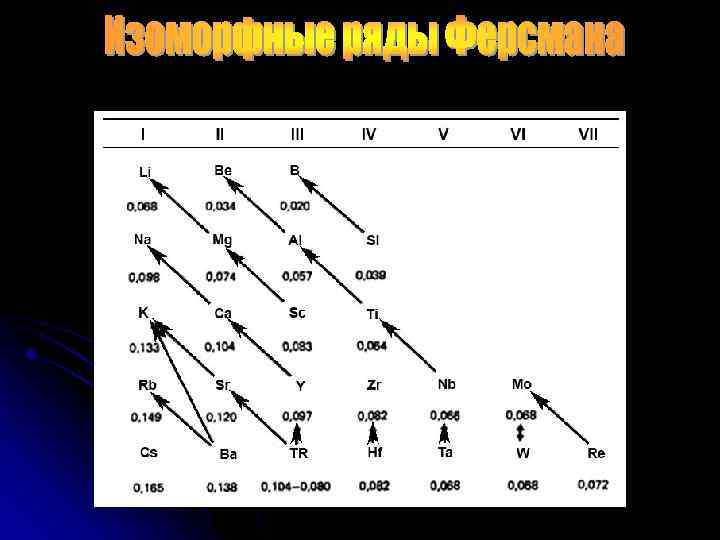
 В этих рядах римские цифры означают замещения химических элементов в минералах: I — коры выветривания, II — метаморфических горных пород, III — массивнокристаллических пород (магматических):
В этих рядах римские цифры означают замещения химических элементов в минералах: I — коры выветривания, II — метаморфических горных пород, III — массивнокристаллических пород (магматических):