 Получение металлов
Получение металлов
 Пирометаллургия • Получение меди из его оксида с помощью восстановителя водорода
Пирометаллургия • Получение меди из его оксида с помощью восстановителя водорода
 Пирометаллургия • Получение меди из его оксида с помощью восстановителя водорода Cu. O + H 2 → Cu + H 2 O
Пирометаллургия • Получение меди из его оксида с помощью восстановителя водорода Cu. O + H 2 → Cu + H 2 O
 Пирометаллургия • Получение свинца из его оксида с помощью восстановителя угля
Пирометаллургия • Получение свинца из его оксида с помощью восстановителя угля
 Пирометаллургия • Получение свинца из его оксида с помощью восстановителя угля Pb. O + C → Pb + CO
Пирометаллургия • Получение свинца из его оксида с помощью восстановителя угля Pb. O + C → Pb + CO
 Пирометаллургия • Получение хрома алюмотермией
Пирометаллургия • Получение хрома алюмотермией
 Пирометаллургия • Получение хрома алюмотермией Cr 2 O 3 + 2 AI → 2 Cr + AI 2 O 3
Пирометаллургия • Получение хрома алюмотермией Cr 2 O 3 + 2 AI → 2 Cr + AI 2 O 3
 2. Гидрометаллургия Например, для получения меди из руды, содержащей оксид меди (II) Cu. O: Сu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. SO 4 + Fe = Fe. SO 4 + Cu Таким же способом получают серебро, цинк, молибден, золото, уран и т. д.
2. Гидрометаллургия Например, для получения меди из руды, содержащей оксид меди (II) Cu. O: Сu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. SO 4 + Fe = Fe. SO 4 + Cu Таким же способом получают серебро, цинк, молибден, золото, уран и т. д.
 3. Электрометаллургия Это способы получения металлов с помощью электрического тока (электролиза).
3. Электрометаллургия Это способы получения металлов с помощью электрического тока (электролиза).
 • «Катод» - отрицательно заряженный электрод, на котором происходит процесс восстановления. • «Анод» - положительно заряженный электрод, на котором происходит процесс восстановления. • «Катионы» - положительно заряженные ионы. • «Анионы» - отрицательно заряженные ионы.
• «Катод» - отрицательно заряженный электрод, на котором происходит процесс восстановления. • «Анод» - положительно заряженный электрод, на котором происходит процесс восстановления. • «Катионы» - положительно заряженные ионы. • «Анионы» - отрицательно заряженные ионы.
 Электролиз раствора хлорида меди (II)
Электролиз раствора хлорида меди (II)
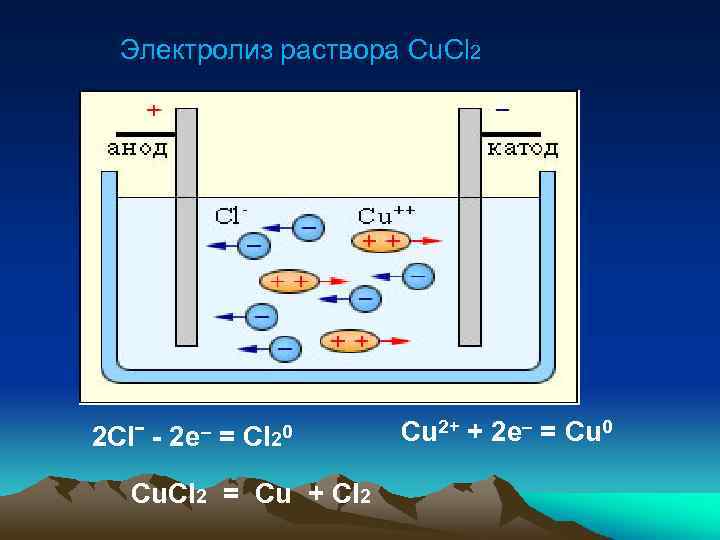 Электролиз раствора Cu. Cl 2 2 Clˉ - 2 e– = Cl 20 Cu. Cl 2 = Cu + Cl 2 Cu 2+ + 2 e– = Cu 0
Электролиз раствора Cu. Cl 2 2 Clˉ - 2 e– = Cl 20 Cu. Cl 2 = Cu + Cl 2 Cu 2+ + 2 e– = Cu 0
 Выводы:
Выводы: