Инсулин.ppt
- Количество слайдов: 21

Получение инсулина 1

Социально – значимое заболевание • Первое описание СД было сделано египтянином Имхотепом в 2980 г. до н. э. Также сохранились древнегреческие папирусы, датируемые 1500 г. до н. э. , в которых говорится о СД как о состоянии, сопровождающемся обильным выделением мочи. В 201 г. н. э. греческий врач Аратеус ввел понятие СД, означающее «сифон» , «расплавление мышечной ткани и кости и выделение с мочой» .

Типы диабета • Нарушение секреции инсулина вследствие деструкции бета-клеток — абсолютная недостаточность инсулина — является ключевым звеном патогенеза сахарного диабета 1 -го типа. Нарушение действия инсулина на ткани — относительная инсулиновая недостаточность — имеет важное место в развитии сахарного диабета 2 -го типа.

Инсулин (от лат. insula — остров) — гормон пептидной природы, образуется в бета-клетках островков Лангерганса поджелудочной железы. Основная функция инсулина – обеспечивать проницаемость клеточных мембран для молекул глюкозы.

История открытия • В 1869 г. ученый Пауль Лангерганс открыл группы клеток в поджелудочной железе, которые впоследствии были названы в его честь «островками Лангерганса» . Из клеток этих островков в последующем был выделен инсулин. • В 1889 г. исследования ученых Оскара Минковски и Вон Меркинга, проведенные на собаках, показали, что при удалении поджелудочной железы у животных развивается СД. Но при введении этим же собакам экстракта из поджелудочной железы симптомы СД исчезали и уровень сахара в крови снижался. • В 1900 г. Л. В. Соболев обнаружил, что после перевязки протоков поджелудочной железы железистая ткань атрофируется, а островки Лангерганса сохраняются. СД при этом не возникает. Соболев предложил использовать железу новорожденных животных, у которых островки хорошо развиты по отношению к пищеварительному аппарату, для выделения вещества, обладающего противодиабетическим действием.

практическое выделение инсулина Лауреаты Нобелевской премии по физиологии и медицине в 1923 году Фредерик Грант Бантинг (знал о работах Соболева и практически реализовал идеи Соболева, но не сослался на них) Джон Джеймс Рикард Маклеод

первичная структура инсулина пространственное строение молекулы инсулина Фредерик Сенгер Дороти Кроуфут-Ходжкин Нобелевская премия по химии (1964) Нобелевская премия 1958 году Большая золотая медаль имени М. В. Ломоносова (1985)

Структура инсулина • Структура инсулина достаточно консервативна. Аминокислотная последовательность инсулина человека и многих животных различается всего на 1 -2 аминокислоты. Он состоит из двух полипептидных цепей, соединенных двумя дисульфидными связями. Полипептидная цепь А содержит 21 аминокислотный остаток, а цепь В- 30 аминокислотных остатков, молекулярная масса инсулина 5, 7 к. Dа.

Химический синтез • В начале 70 -х г. г. советскими учеными А. Юдаевым и С. Швачкиным был предложен химический синтез инсулина, однако осуществление данного синтеза в промышленном масштабе было дорогостоящим и нерентабельны
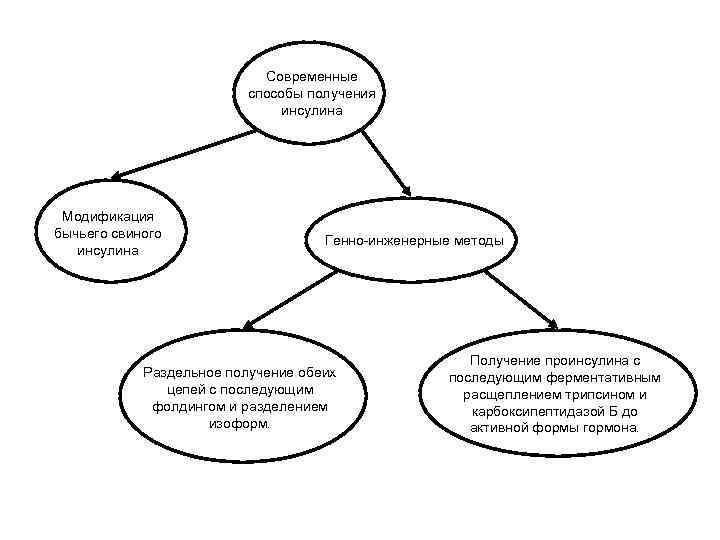
Современные способы получения инсулина Модификация бычьего свиного инсулина Генно-инженерные методы Раздельное получение обеих цепей с последующим фолдингом и разделением изоформ. Получение проинсулина с последующим ферментативным расщеплением трипсином и карбоксипептидазой Б до активной формы гормона.

Получение из поджелудочной животных • Для получения 100 г кристаллического инсулина требуется 800 -1000 кг поджелудочной железы, а одна железа коровы весит 200 - 250 грамм.

• Для получения штамма-продуцента гибридного полипептида, содержащего проинсулин человека, трансформируют компетентные клетки Escherichia coli JM 109 рекомбинантной плазмидной ДНК p. PINS 07. • Рекомбинантная плазмидная ДНК p. PINS 07 кодирует гибридный белок, в котором последовательность Ig. G-связывающего домена В стафилококкового белка А соединена через пептидный линкер His 6 Gly. Ser. Arg с аминокислотной последовательностью проинсулина человека. Она содержит Eco. RI/Hind. III-фрагмент плазмиды р. КК 223 -3, включающий гибридный tac-промотор, ген -лактамазы (bla), участок инициации репликации (ori) и терминатор транскрипции рибосомого оперона Е. coli, Eco. RI/Bam. HI-фрагмент (220 п. о. ), кодирующий Ig. Gсвязывающий домен белка A из S. aureus и гексагистидиновый домен, и синтетический Bam. HI/Hind. III-фрагмент (271 п. о. ), кодирующий последовательность аргинил-проинсулина человека.

• культивируют клетки штамма-продуцента Escherichia coli ДН 5/p. VK 100, разрушают бактериальные клетки дезинтеграцией, отделяют фракцию телец включения, содержащих гибридный белок, от водорастворимых примесей при помощи центрифугирования, растворяют тельца включения в буфере, содержащем 8 М мочевину, 1 м. М дитиотреитола, 0, 1 М трис HCl, p. H 8, 0, в течение 12 - 16 часов. Нерастворившиеся примеси удаляют центрифугированием, после чего увеличивают концентрацию дитиотреитола до 10 м. М и восстанавливают дисульфидные связи при 4 o. C в течение 1 часа. Раствор разбавляют в 5 раз холодной водой, на p. H-метре доводят p. H до 4, 5 и выдерживают 2 часа при 4 o. C для формирования осадка. Осадок, содержащий гибридный белок, отделяют центрифугированием и ренатурируют, быстро растворяют в холодной воде при p. H 10 -12, после чего разводят 10 м. М гициновым буфером p. H 10, 8 и выдерживают при 4 o. C в течение ночи. После ультрафильтрации раствор подвергают гель-фильтрации на колонке с сефадексом G-50 и элюируют 10 м. М глициновым буфером. Собирают фракции, содержащие гибридный белок, проводят ультрафильтрацию и лиофильно высушивают. Полученный гибридный белок растворяют в 0, 08 М трис HCl буфере, p. H 7, 5 до концентрации 10 мг/мл и расщепляют одновременно трипсином и карбоксипептидазой Б в соотношении 0, 3: 1: 10 (белок карбоксипептидазы Б : белок трипсинат : гибридный белок) при 37 o. C в течение 30 минут. Затем добавляют изопропанол до 40%. Смесь немедленно подвергают хроматографической очистке на колонке с ДЭАЕ-сефадексом А-25 и элюируют 0, 05 М трис HCl буфером, p. H 7, 5 с 40% изопропанола с линейным градиентом хлористого натрия от 0 до 0, 1 М. После испарения изопропанола концентрацию хлористого натрия увеличивают до 25% и сдвигают p. H до 2, 0, добавляя 4 N соляную кислоту. Собирают осадок целевого продукта-инсулина.

• Для получения рекомбинантного инсулина человека используют рекомбинантный штамм бактерии Escherichia coli JM 109/p. PINS 07 продуцент гибридного полипептида, содержащего проинсулин человека. Штамм депонирован в Центральной коллекции микроорганизмов Российского акционерного общества "БИОПРЕПАРАТ" ЦКМК "Б" под N ЦКМ В-66 ИН.

Культивирование клеток рекомбинантного штамма Escherichia coli JM 109/p. PINS 07 -продуцента гибридного полипептида (белка), содержащего проинсулин человека ведут на питательной среде следующего состава (г/л): • Гидролизат казеина солянокислотный - 20 • Экстракт пекарских дрожжей - 14 • Двухзамещенный фосфат калия трехводный - 6 • Однозамещенный фосфат калия - 3 • Сульфат магния - 0, 5 • Натрий хлористый - 5 • Глюкоза - 10 • Ампициллина натриевая соль - 0, 05 • Дистиллированная вода - Остальное
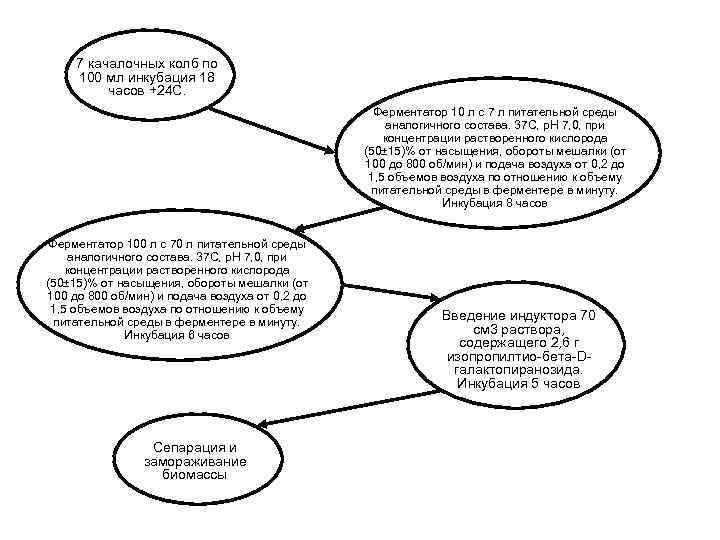
7 качалочных колб по 100 мл инкубация 18 часов +24 C. Ферментатор 10 л с 7 л питательной среды аналогичного состава. 37 C, p. H 7, 0, при концентрации растворенного кислорода (50± 15)% от насыщения, обороты мешалки (от 100 до 800 об/мин) и подача воздуха от 0, 2 до 1, 5 объемов воздуха по отношению к объему питательной среды в ферментере в минуту. Инкубация 8 часов Ферментатор 100 л с 70 л питательной среды аналогичного состава. 37 C, p. H 7, 0, при концентрации растворенного кислорода (50± 15)% от насыщения, обороты мешалки (от 100 до 800 об/мин) и подача воздуха от 0, 2 до 1, 5 объемов воздуха по отношению к объему питательной среды в ферментере в минуту. Инкубация 6 часов Сепарация и замораживание биомассы Введение индуктора 70 см 3 раствора, содержащего 2, 6 г изопропилтио-бета-Dгалактопиранозида. Инкубация 5 часов

Далее осуществляют выделение и очистку гибридного белка, включающие следующие этапы. • Получение телец включения, содержащих гибридный белок рекомбинантного инсулина человека. • 100 г осажденных клеток Е. coli штамма-продуцента JM 109/p. PINS 07 с суммарным содержанием белка 10 г, определяемым методом Лоури, и содержанием гибридного белка 2 г, определяемым электрофорезом в ПААГ и высокоэффективной жидкостной хроматографией, суспендируют в 500 мл буфера, p. H 7, 5, содержащего 0, 05 М трис-(гидроксиметил)- аминометана, 0, 05 М этилендиаминотетрауксусной кислоты, 2 М мочевины, и дезинтегрируют на ультразвуковом дезинтеграторе или на дезинтеграторе Гаулина. После разрушения клеток фракцию телец включения отделяют центрифугированием при 9000 об/мин в течение 30 минут. • Растворение телец включения. • Полученные тельца включения растворяют в соотношении 1: 4 (вес телец включения в граммах, объем буфера в см 3) на магнитной мешалке при постоянном перемешивании в 0, 05 М трис-HCl, p. H 8, 0, содержащем 8, 0 М мочевину и 0, 001 М дитиотреитол. Растворение проводят при температуре 18 o. C в течение 12 часов. • Восстановление дисульфидных связей гибридного белка. • Раствор гибридного белка помещают в водяную баню и по достижении температуры 37 C добавляют до 5 м. М сухого дитиотреитола при постоянном перемешивании. После полного растворения соли смесь инкубируют в течение часа при постоянном перемешивании. • Кислотное осаждение гибридного белка. • Раствор гибридного белка разбавляют при перемешивании на магнитной мешалке пятью объемами предварительно охлажденной до 4 o. C ультрачистой водой 0, 1 N соляной кислотой, доводят p. H раствора до 4, 5 и при температуре 4 o. C инкубируют раствор гибридного белка в течение 3 часов. В процессе инкубации образуется осадок, содержащий гибридный белок, который отделяют центрифугированием при 9000 об/мин в течение 30 минут.

• Ренатурация гибридного белка. • Осадок взвешивают на весах, растворяют в двойном объеме по отношению к весу осадка ультрачистой воды, доводя до p. H 12 1 N Na. OH, при постоянном перемешивании. Нерастворившийся материал отделяют центрифугированием при 9000 об/мин в течение 30 минут. Супернатант помещают в емкость и добавляют 0, 05 М глицин-Na. OH буфер, p. H 10, 8 в количестве, необходимом для получения концентрации белка 0, 5 мг/мл. Раствор оставляют при температуре 14 o. C на 14 часов. • Спиртовое осаждение примесных белков. • 1 N соляной кислотой на p. H-метре доводят p. H раствора до 7, 5. К раствору добавляют изопропанол до конечной концентрации, равной 40%. • Смесь инкубируют при температуре 4 o. C в течение 14 часов. Образующийся осадок отделяют центрифугированием при 9000 об/мин в течение 30 минут. • Хроматография гибридного белка на КМ-сефарозе. • Супернатант подвергают хроматографической очистке на КМ-сефарозе. Колонку размером 26/30, содержащую 30 мл КМ-сефарозы, уравновешивают 0, 05 М трис-HCl буфером, p. H 7, 5, с добавлением 1, 5 М мочевины. Наносят на колонку раствор гибридного белка и промывают уравновешивающим буфером до достижения базовой линии контрольного оборудования для детекции белков. Сорбированный белок элюируют с колонки, пропуская через нее исходный буфер с добавлением 0, 25 М Na. Cl. Фракции, содержащие гибридный белок, объединяют и используют для получения высокоочищенной субстанции инсулина.

• Расщепление гибридного белка трипсином. • Определяют в растворе содержание гибридного белка методом Лоури, доводят его концентрацию на ультрафильтрационной ячейке до 5 мг/мл и добавляют раствор трипсина в соотношении гибридный белок: трипсин, равном 600: 1. Для остановки реакции триптического расщепления гибридного белка в раствор вносят трифторуксусную кислоту до p. H 3, 85. Критерием выбора времени остановки реакции триптического расщепления белка является прекращение накопления диаргинининсулина и увеличение содержания других продуктов (особенно, дезамидоинсулина). • Хроматография продуктов трипсинолиза гибридного белка на СП-сефарозе. • Раствор с продуктами триптического расщепления гибридного белка наносят на колонку размером 26/30, содержащую 100 мл СП-сефарозы ФФ, предварительно уравновешенную 0, 03 М аммоний-ацетатным буфером, p. H 5, 0 с 6 М мочевиной. Промывают уравновешивающим буфером до достижения базовой линии контрольного оборудования для детекции белков. Сорбированный материал элюируют линейным градиентом хлористого натрия от 0 до 0, 5 М в стартовом буфере в течение 8 часов при скорости протока элюента 180 мл/час. Объединяют фракции, содержащие диаргинининсулин без примеси дезтреонининсулина. • В качестве уравновешивающего может быть использован 0, 02 М аммоний-ацетатный буфер, p. H 6, 0 с 6 М мочевины. • Удаление концевых аргининов обработкой карбоксипептидазой Б. • Объединенный материал, полученный после хроматографии на СП-сефарозе, концентрируют методом ультрафильтрации, определяют содержание белка и приводят раствор к следующим условиям: концентрация диаргинининсулина 1 мг/мл, мочевины 3 М, трис-HCl буфер, p. H 7, 85. Превращение диаргинининсулина в инсулин достигается путем его расщепления карбоксипептидазой Б в соотношении 1: 500 (количество белка карбоксипептидазы Б: количество белка диаргинининсулина). Для этого при комнатной температуре в раствор диаргинининсулина вносят при перемешивании расчетное количество карбоксипептидазы Б. Для остановки реакции под контролем p. H-метра при непрерывном перемешивании в реакционную смесь добавляют 10%-ный раствор трифторуксусной кислоты, доводя p. H раствора до 3, 85. Критерием выбора времени остановки реакции является полное превращение диаргинининсулина в инсулин, определяемое аналитически методом высокоэффективной жидкостной хроматографии (ВЭЖХ).

• Очистка инсулина методом высокоэффективной жидкостной хроматографии на обращенных фазах. • Полученный раствор инсулина концентрируют ультрафильтрацией до концентрации 8 мг белка в 1 мл и подвергают хроматографической очистке на обращенных фазах. • Очистку инсулина проводят на стандартном оборудовании для обращенно-фазовой жидкостной хроматографии высокого давления любой из фирм, производящих такое оборудование. Для проведения работ устанавливают колонку для хроматографии "Диасорб" C 16 T, 25 х 250, 6 - 7 мкм или аналогичную другой фирмы-производителя. Колонку уравновешивают водным раствором, содержащим 10% ацетонитрила и 0, 1% трифторуксусной кислоты. В подготовленную колонку при помощи петли и инжектора вводят пробу, содержащую инсулин в количестве 1, 0 г белка. Разделение ведут по программе, представленной в таблице. • Регистрацию процесса разделения ведут при 220 нм на проточном спектрофотометре при чувствительности прибора 0, 1. Собранные фракции основного пика инсулина анализируют на содержание примесей методом высокоэффективной жидкостной хроматографии. Фракции инсулина, не содержащие примесей дезамидоинсулина, используют для дальнейшей очистки. • Получение высушенного инсулина. • Из объединенных фракций, содержащих инсулин, удаляют ацетонитрил путем выпаривания на роторном испарителе, после чего препарат лиофильно высушивают. • Очистка инсулина методом гель-фильтрации. • Гель-фильтрацию инсулина проводят на колонке размером 26/60, содержащей 250 мл сефадекса G-50. Колонку уравновешивают 1 М раствором уксусной кислоты. Препарат инсулина человека в 1 М растворе уксусной кислоты доводят до оптической плотности 90 -100 единиц при длине волны, равной 277 нм. При необходимости, если раствор инсулина мутный, производят корректировку p. H до 3, 0 концентрированной уксусной кислотой. Перед введением раствора инсулина в хроматографическую колонку его фильтруют через мембрану с размером пор 0, 22 мкм. Раствор инсулина вводят в верхнюю часть колонки с помощью перистальтического насоса со скоростью 4, 8 мл/см 2 в час. После введения раствора инсулина в колонку подают элюент, 1 М раствор уксусной кислоты, с той же скоростью. Раствор 1 М уксусной кислоты пропускают через колонку с носителем до отсутствия поглощения в ультрафиолетовой части спектра при 277 нм. Фракции белка объединяют в соответствии с хроматографическими зонами на выходной кривой распределения белков. В объединенной фракции, используемой как субстанция инсулина, спектрофотометрически определяют содержание белка и биологическую активность, которая составляет 26, 5 Е/мг инсулина. • Таким образом, проведение хроматографической очистки на нейтральных носителях позволяет получить инсулин человека с чистотой не ниже 96% и активностью не ниже 26 Е/мг.
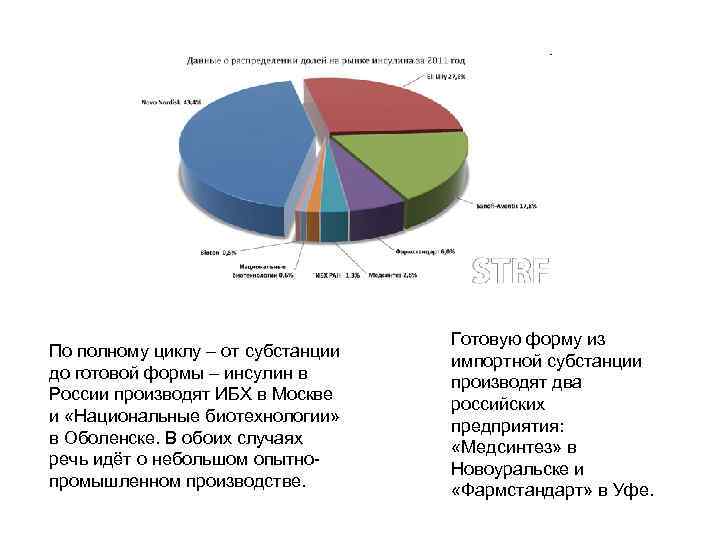
По полному циклу – от субстанции до готовой формы – инсулин в России производят ИБХ в Москве и «Национальные биотехнологии» в Оболенске. В обоих случаях речь идёт о небольшом опытнопромышленном производстве. Готовую форму из импортной субстанции производят два российских предприятия: «Медсинтез» в Новоуральске и «Фармстандарт» в Уфе.
Инсулин.ppt