ск слайдах.pptx
- Количество слайдов: 105

Получение бутадиена из этилового спирта. На первых заводах синтетического каучука бутадиен производился путем каталитического разложения этилового спирта по способу С. В. Лебедева, который описывается следующим суммарным уравнением: 2 С 2 Н 5 ОН → С 4 Н 6 + 2 Н 2 О + Н 2 Другой способ получения бутадиена из этилового спирта был предложен И. И. Остромысленским. Получение бутадиена по этому способу протекает в две стадии: сначала этанол дегидрируют до ацетальдегида, а затем полученная смесь спирта и ацетальдегида пропускают над катализатором (окись тантала на силикагеле) при 3500 С. Этот процесс был реализован В США. В дальнейшем процесс был законсервирован изза его нерентабельности.

. Синтез бутадиена из ацетилена • Синтез бутадиена из ацетилена был внедрен в Германии. Процесс производства осуществляется двумя путями: • Ацетилен → ацетальдегид → альдоль → 1, 3 бутиленгликоль → бутадиен; • Ацетилен → формальдегид → 2 бутиндиол 1, 4 → 1, 4 бутиленгликоль → бутадиен. • Вследствие высокой стоимости ацетилена и многостадийности процессов синтеза оба эти способа по экономическим показателям уступают всем другим промышленным способам. •

Одностадийное дегидрирование n-бутана • • • . Одностадийное дегидрирование бутана проводится в присутствии алюмохромовых катализаторов при достаточно высоких температурах и низких парциальных давлениях углеводородов. Процесс известный под названиями «процесс Гудри» или «Катадиен» , осуществляется на неподвижном слое катализатора с адиабатическим регенеративным циклом. Процесс осуществляется с объемной скоростью 250 350 м 3 на 1 м 3 катализатора в час. Температура реакции 600 6300 С, давление 16, 6 19, 6 к. Па [2]. Гранулированный алюмохромовый катализатор содержит 18 20% оксида хрома. Срок службы современных катализаторов составляет более 2 х лет. Катализатор регенерируют смесью воздуха с домовыми газами, поступающей с объемной скоростью 4000 5000 м 3 на 1 м 3 катализатора в час. Выход бутадиена на пропущенную бутан бутиленовую смесь составляет 12, 5 14% при селективности на исходный бутан 57%. К достоинствам метода следует отнести исключение расхода водяного пара и других разбавителей, автотермичность процесса, обеспечивающую минимальный расход топлива на осуществление эндотермической реакции дегидрирования. Основным недостатком процесса является невысокий выход бутадиена [2]. Процесс проводится циклически в батарее, состоящей из нескольких реакторов.

Окислительное дегидрирование н-бутана • • Окислительное дегидрирование бутана в присутствии йода описывается уравнениями: С 4 Н 10 + I ↔ С 4 Н 8 + 2 НI С 4 Н 8 + I 2 ↔ С 4 Н 6+ 2 НI + ½ О 2 → I 2 + Н 2 О Учитывая, что скорость второй реакции выше первой, образующиеся бутилены быстро превращаются в бутадиен, и процесс фактически протекает как одностадийный. При этом выход и селективность процесса выше, чем при других методах дегидрирования. Однако, такой процесс практически неприемлем для промышленной реализации из за высокой экзотермичности процесса и высокой агрессивности среды. Другим существенным недостатком процесса окислительного дегидрирования с иодом (бромом) является образование иодорганических соединений, из которых регенерация иода достаточно сложна.

Окислительное дегидрирование бутенов • • ПРЕИМУЩЕСТВА Реакции окислительного дегидрирования практически необратимы. Отсутствие термодинамических ограничений позволяет значительно увеличить выходы диенов. Кроме того, в отличие от обычных процессов дегидрирования процессы окислительного дегидрирования являются экзотермическими, что позволяет проводить их при меньших энергетических затратах. Первыми процессы окислительного дегидрирования н бутенов, разработаны и реализованы в промышленности американскими фирмами «Филипс» и «Тетро Текс» . В России процесс окислительного дегидрирования бутиленов был внедрен в реакторах адиабатического типа на сложном железоокисном катализаторе, разработанного в НИИМСК, марки ИМ 603.

Реакции, протекающие при каталитическом окислительном дегидрировании н-бутиленов • • • • Основная реакция окислительного дегидрирования н С 4 Н 8 + ½ О 2 → С 4 Н 6 + Н 2 О Полное горение углеводородов до СО 2, СО и Н 2 О С 4 Н 8 + 6 О 2 → 4 СО 2 + 4 Н 2 О С 4 Н 6 + 3, 5 О 2→ 4 СО + 3 Н 2 О Окисление углеводородов: С 4 Н 8 или С 4 Н 6 → фуран, ацетальдегид, формальдегид, непредельные альдегиды, малеиновая и др. кислоты. Реакции водяного пара: Н С 4 Н 8 +Н 2 О→ Н 2, СО С (кокс) +Н 2 О→ Н 2, СО Крекинг н С 4 Н 8, С 4 Н 6. Изомеризация с перемещением двойной связи и скелетная изомеризация i. С 4 Н 8 ↔ 2 цис С 4 Н 8 ↔ 2 транс С 4 Н 8 н С 4 Н 8 ↔ изо. С 4 Н 8

Технологическая схема процесса получения бутадиена окислительным • • Дегидрирование Н бутенов на железоцинкмагниевом катализаторе ИМ 603 включает следующие узлы: окислительного дегидрирования Н бутенов, охлаждения и очистки контактного газа; выделения фракции С 4 углеродов из контактного газа; выделения и очистки бутадиена экстрактивной ректификацией с ацетонитрилом. Перегретые пары сырья, воздуха и водяного пара поступают с температурой 0 С в верхнюю часть реактора, где в слое катализатора ИМ 603 протекает 350 экзотермическая реакция окислительного дегидрирования Н бутенов в бутадиен. Температура контактного газа на выходе из слоя катализатора составляет 590 600 0 С. В однослойном реакторе при мольном соотношении С 4 Н 8: О 2: Н 2 О = 1, 0: 0, 7: 15 достигнуты выход бутадиена до 60% мольн, избирательность 88% мольн. Причем, внедрение процесса было проведено на базе существующих установок дегидрирования Н бутенов Недостатком процесса является образование кислородосодержащих продуктов: фурана, ацетальдегида, акролеина, метакролеина, органических кислот. Состав и количество кислородосодержащих продуктов колеблется в зависимости от типа применяемого катализатора и условий проведения процесса. Наличие этих соединений в продуктах дегидрирования усложняет процесс выделения и очистки бутадиена. Повышенная пожаро и взрывоопасность процесса. Трудность поддержания стационарного режима.

Недостатки процесса • Недостатком процесса является образование кислородосодержащих продуктов: фурана, ацетальдегида, акролеина, метакролеина, органических кислот. • Состав и количество кислородосодержащих продуктов колеблется в зависимости от типа применяемого катализатора и условий проведения процесса. • Наличие этих соединений в продуктах дегидрирования усложняет процесс выделения и очистки бутадиена. • Повышенная пожаро и взрывоопасность процесса. • Трудность поддержания стационарного режима.

Выделение бутадиена из пиролизных фракций С 4. • • В промышленности для выделения бутадиена применяются в основном два метода: хемосорбция растворами медных солей ; экстрактивная ректификация с полярными растворителями. Метод выделения бутадиена хемосорбцией основан на способности диенов, образовывать нестойкие комплексные соединения с солями металлов переменной валентности (меди, ртути, серебра). Самые доступные – это медные соли, однако их недостатком является образование с бутадиеном твердых комплексов, выпадающих из растворов, что осложняет технологическое оформление процесса. Промышленная реализация метода стала возможной после получения водорастворимых комплексов диолефинов с медью за счет введения в раствор аммиака или алеинов. Были предложены ацетаты, салицилаты, формиаты и др. анионы одновалентной меди. Практическое применение нашел ацетат оксида меди. В промышленности, как правило, используется аммиак – наиболее дешевый и удобный с точки зрения технологического оформления процесса. Бутадиен взаимодействует с медноаммиачным комплексом по реакции: • (СН 3 СОО)2 Си 2(№Н 3)4 +С 4 Н 6 ------(СН 3 СОО)2 Си 2(№Н 3)3 С 4 Н 6+№Н 3. • Хемосорбционный раствор приготавливается растворением металлической меди • • в аммиачном растворе уксуснокислого аммиака и содержит 3, 0 3, 5 моль/л оксида меди (I), 0, 3 моль/л оксида меди (II), 4, 0 4, 8 моль/л уксусной кислоты и 11, 0 – 12, 0 моль/л аммиака. .

Технологическая схема процесса • Исходная фракция С 4 подается в нижнюю часть поглотительной колонны, а сверху противотоком поступает хемосорбционный раствор. Колонна работает под давлением около 2·105 Па. Сверху колонны отбираются бутан и бутилены, а насыщенный хемосорбционный раствор отбирается снизу и подается в верхнюю часть обогатительной колонны. Выходящий из куба обогатительной колонны насыщенный хемосорбент поступает в теплообменник, затем сепаратор, работающий под давление 0, 35 МПа. В сепараторе бутадиен частично десорбируется и направляется в качестве рецикла в обогатительную колонну. Из сепаратора абсорбент поступает в десорбер. Бутадиен последовательно отмывается от аммиака и карбонильных соединений и направляется в ректификационную колонну для окончательной ректификации

Экстрактивная ректификация • • • Методы выделения бутадиена экстрактивной ректификации основан на зависимости поляризации углеводородов от степени их непредельности. Из большого числа предложенных экстрагентов в промышленной практике нашли применение ацетинитрил, диметилформамид, диметилацетамид, N метилпирролидон, фурфурол. В России осуществлены методы двухступенчатой экстрактивной ректификации с применением в качестве экстрагентов диметилформамида и ацетинитрила. Технологический процесс выделения бутадиена из пиролизных фракций методом двухступенчатой экстрактивной ректификации с ДМФА состоит из следующих стадий: первичная экстрактивная ректификация, вторичная экстрактивная ректификация; ректификация бутадиена; регенерация растворителя. Выделение бутадиена из пиролизной фракции С 4 является наиболее эффективным методом. Однако, из за ограниченности сырьевой базы, метод не может удовлетворить спрос на бутадиен в полном объеме. Поэтому встает вопрос о реанимации и повышении эффективности ранее существующих технологий получения бутадиена дегидрированием.

• • Требования к подготовке бутадиен содержащих фракций Во всех процессах синтеза бутадиен первоначально получается в смеси с другими углеводородами, близкими к нему по летучести. Выделение из таких смесей концентрированного бутадиена, используемого для производства каучука является весьма сложной задачей. В последние годы эта задача еще более усложнилась в связи с развитием процессов стереорегулярной полимеризации в присутствии металлоорганических катализаторов. Для стереорегулярной полимеризации необходим бутадиен, тщательно очищенный от примесей других углеводородов диенового и ацетиленового ряда и соединений неуглеводородного характера. Концентрация бутадиена для стереорегулярной полимеризации принята не ниже 99 % вес. , а содержание примесей не выше (% вес. ): ацетиленовых углеводородов 0, 005 алленовых углеводородов 0, 01 – 0, 03 циклопентадиена 0, 001 карбонильных соединений 0, 01 азотистых соединений (в пересчете на азот) 0, 001 0, 002

Требования к подготовке бутадиен содержащих фракций Подготовка преследует две цели: удалить примеси, затрудняющие работу системы разделени; облегчить дальнейшую очистку выделенного бутадиена за счет удаления части примесей, являющихся ядами полимеризации. • К примесям первого характера относятся легкие и тяжелые углеводороды. Повышенное содержание легких углеводородов (обычно это углеводороды С 3) приводит к повышению давления в системах разделения и более высоким температурам, что нежелательно из за термополимеризации. Требование не является жестким; известна переработка на установках экстрактивной ректификации фракций С 4 пиролиза, содержащих 1% и более углеводородов С 3.

Очистка С 4 фракции от ацетиленов • Наличие в некоторых фракциях большого количества ацетиленовых соединений не препятствует нормальной работе установок экстрактивной ректификации, однако весьма отрицательно сказывается на работе установок хемосорбции из за взаимодействия ацетиленовых соединений и компонентов раствора, которые образуют различные вязкие поверхностноактивные и взрывоопасные вещества. Считается недопустимым направлять на хемосорбцию фракции с содержанием более 0, 03 0, 05% ацетиленовых соединений, так как последние , взаимодействуя с компонентами хемосорбента, приводят к резкому ухудшению его рабочих свойств.

Очистка С 4 фракции от ацетиленов • • • Для очистки от ацетиленовых соединений в промышленности применяется два метода: хемосорбционный форконтакт ; селективное каталитическое гидрирование. Первый метод основан на большей по сравнению с бутадиеном растворимостью ацетиленовых соединений в различных хемосорбентах. Второй метод – каталитическое гидрирование, основан на резком различии в скоростях взаимодействия с водородом углеводородов разной степени ненасыщенности в присутствии селективных катализаторов. Сила адсорбции на поверхности катализатора и скорость гидрирования углеводородов возрастает в ряду: алкан < алкен < алкадиен < алкин. Путем выбора соответствующего катализатора и регулирования условий гидрирования удается получить значительное снижение концентрации – ацетиленовых соединений в углеводородных фракциях. Наибольшее применение при гидрировании углеводорода получили катализаторы на основе палладия и никеля. Очистка бутадиенсодержащих от ацетиленовых соединений на этих катализаторах может проводиться как в газовой, так и в жидких фазах. Недостатком процесса является превращение бутадиена (от 1, 0 до 1, 5% масс. ) в бутилен (побочная реакция), что увеличивает затраты на переработку фракций в бутадиен.

Технологическая схема. Очистка пиролизной фракции от ацетиленовых углеводородов гидрированием • • После азеотропной осушки и ректификации от фракции С 5 и выше, а также частичного выделения бутан бутиленовой фракции, пиролизная фракция поступает на узел гидрирования ацетиленовых соединений. Узел гидрирования состоит из 2 х параллельно работающих блоков реакторов гидрирования по схеме: 103/1, 2 104/3 7 105/1, 2 Сырьё на 1 блок реакторов гидрирования поступает через межтрубное пространство холодильника поз. 103/1, 2, где захолаживается нулевым рассолом до температуры не более 25 °С. Температура сырья регистрируется и регулируется вручную, подачей рассола в трубное пространство холодильника поз. 103/1, 2. Захоложенное сырьё поступает в нижнюю часть реактора поз. 104/3, 7. Реакторы поз. 104/3, 4 включаются в любой последовательности. Гидрирование ацетиленовых углеводородов осуществляется электролитическим водородом на поверхности катализатора "палладий на окиси алюминия « загруженного в реакторы поз. 104/3 7. Процесс протекает при температуре слоя катализатора не более 45 °С и давлении не более 6 кгс/см 2. Водород подаётся в нижнюю часть реакторов поз. 104/3 7. • • •

Технологическая схема. Очистка пиролизной фракции от ацетиленовых углеводородов гидрированием • С верха первого по ходу реактора 1 блока реакторов поз. 104/3, 4 пиролизная фракция и непрореагировавший водород поступают в межтрубное пространство промежуточных холодильников поз. 105/1, 105/2, где происходит захолаживание фракции до температуры не более 25 °С далее фракция поступает в низ следующего по ходу реактора поз. 104/3, 4. • С верха последнего по ходу работающего реактора поз. 104/3, 4 пиролизная фракция поступает в конденсатор поз. 109/1, где происходит захолаживание пиролизной фракции перед подачей в сепаратор поз. 106.

Технологическая схема. Очистка пиролизной фракции от ацетиленовых углеводородов гидрированием • Продолжительная работа катализаторов приводит к снижению селективности катализатора, что ведет к увеличению потерь бутадиена. • Свежезагруженный катализатор обладает большой активностью, что вызывает увеличение потерь, для снижения которых предусматривается предварительная пассивация катализатора. Пассивация заключается в заполнении загруженного катализатором реактора пиролизной фракцией с температурой не менее 20 °С на 2 часа, после чего реактор включается в работу последним по ходу.

Реакция гидрирования • • • СН 2 = СН - С СН + Н 2 ⇆ СН 2 = СН - СН = СН 2 винилацетилен (дивинил) бутадиен 1, 3 СНз - СН 2 - С СН + Н 2 ⇆ СН 3 - СН 2 - СН = СН 2 этилацетилен бутилен • Реакция гидрирования протекает на поверхности катализатора, имеющего активные центры из молекул палладия (Рd). Необходимым условием является адсорбция водорода (Н 2) и ацетиленовых соединений на активных центрах с образованием промежуточных комплексов. В результате перераспределения связей и последующей десорбции образуются продукты реакций: бутадиен и бутилен. Подача водорода на гидрирование осуществляется с избытком от 4 до 40 молей на 1 моль ацетиленовых соединений. В связи с этим происходит частичное гидрирование бутадиена. • • • СН 2 = СН - СН = СН 2 + Н 2 ⇆ СНз - СН 2 - СH = СН 2, • • • бутадиен бутилен что выражается в потерях бутадиена при гидрировании (от 1, 5 до 5 % масс. ). На эффективность очистки пиролизной фракции от ацетиленовых соединений и селективность реакции оказывает влияние объёмная скорость подачи фракции, концентрация ацетиленовых соединений, давление и температура. С повышением температуры скорость гидрирования возрастает, что приводит к увеличению потерь бутадиена.

Способы получения изопрена 1. Синтез изопрена из ацетилена и ацетона • • Синтез изопрена из ацетона и ацетилена был впервые осуществлен академиком А. Е. Фаворским. • Процесс состоит из трех стадий. • На первой стадии происходит конденсация ацетилена и ацетона с получением метилбутинола (диметилэтинилкарбинола): • СН 3 • ∕ • СН СН + СН 3 СО СН 3 С С СН • • ОН • •

Синтез изопрена из ацетилена и ацетона • На второй стадии – гидрирование метилбутинола в метилбутенол (диметилвинилкарбинол) • СН 3 / 2 СН 3 С С СН +Н 2 ⇾ 2 СН 3 С СН=СН 2 • • ОН ОН •
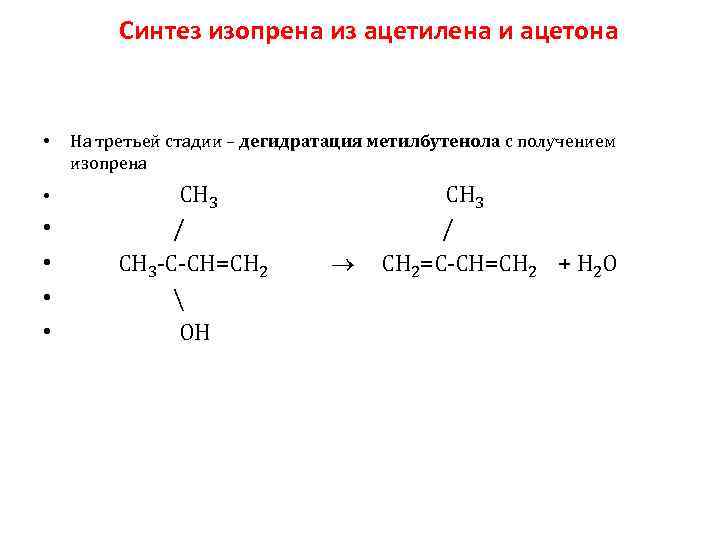
Синтез изопрена из ацетилена и ацетона • На третьей стадии – дегидратация метилбутенола с получением изопрена • СН 3 / СН 3 С СН=СН 2 СН 2=С СН=СН 2 + Н 2 О ОН • •

Синтез изопрена из ацетилена и ацетона • Метод был реализован в опытно промышленном масштабе в Ленинграде. В 1972 году производство изопрена из ацетилена и ацетона было осуществлено в Италии (фирма «Анич» ). • К преимуществам метода относится высокое качество получаемого изопрена; • к недостаткам – многостадийность, а также известные технологические трудности, характерные для всех синтезов на основе ацетилена. В этой связи следует отметить наблюдающуюся в последние годы тенденцию замены ацетилена в большинстве классических процессов, таких, как синтезы хлористого винила, хлоропрена, нитрила акриловой кислоты нефтехимическим сырьем. •

Процесс одностадийного синтеза из изобутилена ( или трет-бутанола) и формальдегида (ОИФ) • Процесс ОИФ основан на использовании реакций: • СН 3 • / • СН 3 С=СН 2 + СН 2 О СН 2=С СН=СН 2 + Н 2 О • СН 3 СН 3 / СН 3 С ОН + СН 2 О СН 2=С СН=СН 2+ 2 Н 2 О СН 3

Процесс ОИФ • • Селективность превращения изобутилена и формальдегида в изопрен составляет 70 и 71% Химические превращения протекают в жидкой фазе в двух последовательных реакционных зонах, работающих с одной и той же каталитической системой, но в разных температурных режимах (90110 о. С и 140 -160 о. С), практически, без промежуточного разделения катализата после первого реактора. Это дает основание считать процесс одностадийным. Эффективной реализации процесса ОИФ способствует разработка весьма простой и экономичной технологии получения трет бутанола из изобутиленсодержащих С 4 фракций путем гидратации с применением формованных сульфакатионитных катализаторов типа КУ КФПП. В перспективе большой интерес представляет получение трет бутанола путем жидкофазного окисления изобутана и использование метилаля в качестве источника С 1 (формальдегида). Метилаль в отличие от формальдегида не разлагается на СО и Н 2, слабо реагирует с бутеном 1, поэтому в качестве сырья можно использовать смесь С 4. Процесс получения изопрена с использованием метилаля состоит из двух стадий :

Процесс ОИФ • получение метилаля • СН 2 О+ 2 СН 3 ОН СН 2(ОСН 3)2 + Н 2 О • парофазная реакция одного моля метилаля с изобутиленом СН 3 • / / • СН 3 С=СН 2+ СН 2(ОСН 3)2 СН 2=С СН=СН 2 + 2 СН 3 ОН • Цис и транс бутен 2 будут также реагировать с метилалем с образованием изопрена: • СН 3 • / • СН 3 СН=СН СН 3 + СН 2(ОСН 3)2 СН 2=С СН=СН 2 + 2 СН 3 ОН • Относительные скорости реакции бутенов находятся в следующем порядке: • трет. вторич. первич.

Процесс на основе жидкофазного окисления изопентана и эпоксидирования метилбутена (ОКСЭП) • Процесс ОКСЭП основан на использовании реакций: • жидкофазного окисления изопентана гидропероксид и трет амиловый спирт • i C 5 H 12 + O 2 i C 5 H 11 OOH + i C 5 H 11 OH К=8%, S=75 80% • эпоксидирования метилбутена в оксид 2 -метил-2 бутена: К=100% по гидропероксиду, S = 96 98% • i C 5 H 11 OOH + i-C 5 H 10 i C 5 H 11 OH + i C 5 H 10 O • дегидратации трет-амилового спирта в трет-амилены: • i C 5 H 11 OH i-C 5 H 10 + H 2 O К=98%, S=99% • превращения оксида трет-амила в изопрен: • i C 5 H 10 O i C 5 H 8 + H 2 O К=100%, S=80 82%

Процесс на основе жидкофазного окисления изопентана и эпоксидирования метилбутена (ОКСЭП) • Несмотря на многостадийность, процесс является весьма экономичным, так как все реакции реализуются при умеренных температурах и большей частью в жидкой фазе. • В изопрене сырце отсутствуют трудноудаляемые примеси, и достигается его глубокая очистка методами ректификации и отмывки без применения химических методов. • Основным побочным продуктом является метилизопропилкетон, являющийся ценным растворителем для лакокрасочной промышленности. •

Условия проведения процесса ОКСЭП • 1 стадия. Окисление изопентана кислородом воздуха, Температура 125 155 С; Р 20 50 атм. • Отделение состоит: Узел ректификации изопентана; • Компрессорный узел воздуха и азота; • Узел окисления изопентана. Реактор: барбатажного или эрлифтного типа. (Стенки аппарата пассивируется или вводятся добавки дезактивирующие поверхность за счет образования прочных комплексов полифосфатов, пирофосфатов натрия). • • • Узел концентрирования оксидата; Узел абсорбции изопентана из отработанного газа; Узел отмывки изопентана. Выход продуктов на прореагировавший изопентан: % мольн. Сумма ГП 67, 2 ТАС 11. 1 Ацетон 8. 5 кетоны. С 4 С 5 2, 4 Уксусная кислота 3, 5 превращается в СО 2 за счет ее декабоксилирования.

Условия проведения процесса ОКСЭП • • 2 стадия. Эпоксидирования 2 МБ 2 с ГПТА в оксид 2 метил 2 бутена Шихта : катализатор (пентохлорид молибдена, нафтенаты, ацетаты молибдена, тетрахлорид титана)=1: 0. 001 Температура 90 100 С; Давление 2. 4 4, 5 атм. Конверсия ГП 100 %. Выход на прореагировавший ГП: Окиси 2 МБ 2 96 %; 2 метилбутандиол 4 %. ТАС 100 % Отделение состоит: Реакционный узел эпоксидирования ( секционный аппарат колонного типа ); • • • Узел разделения эпоксидата и выделения окиси 2 МБ 2; Узел выделения фракции ТАС; Узел регенерации и приготовления катализатора

Условия проведения процесса ОКСЭП • 3 Стадия. Дегидратация ТАС в 2 МБ 2 с возвратом на стадию эпоксидирования. • Температура 95 110 С; Давление 1. 5 1. 7 атм; Катализатор ионообменные смолы. Неорганические кислоты. • Конверсия ТАС-95 %. • Выход 2 МБ 2 -99, 7 %. • Отделение: • Реакционный узел. Аппарат возможно реакционно ректификационного типа, средняя часть заполнена катализатором. • Узел ректификации изоамиленов.

Условия проведения процесса ОКСЭП • 4 стадия. Вариант. А. • • • 1. Изомеризация окиси 2 МБ 2 в непредельный спирт. СН 3 СН 3 ОН ∕ ∣ ∣ СН 3 С СН СН 3 ⇾СН 2 = С С СН 3 2 метилбутен 1 ол 3 ∖ ∕ ( Карбинол) О Температура 250 300 С, литиевые катализаторы. Конверсия окиси 2 МБ 2 70 80 %; Выход спирта 83 95 %. 2. Дегидратация карбинола в изопрен. Температура 280 С; катализатор полимеры, фосфаты кальция

Условия проведения процесса ОКСЭП • 4 Стадия. В. 2. • Прямая дегидратация 2 МБ 2 В изопрен. РФ Катализатор ИМ 22201 промотированный фосфат стронция; Германия Фосфат кальция или полимерный катализатор Т=240 С. Давление 3 4 атм; Температура 320 370 С; Разбав. окиси: вода=1: 1 Конверсия 100 %; Выход изопрена-81 %; Метилизопропилкетон 10, 5% (МИПК) Диметилпропоналя 4. 8 % 2 МБ 1 ол 3 1 %. Отделение: Узел разложения окиси 2 МБ 2 в изопрен; Узел разложения или выделения в виде товарного продукта МИПК; Узел выделения и очистки изопрена.

Процесс из 2 -бутенов и синтез-газа (БУСИГ) • Процесс БУСИГ основан на использовании реакций: • гидроформилирования 2 бутена (К=85%, S=97%) • СН 3–СН СН–СН 3 + CO + H 2 C 2 H 5 - CH(CH 3)-CНO • и дегидратации 2 метилбутаналя в изопрен (К=70%, S=90%) • C 2 H 5 - CH(CH 3)-CНO i-C 5 H 8 + H 2 O

Процесс Бусиг • Преимущества: В последнее время вследствие возникновения на ряде предприятий свободных ресурсов н бутенов, которые раньше были сырьем для производства 1, 3 бутадиена, привлекательность этого процесса возрастает. Достоинством является и привлечение дешевого второго сырья – природного газа для получения синтез газа. • Недостаток процесса (применительно к реконструкции имеющихся производств изопрена) – необходимость строительства установок для производства синтез газа, а также относительно высокое давление на стадии гидроформилирования ( 60 атм). •

Процесс БУСИГ • • Двухстадийный синтез изопрена из бутенов 2 и синтез газа «процесс БУСИГ» (смесь С 0 и Н 2) через 2 метилбутаналь совместная разработка ОАО НИИ «Ярсинтез» и ИНХС РАН им. А. В. Топчиева. Производство изопрена данным методом по сравнению с действующими базируется на принципиально новой сырьевой базе, исключает операции получения метанола и окисления его в формальдегид, высвобождает ресурсы изопентана, изобутилена и метанола, потребность в которых в производстве высокооктановых бензинов неуклонно возрастает. Бутены 2 могут быть получены выделением из ББФ каталитического крекинга и пиролиза, а также дегидрированием н бутана и диспропорционированием пропилена. Содержание бутена-2 в пиролизной фракции С 4 составляет 8 -10% масс. ---- после очистки перед гидрированием---- 2, 5 -4, 0 %, --- после выделения изобутиленов ( в сырье Д-6 ) – 11 -15 %масс. Через дегидрирование бутана ---- в контактном газе содержание бутена-2 1823%масс. ----- после выделения бутиленов 50 -56%масс. Для каталитического дегидрирования пропана и бутана существует процесс «Oleflex» , селективностью процесса по пропилену 90%, по бутиленам 92%. . В качестве катализатора используют платину на оксиде алюминия. Пропилен, получаемый на установках каталитического крекинга (28%) в основном расходуется на получение моторного алкилата и кумола. Количество пропилена получаемого методом пиролиза в среде водяного пара ( около 70%) зависит от спроса на этилен.

Синтез-газ • Синтез газ в крупнотоннажном производстве метанола и оксосинтезе получают • паровой или пароуглекислотной конверсией природного газа, а также высокотемпературной конверсией углеводородов, включая тяжелые фракции нефтеперерабатывающей промышленности и мазуты. • Паровая конверсия (Никелевые катализаторы, температура 800 о. С, синтез газ с повышенным содержанием водорода, до 75%). • Для процессов гидроформилирования ( оксо- синтез) в основном используют метод углекислотной или пароуглекислотной конверсии с соотношением в синтез газе СО: Н 2 = 1: 1. • В настоящее время В Малайзии, США и ЮАР имеются установки автотермического реформинга ( термический нейтральный процесс за счет комбинирования реакции паровой и кислородной конверсии метана). Синтез газ полученный по данной технологией используется в производстве спиртов и жидкого топлива. •

Стадии процесса • Гидроформилирование бутенов 2 осуществляется в жидкой фазе в среде растворителя при давлении 50 60 атм и температуре 80 100 0 С в присутствии модифицированного карбонилродиевого катализатора. • В институте Топчиева (заведующий лабораторией Е. В. Сливинский) лабораторные исследования проведены с использованием в качестве растворителя п-ксилола, катализатор трифенилфосфитные комплексы родия (карбонилродиевые катализаторы модифицированные фосфорсодержащими лигандами). Используется аппарат с перемешивающим устройством. Реакция первого порядка. В процессе наблюдается изомеризация в сторону образования транс бутена-2. • Конверсия бутенов 2 составляет 80 -90% при селективности по 2 • • метилбутаналю 94 97%. Предполагаемый расход металлического родия 0, 33 г/т изопрена при условии предъявления высоких требований к чистоте исходного сырья. Основным побочным продуктом синтеза является н пентаналь (70 кг/т изопрена), используемый для производства н амилового спирта. 2. Дегидратация 2 метилбутаналя в изопрен осуществляется в газовой фазе в реакторе на гетерогенном катализаторе при атмосферном давлении, температуре 350 400 0 С и объемной скорости подачи альдегида по жидкости не менее 1, 0 ч 1. Конверсия 2 метилбутаналя на кальцийборфосфатном катализаторе составляет около 70% при селективности по изопрену до 90 % мол. Основным побочным продуктом является метилизопропилкетон, который возвращают в рецикл или выделяют в качестве сопутствующего изопрену товарного продукта.

Технологическая схема процесса • • • включает следующие узлы: получения и тонкой очистки синтез газа; подготовки и тонкой очистки технологического сырья; приготовления родиевого гомогенного каталитического комплекса; гидроформилирования; разделения продуктов реакции гидроформилирования; дегидратации 2 метилбутаналя; охлаждения и конденсации контактного газа; переработки водного слоя; переработки углеводородного слоя; выделения и очистки изопрена.

• • • ЭКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА В экологическом отношении представленный процесс является малоотходным производством по сравнению с действующими производствами изопрена. Углеводородные отходы и отработанный синтез газ используются в качестве топлива. Фракция н пентаналя используется для производства н амилового спирта гидрированием. Отработанный родиевый катализатор направляется на извлечение родия. Сточные воды (33 кг/т изопрена) направляются на сжигание. ОПЫТ РАБОТЫ, ПРОМЫШЛЕННЫЕ АНАЛОГИ Процесс производства изопрена из синтез газа и бутена 2 отработан на модельных установках ОАО НИИ «Ярсинтез» по полному циклу. Технология получения синтез газа и изовалерианового альдегида была отработана на цеховой опытной установке производительностью по синтез газу 20 нм 3/ч (эквивалентного состава), по альдегиду 5 кг/ч. В ходе эксплуатации модельной и опытной установок подобраны оптимальные режимы процесса и сняты основные показатели для выполнения технико экономической оценки. В зарубежной промышленной практике (США, ФРГ, Японии, КНР, Швеции) с 1976 года успешно эксплуатируются процессы гидроформилирования олефинов с использованием родиевого катализатора суммарной мощностью по оксопродуктам более 1 млн. т/г. В России методом гидроформилирования организовано производство уксусной кислоты мощностью 150 тыс. т/г в НПО «Азот» (Северодонецк). Кроме того, выполнены проекты для установок ряда оксопродуктов гидроформилированием олефинов в присутствии гомогенного родиевого катализатора в ПО «Ангарскнефтеоргсинтез» , ПО «Салаватнефтеоргсинтез» и ПО «Пермьнефтеоргсинтез» .


Недостатки процесса • : неясность в объемах сырья по бутену 2; • многостадийность (технологическая схема состоит из 10 стадий без учета стадий синтеза и выделения бутена 2); • необходимость строительства установок для производства синтез газа, а также относительно высокое давление на стадии гидроформилирования. •

РАСХОД СЫРЬЯ И ЭНЕРГЕТИКИ •

ОСНОВНЫЕ ПРЕИМУЩЕСТВА ПРОЦЕССА • • • Процесс обладает следующими преимуществами по сравнению с другими действующими или перспективными процессами: реализация производства изопрена из н бутиленов и синтез газа позволяет использовать недефицитное сырье; относительно «мягкие» условия гидроформилирования обеспечивают высокую избирательность при высокой конверсии и следовательно сравнительно низкую металлоемкость, энергозатраты и весьма благоприятную экономику производства; высокая активность родиевого катализатора обеспечивает высокую скорость реакции гидроформилирования (50 70 *10 – 3 моль/л. мин) при минимальной концентрации катализатора в гомогенной системе (~ 300 ppm) и следовательно большую производительность реактора; малый расход родиевого катализатора (0, 00033 кг/т изопрена) позволяет предусмотреть в схеме производства компактный узел его приготовления; кальцийборофосфатный катализатор для стадии дегидратации 2 метилбутаналя в изопрен выпускается отечественной промышленностью; аппаратурно технологическое оформление процессов гидроформилирования, дегидратации и узла получения синтез газа имеет ряд действующих зарубежных и отечественных аналогов и при реализации процесса не вызовет каких либо технических трудностей; реализация производства изопрена из бутенов 2 и синтез газа возможна как в варианте нового строительства, так и для реконструкции существующих двухстадийных производств бутадиена и изопрена (особенно изопрена из изобутилена и формальдегида).


ЭКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА • • • • В экологическом отношении представленный процесс является малоотходным производством по сравнению с действующими производствами изопрена. Углеводородные отходы и отработанный синтез газ используются в качестве топлива. Фракция н пентаналя используется для производства н амилового спирта гидрированием. Отработанный родиевый катализатор направляется на извлечение родия. Сточные воды (33 кг/т изопрена) направляются на сжигание. ОПЫТ РАБОТЫ, ПРОМЫШЛЕННЫЕ АНАЛОГИ Процесс производства изопрена из синтез газа и бутена 2 отработан на модельных установках ОАО НИИ «Ярсинтез» по полному циклу. Технология получения синтез газа и изовалерианового альдегида была отработана на цеховой опытной установке производительностью по синтез газу 20 нм 3/ч (эквивалентного состава), по альдегиду 5 кг/ч. В ходе эксплуатации модельной и опытной установок подобраны оптимальные режимы процесса и сняты основные показатели для выполнения технико экономической оценки. В зарубежной промышленной практике (США, ФРГ, Японии, КНР, Швеции) с 1976 года успешно эксплуатируются процессы гидроформилирования олефинов с использованием родиевого катализатора суммарной мощностью по оксопродуктам более 1 млн. т/г. В России методом гидроформилирования организовано производство уксусной кислоты мощностью 150 тыс. т/г в НПО «Азот» (Северодонецк). Кроме того, выполнены проекты для установок ряда оксопродуктов гидроформилированием олефинов в присутствии гомогенного родиевого катализатора в ПО «Ангарскнефтеоргсинтез» , ПО «Салаватнефтеоргсинтез» и ПО «Пермьнефтеоргсинтез» .

Одностадийное дегидрирование изопентана а) одностадийное дегидрирование под вакуумом • • • Процесс одностадийного дегидрирования под вакуумом, известный под названием «процесс Гудри» , впервые был осуществлен в США в 1943 1944 годы для дегидрирования н бутана на неподвижном слое алюмохромового катализатора. Дегидрирование изопентана проводят при 535 625 о. С и остаточном давлении до 27 к. Па. Скорость подачи сырья составляет 1, 5 3, 5 объёма на один объём катализатора. На контактирование подают смесь перегретых паров изопентана и рецикловой изопентан метилбутеновой фракции. Процесс имеет ряд преимуществ по сравнению с двухстадийным процессом. Прежде всего это более простая технологическая схема вследствие исключения стадии разделения изопентан метилбутеновых смесей. Однако он уступает двухстадийному по выходу целевого продукта. Согласно основные расходные коэффициенты сырья и энергетических средств на 1 т изопрена составляют: изопентан, т …………………. . 2, 01 электроэнергия, к. Вт…………. 1492 вода, м 3 ……………. 59 топливо, 103 п. Дж ……………. . 5010

б) процесс одностадийного дегидрирования изопентана в изопрен при атмосферном давлении • • Процесс получения изопрена одностадийным дегидрированием изопентана на платиносодержащем катализаторе ИМ 22101 разработан в ОАО НИИ «Ярсинтез» . Процесс предлагается осуществлять в адиабатических реакторах со стационарным слоем катализатора в присутствии водяного пара и водородсодержащего газа собственного производства короткими (по 10 15 минут) циклами дегидрирование – регенерация. По техническому уровню данный процесс не уступает процессу вакуумного дегидрирования изопентана. Условия проведения процесса: разбавление сырья водяным паром и Н 2 1: 8 и 1: 0, 8 моль/моль, соответственно; объёмные скорости подачи сырья и дымовых газов 400 и 600 час 1, соответственно. Выходы изопрена на пропущенную фракцию С 5 и на разложенный изопентан составляют 15, 2% и 64, 5% мас. , соответственно. Для этого процесса может быть использовано оборудование второй стадии существующих двухстадийных процессов дегидрирования изопентана в изопрен.

Процесс двухстадийного дегидрирования изопентана в изопрен Сущность процесса двухстадийного дегидрирования изопентана состоит в последовательном превращении изопентана в метилбутены и смеси последних – в изопрен. Этот процесс является вторым, после синтеза из изобутилена и формальдегида, промышленным методом синтеза изопрена, разработанным и внедренным в России. • Целевыми реакциями являются дегидрирование изопентана в смесь трех метилбутенов и, далее, в изопрен. • К числу побочных относятся реакции крекинга с образованием углеводородов С 1 С 4 и выше, водорода и кокса; • скелетной изомеризации изопентана, метилбутенов и изопрена с получением соответствующих углеводородов С 5 нормального строения; реакции циклизации и дегидроциклизации. • Характерной особенностью процессов дегидрирования С 5 углеводородов , является то, что практически все реакции протекают и на стадии дегидрирования изопентана, и при дегидрировании метилбутенов. Различия стадий заключаются только в количественном составе реакционных смесей. • В промышленных условиях дегидрирование метилбутенов осуществляют при 570 630 о. С с разбавлением сырья водяным паром при мольном соотношении 1: 20. На сегодняшний день все блоки дегидрирования метилбутенов в России переведены на железооксидные саморегенерирующиеся катализаторы. • • •


Дегидрирование • Под дегидрированием понимают химические процессы, связанные с отщеплением атомов водорода от органических соединений. К числу важнейших промышленных продуктов, получаемых в том числе и методами дегидрирования, относятся пропилен, н бутены, изобутилен, изоамилены, бутадиен 1. 3, изопрен, стирол, формальдегид, циклогексан, гексаметилендиамин, анилин и др • Основные, наиболее значительные на наш взгляд, исторические этапы в области создания катализаторов и методов дегидрирования представлены в таблице 1. Следует отметить, что • динамика развития методов дегидрирования в нашей стране отличалась от ситуации, которая складывалась в это же время в западных странах. • Производство синтетических каучуков (СК) было и остается одной из наиболее развитых отраслей отечественной промышленности. До 90 х годов СССР занимал лидирующие: позиции в мире по объему производства СК, рекордный уровень 2. 5 млн тонн, был достигнут в 1987 г. [1]. Помимо удовлетворения внутренних потребностей, часть каучука поставлялась на экспорт. Отечественная промышленность была ориентирована в основном на выпуск СК общего назначения бутадиен стирольные, полиизопреновые, полибутадиеновые бутилкаучики. В производстве СК основная доля затрат (75 85 %) приходится на получение мономеров (бутадиена, изопрена, этилбензола, изобутилсна, стирола). По этой причине экономика СК в основном определяется научно техническим прогрессом в области производства мономеров. Значительная доля мономеров СК в нашей стране получалась именно методами дегидрирования. Это было обусловлено, по крайней мере, двумя причинами. Во первых, это связано с уникальным запасом углеводородов С 3 С 5 в нефти и газовом конденсате, добываемых в нашей стране. Во вторых, хотя в эти годы также наращивалась доля мономеров, получаемых из фракции пиролиза, однако развитие методов пиролиза отставало от постоянного роста производства СК и, как следствие, это продолжало стимулировать производство мономеров методами дегидрирования.
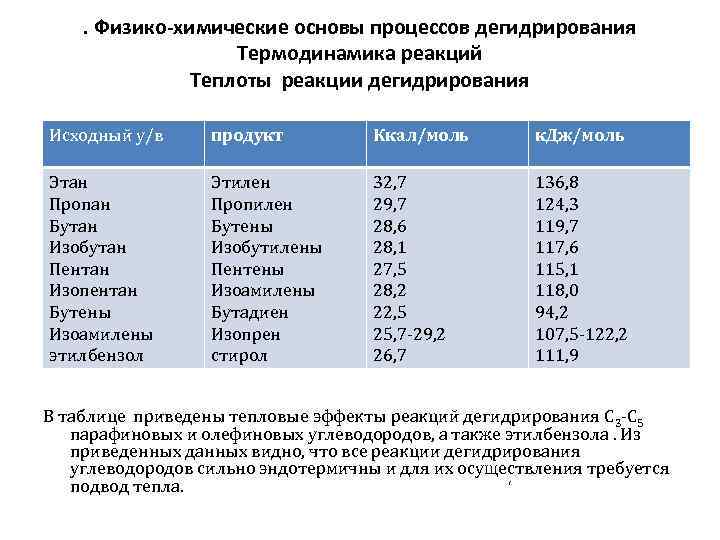
. Физико-химические основы процессов дегидрирования Термодинамика реакций Теплоты реакции дегидрирования Исходный у/в продукт Ккал/моль к. Дж/моль Этан Пропан Бутан Изобутан Пентан Изопентан Бутены Изоамилены этилбензол Этилен Пропилен Бутены Изобутилены Пентены Изоамилены Бутадиен Изопрен стирол 32, 7 29, 7 28, 6 28, 1 27, 5 28, 2 22, 5 25, 7 29, 2 26, 7 136, 8 124, 3 119, 7 117, 6 115, 1 118, 0 94, 2 107, 5 122, 2 111, 9 В таблице приведены тепловые эффекты реакций дегидрирования С 3 С 5 парафиновых и олефиновых углеводородов, а также этилбензола. Из приведенных данных видно, что все реакции дегидрирования углеводородов сильно эндотермичны и для их осуществления требуется подвод тепла. ‘

Дегидрирование • Важной характеристикой реакций дегидрирования является их обратимость. Очевидно, что вследствие эндотермичности дегидрирования равновесие будет смещаться в его сторону при повышенных температурах. С повышением молекулярной массы парафов равновесие становится более благоприятным для дегидрирования парафинов. Наличие фенильных заместителей и разветвление углеводородной цепи способствует отщеплению водорода. Наиболее легко происходит дегидрирование шестичленных нафтенов , что объясняется образованием устойчивой ароматической системы, Наоборот, отщепление водорода с получением углеводородов с сопряженными двойными и особенно с тройными связями термодинамически наименее выгодно.

Равновесие реакций • • Равновесие реакций дегидрирования низших парафинов неоднократно рассчитывалось различными авторами. Обзор показывает что приемлемые для промышленного производства конверсии углеводородов могут быть достигнуты только при дегидрировании при очень высоких температурах. Так, для н бутана, изобутана и изопентана конверсии выше 50 % могут быть достигнуты при температурах выше 520 570 °С. Еще более неблагоприятны термодинамические характеристики при дегидрировании пропана, С 4 С 5 олефинов и алкилароматических углеводородов. Здесь для того, чтобы процессы были экономически выгодными, требуются температуры выше 600 650 °С. Однако повышение температуры с целью увеличения глубиныдегидрирования накладывается на то обстоятельство, что при высоких температурах будут протекать нежелательные побочные реакции, такие как крекинг, гидрогенолиз, изомеризация, дегидроконденсация с образованием коксовых отложений. Энергия разрыва С—С связи равна 330 к. Дж/моль, в то время как, разрыв С Н связи требует примерно 380 420 к. Дж/моль. Побочные реакции имеют более высокую энергию активации, чем дегидрирование. Так, для крекинга н бутана энергия активации равна я 250 к. Дж/моль, а для его дегидрирования в н бутены она существенно ниже и составляет порядка 168 185 к. Дж/моль. Отсюда следует, что с ростом температуры скорость побочных реакций будет возрастать быстрее, чем скорость основной реакции, и по этой причине при очень высоких температурах процесса наряду с увеличением глубины превращения будет происходить резкое снижени селективности, что является экономически невыгодным. Итак, термическое дегидрирование протекает с малой скоростью и и низкой селективностью. По этой причине в промышленности процессы дегидрирования углеводородов проводят только в присутствии катализаторов. Применение катализаторов позволяет достигать высокой скорости процессов при сравнительно низких температурах, оптимальный предел которых ограничен условиями термодинамического равновесия для каждого конкретного углеводорода, когда еще не получают значительного

Дегидрирование • При дегидрировании углеводородов из за отщеплени водорода всегда происходит увеличение объема газа. Исходя из принципа Ле Шателье для обратимых реакций, протекающих с увеличением объема, снижение давления должно способствовать повышению степени превращения. По этой причине в промышленности процессы дегидрирования стараются проводить при пониженных давлениях. Особенно необходимо снижение давления при дегидрировании олефинов и алкилароматических углеводородов. Иногда, вместо того чтобы применять вакуум, удобно разбавлять реакционную смесь инертным газом или паром, что также ведет к снижению равновесной степени конверсии. Так как водород смещает равновесие в сторону гидрирования, а другие газы затрудняют выделение целевых продуктов, то на практике, в тех случаях, когда позволяет природа катализатора, применяют перегретый водяной пар, сохраняя общее давление близким или несколько большим атмосферного, чтобы преодолеть гидродинамическое сопротивление слоя катализатора. •

Основные этапы в области развития методов и катализаторов дегидрирования ко второй половине ХХ-го века • Россия- 50 е гг. создание первых отечественных катализаторов (К 5. К 16, КНФ, К 22) • • 60 80 е гг. — разработка и интенсивное внедрение новых катализаторов: ИМ 2201, К 16 у, ИМ 2204, ИМ 2206, К 24, К 28 и др. • Покупка лицензии на процесс «Катадиен» . • Разработка нового катализатора ИМ 22101 для одностадийного дегидрирования изопентана в среде водяного пара (испытания на полузаводской установке в конце 80 х годов) • • 90 е годы: внедрение микросферического катализатора СПС (FFB) для • дегидрирования изобутана; сокращение научных исследований по катализаторам и процессам дегидрирования; резкий спад в области • создания и внедрения новых катализаторов; • увеличение потребностей в изобутилене для синтеза МТБЭ и в полиэтилене для производства полипропилена; • • 2000 г. внедрение в промышленность новой модификации микросферического алюмохромового катализатора АОК 73 21.

• • • За рубежом • 40 е гг. внедрение фирмой UOP алюмохромового катализатора для дегидрирования в кипящем слое • 50 е и начало 60 х гг. пик интенсивных исследований в области дегидрирования, внедрение новых катализаторов и процессов; катализатор Гудри (Houdry) и процесс «Катадиен» , ДАУ Б, ШЕЛЛ • 60 80 с гг. постепенное сокращение производства олефинов и диолефинов с использованием каталитического дегидрирования из за интенсивного развития методов парового пиролиза (SC) и крекинга (FCC). • Конец 70 х начало 80 х резкий рост числа патентов по нанесенным биметаллическим катализаторам дегидрирования низших парафинов • 80 е гг. увеличение потребностей в изобутилене для синтеза МТБЭ и в полиэтилене для производства полипропилена; • 1986 г. коммерциализация процесса Catofin для дегидрирования изобутана • 1990 г. пуск первой установки Oleflex (UOP) в Таиланде • 1994 г. пуск опытной установки процесса STAR в Аргентине (Phiilipo Petroleum) • 1998 г. внедрение процесса SMART UOP/Lammus
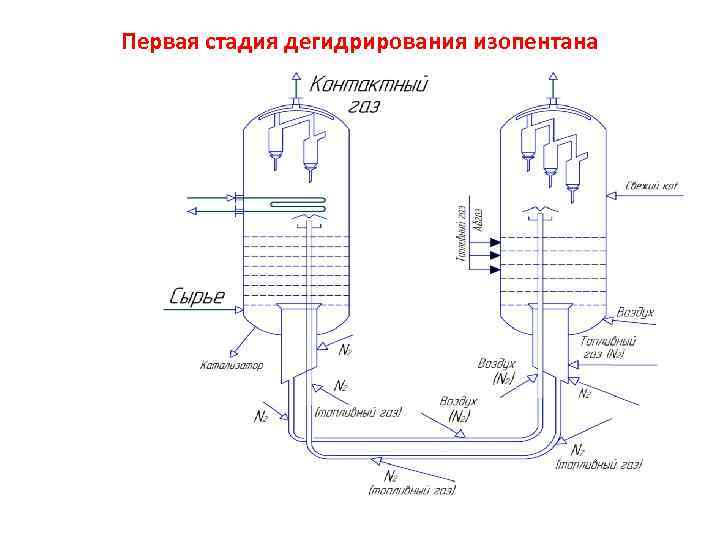
Первая стадия дегидрирования изопентана

Технологическая схема дегидрирования Метилбутенов в изопрен 1 —печь; 2 —реактор; 3 —котлы утилизаторы; 4, 8 скрубберы; 5, 9 — насосы; 6, 7, 10, 11 —теплообменники;

К числу основных факторов, определяющих технологическое и конструктивное оформление процессов дегидрирования, относятся: Необходимость подвода большого количества тепла в зону реакции из за эндотермического характера реакций Обеспечение высокой температуры для достижения рентабельных глубин дегидрирования Малое время контакта для получения высокой селективности Необходимость выжига коксовых отложений или создания катализаторов, устойчивых к коксу Необходимость быстрого охлаждения продуктов реакции для предотвращения протекания реакции полимеризации. • Снижение парциального давления углеводородов является эффективным способом увеличения выхода целевых продуктов. Для этой цели дегидрирование можно проводить: • под вакуумом; • при разбавлении сырья водяным паром; • путем связывания образующегося водорода: Н 2 О.

Основные факторы, определяющие технологические и конструктивное оформление процессов дегидрирования • • По своей продолжительности процессы дегидрирования делятся: на процессы с чередованием циклов дегидрирования и регенерации катализаторов на процессы, проводимые в непрерывном режиме. . • Процессы дегидрирования парафинов проводят в реакторах : с кипящим слоем катализатора с циркуляцией микросферического катализатора по контуру реактор регенератор, • в движущемся слое сферического катализатора, • в стационарном слое катализатора или трубчатых реакторах. • Технологии дегидрирования олефиновых и алкиларомагггеских углеводородов реализованы в реакторах аксиального или радиального типа со стационарным слоем катализатора. •

Основные факторы, определяющие технологические и конструктивное оформление процессов дегидрирования • Для подвода тепла в зону реакции используют • • Прямой и промежуточный разогрев исходного сырья; • • Разогрев катализатора в процессе регенерации (статический режим, циркуляция катализатора по контуру реактор регенератор); • • Подвод тепла с помощью водяного пара; • • Сжигание топлива в межтрубном пространстве. •

Виды изомеризации три типа промышленных процессов изомеризации: • ― высокотемпературная изомеризация (360 -440 °С) на алюмоплатиновых фторированных катализаторах; • ― среднетемпературная изомеризация (250 -300 °С) на цеолитных катализаторах; • ― низкотемпературная изомеризация на оксиде алюминия, промотированном хлором (120 180 °С) и на сульфатированных оксидах металлов (180 -210 °С). • В настоящее время разработано

Термодинамические и кинетические закономерности процесса изомеризации

Термодинамические и кинетические закономерности процесса изомеризации • Прежде всего, реакции изомеризации углеводородов – равновесные, и с понижением температуры процесса равновесный выход изопарафинов повышается, но приблизиться к его значениям можно только при бесконечном времени пребывания сырья в зоне реакции или при очень низкой объемной скорости подачи сырья. • С другой стороны, увеличение температуры всегда соответствует увеличению скорости реакции. Следовательно, при низкой температуре процесса действительный выход изокомпонентов будет намного ниже равновесного из за низкой реакционной скорости. И, наоборот, при высоких температурах к равновесному выходу легче приблизиться из за высокой скорости реакции. Таким образом, при высоких температурах выход изопарафинов ограничивается термодинамическим равновесием, а при низких температурах – низкой скоростью реакции (кинетическое ограничение.

Рис. 1. Схема процесса изомеризации на цеолитных катализаторах

Цеолитные катализаторы • наименее активны и используются при более высоких температурах по сравнению с катализаторами других типов, и как следствие – низкие октановые числа изомеризата. • Однако они обладают высокой устойчивостью к отравляющим примесям в сырье и способностью к полной регенерации в реакторе установки. В технологической схеме данного процесса предусматриваются огневые подогреватели для нагрева газо сырьевой смеси до температуры реакции. Требуется высокое отношение водорода к углеводородному сырью (наряду с изомеризацией водород тратится на гидроочистку и деароматизацию сырья), поэтому необходим компрессор для подачи циркулирующего ВСГ и • сепаратор для отделения ВСГ (рис. 1).
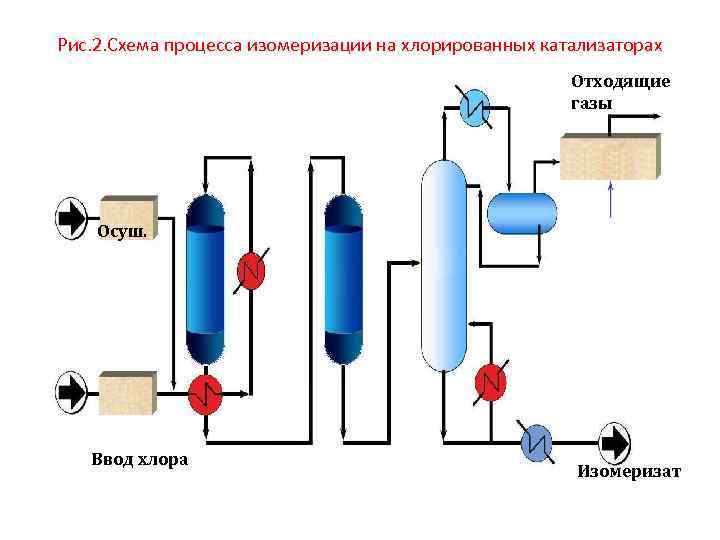
Рис. 2. Схема процесса изомеризации на хлорированных катализаторах Отходящие газы Осуш. Ввод хлора Изомеризат

Катализаторы на основе хлорированной окиси алюминия • наиболее активны и обеспечивают самый высокий выход и октановое число изомеризата. • Следует отметить, что в ходе изомеризации катализаторы теряют хлор, в результате активность снижается. Поэтому предусматривается введение в сырье хлорсодержащих соединений (обычно ССl 4) для поддержания высокой активности катализатора, и как следствие необходима щелочная промывка от органического хлорида в специальных скрубберах. Существенным недостатком является то, что данный тип катализатора очень чувствителен к каталитическим ядам (к • кислородсодержащим соединениям, включая воду, к азоту) и требует обязательной предварительной гидроочистки и осушки сырья. Кроме того, возникают • проблемы при регенерации (рис. 2)
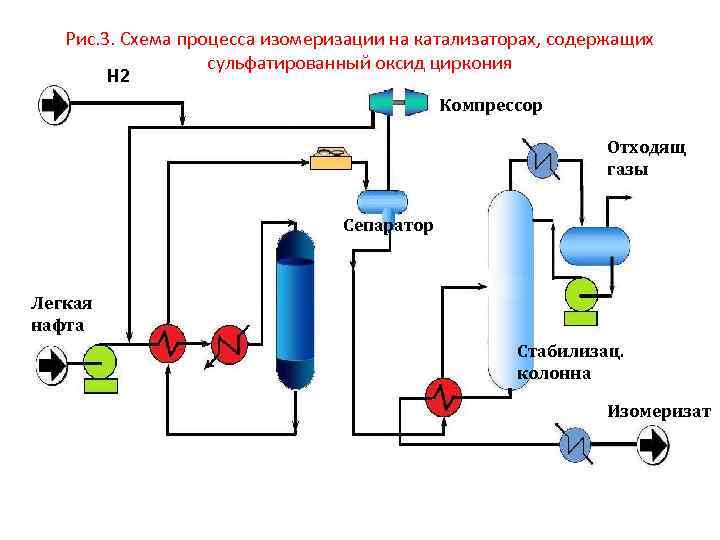
Рис. 3. Схема процесса изомеризации на катализаторах, содержащих сульфатированный оксид циркония Н 2 Компрессор Отходящ газы Сепаратор Легкая нафта Стабилизац. колонна Изомеризат

Катализаторы, содержащие суфатированные оксиды металлов • Последние годы получили повышенный интерес, так как они сочетают в себе основные достоинства среднетемпературных и низкотемпературных катализаторов: активны и устойчивы к действию каталитических ядов, способны к регенерации. • Единственным недостатком, так же как и для цеолитных катализаторов, является • необходимость в компрессоре для подачи циркулирующего ВСГ (рис. 3)

Марки каучуков. • • СКЭПТ - Синтетический каучук этилен пропиленовый резино технических изделий; СКН СК бутадиен нитрильный – резиновые изделия; • БК Бутиловый каучук – изделия строительного значения; • СКД Полибутадиеновый – в шинной, резинотехнической, кабельной промышленности; • СКМ (СКМС) Бутадиен стирольный в шинной и резинотехнической промышленности; • СКИ Изопреновые в шинной и резинотехнических изделий широкого ассортимента. • • СКЭХГ - СК эпихлоргидриновый; • • СКПО - СК окись пропилена. • • ДСТ – Дивинил стирольный термоэластопластов – кровельный, обувной, дорожной промышленности.

Марки каучуков СКМС-30 АРКМ-15 - СК метилстирольный(30%) – низкотемпературный – регулированный канифольный маслонаполненный (15%). СКИ 3 СК Изопреновый СКИ 3 С СК изопреновый светлый; СКИ 3 Д СК изопреновый – диэлектрический; СКИ 5 ПМ пищевой, медицинский

Полимеризация Способы производства ПВХ • • • 1. Полимеризация в массе — блочный метод 2. Эмульсионная полимеризация 3. Суспензионная полимеризация Полимеризация в массе — способ, происходящий по периодической схеме в 2 ступени. Данная технология развивается единственной фирмой Peshine Sant Gobain (Франция). В последние время интерес к этому способу упал, так как полученная таким образом смола поливинилхлоридная имеет достаточно узкое применение и сложно освобождается от остаточного винилхлорида. Данный метод имеет следующие недостатки: в процессе реакции необходимо выдерживать определенную температуру, но из за конструктивных особенностей отвод тепла реакции, в данном случае, затруднен; образование корки на стенках аппаратуры влияет на однородность получаемого поливинилхлорида; получаемая смола имеет сравнительно низкие характеристики термостойкости и однородности;

Эмульсионная полимеризация • • — способ, происходящий по непрерывной или периодической схемам. Непрерывная схема — самая высокопроизводительная, но получаемые частицы эмульсионной смолы имеют слишком разнородный состав, поэтомучаще используется периодическая схема. При периодической технологии ПВХ эмульсионная смола получается необходимого гранулометрического состава, что важно при её переработки. Производство эмульсионной смолы имеет весомый недостаток это добавки (различные вспомогательные вещества), которые с одной стороны ускоряют и увеличивают образование ПВХ эмульсионной смолы, а с другой ее загрязняют. Из за этого эмульсионная смола ПВХ в конечном итоге используется только для производства пластизолей и паст. ПВХ эмульсионная смола имеет широкое молекулярно массовое распределение, высокое содержание примесей и относительно высокое водопоглощение, худшие диэлектрические характеристики, худшею термостойкость и светостойкость. ПВХ эмульсионная смола перерабатывается в изделия методом экструзии, литьем под давлением, прессованием, в мягкие же изделия через пасты.

Суспензионная полимеризация Способ, происходящий по периодической схеме и являющийся самым распространенным методом производства смолы поливинилхлоридной. Данный метод объединяет те преимущества, которых лишены предыдущие два: легкий отвод тепла от реакции; высокая производительность; относительно эмульсионного поливинилхлорида, смола ПВХ суспензионная намного чище; при переработке смола ПВХ суспензионная прекрасно совмещается с другими компонентами; смола суспензионная достаточно легко поддается модификации свойств. Смола ПВХ суспензия обладает сравнительно узким молекулярно массовым распределением, малой степенью разветвленности, высокой степенью чистоты, низким водопоглощением, хорошими диэлектрическими свойствами, лучшей термостойкостью и светостойкостью по сравнению с эмульсионной смолой. Смола ПВХ суспензионная перерабатывается в изделия методом эксрузии, вальцеванием, прессованием и литьем под давлением. Используется суспензионная смола для производства жестких, полумягких и мягких (пластифицированных), пластических масс. Доля смолы ПВХ суспензионной постоянно растет и уже составляет восемьдесят процентов от всего мирового объема производства.

Инициаторы полимеризации Инициатор Trigonox EHP W 60 бис(2 этилгексилпероксидикарбонат) – жидкость с содержанием основного вещества 60 %, в качестве замедлителя используется вода. • Инициатор Перкадокс – дицетилпероксидикарбонат. Выпускается в виде хлопьев или порошка. • Поливиниловый спирт марки РVА К 800 – частично гидролизованный поливинилацетат со степенью гидролиза – 72, 9 мол. %. Применяется в качестве первичного эмульгатора при полимеризации ВХ. • Алькотекс WD 100 – жидкость светло желтого цвета, частично гидролизованный поливинилацетат со степенью гидролиза – 43, 2 %. •

Полимеризация бутадиена с альфаметилстиролом • (сополимеризация) осуществляется под влиянием окислительно восстановительной системы, состоящей из железо трилонового комплекса, ронгалита и гидроперекиси изопропилбензола. • 1 Схема реакции окислительно восстановительного инициирования: • а) образование активного радикала RO˙ гидроперекиси ROOH: • ROOH + Fe 2+ RO˙ + OH¯ + Fe 3+; • б) восстановление трёхвалентного железа в двухвалентное ронгалитом: • O • ║ • 2 Fe 3+ + OH¯ + Na. O – S – CH 2 OH 2 Fe 2+ + Na. O – S – CH 2 OH + H 2 O • ║ • O

Полимеризация бутадиена с альфаметилстиролом • Рост цепи происходит присоединением молекулы мономера к свободному радикалу. • CH 3 • | RO˙ + n. CH 2 = CH 2 + m. CH 2 = C RO (CH 2 CH = C=CH 2)n • | • C 6 H 5 • CH 3 • | • RO ( CH 2 CH = CH 2 )n (CH 2 C)m 1 CH 2 C • | • C 6 H 5 • растущая полимерная цепь (Р˙). Растущая полимерная цепь представляет собой свободный радикал и сохраняет его свойства.

Полимеризация бутадиена с альфаметилстиролом • Регулирование длины цепи под действием третичного додецилмеркаптана С 12 Н 25 SH: • Р˙ + С 12 Н 25 SH РН + С 12 Н 25 S˙ • С 12 Н 25 S˙ + СН 2 = СН 2 С 12 Н 25 S СН 2 СН = СН 2.

Полимеризация бутадиена с альфаметилстиролом • Обрыв цепи осуществляется стоппером при достижении заданной степени конверсии мономеров. ДДК (диметилдитиокарбамат натрия ) разлагаясь на радикалы, взаимодействует с растущей полимерной цепью и прекращает её рост, а также взаимодействует с оставшимся инициатором, предотвращая образование новых радикалов. • • • Н 3 C СН 3 CH 3 N C S Na + 2 ROOH N C S S C N + 2 ROONa H 3 C ║ СН 3 ║ CH 3 S

Полимеризация бутадиена с альфаметилстиролом Обрыв цепи • • Н 3 C СН 3 N C S S N 2 N C S˙ H 3 C ║ СН 3 ║ S
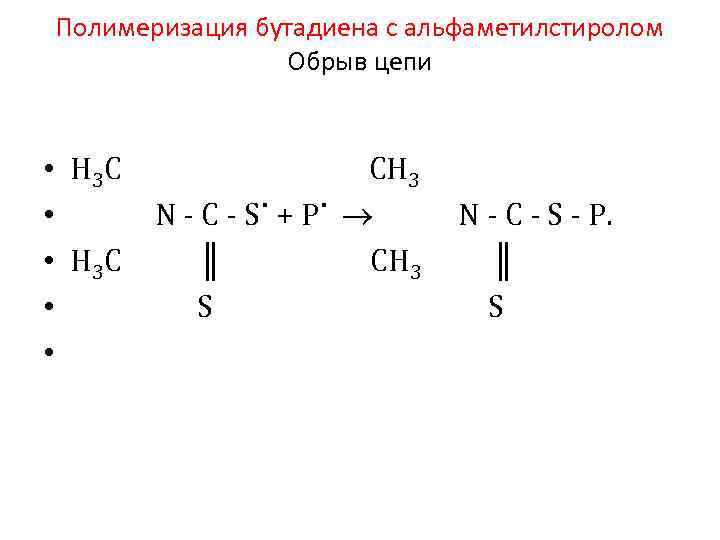
Полимеризация бутадиена с альфаметилстиролом Обрыв цепи • • • Н 3 C СН 3 N C S˙ + P˙ N C S P. H 3 C ║ СН 3 ║ S

ДЭГА (диэтилгидроксиламин )прекращает рост цепи, взаимодействуя со свободными радикалами: • • С 2 Н 5 N C 2 H 5 + P˙ С 2 Н 5 N С 2 Н 5 | | OH O. С 2 Н 5 N C 2 H 5 + P˙ С 2 Н 5 N С 2 Н 5 | | O. О Р

Полимеризация бутадиена с альфаметилстиролом • Полимеризация (сополимеризация) осуществляется под влиянием окислительно восстановительной системы, состоящей из железо трилонового комплекса, ронгалита и инициатора при температуре 4 8 С. • время реакции 14 часов. • • непрерывным способом в полимеризационной батарее, состоящей из последовательно включенных в технологическую схему полимеризаторов , снабжённых перемешивающими устройствами.

Инициаторы полимеризации п Изопропилциклогексилбензола 1, 1 Дифенилэтана Циклогексилбензола 1, 3, 5 Триизопропилбензола п Диизопропилбензола п Изопропил трет. бутилбензола 1 фенил 1 (п этилфенил) этана 1, 4 Ди (изопропил) 2 хлорбензола. Изопропилбензола • п Изопропил втор бутилбензола • п Ди (втор бутил) бензола • •

Эмульсионная полимеризация бутадиена • Промышленное производство синтетических каучуков в подавляющем большинстве случаев состоит из трех стадий: • подготовка исходных компонентов; • полимеризация; • отделение полимера от незаполимеризовавшихся мономеров.

Первая стадия процесса • – подготовка исходных компонентов – включает обычно приготовление растворов определенных концентраций и их дозирование в полимеризационные аппараты. Протекающие при этом процессы дозирования, растворения, фильтрования, подогрева (или охлаждения), обычно не имеют каких либо отличительных особенностей и могут оснащаться типовой химической аппаратурой.

Вторая стадия • На второй стадии технологии происходит образование высокомолекулярного вещества. • Процессы полимеризации при получении синтетических каучуков в зависимости от способа инициирования, природы мономера, желаемой микроструктуры полимера осуществляют в разных условиях: • полимеризация в массе мономера; • полимеризация в растворе; • полимеризация в водной эмульсии.

Исторические ссылки. Эмульсионная полимеризация бутадиена впервые была произведена немецким химиком Гофманом в 1912 г. (без инициатора, под давлением, эмульгатор – яичный белок). • В ходе эмульсионной полимеризации исходная грубодисперсная эмульсия мономеров превращается ( в коллоидную дисперсию полимера)латекс с размерами частиц от 30 до 300 нм. Низкая вязкость реакционной среды позволяет сравнительно легко отводить теплоту полимеризации, но довольно сложными и энергоемкими оказываются процессы отгонки незаполимеризовавшихся мономеров и выделения каучука из латекса. Вместе с тем эти затраты оказываются значительно ниже, чем при выделении каучуков из раствора и регенерации растворителя. Поэтому в целом каучуки, полученные путем эмульсионной полимеризации, имеют более низкую себестоимость, чем растворные.

Достоинства эмульсионной полимеризации возможность получать полимер с высокой молекулярной массой; • возможность регулирования процесса и качества; • возможность проведения процесса при более низких температурах; • уменьшение пожаробезопасности процесса в связи с использованием воды в качестве дисперсионной среды. • Крупнотоннажные процессы растворной и эмульсионной полимеризации осуществляются, как правило, по непрерывной схеме в каскаде реакторов, работающих в режиме, близком к режиму идеального смешения, тогда как работа всего каскада приближа ется к режиму аппаратов полного вытеснения. • Увеличение объема полимеризаторов снижает удельные затраты на производство единицы продукции, Но с ростом объема реактора усложняются проблемы перемешивания и особенно отвода теплоты реакции, и в настоящее время обычно используются полимеризаторы объёмом от 12 до 20 м 3.

Роль основных инградиентов • • основной мономер, основная дисперсная фаза – бутадиен-1, 3; вспомогательный мономер – вещество, вводимое в эмульсию для сополимеризации с основным мономером – альфаметилстирол; эмульсионная или дисперсная среда вода, очищенная от минеральных примесей; эмульгатор – вещество, придающее эмульсии стойкость. В качестве эмульгаторов применяют мыла, обладающие большим молекулярным весом. Это мыла диспропорционированной канифоли, жирные кислоты, лейканол; инициатор – вещество, дающие при распаде радикалы, образующие активные центры полимеризации. регулятор – добавка, приводящая к образованию молекулярной цепи полимера некоторой величины. В качестве регулятора применяются сернистые соединения (меркаптан); активатор – компонент эмульсии, роль которого состоит во взаимодействии с окислителем для выделения свободных радикалов, служащих активными центрами полимеризации.

полимеризация в растворе • Одним из основных способов получения синтетических каучуков в нашей стране стала полимеризация в растворе. Особенностями процесса являются высокая вязкость реакционной среды, что за трудняет отвод теплоты полимеризации, и возможное налипание полимера на стенки реактора. Реже используют вариант растворной полимеризации, при котором полимер не растворяется в используемом растворителе, и полимеризат представляет собой суспензию твердого или набухшего полимера. Вязкость такой системы оказывается ниже, чем в первом случае, что облегчает теплосъем и позволяет повысить содержание полимера в суспензии. Это снижает энергозатраты при последующем выделении полимера и регенерации растворителя.


Производство раствора цис-1, 4 -полиизопрена включает следующие стадии: 1) приготовление каталитического комплекса; 2) приготовление, азеотропная осушка изопентан-изопреновой шихты, отгонка фракции С 4; 3) охлаждение, очистка от микропримесей осушенной изопентан-изопре-новой шихты; 4) полимеризация изопрена в растворе изопентана; 5) дезактивация каталитического комплекса, отмывка и стабилизация полимеризата.


1. Приготовление каталитического комплекса 1. 1 При полимеризации изопрена в производстве каучука марки СКИ 3 применяется каталитический комплекс, который является продуктом взаимодействия четырёххлористого титана с триизобутилалюминием в присутствии дифенилоксида и пиперилена. CH 3 CH ДФО+пиперилен Cl Al(i. C 4 H 9)3 + Ti. Cl 4 Ti Cl CH 2 Cl CH 3 CH 2 Al CH CH 2 Cl В результате реакции, четырёххлористый титан восстанавливается триизобутилалюминием до трёхвалентного и образуется твёрдый кристаллический продукт.

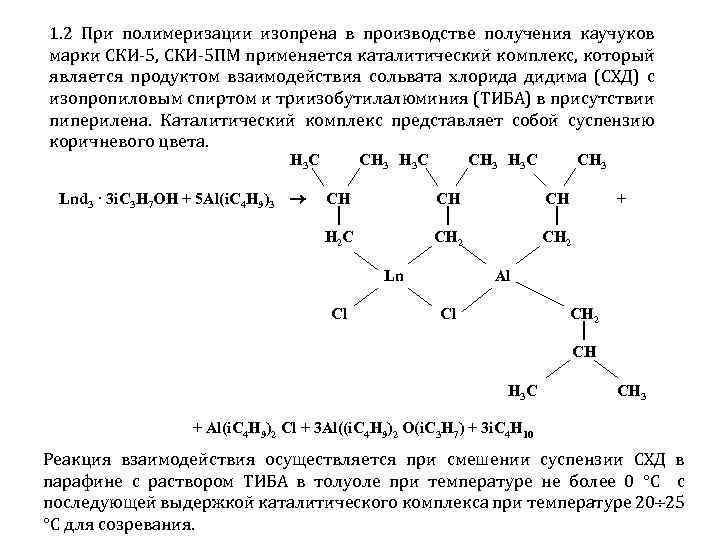
1. 2 При полимеризации изопрена в производстве получения каучуков марки СКИ 5, СКИ 5 ПМ применяется каталитический комплекс, который является продуктом взаимодействия сольвата хлорида дидима (СХД) с изопропиловым спиртом и триизобутилалюминия (ТИБА) в присутствии пиперилена. Каталитический комплекс представляет собой суспензию коричневого цвета. Н 3 С Lnd 3 · 3 i. C 3 H 7 OH + 5 Al(i. C 4 H 9)3 СН 3 Н 3 С СН H 2 C СН 3 Н 3 С СН 2 Ln Cl СН 3 СН 2 + Al Cl СН 2 СН Н 3 С СН 3 + Al(i. C 4 H 9)2 Cl + 3 Al((i. C 4 H 9)2 O(i. C 3 H 7) + 3 i. C 4 H 10 Реакция взаимодействия осуществляется при смешении суспензии СХД в парафине с раствором ТИБА в толуоле при температуре не более 0 С с последующей выдержкой каталитического комплекса при температуре 20 25 С для созревания.


Полимеризация изопрена в растворе изопентана Получение полимеризата для выпуска каучука марки СКИ-3 Процесс полимеризации в растворе является одним из видов каталитической полимеризации, для проведения которой используются высокоактивные стереоспецифические катализаторы Циглера, получаемые взаимодействием металлоорганического соединения с хлоридами титана. Процесс полимеризации состоит из трёх элементарных реакций: 1) зарождение активных центров полимеризации при взаимодействии активных центров катализатора с мономером: Ti. Cl 3 (i. C 4 H 9)2 Al. Cl + i. C 5 H 8 Ti. Cl 3(i. C 4 H 9) (i. C 5 H 8) Al(i. C 4 H 9) Cl 2) рост полимерных цепей при взаимодействии активных центров полимеризации с мономером: Ti. Cl 3 (i. C 4 H 9) (i. C 5 H 8)n Al(i. C 4 H 9)Cl+i. C 5 H 8 Ti. Cl 3(i. C 4 H 9) (i. C 5 H 8)n+1 Al(i. C 4 H 9) Cl 3) обрыв роста полимерных цепей: Ti. Cl 3 (i. C 4 H 9) (i. C 5 H 8)n Al(i. C 4 H 9)Cl Ti. Cl 3 + (i. C 4 H 9) (i. C 5 H 8)n + Al(i. C 4 H 9) Cl Процесс полимеризации изопрена протекает с выделением большого количества тепла. Тепло реакции составляет 964 к. Дж/кг.


Получение полимеризата для выпуска каучука марки СКИ-5 При выпуске каучука марок СКИ 5, СКИ 5 ПМ применяется каталитический комплекс, который является продуктом взаимодействия сольвата хлорида дидима с изопропиловым спиртом и триизобутилалюминием в присутствии пиперилена. Процесс полимеризации состоит из трёх элементарных реакций: 1) зарождение активных центров полимеризации при взаимодействии активных центров катализатора с мономером: i. C 4 H 9 Ln Cl i. C 4 H 9 Al Cl i. C 4 H 9 +i. C 5 H 8 i. C 4 H 9 Ln Cl (i. C 5 H 8)i. C 4 H 9 Al Cl i. C 4 H 9 2) рост полимерных цепей при взаимодействии активных центров полимеризации с мономером: i. C 4 H 9 (i. C 5 H 8)i. C 4 H 9 Ln i. C 4 H 9 Al Cl Cl +(i. C 5 H 8)n i. C 4 H 9 (i. C 5 H 8)ni. C 4 H 9 Ln Cl i. C 4 H 9 Al Cl i. C 4 H 9 3) обрыв роста полимерных цепей под влиянием ДИБАГ i. C 4 H 9 (i. C 5 H 8)ni. C 4 H 9 Ln Cl i. C 4 H 9 R Ln Н i. C 4 H 9 Al Cl H + R-Al-R Al Cl i. C 4 H 9 + R-Al-(i. C 5 H 8)n+1 i. C 4 H 9


Дезактивация каталитического комплекса протекает по следующей реакции: Ti. Cl 3 + 6 СН 3 ОН Ti. Cl 3 6 СН 3 ОН Аl(i. С 4 Н 9)2 Сl + 2 СН 3 ОН Аl. Сl(ОСН 3)2 + 2 С 4 Н 10 При отмывке полимеризата водой от продуктов разложения каталитического комплекса, полученные алкоголяты гидролизуются: Аl. Сl(ОСН 3)2 + 2 Н 2 О Аl. ОСl + 2 СН 3 ОН Ti. Cl 3 6 СН 3 ОН + 6 Н 2 О Ti. Cl 3 6 Н 2 О + 6 СН 3 ОН
ск слайдах.pptx