Тема 2.1.1. Галогены.ppt
- Количество слайдов: 33
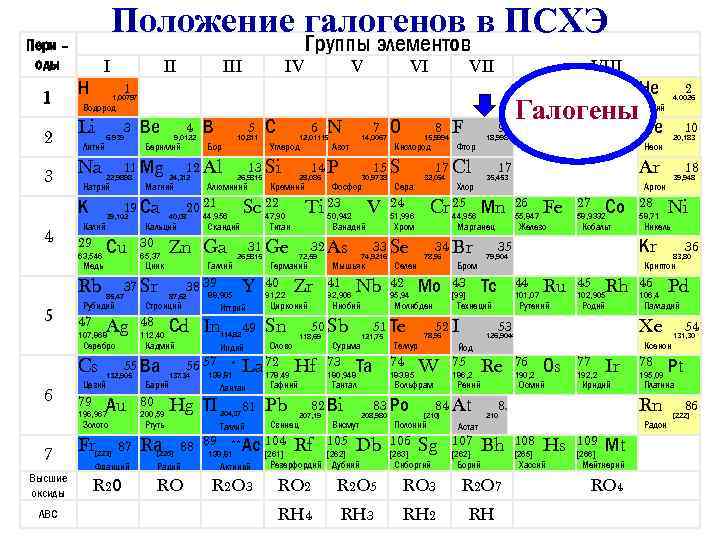 Положение галогенов в ПСХЭ Пери – оды 1 I Н Na Литий 3 6. 939 Калий 29 39, 102 Сu Медь Rb Ag Серебро Cs Цезий 55 Ва 132, 905 196, 967 Золото Fr 112, 40 [223] Алюминий VI Иттрий Сd In 114, 82 80 200, 59 Rа Hg ТI [226] * 138, 81 204, 37 Таллий Zr Цирконий Sn VII Мышьяк 41 92, 906 Nb Сурьма 73 Та VIII Свинец Rf [262] Селен 42 95, 94 Теллур Db Дубний Фтор Марганец 34 Br 78, 96 Мо [263] 26 55, 847 Fe 27 Со 58, 9332 Кобальт 52 I 44 101, 07 Ru Рутений 45 Rh 102, 905 Родий 75 186, 2 Re Рений 84 At Sg Сиборгий 76 190, 2 Оs 77 192, 2 Ir Иридий [262] Bh Франций Радий Актиний Резерфордий Борий R 2 О RO R 2 O 3 RO 2 R 2 O 5 RO 3 R 2 O 7 RH 4 RH 3 RH 2 RH Никель 46 106, 4 36 83, 80 Pd Палладий 78 195, 09 54 Радон 108 [265] Hs Хассий 109 [266] Мt Мейтнерий RO 4 131, 30 Рt Платина Rn 85 210 Астат 107 Ni Ксенон Осмий [210] 58, 71 Xe 126, 9044 Йод W 28 Криптон 53 78, 96 18 39, 948 Кr 35 Технеций Полоний 106 [99] 10 20, 183 Аргон Железо Тс 43 Гелий Ar 79, 904 Бром 2 4. 0026 Неон 17 Хлор Не Nе 35, 453 44, 956 Вольфрам 83 Ро Висмут 105 51, 996 183. 85 208, 980 9 Галогены 18, 9984 Cr 25 Мn 24 74 180, 948 Тантал 207, 19 Сера 32, 064 Молибден 121, 75 F 17 Cl 51 Тe 82 Вi Pb Кислород 33 Se 74, 9216 50 Sb Гафний 8 15, 9994 Хром Ниобий 118, 69 Олово 88 89 ** Ас 104 138, 81 [261] V 32 As 178. 49 81 Фосфор Ванадий 72, 59 О 15 S 30, 9738 50, 942 Германий 91, 22 Азот Ti 23 La 72 Hf Лантан Ртуть 87 49 Индий Барий Кремний 40 7 14, 0067 14 P 28, 086 31 Ge Y N 12, 01115 Титан 26, 9815 88, 905 56 57 Углерод 47, 90 Скандий 38 39 137. 34 6 Sc 22 44, 956 Галлий 87, 62 С 13 Si 26, 9815 Zn Ga Стронций 48 Бор Кадмий Аu 79 65, 37 5 10, 811 20 21 40, 08 Кальций 37 Sr 85, 47 107, 868 ЛВС Магний 30 В 12 Al 24, 312 Цинк Рубидий 47 4 9, 0122 Бериллий 19 Сa 63, 546 Высшие оксиды Ве 11 Мg 22, 9898 Натрий К 7 V Водород 3 6 IV 1 Li 5 III 1, 00797 2 4 II Группы элементов 86 [222]
Положение галогенов в ПСХЭ Пери – оды 1 I Н Na Литий 3 6. 939 Калий 29 39, 102 Сu Медь Rb Ag Серебро Cs Цезий 55 Ва 132, 905 196, 967 Золото Fr 112, 40 [223] Алюминий VI Иттрий Сd In 114, 82 80 200, 59 Rа Hg ТI [226] * 138, 81 204, 37 Таллий Zr Цирконий Sn VII Мышьяк 41 92, 906 Nb Сурьма 73 Та VIII Свинец Rf [262] Селен 42 95, 94 Теллур Db Дубний Фтор Марганец 34 Br 78, 96 Мо [263] 26 55, 847 Fe 27 Со 58, 9332 Кобальт 52 I 44 101, 07 Ru Рутений 45 Rh 102, 905 Родий 75 186, 2 Re Рений 84 At Sg Сиборгий 76 190, 2 Оs 77 192, 2 Ir Иридий [262] Bh Франций Радий Актиний Резерфордий Борий R 2 О RO R 2 O 3 RO 2 R 2 O 5 RO 3 R 2 O 7 RH 4 RH 3 RH 2 RH Никель 46 106, 4 36 83, 80 Pd Палладий 78 195, 09 54 Радон 108 [265] Hs Хассий 109 [266] Мt Мейтнерий RO 4 131, 30 Рt Платина Rn 85 210 Астат 107 Ni Ксенон Осмий [210] 58, 71 Xe 126, 9044 Йод W 28 Криптон 53 78, 96 18 39, 948 Кr 35 Технеций Полоний 106 [99] 10 20, 183 Аргон Железо Тс 43 Гелий Ar 79, 904 Бром 2 4. 0026 Неон 17 Хлор Не Nе 35, 453 44, 956 Вольфрам 83 Ро Висмут 105 51, 996 183. 85 208, 980 9 Галогены 18, 9984 Cr 25 Мn 24 74 180, 948 Тантал 207, 19 Сера 32, 064 Молибден 121, 75 F 17 Cl 51 Тe 82 Вi Pb Кислород 33 Se 74, 9216 50 Sb Гафний 8 15, 9994 Хром Ниобий 118, 69 Олово 88 89 ** Ас 104 138, 81 [261] V 32 As 178. 49 81 Фосфор Ванадий 72, 59 О 15 S 30, 9738 50, 942 Германий 91, 22 Азот Ti 23 La 72 Hf Лантан Ртуть 87 49 Индий Барий Кремний 40 7 14, 0067 14 P 28, 086 31 Ge Y N 12, 01115 Титан 26, 9815 88, 905 56 57 Углерод 47, 90 Скандий 38 39 137. 34 6 Sc 22 44, 956 Галлий 87, 62 С 13 Si 26, 9815 Zn Ga Стронций 48 Бор Кадмий Аu 79 65, 37 5 10, 811 20 21 40, 08 Кальций 37 Sr 85, 47 107, 868 ЛВС Магний 30 В 12 Al 24, 312 Цинк Рубидий 47 4 9, 0122 Бериллий 19 Сa 63, 546 Высшие оксиды Ве 11 Мg 22, 9898 Натрий К 7 V Водород 3 6 IV 1 Li 5 III 1, 00797 2 4 II Группы элементов 86 [222]
 • К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат At • Общее название - галогены (греч. «солеобразующие» ) - большинство их соединений с металлами представляют собой типичные соли (KCl, Na. Cl и т. д. ).
• К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат At • Общее название - галогены (греч. «солеобразующие» ) - большинство их соединений с металлами представляют собой типичные соли (KCl, Na. Cl и т. д. ).
 • В свободном виде не встречаются Флюорит Ca. F 2
• В свободном виде не встречаются Флюорит Ca. F 2
 Галит Na. Cl
Галит Na. Cl
 Cильвинит KCl Na. Cl
Cильвинит KCl Na. Cl
 Нахождение галогенов в природе Апатит 3 Ca(PO 4 ) 2*Ca. F 2
Нахождение галогенов в природе Апатит 3 Ca(PO 4 ) 2*Ca. F 2
 Ag. I (йодаргирит)примесь к другим минералам
Ag. I (йодаргирит)примесь к другим минералам
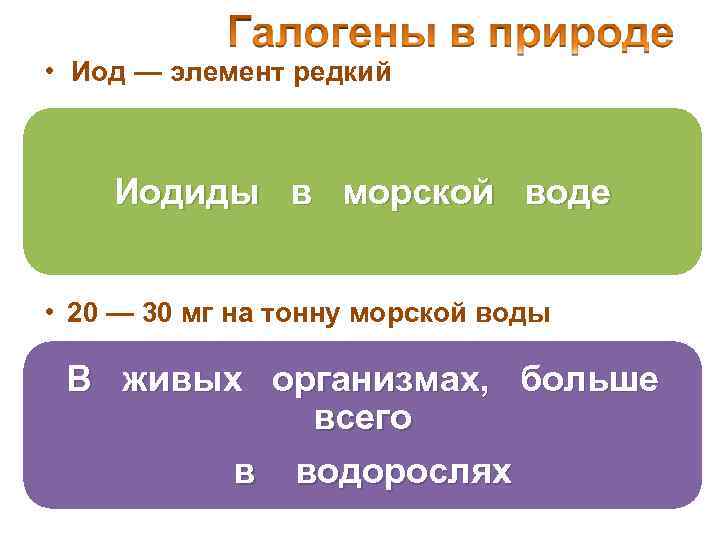 • Иод — элемент редкий Иодиды в морской воде • 20 — 30 мг на тонну морской воды В живых организмах, больше всего в водорослях
• Иод — элемент редкий Иодиды в морской воде • 20 — 30 мг на тонну морской воды В живых организмах, больше всего в водорослях
 5 кг на тонну высушенной морской капусты (ламинарии)
5 кг на тонну высушенной морской капусты (ламинарии)
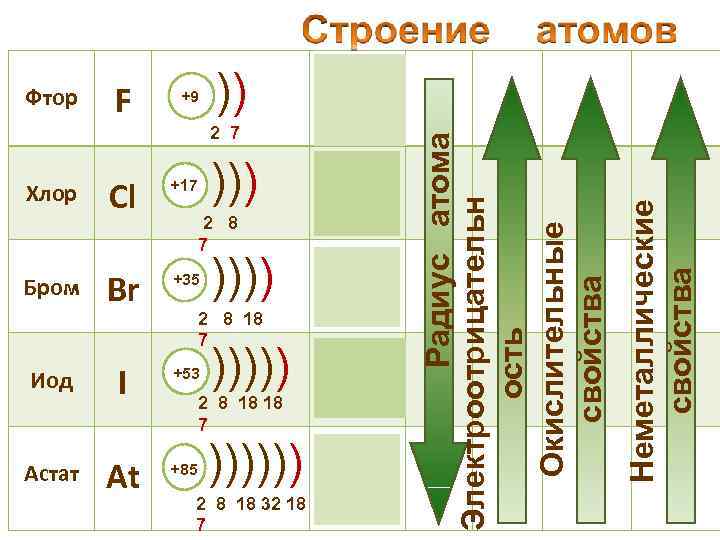 +9 )) 2 s 22 р5 2 7 ))) Cl +17 Br +35 Иод I +53 Астат At +85 Хлор Бром 3 s 23 p 5 2 8 7 )))) 4 s 24 p 5 2 8 18 7 ))))) 5 s 25 p 5 2 8 18 18 7 )))))) 6 s 6 p 2 5 2 8 18 32 18 7 Неметаллические свойства F Радиус атома Электроотрицательн ость Окислительные свойства Фтор
+9 )) 2 s 22 р5 2 7 ))) Cl +17 Br +35 Иод I +53 Астат At +85 Хлор Бром 3 s 23 p 5 2 8 7 )))) 4 s 24 p 5 2 8 18 7 ))))) 5 s 25 p 5 2 8 18 18 7 )))))) 6 s 6 p 2 5 2 8 18 32 18 7 Неметаллические свойства F Радиус атома Электроотрицательн ость Окислительные свойства Фтор
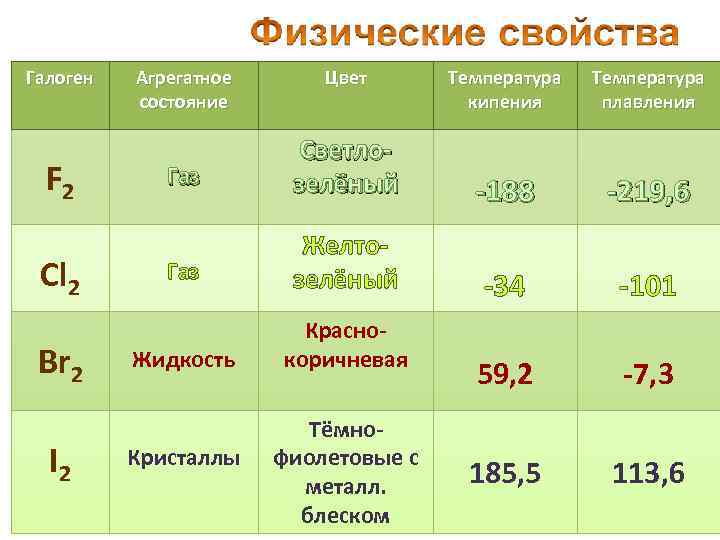 Галоген F 2 Cl 2 Br 2 I 2 Агрегатное состояние Tемпература кипения Температура плавления Газ Светлозелёный -188 -219, 6 Газ Желтозелёный -34 -101 Жидкость Краснокоричневая 59, 2 -7, 3 185, 5 113, 6 Кристаллы Цвет Тёмнофиолетовые с металл. блеском
Галоген F 2 Cl 2 Br 2 I 2 Агрегатное состояние Tемпература кипения Температура плавления Газ Светлозелёный -188 -219, 6 Газ Желтозелёный -34 -101 Жидкость Краснокоричневая 59, 2 -7, 3 185, 5 113, 6 Кристаллы Цвет Тёмнофиолетовые с металл. блеском
 Галогены
Галогены
 9 18, 99 8 7 2 • Название "фтор" (от греческого phthoros - разрушение, гибель) • В свободном состоянии фтор был получен 26 июня 1886 г. французским химиком Муассаном. • Это зеленовато-желтый газ, немного тяжелее воздуха, с характерным запахом и необыкновенной химической
9 18, 99 8 7 2 • Название "фтор" (от греческого phthoros - разрушение, гибель) • В свободном состоянии фтор был получен 26 июня 1886 г. французским химиком Муассаном. • Это зеленовато-желтый газ, немного тяжелее воздуха, с характерным запахом и необыкновенной химической
 17 35, 45 3 7 8 2 • Хлор был открыт шведским химиком Карлом Шееле в 1774 г. • в 1810 году сэр Гемфри Дэви назвал газ "хлорином"(Chlorine), от греческого "зелёный". • Этот термин используется в английском языке, а в других языках закрепилось название "хлор". • Газ желто-зеленого цвета с резким запахом, ядовит • в 2, 5 раза тяжелее воздуха
17 35, 45 3 7 8 2 • Хлор был открыт шведским химиком Карлом Шееле в 1774 г. • в 1810 году сэр Гемфри Дэви назвал газ "хлорином"(Chlorine), от греческого "зелёный". • Этот термин используется в английском языке, а в других языках закрепилось название "хлор". • Газ желто-зеленого цвета с резким запахом, ядовит • в 2, 5 раза тяжелее воздуха
 35 79, 9 7 18 8 2 79 Вr (50, 56%) 81 Вr (49, 44%) • от греч. bromos – зловоние • единственный неметалл, жидкий при комнатной температуре • тяжелая красно-бурая жидкость с неприятным запахом • пары брома имеют желто-бурый цвет • при температуре – 7, 25° C бром затвердевает, превращаясь в краснокоричневые игольчатые кристаллы со слабым металлическим блеском
35 79, 9 7 18 8 2 79 Вr (50, 56%) 81 Вr (49, 44%) • от греч. bromos – зловоние • единственный неметалл, жидкий при комнатной температуре • тяжелая красно-бурая жидкость с неприятным запахом • пары брома имеют желто-бурый цвет • при температуре – 7, 25° C бром затвердевает, превращаясь в краснокоричневые игольчатые кристаллы со слабым металлическим блеском
 53 7 18 18 8 2 • от греч. iodes—имеющий фиалковый цвет • в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); • пары -фиолетового цвета Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент 126, 9 Известны 37 изотопов иода с массовыми числами
53 7 18 18 8 2 • от греч. iodes—имеющий фиалковый цвет • в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); • пары -фиолетового цвета Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент 126, 9 Известны 37 изотопов иода с массовыми числами
 • Превращение в пары, минуя жидкое состояние
• Превращение в пары, минуя жидкое состояние
 • Молекулы галогенов состоят из двух атомов. Cl + Cl → Cl Cl • Связь – ковалентная неполярная
• Молекулы галогенов состоят из двух атомов. Cl + Cl → Cl Cl • Связь – ковалентная неполярная
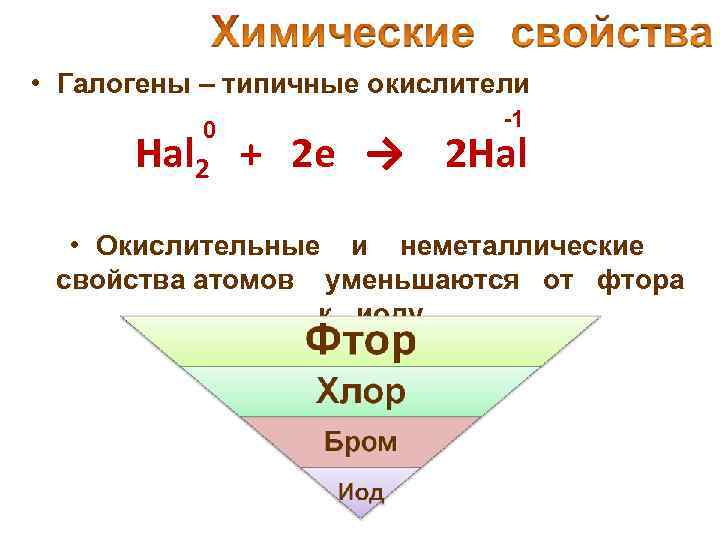 • Галогены – типичные окислители 0 -1 Hal 2 + 2 e → 2 Hal • Окислительные и неметаллические свойства атомов уменьшаются от фтора к иоду
• Галогены – типичные окислители 0 -1 Hal 2 + 2 e → 2 Hal • Окислительные и неметаллические свойства атомов уменьшаются от фтора к иоду
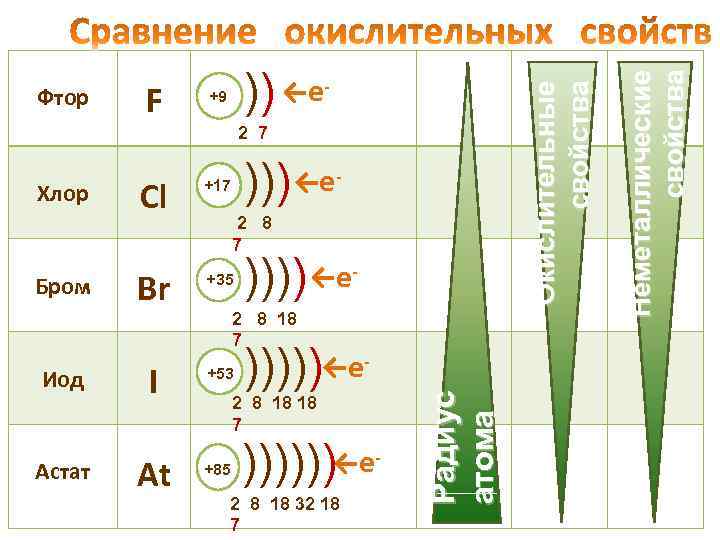 - 2 7 ))) Cl +17 Br +35 Иод I +53 Астат At +85 Бром 2 8 7 )))) ←е - 2 8 18 7 ← - ))))) е 2 8 18 18 7 )))))) ←е - 2 8 18 32 18 7 Радиус атома Хлор ←е - Неметаллические свойства F )) ←е +9 Окислительные свойства Фтор
- 2 7 ))) Cl +17 Br +35 Иод I +53 Астат At +85 Бром 2 8 7 )))) ←е - 2 8 18 7 ← - ))))) е 2 8 18 18 7 )))))) ←е - 2 8 18 32 18 7 Радиус атома Хлор ←е - Неметаллические свойства F )) ←е +9 Окислительные свойства Фтор
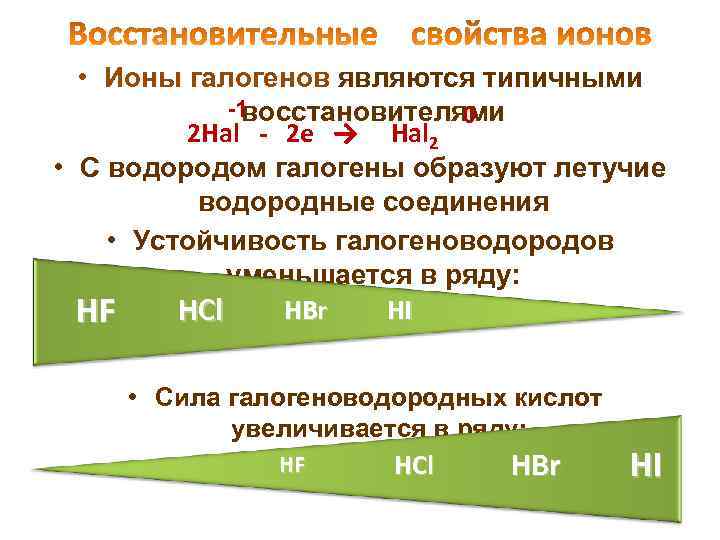 • Ионы галогенов являются типичными -1 восстановителями 0 2 Hal - 2 e → Hal 2 • С водородом галогены образуют летучие водородные соединения • Устойчивость галогеноводородов уменьшается в ряду: HBr HI HCl HF • Cила галогеноводородных кислот увеличивается в ряду: HF HCl HBr HI
• Ионы галогенов являются типичными -1 восстановителями 0 2 Hal - 2 e → Hal 2 • С водородом галогены образуют летучие водородные соединения • Устойчивость галогеноводородов уменьшается в ряду: HBr HI HCl HF • Cила галогеноводородных кислот увеличивается в ряду: HF HCl HBr HI
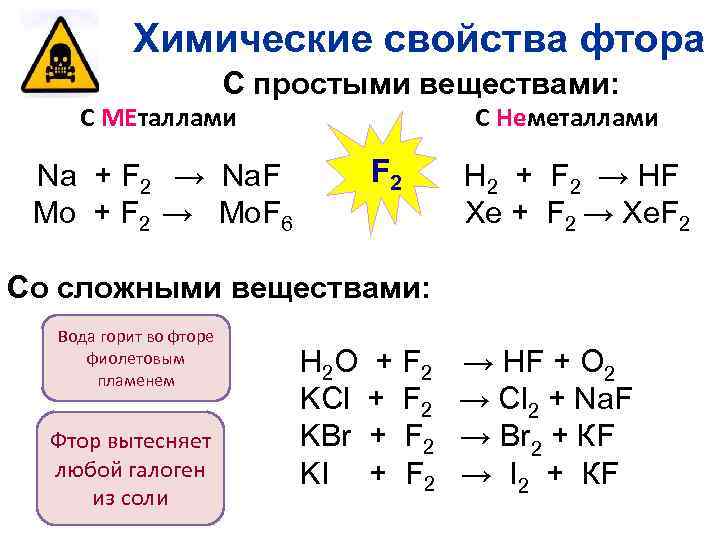 Химические свойства фтора С простыми веществами: С МЕталлами Na + F 2 → Na. F Mo + F 2 → Mo. F 6 С Неметаллами F 2 H 2 + F 2 → HF Xe + F 2 → Xe. F 2 Со сложными веществами: Вода горит во фторе фиолетовым пламенем H 2 O + F 2 KCl + F 2 KBr + F 2 Фтор вытесняет любой галоген KI + F 2 из соли → HF + O 2 → Cl 2 + Na. F → Br 2 + КF → I 2 + КF
Химические свойства фтора С простыми веществами: С МЕталлами Na + F 2 → Na. F Mo + F 2 → Mo. F 6 С Неметаллами F 2 H 2 + F 2 → HF Xe + F 2 → Xe. F 2 Со сложными веществами: Вода горит во фторе фиолетовым пламенем H 2 O + F 2 KCl + F 2 KBr + F 2 Фтор вытесняет любой галоген KI + F 2 из соли → HF + O 2 → Cl 2 + Na. F → Br 2 + КF → I 2 + КF
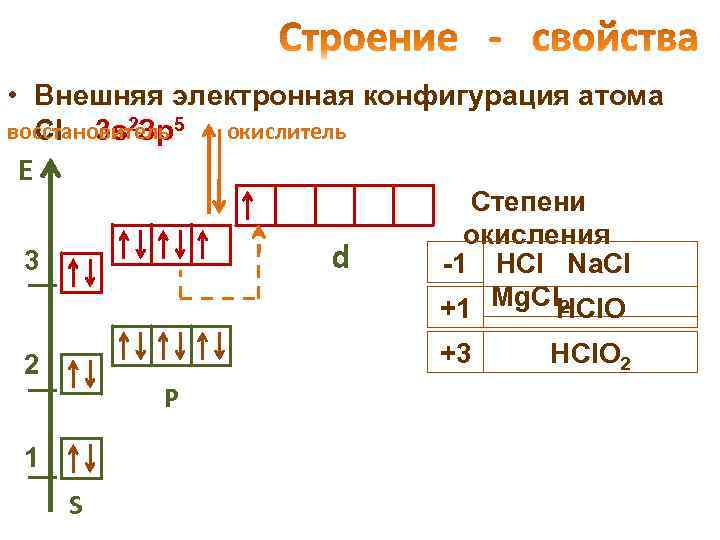 • Внешняя электронная конфигурация атома восстановитель 5 окислитель Cl 3 s 2 Зр Е d 3 Степени окисления -1 HCl Na. Cl 2 +1 Mg. Cl. HCl. O +3 2 Р 1 S HCl. O 2
• Внешняя электронная конфигурация атома восстановитель 5 окислитель Cl 3 s 2 Зр Е d 3 Степени окисления -1 HCl Na. Cl 2 +1 Mg. Cl. HCl. O +3 2 Р 1 S HCl. O 2
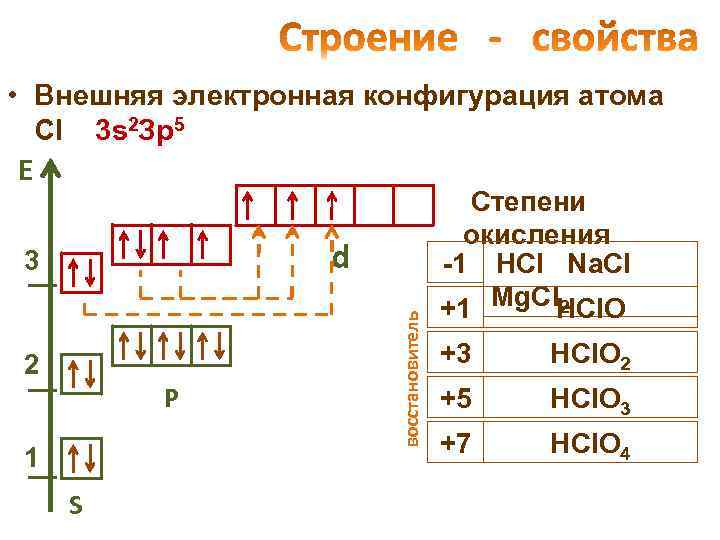 • Внешняя электронная конфигурация атома Cl 3 s 2 Зр5 Е 2 Р 1 S восстановитель d 3 Степени окисления -1 HCl Na. Cl 2 +1 Mg. Cl. HCl. O +3 HCl. O 2 +5 HCl. O 3 +7 HCl. O 4
• Внешняя электронная конфигурация атома Cl 3 s 2 Зр5 Е 2 Р 1 S восстановитель d 3 Степени окисления -1 HCl Na. Cl 2 +1 Mg. Cl. HCl. O +3 HCl. O 2 +5 HCl. O 3 +7 HCl. O 4
 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии -1 влаги или при нагревании): 2 Na + Cl 2 → 2 Na. Cl -1 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 2. Взаимодействие с неметаллами C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. -1 Cl 2 + H 2 → 2 HCl -1 5 Cl 2 + 2 P → 2 PCl 5
1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии -1 влаги или при нагревании): 2 Na + Cl 2 → 2 Na. Cl -1 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 2. Взаимодействие с неметаллами C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. -1 Cl 2 + H 2 → 2 HCl -1 5 Cl 2 + 2 P → 2 PCl 5
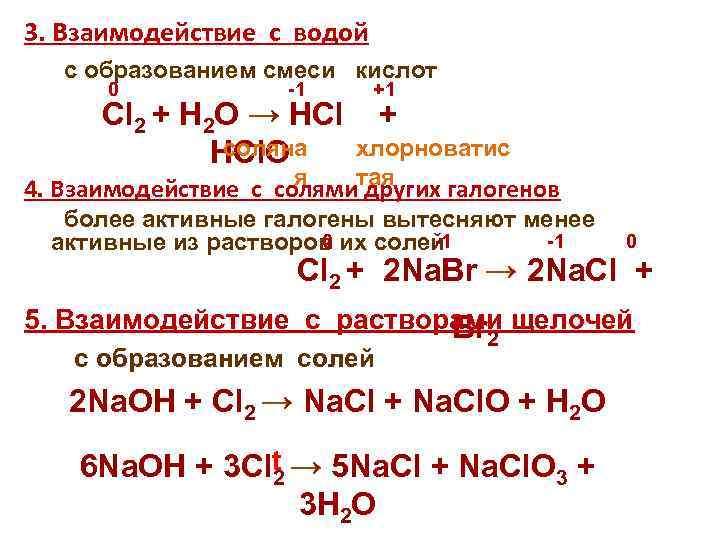 3. Взаимодействие с водой с образованием смеси кислот 0 -1 +1 Cl 2 + H 2 О → HCl + соляна хлорноватис HCl. O я 4. Взаимодействие с солямитая других галогенов более активные галогены вытесняют менее 0 -1 -1 активные из растворов их солей 0 Cl 2 + 2 Na. Br → 2 Na. Cl + 5. Взаимодействие с растворами щелочей Br с образованием солей 2 2 Na. OH + Cl 2 → Na. Cl + Na. Cl. O + H 2 O 6 Na. OH + 3 Clt → 5 Na. Cl + Na. Cl. O 3 + 2 3 H 2 O
3. Взаимодействие с водой с образованием смеси кислот 0 -1 +1 Cl 2 + H 2 О → HCl + соляна хлорноватис HCl. O я 4. Взаимодействие с солямитая других галогенов более активные галогены вытесняют менее 0 -1 -1 активные из растворов их солей 0 Cl 2 + 2 Na. Br → 2 Na. Cl + 5. Взаимодействие с растворами щелочей Br с образованием солей 2 2 Na. OH + Cl 2 → Na. Cl + Na. Cl. O + H 2 O 6 Na. OH + 3 Clt → 5 Na. Cl + Na. Cl. O 3 + 2 3 H 2 O
 1. В промышленности: электролиз расплава или раствора хлорида натрия 2 Na. Cl → 2 Na + Cl 2 2. В лаборатории: 4 HСl + Mn. O 2 → Mn. Cl 2 + Cl 2 ↑+ H 2 O HСl + Mn. O ↑+ 2 H 16 HСl + 2 KMn. O 4 → 2 KСl + 2 Mn. Cl 2 + 5 Cl 2 ↑+ 8 H 2 O
1. В промышленности: электролиз расплава или раствора хлорида натрия 2 Na. Cl → 2 Na + Cl 2 2. В лаборатории: 4 HСl + Mn. O 2 → Mn. Cl 2 + Cl 2 ↑+ H 2 O HСl + Mn. O ↑+ 2 H 16 HСl + 2 KMn. O 4 → 2 KСl + 2 Mn. Cl 2 + 5 Cl 2 ↑+ 8 H 2 O
 Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида I II IV ?
Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида I II IV ?
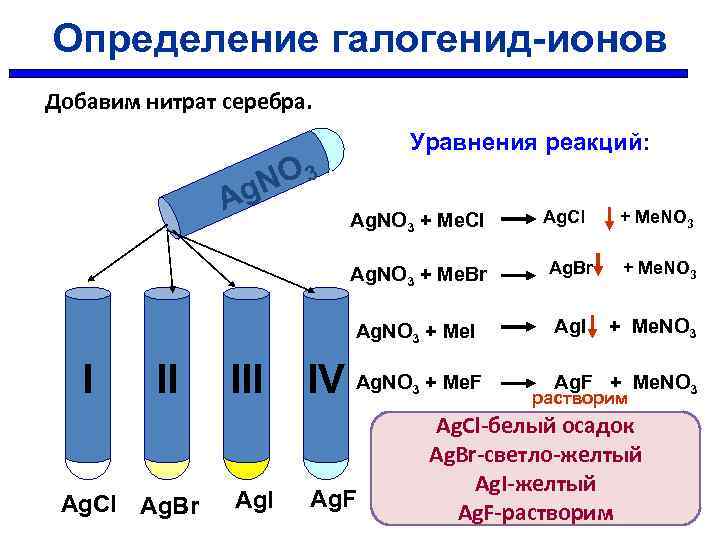 Определение галогенид-ионов Добавим нитрат серебра. Уравнения реакций: NO 3 g A Ag. Cl Ag. Br III Ag. Br + Me. NO 3 Ag. NO 3 + Me. I II Ag. Cl + Me. NO 3 Ag. NO 3 + Me. Br I Ag. NO 3 + Me. Cl Ag. I + Me. NO 3 IV Ag. NO + Me. F 3 Ag. F + Me. NO 3 растворим Ag. Cl-белый осадок Ag. Br-светло-желтый Ag. I-желтый Ag. F-растворим
Определение галогенид-ионов Добавим нитрат серебра. Уравнения реакций: NO 3 g A Ag. Cl Ag. Br III Ag. Br + Me. NO 3 Ag. NO 3 + Me. I II Ag. Cl + Me. NO 3 Ag. NO 3 + Me. Br I Ag. NO 3 + Me. Cl Ag. I + Me. NO 3 IV Ag. NO + Me. F 3 Ag. F + Me. NO 3 растворим Ag. Cl-белый осадок Ag. Br-светло-желтый Ag. I-желтый Ag. F-растворим
 Химические свойства галогенов Хлор хвалился: «Нет мне равных! Галоген я - самый главный. Зря болтать я не люблю: Всё на свете отбелю!» Йод красой своей гордился, Твердым был, но испарился. Фиолетовый как ночь, Далеко умчался прочь. Бром разлился океаном, Хоть зловонным. Но румяным. Бил себя он грозно в грудь: «Я ведь бром! Не кто-нибудь!. . » Фтор молчал и думал: «Эх!. . Ведь приду – окислю всех…»
Химические свойства галогенов Хлор хвалился: «Нет мне равных! Галоген я - самый главный. Зря болтать я не люблю: Всё на свете отбелю!» Йод красой своей гордился, Твердым был, но испарился. Фиолетовый как ночь, Далеко умчался прочь. Бром разлился океаном, Хоть зловонным. Но румяным. Бил себя он грозно в грудь: «Я ведь бром! Не кто-нибудь!. . » Фтор молчал и думал: «Эх!. . Ведь приду – окислю всех…»
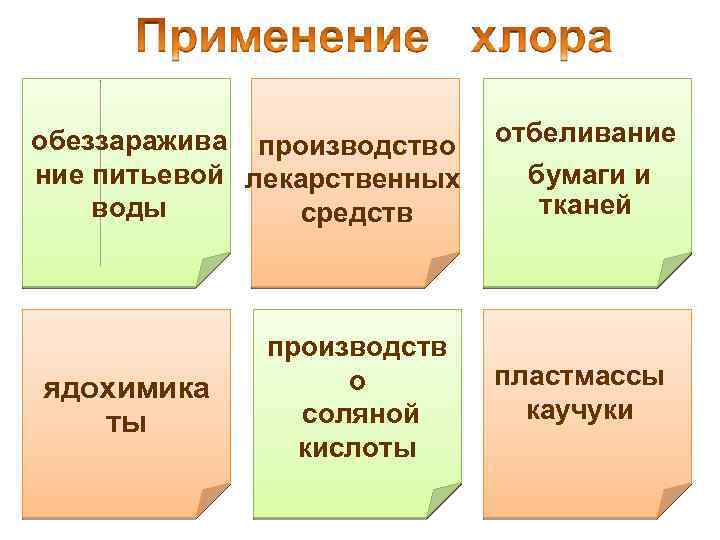 обеззаражива производство отбеливание бумаги и ние питьевой лекарственных тканей воды средств ядохимика ты производств о соляной кислоты пластмассы каучуки
обеззаражива производство отбеливание бумаги и ние питьевой лекарственных тканей воды средств ядохимика ты производств о соляной кислоты пластмассы каучуки
 В медицине - 5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения - В рентгенологических и томографических исследованиях применяются йодсодержащие В технике контрастные препараты - Галоге нная ла мпа — лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода) - Лазерный термоядерный синтез - иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах
В медицине - 5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения - В рентгенологических и томографических исследованиях применяются йодсодержащие В технике контрастные препараты - Галоге нная ла мпа — лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода) - Лазерный термоядерный синтез - иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах


