ПЦР 2003.ppt
- Количество слайдов: 17
 Полимеразная цепная реакция
Полимеразная цепная реакция
 Полимеразная цепная реакция Это уникальная методика, которая заключается в копировании выбранного фрагмента генома возбудителя много миллионов раз с помощью термостабильной ДНКполимеразы в термоциклере, обеспечивающем необходимое для процесса циклическое изменение температуры по заданной программе.
Полимеразная цепная реакция Это уникальная методика, которая заключается в копировании выбранного фрагмента генома возбудителя много миллионов раз с помощью термостабильной ДНКполимеразы в термоциклере, обеспечивающем необходимое для процесса циклическое изменение температуры по заданной программе.
 Строение ДНК Дезоксирибонуклеиновая кислота (ДНК) – один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК построена в виде двойной спирали, состоящей из двух полинуклеотидных цепей, сплетенных друг с другом так, что на каждый виток спирали приходится 10 пар оснований. Каждый нуклеотид состоит из пятиуглеродного сахара, остатка фосфорной кислоты и одного из четырех азотистых оснований.
Строение ДНК Дезоксирибонуклеиновая кислота (ДНК) – один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК построена в виде двойной спирали, состоящей из двух полинуклеотидных цепей, сплетенных друг с другом так, что на каждый виток спирали приходится 10 пар оснований. Каждый нуклеотид состоит из пятиуглеродного сахара, остатка фосфорной кислоты и одного из четырех азотистых оснований.
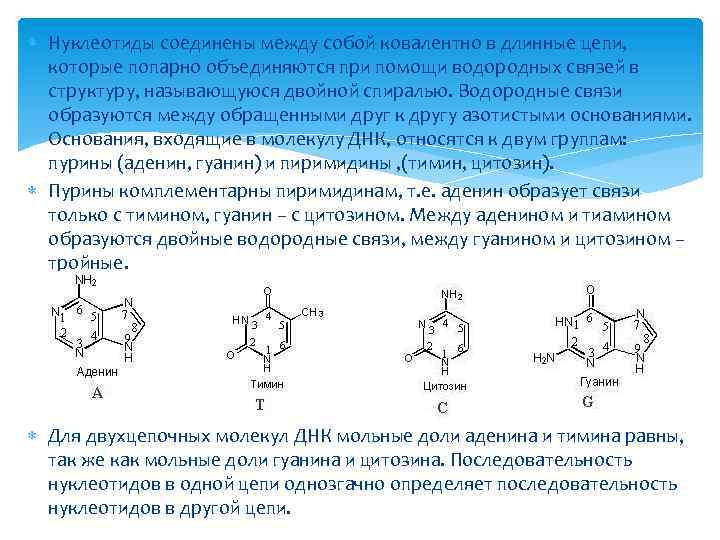 Нуклеотиды соединены между собой ковалентно в длинные цепи, которые попарно объединяются при помощи водородных связей в структуру, называющуюся двойной спиралью. Водородные связи образуются между обращенными друг к другу азотистыми основаниями. Основания, входящие в молекулу ДНК, относятся к двум группам: пурины (аденин, гуанин) и пиримидины , (тимин, цитозин). Пурины комплементарны пиримидинам, т. е. аденин образует связи только с тимином, гуанин – с цитозином. Между аденином и тиамином образуются двойные водородные связи, между гуанином и цитозином – тройные. Для двухцепочных молекул ДНК мольные доли аденина и тимина равны, так же как мольные доли гуанина и цитозина. Последовательность нуклеотидов в одной цепи однозгачно определяет последовательность нуклеотидов в другой цепи.
Нуклеотиды соединены между собой ковалентно в длинные цепи, которые попарно объединяются при помощи водородных связей в структуру, называющуюся двойной спиралью. Водородные связи образуются между обращенными друг к другу азотистыми основаниями. Основания, входящие в молекулу ДНК, относятся к двум группам: пурины (аденин, гуанин) и пиримидины , (тимин, цитозин). Пурины комплементарны пиримидинам, т. е. аденин образует связи только с тимином, гуанин – с цитозином. Между аденином и тиамином образуются двойные водородные связи, между гуанином и цитозином – тройные. Для двухцепочных молекул ДНК мольные доли аденина и тимина равны, так же как мольные доли гуанина и цитозина. Последовательность нуклеотидов в одной цепи однозгачно определяет последовательность нуклеотидов в другой цепи.
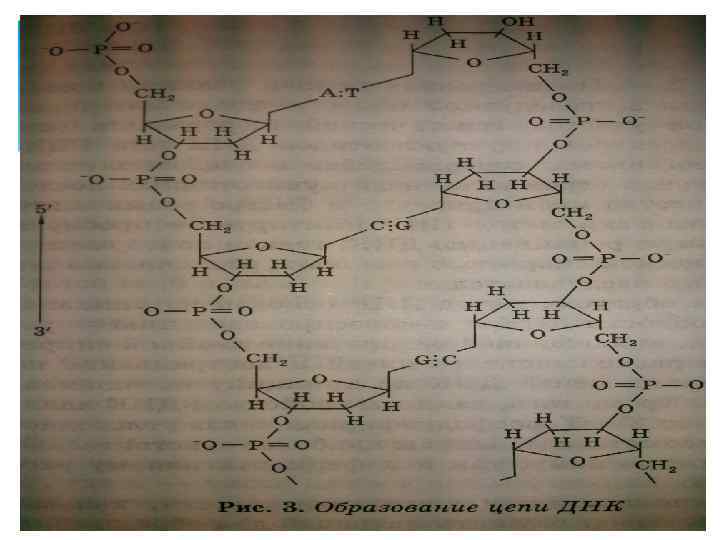
 Остов каждой спирали состоит из регулярно чередующихся фосфатов и сахаров. Фосфатные группы формируют фосфодиэфирные связи между третьим и пятым атомами углерода соседних молекул дезоксирибозы в результате взаимодействия между 3’-гидроксильной группой одной молекулы дезоксирибозы и 5’-фосфатной группой другой. Ассиметричные концы цепи ДНК называются 5’ (пять штрих) и 3’ (три штрих). По своему химическому строению две цепи молекулы ДНК ориентированы противоположно – цепи «антипараллельны» другу, 3’-конец одной цепи связан с 5’-концом другой, и наоборот (рис. 3). Носитель генетической информации должен удовлетворять двум основным требованиям: воспроизводиться с высокой точностью и детерминировать синтез белковых молекул.
Остов каждой спирали состоит из регулярно чередующихся фосфатов и сахаров. Фосфатные группы формируют фосфодиэфирные связи между третьим и пятым атомами углерода соседних молекул дезоксирибозы в результате взаимодействия между 3’-гидроксильной группой одной молекулы дезоксирибозы и 5’-фосфатной группой другой. Ассиметричные концы цепи ДНК называются 5’ (пять штрих) и 3’ (три штрих). По своему химическому строению две цепи молекулы ДНК ориентированы противоположно – цепи «антипараллельны» другу, 3’-конец одной цепи связан с 5’-концом другой, и наоборот (рис. 3). Носитель генетической информации должен удовлетворять двум основным требованиям: воспроизводиться с высокой точностью и детерминировать синтез белковых молекул.
 Основные компоненты ПЦР Для создания стартовых блоков в заданных участках ДНК используют две олигонуклеотидные затравки – праймеры размером 20 -30 нуклеотидов, комплементарные участкам матричной ДНК, между которыми находится последовательность-мишень. ДНК-полимераза – фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент читает и использует в качестве матрицы. ДНК-полимераза начинает репликацию ДНК, связываясь с отрезком моноспирали.
Основные компоненты ПЦР Для создания стартовых блоков в заданных участках ДНК используют две олигонуклеотидные затравки – праймеры размером 20 -30 нуклеотидов, комплементарные участкам матричной ДНК, между которыми находится последовательность-мишень. ДНК-полимераза – фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент читает и использует в качестве матрицы. ДНК-полимераза начинает репликацию ДНК, связываясь с отрезком моноспирали.
 Полимеразная цепная реакция - это циклический процесс, принцип которого сводится к следующему: молекулу ДНК подвергают температурному плавлению при температуре 95 °С (денатурация) для расплетения двойной цепи ДНК; затем при охлаждении до 55 -65 °С праймеры комплементарно присоединяются к специфическому фрагменту одноцепочечной ДНК (отжиг праймеров), и при последующем повышении температуры до 72 °С начинается ферментативный процесс достройки (синтез, элонгации) молекулы ДНК при участии ДНК-полимеразы. Эти три операции составляют один цикл ПЦР и приводят к удвоению количества ДНК в исследуемом образце. Во время денатурации под действием высокой температуры происходит разрыв водородных связей между азотистыми основаниями двухцепочечной молекулы ДНК, цепи разделяются, и ДНК переходит в одноцепочечную форму (15 -30 сек). Затем температуру понижают до оптимальной (для каждого возбудителя) температуры отжига праймеров. Одноцепочечные участки ДНК, комплементарные другу, стремятся гибридизоваться, вновь образуя двухцепочечную структуру.
Полимеразная цепная реакция - это циклический процесс, принцип которого сводится к следующему: молекулу ДНК подвергают температурному плавлению при температуре 95 °С (денатурация) для расплетения двойной цепи ДНК; затем при охлаждении до 55 -65 °С праймеры комплементарно присоединяются к специфическому фрагменту одноцепочечной ДНК (отжиг праймеров), и при последующем повышении температуры до 72 °С начинается ферментативный процесс достройки (синтез, элонгации) молекулы ДНК при участии ДНК-полимеразы. Эти три операции составляют один цикл ПЦР и приводят к удвоению количества ДНК в исследуемом образце. Во время денатурации под действием высокой температуры происходит разрыв водородных связей между азотистыми основаниями двухцепочечной молекулы ДНК, цепи разделяются, и ДНК переходит в одноцепочечную форму (15 -30 сек). Затем температуру понижают до оптимальной (для каждого возбудителя) температуры отжига праймеров. Одноцепочечные участки ДНК, комплементарные другу, стремятся гибридизоваться, вновь образуя двухцепочечную структуру.
 Преимущественно начинают образовываться комплекс «праймерматричная ДНК» , причем этот комплекс ограничен 5’-концами праймеров на обеих цепях исходной молекулы ДНК. При образованиии такого комплекса появляются условия для начала работы ДНКполимеразы (двухцепочечная ДНК с выступающим 3’-концом является субстратом для ДНК-полимеразы). Время отжига праймеров 10 секунд – 1 минута. В дальнейшем температуру повышают до 72 °С и начинается элонгация двухцепочечных молекул ДНК.
Преимущественно начинают образовываться комплекс «праймерматричная ДНК» , причем этот комплекс ограничен 5’-концами праймеров на обеих цепях исходной молекулы ДНК. При образованиии такого комплекса появляются условия для начала работы ДНКполимеразы (двухцепочечная ДНК с выступающим 3’-концом является субстратом для ДНК-полимеразы). Время отжига праймеров 10 секунд – 1 минута. В дальнейшем температуру повышают до 72 °С и начинается элонгация двухцепочечных молекул ДНК.
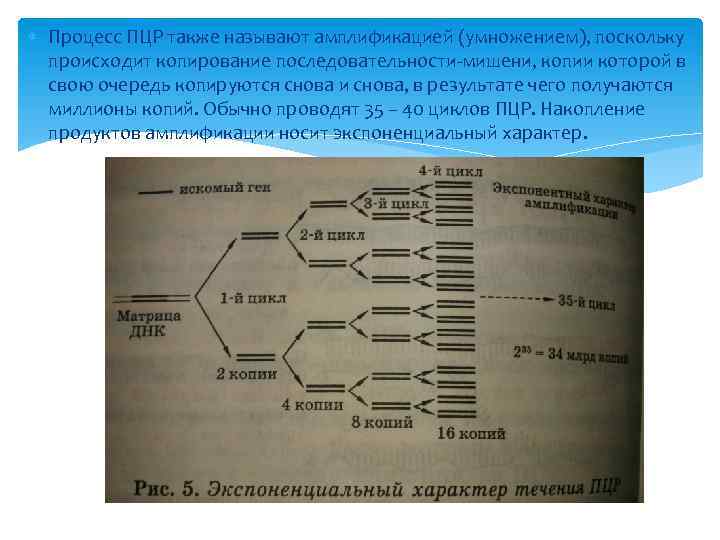 Процесс ПЦР также называют амплификацией (умножением), поскольку происходит копирование последовательности-мишени, копии которой в свою очередь копируются снова и снова, в результате чего получаются миллионы копий. Обычно проводят 35 – 40 циклов ПЦР. Накопление продуктов амплификации носит экспоненциальный характер.
Процесс ПЦР также называют амплификацией (умножением), поскольку происходит копирование последовательности-мишени, копии которой в свою очередь копируются снова и снова, в результате чего получаются миллионы копий. Обычно проводят 35 – 40 циклов ПЦР. Накопление продуктов амплификации носит экспоненциальный характер.
 Постановку ПЦР осуществляют в специальном программируемом термостате – амплификаторе.
Постановку ПЦР осуществляют в специальном программируемом термостате – амплификаторе.
 Электрофоретическая детекция продуктов амплификации Заключительным этапом ДНК-анализа на основе ПЦР является детекция продуктов амплификации, которая осуществляется в основном электрофоретическим разделением ПЦР-смеси на окрашенном бромистым этидием агарозном или полиакриламидном геле, что позволяет идентифицировать продукт ПЦР по длине. Бромистый этидий образует с фрагментами ЭДНК устойчивое соединение внедрения, проявляющееся в виде светящихся полос при облучении геля УФизлучением. Принцип гель-электрофореза: исследуемый препарат вносят в лунку, расположенную у края геля – полужидкой среды с сетчатой пространственной структурой. Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, и когда через гель пропускают электрический ток, они перемещаются в электрическое поле. Молекулы одинакового размера и одинакового заряда движутся единым фронтом, образуя в геле невидимые полосы. Постепенно исходный препарат, состоящий из разных макромолекул, разделяется на зоны, распределенные по пластине геля.
Электрофоретическая детекция продуктов амплификации Заключительным этапом ДНК-анализа на основе ПЦР является детекция продуктов амплификации, которая осуществляется в основном электрофоретическим разделением ПЦР-смеси на окрашенном бромистым этидием агарозном или полиакриламидном геле, что позволяет идентифицировать продукт ПЦР по длине. Бромистый этидий образует с фрагментами ЭДНК устойчивое соединение внедрения, проявляющееся в виде светящихся полос при облучении геля УФизлучением. Принцип гель-электрофореза: исследуемый препарат вносят в лунку, расположенную у края геля – полужидкой среды с сетчатой пространственной структурой. Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, и когда через гель пропускают электрический ток, они перемещаются в электрическое поле. Молекулы одинакового размера и одинакового заряда движутся единым фронтом, образуя в геле невидимые полосы. Постепенно исходный препарат, состоящий из разных макромолекул, разделяется на зоны, распределенные по пластине геля.
 Агароза – это особо чистая фракция, получаемая из агара. Для приготовления агарозного геля в СВЧ-печи расплавляют смесь агарозы, буфера для электрофореза и воды. Охлажденную до 50 -60 °С смесь заливают в форму и с помощью специальных гребенок делают в геле лунки для нанесения образца. Гребенки устанавливают таким образом, чтобы между дном лунок и основанием геля оставался слой агарозы в 1 мм.
Агароза – это особо чистая фракция, получаемая из агара. Для приготовления агарозного геля в СВЧ-печи расплавляют смесь агарозы, буфера для электрофореза и воды. Охлажденную до 50 -60 °С смесь заливают в форму и с помощью специальных гребенок делают в геле лунки для нанесения образца. Гребенки устанавливают таким образом, чтобы между дном лунок и основанием геля оставался слой агарозы в 1 мм.
 После застывания гель помещают в камеру для горизонтального электрофореза, заливают буфер для электрофореза и в лунки вносят продукты амплификации. Затем камеру подключают к источнику питания и проводят электрофоретическое разделение продуктов амплификации в течение 30 -45 минут.
После застывания гель помещают в камеру для горизонтального электрофореза, заливают буфер для электрофореза и в лунки вносят продукты амплификации. Затем камеру подключают к источнику питания и проводят электрофоретическое разделение продуктов амплификации в течение 30 -45 минут.
 После окончания электрофореза гель помещают в специальный прибор – трансиллюминатор. Он предназначен для просмотра гелей в видимом и ультрафиолетовом диапазоне. Результаты электрофореза учитывают с помощью видеосистемы.
После окончания электрофореза гель помещают в специальный прибор – трансиллюминатор. Он предназначен для просмотра гелей в видимом и ультрафиолетовом диапазоне. Результаты электрофореза учитывают с помощью видеосистемы.
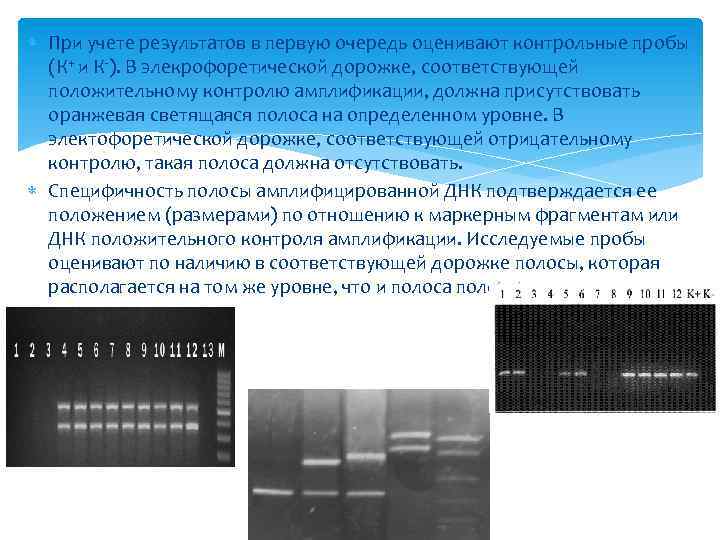 При учете результатов в первую очередь оценивают контрольные пробы (К+ и К-). В элекрофоретической дорожке, соответствующей положительному контролю амплификации, должна присутствовать оранжевая светящаяся полоса на определенном уровне. В электофоретической дорожке, соответствующей отрицательному контролю, такая полоса должна отсутствовать. Специфичность полосы амплифицированной ДНК подтверждается ее положением (размерами) по отношению к маркерным фрагментам или ДНК положительного контроля амплификации. Исследуемые пробы оценивают по наличию в соответствующей дорожке полосы, которая располагается на том же уровне, что и полоса положительного контроля.
При учете результатов в первую очередь оценивают контрольные пробы (К+ и К-). В элекрофоретической дорожке, соответствующей положительному контролю амплификации, должна присутствовать оранжевая светящаяся полоса на определенном уровне. В электофоретической дорожке, соответствующей отрицательному контролю, такая полоса должна отсутствовать. Специфичность полосы амплифицированной ДНК подтверждается ее положением (размерами) по отношению к маркерным фрагментам или ДНК положительного контроля амплификации. Исследуемые пробы оценивают по наличию в соответствующей дорожке полосы, которая располагается на том же уровне, что и полоса положительного контроля.
 Метод ПЦР в ветеринарии применяют для: Выявления ДНК (РНК) возбудителей инфекционных болезней в биологическом (патологическом) материале от животных и птиц, в объектах внешней среды, в кормах для животных и пищевых продуктах; Эпизоотологического мониторинга инфекционных болезней животных и птиц; Определения видовой принадлежности бактериальных культур, а также для обнаружения контаминатов в культуре клеток; Идентификация генетически модифицированных источников растительного происхождения в пищевых продуктах; Научных целей при генотипировании штаммов или других видов анализа.
Метод ПЦР в ветеринарии применяют для: Выявления ДНК (РНК) возбудителей инфекционных болезней в биологическом (патологическом) материале от животных и птиц, в объектах внешней среды, в кормах для животных и пищевых продуктах; Эпизоотологического мониторинга инфекционных болезней животных и птиц; Определения видовой принадлежности бактериальных культур, а также для обнаружения контаминатов в культуре клеток; Идентификация генетически модифицированных источников растительного происхождения в пищевых продуктах; Научных целей при генотипировании штаммов или других видов анализа.


