slaydy.ppt
- Количество слайдов: 20
 Полимеразная цепная реакция Подготовили Студентки 2 курса 14 группы лечебного факультета: Мельникова Юлия Алферова Елена Горохова Анастасия Симонян Маргарита
Полимеразная цепная реакция Подготовили Студентки 2 курса 14 группы лечебного факультета: Мельникова Юлия Алферова Елена Горохова Анастасия Симонян Маргарита
 Введение Одним из самых современных методов молекулярной биологии является метод ПЦР диагностики – полимеразная цепная реакция. Исследование методом ПЦР имеет ряд преимуществ перед привычными способами, так как данный метод ПЦР диагностики позволяет специфично увеличивать (амплифицировать) в сотни раз участок ДНК возбудителя заболевания в исследуемом образце. Теоретически метод ПЦР диагностики позволяет обнаружить даже единственную копию чужеродной ДНК в образце, что позволяет говорить об отсутствии у него предела чувствительности. Кроме высокой чувствительности, исследование методом ПЦР имеет абсолютную специфичность, то есть если метод ПЦР диагностики выполнен правильно, то он не дает ложноположительных результатов. Таким образом, чтобы выявить возбудителя и определить его природу более точно, нужно вместе с обычными анализами сдать анализ ПЦР.
Введение Одним из самых современных методов молекулярной биологии является метод ПЦР диагностики – полимеразная цепная реакция. Исследование методом ПЦР имеет ряд преимуществ перед привычными способами, так как данный метод ПЦР диагностики позволяет специфично увеличивать (амплифицировать) в сотни раз участок ДНК возбудителя заболевания в исследуемом образце. Теоретически метод ПЦР диагностики позволяет обнаружить даже единственную копию чужеродной ДНК в образце, что позволяет говорить об отсутствии у него предела чувствительности. Кроме высокой чувствительности, исследование методом ПЦР имеет абсолютную специфичность, то есть если метод ПЦР диагностики выполнен правильно, то он не дает ложноположительных результатов. Таким образом, чтобы выявить возбудителя и определить его природу более точно, нужно вместе с обычными анализами сдать анализ ПЦР.
 История Первоначально сам принцип метода полимеразной цепной реакции (ПЦР) был разработан Кэри Мюллисом в 1983 г. Открытие ПЦР стало одним из наиболее выдающихся событий в области молекулярной биологии за последние 20 лет, и за разработку ПЦР-анализа Кэрри Мюллис уже в 1993 г. был удостоен Нобелевской премии в области химии. Кэри Мюллис
История Первоначально сам принцип метода полимеразной цепной реакции (ПЦР) был разработан Кэри Мюллисом в 1983 г. Открытие ПЦР стало одним из наиболее выдающихся событий в области молекулярной биологии за последние 20 лет, и за разработку ПЦР-анализа Кэрри Мюллис уже в 1993 г. был удостоен Нобелевской премии в области химии. Кэри Мюллис
 Также появлению ПЦР много способствовало открытие уникального фермента ДНК-полимеразы (или taqполимеразы). Именно этот фермент катализирует и "контролирует" все процессы во время проведения анализа методом ПЦР. Особенность этого фермента - он термостабилен, исключительно термостоек: он выдерживает нагревание до температуры кипения без потери активности, а "любимый" его температурный режим во время работы - 72°С. Многие реакции проведении ПЦР идут почти исключительно при повышенной температуре.
Также появлению ПЦР много способствовало открытие уникального фермента ДНК-полимеразы (или taqполимеразы). Именно этот фермент катализирует и "контролирует" все процессы во время проведения анализа методом ПЦР. Особенность этого фермента - он термостабилен, исключительно термостоек: он выдерживает нагревание до температуры кипения без потери активности, а "любимый" его температурный режим во время работы - 72°С. Многие реакции проведении ПЦР идут почти исключительно при повышенной температуре.
 Область применения ПЦР
Область применения ПЦР
 Виды ПЦР • • Классическая В реальном времени Мультиплексная Миазная.
Виды ПЦР • • Классическая В реальном времени Мультиплексная Миазная.
 Классическая ПЦР В случае классической ПЦР, конечные продукты реакции разделяют в агарозном геле, где фрагменты движутся со скоростью обратно пропорциональной своей массе. Визуализация фрагментов осуществляется с помощью флуоресцирующих красителей, специфически связывающихся с ДНК. Примерная масса ПЦР-продукта определяется по маркеру с известной массой. Такой тип ПЦР является в большей степени качественной.
Классическая ПЦР В случае классической ПЦР, конечные продукты реакции разделяют в агарозном геле, где фрагменты движутся со скоростью обратно пропорциональной своей массе. Визуализация фрагментов осуществляется с помощью флуоресцирующих красителей, специфически связывающихся с ДНК. Примерная масса ПЦР-продукта определяется по маркеру с известной массой. Такой тип ПЦР является в большей степени качественной.
 ПЦР в реальном времени (Real-time PCR) ПЦР в режиме реального времени – метод, который используется для определения концентрации ДНК. Основное отличие от классической ПЦР состоит в том, что при проведении Real-Time ПЦР одновременно происходят амплификация, детекция и количественное определение специфической последовательности ДНК в образце. Также отличительными чертами данного метода являются отсутствие стадии электрофореза, менее строгие требования к организации ПЦР-лаборатории и автоматические регистрация и интерпретация полученных результатов.
ПЦР в реальном времени (Real-time PCR) ПЦР в режиме реального времени – метод, который используется для определения концентрации ДНК. Основное отличие от классической ПЦР состоит в том, что при проведении Real-Time ПЦР одновременно происходят амплификация, детекция и количественное определение специфической последовательности ДНК в образце. Также отличительными чертами данного метода являются отсутствие стадии электрофореза, менее строгие требования к организации ПЦР-лаборатории и автоматические регистрация и интерпретация полученных результатов.
 Преимущества Объединение этапов амплификации и детекции результатов. Появляется возможность оценить кинетику процесса, которая зависит от начального количества исследуемого материала Существенное снижение риска контаминации и ошибок при анализе результатов Высокая специфичность реакции за счет использования высокоспецифичных флуоресцентных зондов.
Преимущества Объединение этапов амплификации и детекции результатов. Появляется возможность оценить кинетику процесса, которая зависит от начального количества исследуемого материала Существенное снижение риска контаминации и ошибок при анализе результатов Высокая специфичность реакции за счет использования высокоспецифичных флуоресцентных зондов.
 Высокая производительность Упрощение требований к организации ПЦР-лаборатории Возможность количественной оценки исходной ДНК матрицы Регистрация и учет данных в электронном формате
Высокая производительность Упрощение требований к организации ПЦР-лаборатории Возможность количественной оценки исходной ДНК матрицы Регистрация и учет данных в электронном формате
 Особенности 1. В состав реакционной смеси наряду с праймерами и остальными компонентами реакции добавлены специальные флуоресцентные метки (зонды). Флуоресцентный зонд представляет собой олигонуклеотид, комплементарный внутренней последовательности амплифицируемого фрагмента ДНК возбудителя. На 3’-конце зонда находится флуоресцентная молекула – флуорофор, а на 5’-конце расположена молекула-“гаситель” флуоресценции. За счет близости флуорофора и “гасителя” вся энергия, поглощенная флуорофором, переходит на “гаситель” по принципу флуоресцентно-резонансного переноса энергии. При этом сигнал флуоресценции отсутствует.
Особенности 1. В состав реакционной смеси наряду с праймерами и остальными компонентами реакции добавлены специальные флуоресцентные метки (зонды). Флуоресцентный зонд представляет собой олигонуклеотид, комплементарный внутренней последовательности амплифицируемого фрагмента ДНК возбудителя. На 3’-конце зонда находится флуоресцентная молекула – флуорофор, а на 5’-конце расположена молекула-“гаситель” флуоресценции. За счет близости флуорофора и “гасителя” вся энергия, поглощенная флуорофором, переходит на “гаситель” по принципу флуоресцентно-резонансного переноса энергии. При этом сигнал флуоресценции отсутствует.
 Особенности 2. В ходе ПЦР при повышении температуры происходит денатурация ДНК возбудителя, и зонд наряду с праймерами гибридизуется с комплементарным участком ДНК. 3. В процессе синтеза новой цепи ДНК, фермент ДНК-полимераза расщепляет этот зонд. При расщеплении зонда флуорофор отделяется от “гасителя”, расстояние между ними увеличивается, процесс тушения флуоресценции становится невозможным. В этот момент можно зарегистрировать флуоресцентный сигнал от флуорофора. В результате такого принципа неспецифическая амплификация не обнаруживается.
Особенности 2. В ходе ПЦР при повышении температуры происходит денатурация ДНК возбудителя, и зонд наряду с праймерами гибридизуется с комплементарным участком ДНК. 3. В процессе синтеза новой цепи ДНК, фермент ДНК-полимераза расщепляет этот зонд. При расщеплении зонда флуорофор отделяется от “гасителя”, расстояние между ними увеличивается, процесс тушения флуоресценции становится невозможным. В этот момент можно зарегистрировать флуоресцентный сигнал от флуорофора. В результате такого принципа неспецифическая амплификация не обнаруживается.
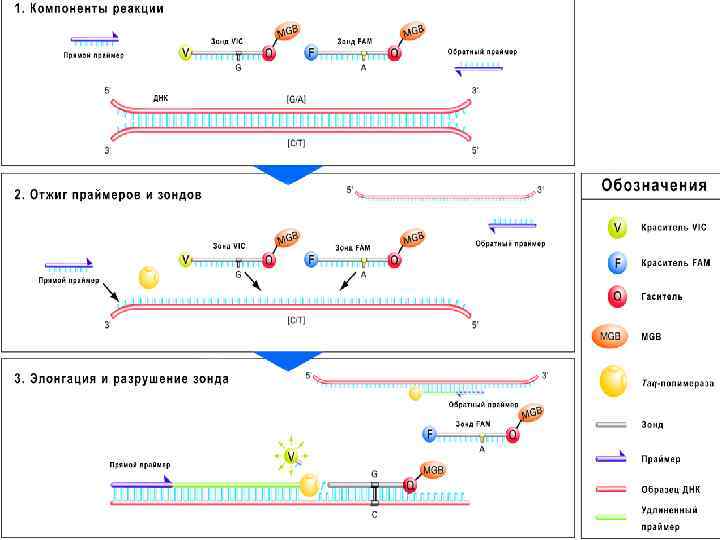 Схема
Схема
 Для детекции продуктов амплификации применяются следующие подходы: 1) Использование модифицированных олигонуклеотидов (зондов), которые флуоресцируют после гибридизации с комплементарными участками ДНК [Taq. Man-зонды (данная методика основана на использовании 5'экзонуклеазной активности полимеразы) и Molecular Beacons-зонды с комплементарными концевыми последовательностями], 2) Использование флуорисцентных красителей, интеркалирующих в двуцепочечные молекулы ДНК (наиболее распространенным является SYBR Green) 3) использование двух зондов с резонансным переносом энергии (Light. Cycler assay).
Для детекции продуктов амплификации применяются следующие подходы: 1) Использование модифицированных олигонуклеотидов (зондов), которые флуоресцируют после гибридизации с комплементарными участками ДНК [Taq. Man-зонды (данная методика основана на использовании 5'экзонуклеазной активности полимеразы) и Molecular Beacons-зонды с комплементарными концевыми последовательностями], 2) Использование флуорисцентных красителей, интеркалирующих в двуцепочечные молекулы ДНК (наиболее распространенным является SYBR Green) 3) использование двух зондов с резонансным переносом энергии (Light. Cycler assay).

 Мультиплексная ПЦР Мультиплексная полимеразная цепная реакция, [лат. multum — много и plex — складка, сгиб] — полимеразная цепная реакция, в которой одновременно используют более одной пары олигонуклеотидных праймеров, что приводит к коамплификации нескольких ДНК-матриц. Такая реакция позволяет экономить время, она широко используется для экспресс-идентификации инфекционных агентов, напр. скрининга сразу по нескольким инфекционным возбудителям, или для исследования состояния нескольких аллельных генов у эукариотических организмов.
Мультиплексная ПЦР Мультиплексная полимеразная цепная реакция, [лат. multum — много и plex — складка, сгиб] — полимеразная цепная реакция, в которой одновременно используют более одной пары олигонуклеотидных праймеров, что приводит к коамплификации нескольких ДНК-матриц. Такая реакция позволяет экономить время, она широко используется для экспресс-идентификации инфекционных агентов, напр. скрининга сразу по нескольким инфекционным возбудителям, или для исследования состояния нескольких аллельных генов у эукариотических организмов.
 Такая реакция заменяет несколько отдельных реакций ПЦР, которые требовали бы большего количества реагентов и времени. Температуры отжига каждого из наборов праймеров должны быть оптимизированы, чтобы они могли правильно работать в рамках одной реакции. Кроме того, размеры участков ДНК, амплифицирующихся должны достаточно различаться, чтобы их можно было розризниты с помощью гелевого электрофореза.
Такая реакция заменяет несколько отдельных реакций ПЦР, которые требовали бы большего количества реагентов и времени. Температуры отжига каждого из наборов праймеров должны быть оптимизированы, чтобы они могли правильно работать в рамках одной реакции. Кроме того, размеры участков ДНК, амплифицирующихся должны достаточно различаться, чтобы их можно было розризниты с помощью гелевого электрофореза.
 Реакцию амплификации можно проводить непосредственно на хромосомных препаратах, при этом в случае использования меченых нуклеотидов продукты амплификации будут гибридизоваться и выявлять комплементарные им участки ДНК на хромосомах (метод PRTNS - polymerase reaction in situ). В последнее время благодаря внесению ряда кардинальных усовершенствований возможно проведение амплификации фрагментов ДНК, достигающих 35 тыс. п. о. В частности, таким образом удалось амплифицировать плазмиду со вставкой 8, 5 тыс. п. о. , равной целому геному вируса HIV 1.
Реакцию амплификации можно проводить непосредственно на хромосомных препаратах, при этом в случае использования меченых нуклеотидов продукты амплификации будут гибридизоваться и выявлять комплементарные им участки ДНК на хромосомах (метод PRTNS - polymerase reaction in situ). В последнее время благодаря внесению ряда кардинальных усовершенствований возможно проведение амплификации фрагментов ДНК, достигающих 35 тыс. п. о. В частности, таким образом удалось амплифицировать плазмиду со вставкой 8, 5 тыс. п. о. , равной целому геному вируса HIV 1.
 Преимущества мультиплексной ПЦР - снижение риска контаминации образца; - возможность контроля ложноотрицательных результатов; - уменьшение расхода реактивов; - сокращение времени подготовки; - более высокое качество эталона, количество которого можно определить в образце
Преимущества мультиплексной ПЦР - снижение риска контаминации образца; - возможность контроля ложноотрицательных результатов; - уменьшение расхода реактивов; - сокращение времени подготовки; - более высокое качество эталона, количество которого можно определить в образце
 Недостатки мультиплексной ПЦР - возможность получения ложных результатов при достаточных различиях концентраций нуклеотидных последовательностеймишеней; - сравнительно большая продолжительность ПЦР и отсутствие оптимизации состава буфера для постановки реакции с комплексным учетом особенностей состава основных реагентов ПЦР: свойств и соотношения неблокированных и модифицированных праймеров и Taqполимеразы.
Недостатки мультиплексной ПЦР - возможность получения ложных результатов при достаточных различиях концентраций нуклеотидных последовательностеймишеней; - сравнительно большая продолжительность ПЦР и отсутствие оптимизации состава буфера для постановки реакции с комплексным учетом особенностей состава основных реагентов ПЦР: свойств и соотношения неблокированных и модифицированных праймеров и Taqполимеразы.


