Вирусология. ПЦР.ppt
- Количество слайдов: 10
 ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР) Выполнила студентка 3 курса ФВМ Новикова Мария
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР) Выполнила студентка 3 курса ФВМ Новикова Мария
 ПЦР - это метод, который позволяет найти в исследуемом клиническом материале небольшой участок генетической информации любого организма среди огромного количества других участков и многократно размножить его. Метод ПЦР основан на принципе естественной репликации ДНК, включающем расплетение двойной спирали ДНК, расхождение нитей ДНК и комплиментарное дополнение обеих. Репликация ДНК может начаться не в любой точке, а только в определенных стартовых блоках - коротких двунитевых участках. Суть метода заключается в том, что маркировав такими блоками специфический только для данного вида (но не для других видов) участок ДНК, можно многократно воспроизвести (амплифицировать) именно этот участок.
ПЦР - это метод, который позволяет найти в исследуемом клиническом материале небольшой участок генетической информации любого организма среди огромного количества других участков и многократно размножить его. Метод ПЦР основан на принципе естественной репликации ДНК, включающем расплетение двойной спирали ДНК, расхождение нитей ДНК и комплиментарное дополнение обеих. Репликация ДНК может начаться не в любой точке, а только в определенных стартовых блоках - коротких двунитевых участках. Суть метода заключается в том, что маркировав такими блоками специфический только для данного вида (но не для других видов) участок ДНК, можно многократно воспроизвести (амплифицировать) именно этот участок.
 Компоненты реакции: ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза) и другие. Дезоксирибонуклеозидтрифосфаты (d. ATP, d. GTP, d. CTP, d. TTP). Ионы Mg 2+, необходимые для работы полимеразы. Буферный раствор, обеспечивающий необходимые условия реакции — р. Н, ионную силу раствора. Содержит соли, бычий сывороточный альбумин. Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
Компоненты реакции: ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза) и другие. Дезоксирибонуклеозидтрифосфаты (d. ATP, d. GTP, d. CTP, d. TTP). Ионы Mg 2+, необходимые для работы полимеразы. Буферный раствор, обеспечивающий необходимые условия реакции — р. Н, ионную силу раствора. Содержит соли, бычий сывороточный альбумин. Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
 Праймеры - это короткие, длиной 20 -30 оснований, одноцепочечные ДНК (дезоксиолигонуклеотиды), комплиментарные 3 -концам цепей копируемой ДНК- матрицы, благодаря которым ограничивается фрагмент ДНК, который будет миллионы раз скопирован ферментом Taq-ДНК - полимеразой, присоединяющейся к 3 -концам праймеров и достраивающей их до заданной длины в несколько сот или тысяч пар оснований. Специфичность получаемого продукта ПЦР в значительной степени определяется так называемой температурой отжига праймеров, при которой они взаимодействуют с комплиментарными участками ДНКматрицы, образуя даухцепочечные структуры. Температура отжига определяется длиной праймера и содержанием ГЦ-пар и рассчитывается по следующей формуле: Т=[(A+T) x 2] + [(Г+С) х 4] - 5 Ц При отклонениях в температуре плавления внутри одной пары праймеров выбор температуры отжига будет менее строгим.
Праймеры - это короткие, длиной 20 -30 оснований, одноцепочечные ДНК (дезоксиолигонуклеотиды), комплиментарные 3 -концам цепей копируемой ДНК- матрицы, благодаря которым ограничивается фрагмент ДНК, который будет миллионы раз скопирован ферментом Taq-ДНК - полимеразой, присоединяющейся к 3 -концам праймеров и достраивающей их до заданной длины в несколько сот или тысяч пар оснований. Специфичность получаемого продукта ПЦР в значительной степени определяется так называемой температурой отжига праймеров, при которой они взаимодействуют с комплиментарными участками ДНКматрицы, образуя даухцепочечные структуры. Температура отжига определяется длиной праймера и содержанием ГЦ-пар и рассчитывается по следующей формуле: Т=[(A+T) x 2] + [(Г+С) х 4] - 5 Ц При отклонениях в температуре плавления внутри одной пары праймеров выбор температуры отжига будет менее строгим.
 Амплификатор ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0, 1 °C. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта» , Touchdown ПЦР и последующего хранения амплифицированных молекул при 4 °C. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
Амплификатор ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0, 1 °C. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта» , Touchdown ПЦР и последующего хранения амплифицированных молекул при 4 °C. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
 Ход реакции Обычно при проведении ПЦР выполняется 20— 35 циклов, каждый из которых состоит из трех стадий: денатурация, отжиг, элонгация. Денатурация: Двухцепочечную ДНК-матрицу нагревают до 94— 96 °C (или до 98 °C, если используется особенно термостабильная полимераза) на 0, 5— 2 мин. , чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение 2— 5 мин. для полной денатурации матрицы и праймеров. Такой приём называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции. Отжиг: Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается на 4— 5°С ниже их температуры плавления. Время стадии — 0, 5— 2 мин. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре).
Ход реакции Обычно при проведении ПЦР выполняется 20— 35 циклов, каждый из которых состоит из трех стадий: денатурация, отжиг, элонгация. Денатурация: Двухцепочечную ДНК-матрицу нагревают до 94— 96 °C (или до 98 °C, если используется особенно термостабильная полимераза) на 0, 5— 2 мин. , чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение 2— 5 мин. для полной денатурации матрицы и праймеров. Такой приём называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции. Отжиг: Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается на 4— 5°С ниже их температуры плавления. Время стадии — 0, 5— 2 мин. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре).
 Элонгация: ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Полимераза начинает синтез второй цепи от 3'-конца праймера, который связался с матрицей, и движется вдоль матрицы в направлении от 3' к 5'. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7 -10 мин. Количество специфического продукта реакции (ограниченного праймерами) теоретически возрастает пропорционально 2 n, где n — число циклов реакции. На самом деле эффективность каждого цикла может быть меньше 100 %, поэтому в действительности P ~ (1+E)n, где P — количество продукта, Е — средняя эффективность цикла. Число «длинных» копий ДНК тоже растет, но линейно, поэтому в продуктах реакции доминирует специфический фрагмент. Рост требуемого продукта в геометрической прогрессии ограничен количеством реагентов, присутствием ингибиторов, образованием побочных продуктов. На последних циклах реакции рост замедляется, это называют «эффектом плато» .
Элонгация: ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Полимераза начинает синтез второй цепи от 3'-конца праймера, который связался с матрицей, и движется вдоль матрицы в направлении от 3' к 5'. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7 -10 мин. Количество специфического продукта реакции (ограниченного праймерами) теоретически возрастает пропорционально 2 n, где n — число циклов реакции. На самом деле эффективность каждого цикла может быть меньше 100 %, поэтому в действительности P ~ (1+E)n, где P — количество продукта, Е — средняя эффективность цикла. Число «длинных» копий ДНК тоже растет, но линейно, поэтому в продуктах реакции доминирует специфический фрагмент. Рост требуемого продукта в геометрической прогрессии ограничен количеством реагентов, присутствием ингибиторов, образованием побочных продуктов. На последних циклах реакции рост замедляется, это называют «эффектом плато» .
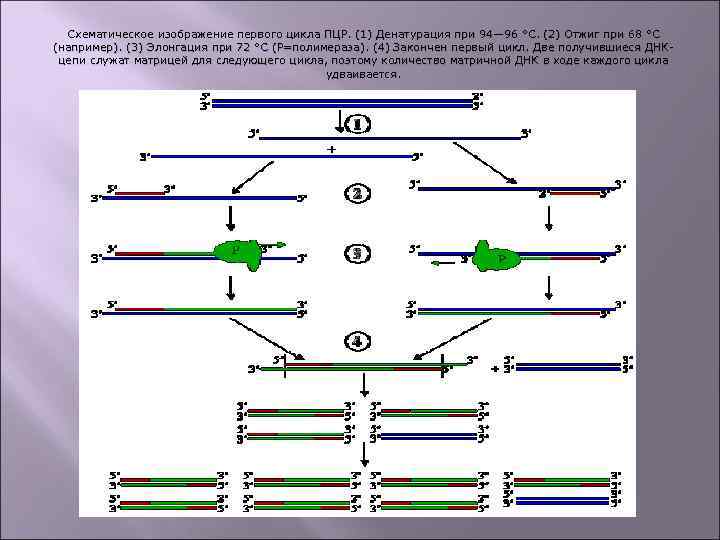 Схематическое изображение первого цикла ПЦР. (1) Денатурация при 94— 96 °C. (2) Отжиг при 68 °C (например). (3) Элонгация при 72 °C (P=полимераза). (4) Закончен первый цикл. Две получившиеся ДНКцепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается.
Схематическое изображение первого цикла ПЦР. (1) Денатурация при 94— 96 °C. (2) Отжиг при 68 °C (например). (3) Элонгация при 72 °C (P=полимераза). (4) Закончен первый цикл. Две получившиеся ДНКцепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается.
 ПЦР-диагностика: В качестве материала для анализа можно использовать и пробу ткани пациента, и одиночный человеческий волос, и каплю засохшей крови. Преимущества метода: - Возбудитель выявляется непосредственно, по специфическому участку ДНК, в отличие от иммуноферментного анализа, при котором вредный микроб выявляется косвенно (по особым белкам – продуктам его жизнедеятельности). - Возможна четкая идентификация ДНК одного определенного возбудителя. Метод позволяет не спутать его ни с каким другим, как это бывает в том же иммуноферментном анализе, где антигены нескольких микроорганизмов нередко реагируют перекрестно. - Метод может выявить даже однуединственную болезнетворную бактерию среди миллиардов других и через несколько часов предоставить 50 миллиардов ее копий! То есть он работает там, где другие методы (микроскопический, бактериологический, иммуноферментный) пасуют.
ПЦР-диагностика: В качестве материала для анализа можно использовать и пробу ткани пациента, и одиночный человеческий волос, и каплю засохшей крови. Преимущества метода: - Возбудитель выявляется непосредственно, по специфическому участку ДНК, в отличие от иммуноферментного анализа, при котором вредный микроб выявляется косвенно (по особым белкам – продуктам его жизнедеятельности). - Возможна четкая идентификация ДНК одного определенного возбудителя. Метод позволяет не спутать его ни с каким другим, как это бывает в том же иммуноферментном анализе, где антигены нескольких микроорганизмов нередко реагируют перекрестно. - Метод может выявить даже однуединственную болезнетворную бактерию среди миллиардов других и через несколько часов предоставить 50 миллиардов ее копий! То есть он работает там, где другие методы (микроскопический, бактериологический, иммуноферментный) пасуют.
 - Метод универсален. Ведь все на свете ДНК состоят из тех же четырех нуклеотидов - аденина (А), гуанина (Г), цитозина (Ц) и тимина (Т). Поэтому способ применим абсолютно для любых бактерий и вирусов. Причем обнаружить можно не только кого угодно, но и где угодно - в крови, моче, мокроте, биоптате (маленький кусочек ткани), почве. -Результаты анализа можно получить чрезвычайно быстро, ведь возбудителя не надо выращивать искусственно (именно эта процедура при лабораторном исследовании занимает много времени). Ответ, как правило, готов уже через 3 -4 часа после обращения. Один недостаток – сверхчувствительность: Как это часто бывает, достоинства метода иногда становятся и его недостатками. Речь идет о феноменальной чувствительности ПЦР, которая может оборачиваться «ложноположительными» результатами, если в посуде, пипетках и прочем оборудовании для анализа будет хотя бы крошечное количество «чужеродной» ДНК. ПЦР размножит эту ДНК и выдаст неправильный результат.
- Метод универсален. Ведь все на свете ДНК состоят из тех же четырех нуклеотидов - аденина (А), гуанина (Г), цитозина (Ц) и тимина (Т). Поэтому способ применим абсолютно для любых бактерий и вирусов. Причем обнаружить можно не только кого угодно, но и где угодно - в крови, моче, мокроте, биоптате (маленький кусочек ткани), почве. -Результаты анализа можно получить чрезвычайно быстро, ведь возбудителя не надо выращивать искусственно (именно эта процедура при лабораторном исследовании занимает много времени). Ответ, как правило, готов уже через 3 -4 часа после обращения. Один недостаток – сверхчувствительность: Как это часто бывает, достоинства метода иногда становятся и его недостатками. Речь идет о феноменальной чувствительности ПЦР, которая может оборачиваться «ложноположительными» результатами, если в посуде, пипетках и прочем оборудовании для анализа будет хотя бы крошечное количество «чужеродной» ДНК. ПЦР размножит эту ДНК и выдаст неправильный результат.


