BT8_PLR_sekven.ppt
- Количество слайдов: 32
 Полімеразна ланцюгова реакція (ПЛР). Секвенування ДНК
Полімеразна ланцюгова реакція (ПЛР). Секвенування ДНК
 Полімеразна ланцюгова реакція (ПЛР) q Метод створено К. Мюллісом у 1983 р. q Полімеразна ланцюгова реакція (ПЛР) – це метод ампліфікації певної ділянки ДНК чи РНК in vitro чи in situ Кері Мюлліс Нобелівський лауреат з хімії, 1993 р. q Під час ПЛР багаторазово повторюють синтез певної ділянки ДНК. Метод дає змогу розмножити певні молекули ДНК до мільйонів копій (мікрограмових кількостей) навіть тоді, коли у вихідному зразку є лише одна копія цієї молекули q Використовують ДНК-полімеразу та олігонуклеотидні праймери, що комплементарні до 3’-кінців фрагмента матриці, який хочуть ампліфікувати q Для виконання ПЛР треба знати послідовність нуклеотидів ділянки, яку хочуть ампліфікувати, та синтезувати відповідні праймери
Полімеразна ланцюгова реакція (ПЛР) q Метод створено К. Мюллісом у 1983 р. q Полімеразна ланцюгова реакція (ПЛР) – це метод ампліфікації певної ділянки ДНК чи РНК in vitro чи in situ Кері Мюлліс Нобелівський лауреат з хімії, 1993 р. q Під час ПЛР багаторазово повторюють синтез певної ділянки ДНК. Метод дає змогу розмножити певні молекули ДНК до мільйонів копій (мікрограмових кількостей) навіть тоді, коли у вихідному зразку є лише одна копія цієї молекули q Використовують ДНК-полімеразу та олігонуклеотидні праймери, що комплементарні до 3’-кінців фрагмента матриці, який хочуть ампліфікувати q Для виконання ПЛР треба знати послідовність нуклеотидів ділянки, яку хочуть ампліфікувати, та синтезувати відповідні праймери
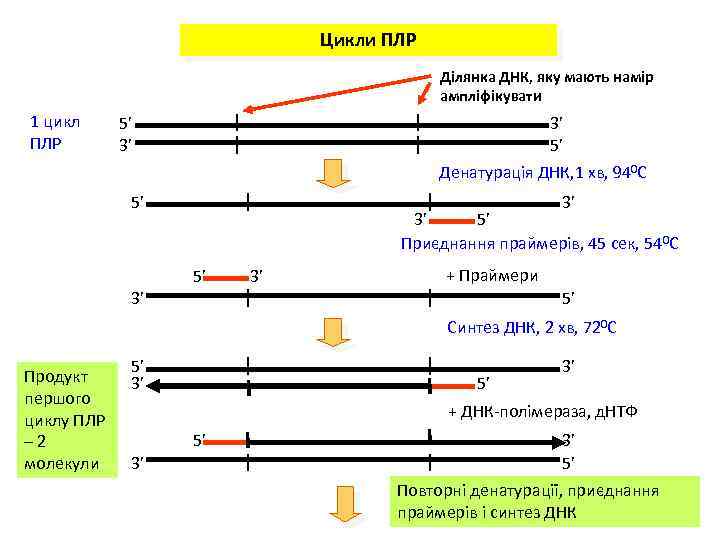 Цикли ПЛР Ділянка ДНК, яку мають намір ампліфікувати 1 цикл ПЛР 5’ 3’ 3’ 5’ Денатурація ДНК, 1 хв, 940 С 5’ 3’ 3’ 5’ Приєднання праймерів, 45 сек, 540 С 5’ 3’ + Праймери 3’ 5’ Синтез ДНК, 2 хв, 720 С Продукт першого циклу ПЛР – 2 молекули 5’ 3’ + ДНК-полімераза, д. НТФ 5’ 3’ 3’ 5’ Повторні денатурації, приєднання праймерів і синтез ДНК
Цикли ПЛР Ділянка ДНК, яку мають намір ампліфікувати 1 цикл ПЛР 5’ 3’ 3’ 5’ Денатурація ДНК, 1 хв, 940 С 5’ 3’ 3’ 5’ Приєднання праймерів, 45 сек, 540 С 5’ 3’ + Праймери 3’ 5’ Синтез ДНК, 2 хв, 720 С Продукт першого циклу ПЛР – 2 молекули 5’ 3’ + ДНК-полімераза, д. НТФ 5’ 3’ 3’ 5’ Повторні денатурації, приєднання праймерів і синтез ДНК
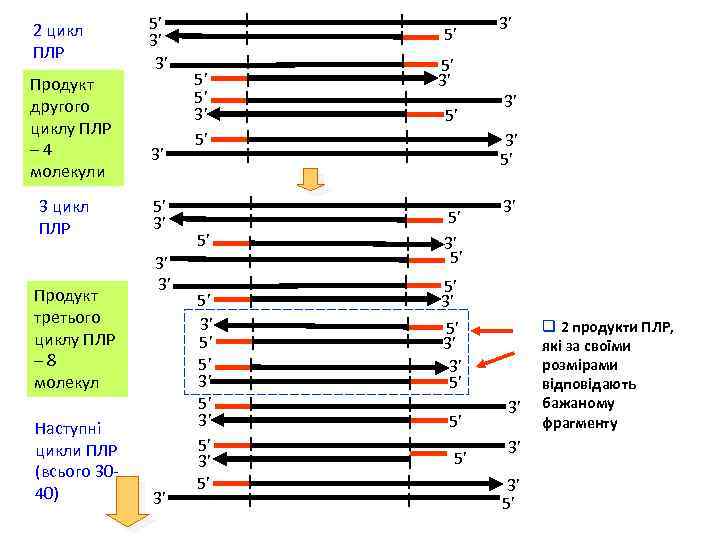 2 цикл ПЛР Продукт другого циклу ПЛР – 4 молекули 3 цикл ПЛР Продукт третього циклу ПЛР – 8 молекул Наступні цикли ПЛР (всього 3040) 5’ 3’ 3’ 5’ 5’ 5’ 3’ 5’ 3’ 3’ 3’ 5’ 5’ 3’ 3’ 5’ 5’ 5’ 3’ 3’ 3’ 5’ q 2 продукти ПЛР, які за своїми розмірами відповідають бажаному фрагменту
2 цикл ПЛР Продукт другого циклу ПЛР – 4 молекули 3 цикл ПЛР Продукт третього циклу ПЛР – 8 молекул Наступні цикли ПЛР (всього 3040) 5’ 3’ 3’ 5’ 5’ 5’ 3’ 5’ 3’ 3’ 3’ 5’ 5’ 3’ 3’ 5’ 5’ 5’ 3’ 3’ 3’ 5’ q 2 продукти ПЛР, які за своїми розмірами відповідають бажаному фрагменту
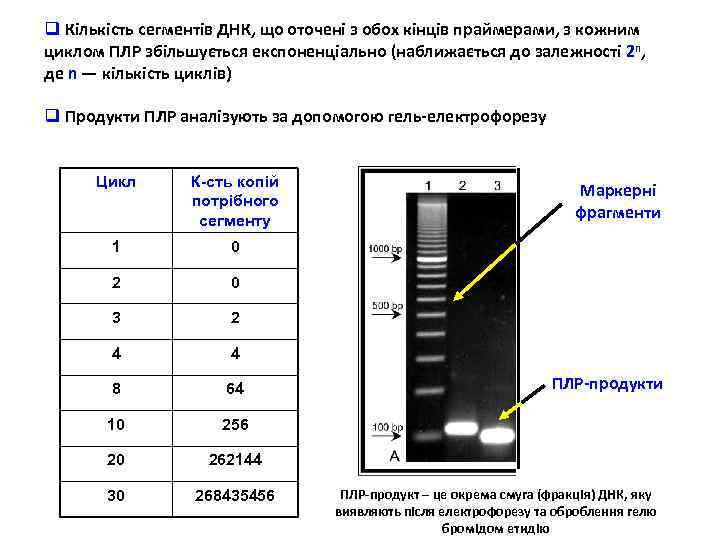 q Кількість сегментів ДНК, що оточені з обох кінців праймерами, з кожним циклом ПЛР збільшується експоненціально (наближається до залежності 2 n, де n — кількість циклів) q Продукти ПЛР аналізують за допомогою гель-електрофорезу Цикл К-сть копій потрібного сегменту 1 0 2 0 3 2 4 4 8 64 10 256 20 262144 30 268435456 Маркерні фрагменти ПЛР-продукт – це окрема смуга (фракція) ДНК, яку виявляють після електрофорезу та оброблення гелю бромідом етидію
q Кількість сегментів ДНК, що оточені з обох кінців праймерами, з кожним циклом ПЛР збільшується експоненціально (наближається до залежності 2 n, де n — кількість циклів) q Продукти ПЛР аналізують за допомогою гель-електрофорезу Цикл К-сть копій потрібного сегменту 1 0 2 0 3 2 4 4 8 64 10 256 20 262144 30 268435456 Маркерні фрагменти ПЛР-продукт – це окрема смуга (фракція) ДНК, яку виявляють після електрофорезу та оброблення гелю бромідом етидію
 q У ПЛР використовують термостабільні полімерази, як наприклад, Taq-полімеразу з термофільної бактерії Thermus aquaticus q Оптимальна температура для реакції полімеризації, яку каталізує цей фермент, – від 75 до 80°С. При нагріванні інкубаційної суміші фермент не денатурує. Тому після кожного циклу немає потреби знов вносити полімеразу у реакційну суміш. Це дало змогу автоматизувати ПЛР та досягти надзвичайно високого ступеня продуктивності та чутливості методу q При високій температурі спарювання праймерів та матриці більш специфічне, ніж при температурі 37°С, й не відбувається ампліфікації небажаних ділянок ДНК. Це суттєво підвищує специфічність і чутливість методу q Процес здійснюється в автоматичній ПЛР-машині, яка нагріває та охолоджує пробірки із реакційною сумішшю за дуже короткий проміжок часу
q У ПЛР використовують термостабільні полімерази, як наприклад, Taq-полімеразу з термофільної бактерії Thermus aquaticus q Оптимальна температура для реакції полімеризації, яку каталізує цей фермент, – від 75 до 80°С. При нагріванні інкубаційної суміші фермент не денатурує. Тому після кожного циклу немає потреби знов вносити полімеразу у реакційну суміш. Це дало змогу автоматизувати ПЛР та досягти надзвичайно високого ступеня продуктивності та чутливості методу q При високій температурі спарювання праймерів та матриці більш специфічне, ніж при температурі 37°С, й не відбувається ампліфікації небажаних ділянок ДНК. Це суттєво підвищує специфічність і чутливість методу q Процес здійснюється в автоматичній ПЛР-машині, яка нагріває та охолоджує пробірки із реакційною сумішшю за дуже короткий проміжок часу
 Переваги ПЛР q Висока чутливість методу. Він дає змогу виявити 1 певну послідовність ДНК на 100 тис. – 1 млн. клітин. Можна надійно виявити однокопійні гени у таких великих і складних геномах, як геном людини q Невелика кількість матеріалу, необхідного для ПЛР. Достатньо однієї клітини, щоб за допомогою ПЛР ампліфікувати її ДНК q Для ПЛР не завжди потрібна високоочищена ДНК може бути частково деградованою і виділятися з незвичайних джерел (наприклад, тканин, фіксованих у 10% формаліні і залитих у парафінові блоки, слини, волосяних сумок, нігтів, кісток, клаптиків шкіри, спинномозкової рідини, крові, що висохла тощо) q Швидкість. 25 – 50 циклів ПЛР проходять за 2 - 4 год q Велика кількість продуктів ПЛР (мкг). Розмножений in vitro фрагмент отримують у кількостях, достатніх для його прямого секвенування та інших процедур. Оскільки при цьому не потрібно проміжного етапу клонування фрагмента ДНК у векторних молекулах, то ПЛР називають безклітинним молекулярним клонуванням (cell-free molecular cloning)
Переваги ПЛР q Висока чутливість методу. Він дає змогу виявити 1 певну послідовність ДНК на 100 тис. – 1 млн. клітин. Можна надійно виявити однокопійні гени у таких великих і складних геномах, як геном людини q Невелика кількість матеріалу, необхідного для ПЛР. Достатньо однієї клітини, щоб за допомогою ПЛР ампліфікувати її ДНК q Для ПЛР не завжди потрібна високоочищена ДНК може бути частково деградованою і виділятися з незвичайних джерел (наприклад, тканин, фіксованих у 10% формаліні і залитих у парафінові блоки, слини, волосяних сумок, нігтів, кісток, клаптиків шкіри, спинномозкової рідини, крові, що висохла тощо) q Швидкість. 25 – 50 циклів ПЛР проходять за 2 - 4 год q Велика кількість продуктів ПЛР (мкг). Розмножений in vitro фрагмент отримують у кількостях, достатніх для його прямого секвенування та інших процедур. Оскільки при цьому не потрібно проміжного етапу клонування фрагмента ДНК у векторних молекулах, то ПЛР називають безклітинним молекулярним клонуванням (cell-free molecular cloning)
 Недоліки ПЛР q Треба мати інформацію про нуклеотидну послідовність ДНК-мішені, щоб синтезувати праймери q Висока чутливість ПЛР примушує враховувати можливе забруднення зразків сторонньою ДНК, наприклад, ДНК мікроорганізмів або ДНК дослідника q Неточність реплікації ДНК під час ПЛР. Наприклад, Taq-полімеразі не властива 3’ -5’екзонуклеазна активність, тому помилки під час синтезу ДНК виникають з підвищеною частотою. До 40% нових ланцюгів, що утворені Taq-полімеразою, можуть містити неправильні нуклеотиди q Існує ймовірність, що частина праймерів будуть гібридизуватися з неспецифічними (небажаними) послідовностями, і вони будуть ампліфіковані q У ході ПЛР синтезуються відносно короткі ланцюги (до 5 т. п. н. ). Зі зростанням довжини сегменту, який мають намір ампліфікувати, зростають труднощі у проведенні ПЛР
Недоліки ПЛР q Треба мати інформацію про нуклеотидну послідовність ДНК-мішені, щоб синтезувати праймери q Висока чутливість ПЛР примушує враховувати можливе забруднення зразків сторонньою ДНК, наприклад, ДНК мікроорганізмів або ДНК дослідника q Неточність реплікації ДНК під час ПЛР. Наприклад, Taq-полімеразі не властива 3’ -5’екзонуклеазна активність, тому помилки під час синтезу ДНК виникають з підвищеною частотою. До 40% нових ланцюгів, що утворені Taq-полімеразою, можуть містити неправильні нуклеотиди q Існує ймовірність, що частина праймерів будуть гібридизуватися з неспецифічними (небажаними) послідовностями, і вони будуть ампліфіковані q У ході ПЛР синтезуються відносно короткі ланцюги (до 5 т. п. н. ). Зі зростанням довжини сегменту, який мають намір ампліфікувати, зростають труднощі у проведенні ПЛР
 Праймери для ПЛР q Вибір праймерів – найважливіший етап у проведенні ПЛР. Послідовність нуклеотидів праймера залежить від послідовності ДНК-мішені q Розмір праймерів – 18 – 25 нуклеотидів. Їх синтезують на автоматичних синтезаторах ДНК q Найважливіше значення має: довжина праймерів, їхній нуклеотидний склад, те, які нуклеотиди є на 3’-кінці праймера. Усі ці чинники визначають наскільки специфічно приєднується праймер до ДНК-мішені і чи пройде ПЛР Оптимізація ПЛР оптимізують за такими параметами як: q Кількість циклів q Час і температура проходження окремих етапів q Концентрація праймера і його послідовність q Концентрація у реакційній суміші полімерази, д. НТФ, Mg 2+
Праймери для ПЛР q Вибір праймерів – найважливіший етап у проведенні ПЛР. Послідовність нуклеотидів праймера залежить від послідовності ДНК-мішені q Розмір праймерів – 18 – 25 нуклеотидів. Їх синтезують на автоматичних синтезаторах ДНК q Найважливіше значення має: довжина праймерів, їхній нуклеотидний склад, те, які нуклеотиди є на 3’-кінці праймера. Усі ці чинники визначають наскільки специфічно приєднується праймер до ДНК-мішені і чи пройде ПЛР Оптимізація ПЛР оптимізують за такими параметами як: q Кількість циклів q Час і температура проходження окремих етапів q Концентрація праймера і його послідовність q Концентрація у реакційній суміші полімерази, д. НТФ, Mg 2+
 Застосування ПЛР q Клонування певних ділянок з геному, за умови, що можна підібрати відповідні праймери q Пошук певних послідовностей у геномі (як альтернатива методу гібридизації нуклеїнових кислот). Це використовують для: Ø Виявлення мутацій та генетичного поліморфізму популяцій Ø Виявлення філогенетичних зв’язків між особинами, сортами, породами, штамами, популяціями, видами (ДНК-типування) Ø Діагностики спадкових захворювань (виявлення мутацій, які їх зумовлюють) Ø Виявлення патогенів (виявлення специфічних генів, м. РНК патогенних мікроорганізмів) Ø Пренатальної діагностики статі Ø Рятування генів вимерлих організмів Ø Аналізу функціонування генів тощо
Застосування ПЛР q Клонування певних ділянок з геному, за умови, що можна підібрати відповідні праймери q Пошук певних послідовностей у геномі (як альтернатива методу гібридизації нуклеїнових кислот). Це використовують для: Ø Виявлення мутацій та генетичного поліморфізму популяцій Ø Виявлення філогенетичних зв’язків між особинами, сортами, породами, штамами, популяціями, видами (ДНК-типування) Ø Діагностики спадкових захворювань (виявлення мутацій, які їх зумовлюють) Ø Виявлення патогенів (виявлення специфічних генів, м. РНК патогенних мікроорганізмів) Ø Пренатальної діагностики статі Ø Рятування генів вимерлих організмів Ø Аналізу функціонування генів тощо
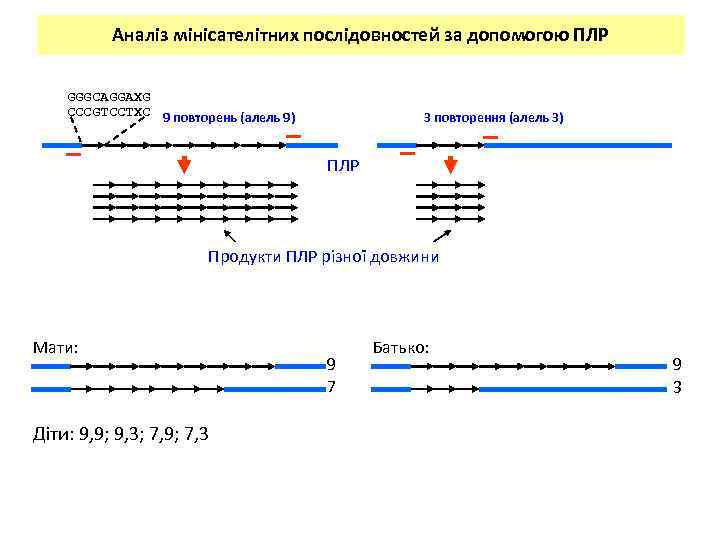 Аналіз мінісателітних послідовностей за допомогою ПЛР GGGCAGGAXG CCCGTCCTXC 9 повторень (алель 9) 3 повторення (алель 3) ПЛР Продукти ПЛР різної довжини Мати: Діти: 9, 9; 9, 3; 7, 9; 7, 3 9 7 Батько: 9 3
Аналіз мінісателітних послідовностей за допомогою ПЛР GGGCAGGAXG CCCGTCCTXC 9 повторень (алель 9) 3 повторення (алель 3) ПЛР Продукти ПЛР різної довжини Мати: Діти: 9, 9; 9, 3; 7, 9; 7, 3 9 7 Батько: 9 3
 Встановлення батьківства за допомогою ПЛР- аналізу повторень ДНК в локусі D 1 S 80 Результати електрофоретичного розділення продуктів ПЛР МС М Д Б? Д+Б? МС 13 13 11 11 9 9 7 7 5 5 3 3 1 1 Підтвердження батьківства Виключення батьківства МС – маркерна суміш алелів; М – мати; Д –дитина; Б? – ймовірний батько; Д+Б? – дитина+ймовірний батько
Встановлення батьківства за допомогою ПЛР- аналізу повторень ДНК в локусі D 1 S 80 Результати електрофоретичного розділення продуктів ПЛР МС М Д Б? Д+Б? МС 13 13 11 11 9 9 7 7 5 5 3 3 1 1 Підтвердження батьківства Виключення батьківства МС – маркерна суміш алелів; М – мати; Д –дитина; Б? – ймовірний батько; Д+Б? – дитина+ймовірний батько
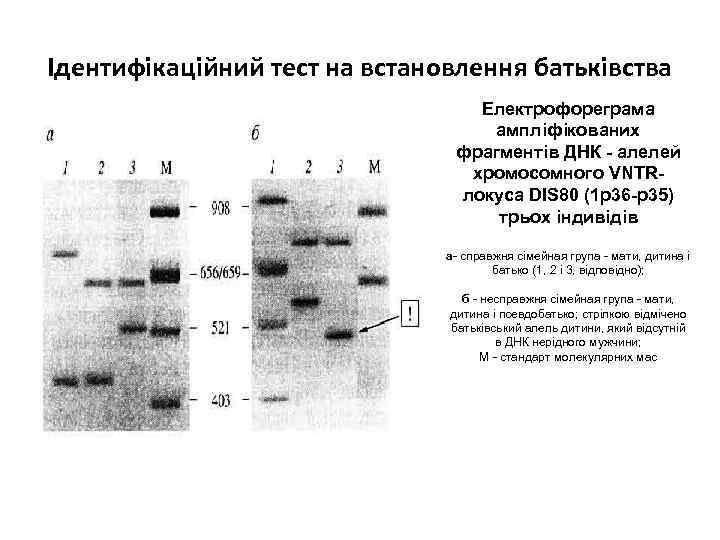 Ідентифікаційний тест на встановлення батьківства Електрофореграма ампліфікованих фрагментів ДНК - алелей хромосомного VNTRлокуса DIS 80 (1 р36 -р35) трьох індивідів а- справжня сімейная група - мати, дитина і батько (1, 2 і 3, відповідно); б - несправжня сімейная група - мати, дитина і псевдобатько; стрілкою відмічено батьківський алель дитини, який відсутній в ДНК нерідного мужчини; М - стандарт молекулярних мас
Ідентифікаційний тест на встановлення батьківства Електрофореграма ампліфікованих фрагментів ДНК - алелей хромосомного VNTRлокуса DIS 80 (1 р36 -р35) трьох індивідів а- справжня сімейная група - мати, дитина і батько (1, 2 і 3, відповідно); б - несправжня сімейная група - мати, дитина і псевдобатько; стрілкою відмічено батьківський алель дитини, який відсутній в ДНК нерідного мужчини; М - стандарт молекулярних мас
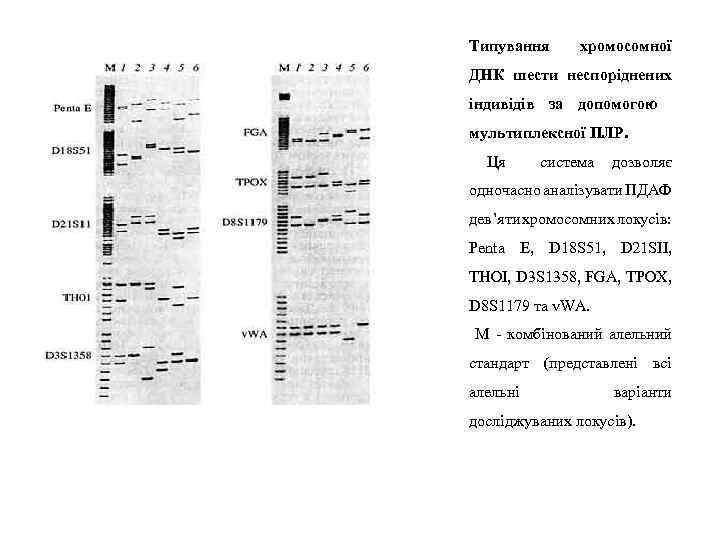 Типування хромосомної ДНК шести неспоріднених індивідів за допомогою мультиплексної ПЛР. Ця система дозволяє одночасно аналізувати ПДАФ дев’яти хромосомних локусів: Penta E, D 18 S 51, D 21 SII, THOI, D 3 S 1358, FGA, ТРОХ, D 8 S 1179 та v. WA. М - комбінований алельний стандарт (представлені всі алельні варіанти досліджуваних локусів).
Типування хромосомної ДНК шести неспоріднених індивідів за допомогою мультиплексної ПЛР. Ця система дозволяє одночасно аналізувати ПДАФ дев’яти хромосомних локусів: Penta E, D 18 S 51, D 21 SII, THOI, D 3 S 1358, FGA, ТРОХ, D 8 S 1179 та v. WA. М - комбінований алельний стандарт (представлені всі алельні варіанти досліджуваних локусів).
 Діагностика муковісцидозу (Cystic fibrosis) за допомогою ПЛР q Муковісцидоз – моногенне рецесивне захворювання, яке розповсюджене в Північній Європі (частота хворих 1/2000, частота гетерозиготних носіїв 1/22) q Симптоми хвороби – підвищений вміст хлоридів у поті, хронічні бактерійні захворювання верхніх дихальних шляхів, часті пневмонії, порушення екзокринної функції підшлункової залози, закупорка кишківника q Зумовлена мутаціями в гені CFTR, який міститься в 7 хромосомі і кодує хлоридний канал цитоплазматичної мембрани. Розмір гена - 230 т. п. н. ; складається з 27 екзонів. Кодує білок з 1480 амінокислотних залишків q Описано > 550 різних мутацій в гені CFTR q 2/3 мутантних алелів, які виявляють у хворих, це мутація ΔF 508 – делеція 3 сусідніх нуклеотидів в екзоні 10, що призводить до втрати залишку фенілаланіну q Мутантний білок ΔF 508 не підлягає правильному дозріванню і швидко деградує
Діагностика муковісцидозу (Cystic fibrosis) за допомогою ПЛР q Муковісцидоз – моногенне рецесивне захворювання, яке розповсюджене в Північній Європі (частота хворих 1/2000, частота гетерозиготних носіїв 1/22) q Симптоми хвороби – підвищений вміст хлоридів у поті, хронічні бактерійні захворювання верхніх дихальних шляхів, часті пневмонії, порушення екзокринної функції підшлункової залози, закупорка кишківника q Зумовлена мутаціями в гені CFTR, який міститься в 7 хромосомі і кодує хлоридний канал цитоплазматичної мембрани. Розмір гена - 230 т. п. н. ; складається з 27 екзонів. Кодує білок з 1480 амінокислотних залишків q Описано > 550 різних мутацій в гені CFTR q 2/3 мутантних алелів, які виявляють у хворих, це мутація ΔF 508 – делеція 3 сусідніх нуклеотидів в екзоні 10, що призводить до втрати залишку фенілаланіну q Мутантний білок ΔF 508 не підлягає правильному дозріванню і швидко деградує
 q Алель ΔF 508 виявляють ампліфікуючи ділянку з 100 п. н. , яка захоплює сайт мутації q Продукти ампліфікації фракціонують за допомогою електрофорезу в поліакриламідному гелі 100 п. н. 97 п. н. Ампліфікована мутантна ділянка коротша від немутантної і має вищу електрофоретичну рухливість
q Алель ΔF 508 виявляють ампліфікуючи ділянку з 100 п. н. , яка захоплює сайт мутації q Продукти ампліфікації фракціонують за допомогою електрофорезу в поліакриламідному гелі 100 п. н. 97 п. н. Ампліфікована мутантна ділянка коротша від немутантної і має вищу електрофоретичну рухливість
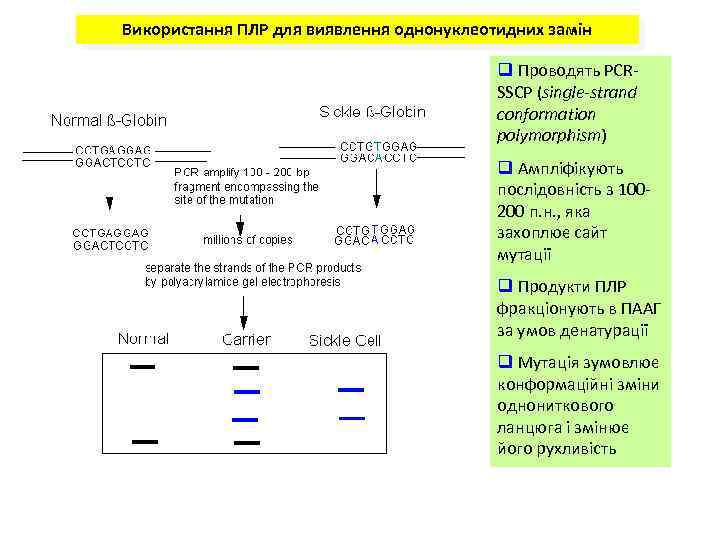 Використання ПЛР для виявлення однонуклеотидних замін q Проводять PCRSSCP (single-strand conformation polymorphism) q Ампліфікують послідовність з 100200 п. н. , яка захоплює сайт мутації q Продукти ПЛР фракціонують в ПААГ за умов денатурації q Мутація зумовлює конформаційні зміни однониткового ланцюга і змінює його рухливість
Використання ПЛР для виявлення однонуклеотидних замін q Проводять PCRSSCP (single-strand conformation polymorphism) q Ампліфікують послідовність з 100200 п. н. , яка захоплює сайт мутації q Продукти ПЛР фракціонують в ПААГ за умов денатурації q Мутація зумовлює конформаційні зміни однониткового ланцюга і змінює його рухливість
 Визначення статі за ДНК • базується на тому, що статеві хромосоми X та Y несуть гомологічний ген амелогеніну, який знаходиться в них в різних алельних станах – ділянка другого інтрона гена в Yхромосомі на 6 пар нуклеотидів довша, ніж в Х-хромосомі. Цей ген кодує компонент зубної емалі амелогенін і необхідний для ембріонального розвитку. . • Для того, щоб виявити чи зразок належить чоловікові чи жінці, зі всієї геномної ДНК аналізують лише область другого інтрона. Зразок ампліфікують методом ПЛР та порівнюють довжину отриманих продуктів (довжину смуг після проведення електрофорезу або піки після проведення ПЛР в реальному часі).
Визначення статі за ДНК • базується на тому, що статеві хромосоми X та Y несуть гомологічний ген амелогеніну, який знаходиться в них в різних алельних станах – ділянка другого інтрона гена в Yхромосомі на 6 пар нуклеотидів довша, ніж в Х-хромосомі. Цей ген кодує компонент зубної емалі амелогенін і необхідний для ембріонального розвитку. . • Для того, щоб виявити чи зразок належить чоловікові чи жінці, зі всієї геномної ДНК аналізують лише область другого інтрона. Зразок ампліфікують методом ПЛР та порівнюють довжину отриманих продуктів (довжину смуг після проведення електрофорезу або піки після проведення ПЛР в реальному часі).
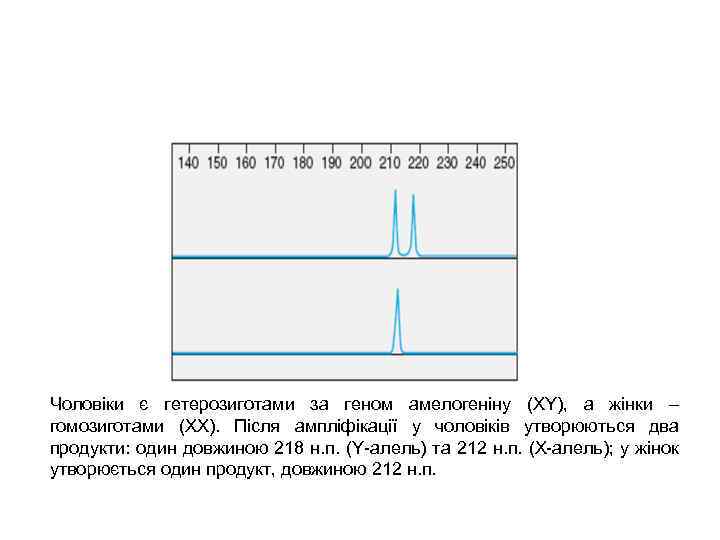 Чоловіки є гетерозиготами за геном амелогеніну (XY), а жінки – гомозиготами (XX). Після ампліфікації у чоловіків утворюються два продукти: один довжиною 218 н. п. (Y-алель) та 212 н. п. (Х-алель); у жінок утворюється один продукт, довжиною 212 н. п.
Чоловіки є гетерозиготами за геном амелогеніну (XY), а жінки – гомозиготами (XX). Після ампліфікації у чоловіків утворюються два продукти: один довжиною 218 н. п. (Y-алель) та 212 н. п. (Х-алель); у жінок утворюється один продукт, довжиною 212 н. п.
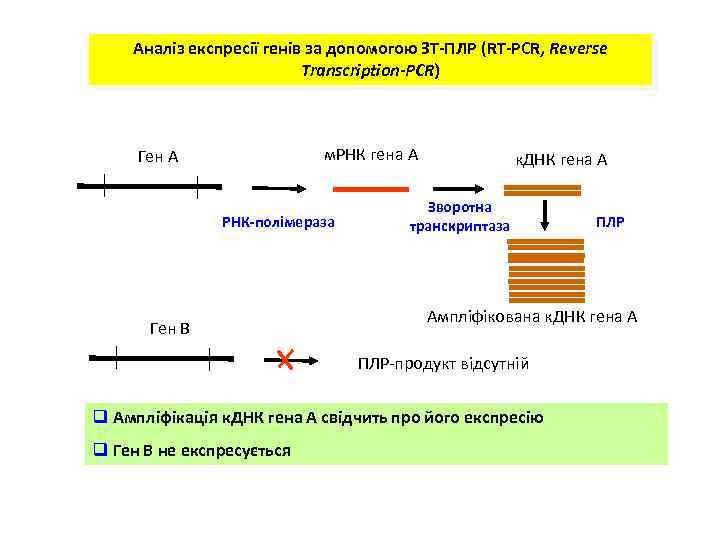 Аналіз експресії генів за допомогою ЗТ-ПЛР (RT-PCR, Reverse Transcription-PCR) м. РНК гена А Ген А РНК-полімераза Ген В к. ДНК гена А Зворотна транскриптаза Ампліфікована к. ДНК гена А ПЛР-продукт відсутній q Ампліфікація к. ДНК гена А свідчить про його експресію q Ген В не експресується ПЛР
Аналіз експресії генів за допомогою ЗТ-ПЛР (RT-PCR, Reverse Transcription-PCR) м. РНК гена А Ген А РНК-полімераза Ген В к. ДНК гена А Зворотна транскриптаза Ампліфікована к. ДНК гена А ПЛР-продукт відсутній q Ампліфікація к. ДНК гена А свідчить про його експресію q Ген В не експресується ПЛР
 ПЛР з зворотною транскрипцією Reverse transcription polymerase chain reaction (RT-PCR) Зворотна транскриптаза: Ø Відкрита у 1970 році Г. Теміном та Д. Балтімором при вивченні життєвого циклу ретровірусів Ø Кодуються геномами ретровірусів Властивості : Ø РНК-залежна ДНК-полімеразна активність Ø активність РНК-ази Н (руйнує РНК в гібриді РНКДНК) Ø низька ДНК-залежна ДНК-полімеразна активність Як матриці для зворотної транскриптази служать зрілі м. РНК певних генів За допомогою зворотної транскриптази синтезують ДНК-копії м. РНК (к. ДНК), в яких представлені екзонні послідовності генів
ПЛР з зворотною транскрипцією Reverse transcription polymerase chain reaction (RT-PCR) Зворотна транскриптаза: Ø Відкрита у 1970 році Г. Теміном та Д. Балтімором при вивченні життєвого циклу ретровірусів Ø Кодуються геномами ретровірусів Властивості : Ø РНК-залежна ДНК-полімеразна активність Ø активність РНК-ази Н (руйнує РНК в гібриді РНКДНК) Ø низька ДНК-залежна ДНК-полімеразна активність Як матриці для зворотної транскриптази служать зрілі м. РНК певних генів За допомогою зворотної транскриптази синтезують ДНК-копії м. РНК (к. ДНК), в яких представлені екзонні послідовності генів
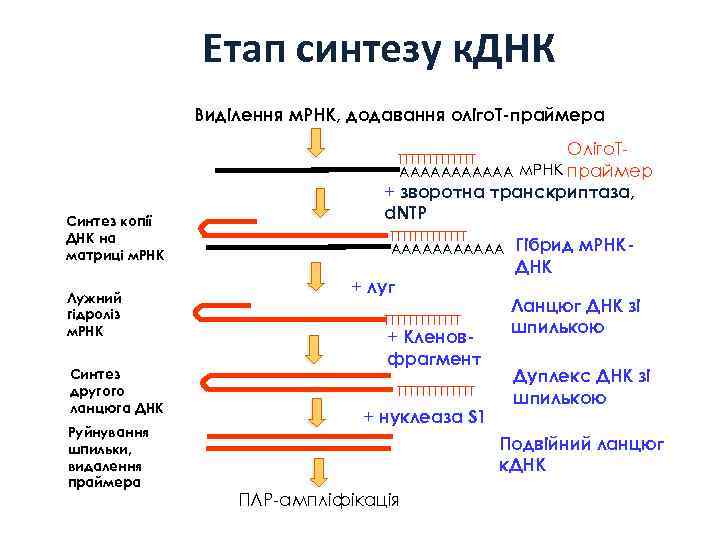 Етап синтезу к. ДНК Виділення м. РНК, додавання оліго. Т-праймера Оліго. Т- TTTTTTT AAAAAA м. РНК праймер Синтез копії ДНК на матриці м. РНК Лужний гідроліз м. РНК Синтез другого ланцюга ДНК Руйнування шпильки, видалення праймера + зворотна транскриптаза, d. NTP TTTTTTT AAAAAA + луг TTTTTTT + Кленовфрагмент TTTTTTT + нуклеаза S 1 Гібрид м. РНКДНК Ланцюг ДНК зі шпилькою Дуплекс ДНК зі шпилькою Подвійний ланцюг к. ДНК ПЛР-ампліфікація
Етап синтезу к. ДНК Виділення м. РНК, додавання оліго. Т-праймера Оліго. Т- TTTTTTT AAAAAA м. РНК праймер Синтез копії ДНК на матриці м. РНК Лужний гідроліз м. РНК Синтез другого ланцюга ДНК Руйнування шпильки, видалення праймера + зворотна транскриптаза, d. NTP TTTTTTT AAAAAA + луг TTTTTTT + Кленовфрагмент TTTTTTT + нуклеаза S 1 Гібрид м. РНКДНК Ланцюг ДНК зі шпилькою Дуплекс ДНК зі шпилькою Подвійний ланцюг к. ДНК ПЛР-ампліфікація
 ПЛР з зворотною транскрипцією Reverse transcription polymerase chain reaction (RT-PCR) Використовують : Ø Аналізу експресії генів; Ø Виявлення РНК-ових мікроорганізмів; Ø Виявлення РНК-ових вірусів (коронавірусні інфекції);
ПЛР з зворотною транскрипцією Reverse transcription polymerase chain reaction (RT-PCR) Використовують : Ø Аналізу експресії генів; Ø Виявлення РНК-ових мікроорганізмів; Ø Виявлення РНК-ових вірусів (коронавірусні інфекції);
 Секвенування ДНК за методом Сенджера (методом термінаторних аналогів нуклеозидтрифосфатів) q. Принципи секвенування білків та ДНК розробив Ф. Сенджер q Неможливо одразу визначити послідовність мономерів у довгому ланцюзі (наприклад, у всьому гені > 1000 п. н. ) 1958 q Його треба розділити в певних місцях на короткі фрагменти (100 – 300 п. н. ) та визначати послідовність мономерів у цих фрагментах, а потім будувати усю послідовність q Молекули полімера ділять принаймні на дві порції. Молекули з порції 1 гідролізують одним агентом (РЕ 1), а молекули з порції 2 – другим агентом (РЕ 2) так, щоб отримати фрагменти, послідовності яких перекриваються 1980 Фредерік Сенджер q Визначають послідовності мономерів у фрагментах, отриманих різними способами. Деякі послідовності певних фрагментів співпадають (перекриваються). Це дає змогу побудувати послідовність усієї молекули
Секвенування ДНК за методом Сенджера (методом термінаторних аналогів нуклеозидтрифосфатів) q. Принципи секвенування білків та ДНК розробив Ф. Сенджер q Неможливо одразу визначити послідовність мономерів у довгому ланцюзі (наприклад, у всьому гені > 1000 п. н. ) 1958 q Його треба розділити в певних місцях на короткі фрагменти (100 – 300 п. н. ) та визначати послідовність мономерів у цих фрагментах, а потім будувати усю послідовність q Молекули полімера ділять принаймні на дві порції. Молекули з порції 1 гідролізують одним агентом (РЕ 1), а молекули з порції 2 – другим агентом (РЕ 2) так, щоб отримати фрагменти, послідовності яких перекриваються 1980 Фредерік Сенджер q Визначають послідовності мономерів у фрагментах, отриманих різними способами. Деякі послідовності певних фрагментів співпадають (перекриваються). Це дає змогу побудувати послідовність усієї молекули
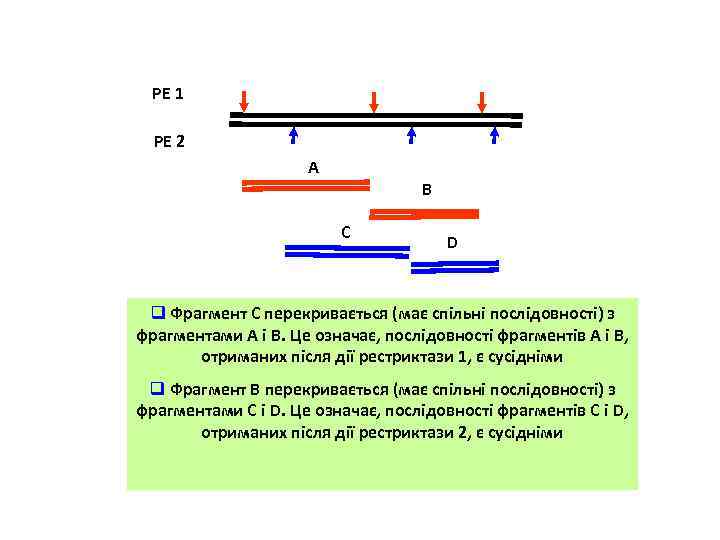 РЕ 1 РЕ 2 А В С D q Фрагмент С перекривається (має спільні послідовності) з фрагментами А і В. Це означає, послідовності фрагментів А і В, отриманих після дії рестриктази 1, є сусідніми q Фрагмент В перекривається (має спільні послідовності) з фрагментами С і D. Це означає, послідовності фрагментів С і D, отриманих після дії рестриктази 2, є сусідніми
РЕ 1 РЕ 2 А В С D q Фрагмент С перекривається (має спільні послідовності) з фрагментами А і В. Це означає, послідовності фрагментів А і В, отриманих після дії рестриктази 1, є сусідніми q Фрагмент В перекривається (має спільні послідовності) з фрагментами С і D. Це означає, послідовності фрагментів С і D, отриманих після дії рестриктази 2, є сусідніми
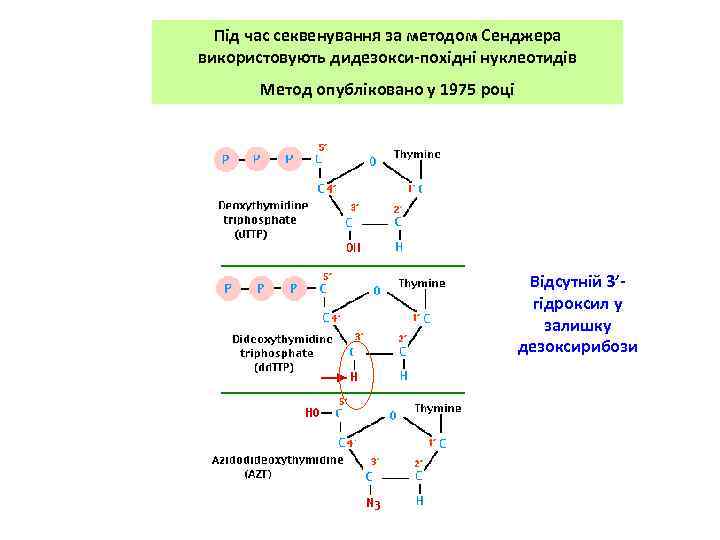 Під час секвенування за методом Сенджера використовують дидезокси-похідні нуклеотидів Метод опубліковано у 1975 році Відсутній 3’гідроксил у залишку дезоксирибози
Під час секвенування за методом Сенджера використовують дидезокси-похідні нуклеотидів Метод опубліковано у 1975 році Відсутній 3’гідроксил у залишку дезоксирибози
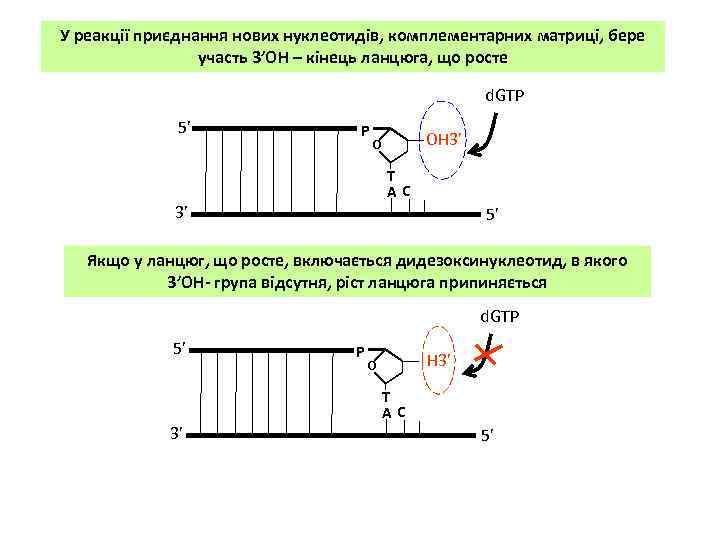 У реакції приєднання нових нуклеотидів, комплементарних матриці, бере участь 3’OH – кінець ланцюга, що росте d. GTP 5’ Р ОН 3’ о Т АC 3’ 5’ Якщо у ланцюг, що росте, включається дидезоксинуклеотид, в якого 3’OH- група відсутня, ріст ланцюга припиняється d. GTP 5’ 3’ Р Н 3’ о Т АC 5’
У реакції приєднання нових нуклеотидів, комплементарних матриці, бере участь 3’OH – кінець ланцюга, що росте d. GTP 5’ Р ОН 3’ о Т АC 3’ 5’ Якщо у ланцюг, що росте, включається дидезоксинуклеотид, в якого 3’OH- група відсутня, ріст ланцюга припиняється d. GTP 5’ 3’ Р Н 3’ о Т АC 5’
 q Ділянку ДНК, послідовність якої хочуть визначити, клонують у векторах і отримують однониткові ланцюги цієї ділянки (матриці) q За допомогою ДНК-полімерази синтезують уривки – копії з матриці ДНК, первинну структуру якої визначають q Синтез копії обривається випадково на різних за положенням, але однакових типах нуклеотидів матриці (наприклад, тільки на А, чи тільки на Т, С, G) q Копії, синтез яких обривається на А, містять на своїх 3’-кінцях Т (це так звані Т -копії). Припинення синтезу на нуклеотидах Т, С, G дає А-, G-, С- копії Т-копії різної довжини 5’ 5’ 5’ 3’ T T T T А А А T TT T Синтез Т-копій А Матриця, послідовність якої визначають АА 5’ Довжина Ткопій вказує на положення залишків А в матриці
q Ділянку ДНК, послідовність якої хочуть визначити, клонують у векторах і отримують однониткові ланцюги цієї ділянки (матриці) q За допомогою ДНК-полімерази синтезують уривки – копії з матриці ДНК, первинну структуру якої визначають q Синтез копії обривається випадково на різних за положенням, але однакових типах нуклеотидів матриці (наприклад, тільки на А, чи тільки на Т, С, G) q Копії, синтез яких обривається на А, містять на своїх 3’-кінцях Т (це так звані Т -копії). Припинення синтезу на нуклеотидах Т, С, G дає А-, G-, С- копії Т-копії різної довжини 5’ 5’ 5’ 3’ T T T T А А А T TT T Синтез Т-копій А Матриця, послідовність якої визначають АА 5’ Довжина Ткопій вказує на положення залишків А в матриці
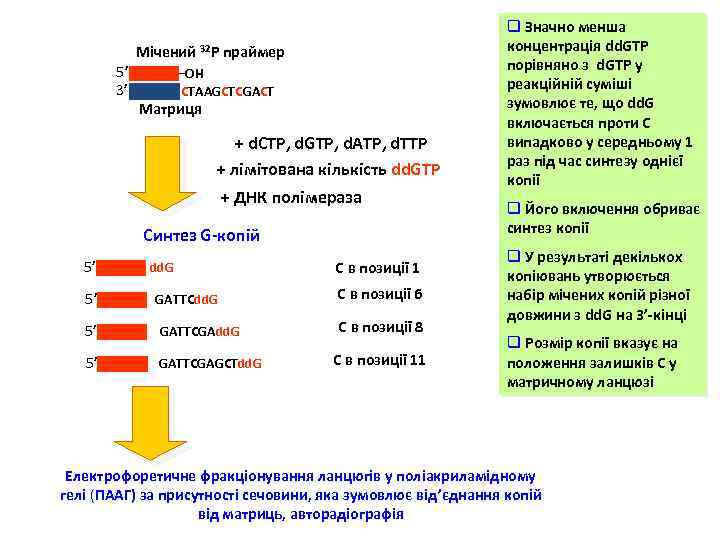 Мічений 32 Р праймер 5’ 3’ OH CTAAGCTCGACT Матриця + d. CTP, d. GTP, d. ATP, d. TTP + лімітована кількість dd. GTP + ДНК полімераза Синтез G-копій 5’ dd. G С в позиції 1 5’ GATTCdd. G С в позиції 6 5’ GATTCGAdd. G С в позиції 8 5’ GATTCGAGCTdd. G С в позиції 11 q Значно менша концентрація dd. GTP порівняно з d. GTP у реакційній суміші зумовлює те, що dd. G включається проти С випадково у середньому 1 раз під час синтезу однієї копії q Його включення обриває синтез копії q У результаті декількох копіювань утворюється набір мічених копій різної довжини з dd. G на 3’-кінці q Розмір копії вказує на положення залишків С у матричному ланцюзі Електрофоретичне фракціонування ланцюгів у поліакриламідному гелі (ПААГ) за присутності сечовини, яка зумовлює від’єднання копій від матриць, авторадіографія
Мічений 32 Р праймер 5’ 3’ OH CTAAGCTCGACT Матриця + d. CTP, d. GTP, d. ATP, d. TTP + лімітована кількість dd. GTP + ДНК полімераза Синтез G-копій 5’ dd. G С в позиції 1 5’ GATTCdd. G С в позиції 6 5’ GATTCGAdd. G С в позиції 8 5’ GATTCGAGCTdd. G С в позиції 11 q Значно менша концентрація dd. GTP порівняно з d. GTP у реакційній суміші зумовлює те, що dd. G включається проти С випадково у середньому 1 раз під час синтезу однієї копії q Його включення обриває синтез копії q У результаті декількох копіювань утворюється набір мічених копій різної довжини з dd. G на 3’-кінці q Розмір копії вказує на положення залишків С у матричному ланцюзі Електрофоретичне фракціонування ланцюгів у поліакриламідному гелі (ПААГ) за присутності сечовини, яка зумовлює від’єднання копій від матриць, авторадіографія
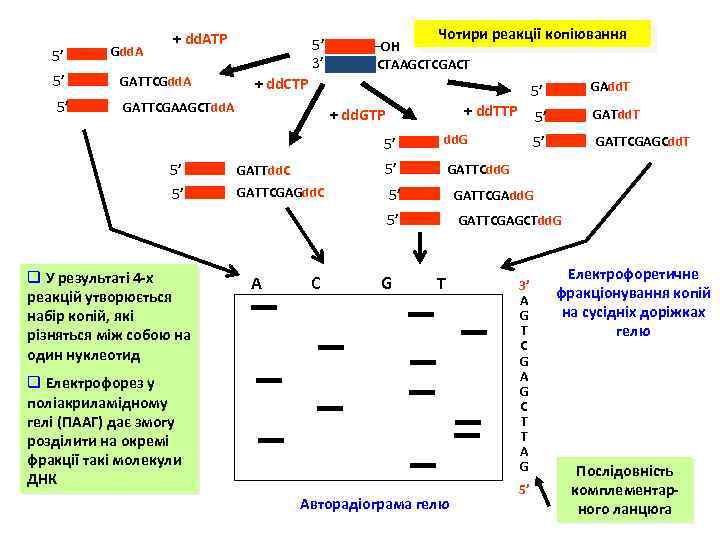 5’ Gdd. A + dd. ATP 5’ GATTCGdd. A 5’ 5’ 3’ GATTCGAAGCTdd. A Чотири реакції копіювання OH CTAAGCTCGACT + dd. CTP GATTdd. C 5’ 5’ GATTCGAGdd. C 5’ GATTCGAdd. G 5’ C GATTCGAGCdd. T GATTCdd. G 5’ A GATdd. T 5’ dd. G GAdd. T 5’ + dd. TTP + dd. GTP 5’ q У результаті 4 -х реакцій утворюється набір копій, які різняться між собою на один нуклеотид 5’ G GATTCGAGCTdd. G T q Електрофорез у поліакриламідному гелі (ПААГ) дає змогу розділити на окремі фракції такі молекули ДНК Авторадіограма гелю 3’ A G T C G A G C T T A G 5’ Електрофоретичне фракціонування копій на сусідніх доріжках гелю Послідовність комплементарного ланцюга
5’ Gdd. A + dd. ATP 5’ GATTCGdd. A 5’ 5’ 3’ GATTCGAAGCTdd. A Чотири реакції копіювання OH CTAAGCTCGACT + dd. CTP GATTdd. C 5’ 5’ GATTCGAGdd. C 5’ GATTCGAdd. G 5’ C GATTCGAGCdd. T GATTCdd. G 5’ A GATdd. T 5’ dd. G GAdd. T 5’ + dd. TTP + dd. GTP 5’ q У результаті 4 -х реакцій утворюється набір копій, які різняться між собою на один нуклеотид 5’ G GATTCGAGCTdd. G T q Електрофорез у поліакриламідному гелі (ПААГ) дає змогу розділити на окремі фракції такі молекули ДНК Авторадіограма гелю 3’ A G T C G A G C T T A G 5’ Електрофоретичне фракціонування копій на сусідніх доріжках гелю Послідовність комплементарного ланцюга
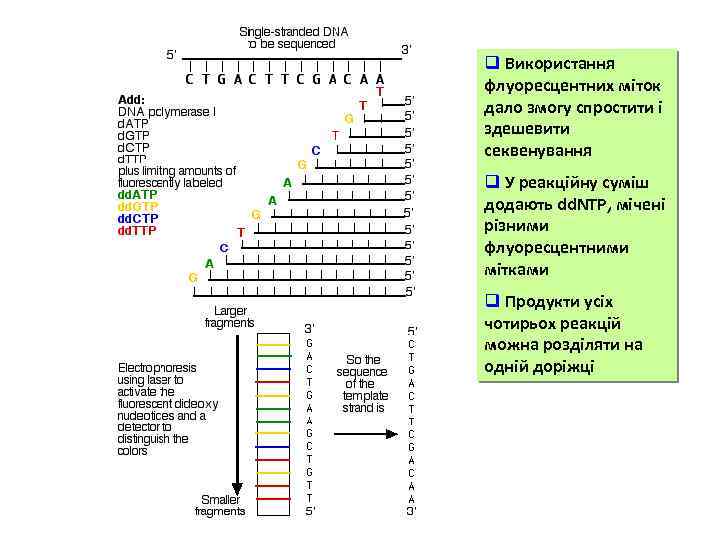 q Використання флуоресцентних міток дало змогу спростити і здешевити секвенування q У реакційну суміш додають dd. NTP, мічені різними флуоресцентними мітками q Продукти усіх чотирьох реакцій можна розділяти на одній доріжці
q Використання флуоресцентних міток дало змогу спростити і здешевити секвенування q У реакційну суміш додають dd. NTP, мічені різними флуоресцентними мітками q Продукти усіх чотирьох реакцій можна розділяти на одній доріжці
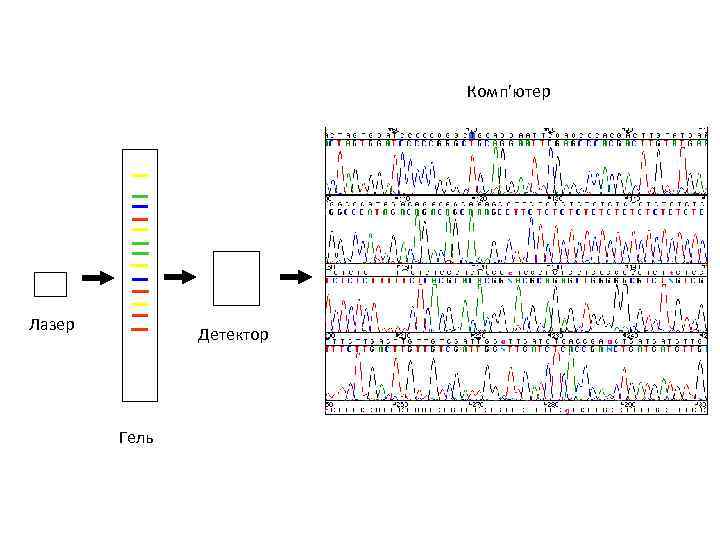 Комп’ютер Лазер Детектор Гель
Комп’ютер Лазер Детектор Гель


