Презентация_8_Поджелудочная железа.pptx
- Количество слайдов: 34
 Поджелудочная железа. Физиологические эффекты гормонов поджелудочной железы.
Поджелудочная железа. Физиологические эффекты гормонов поджелудочной железы.
 Поджелудочная железа - железа смешанной секреции. Экзокринная функция – выработка пищеварительных ферментов, выделяющиеся в полость двенадцатиперстной кишки. Эндокринная функция осуществляется островками Лангерганса.
Поджелудочная железа - железа смешанной секреции. Экзокринная функция – выработка пищеварительных ферментов, выделяющиеся в полость двенадцатиперстной кишки. Эндокринная функция осуществляется островками Лангерганса.
 Строение поджелудочной железы. • Островковая часть составляет у человека не более 3 % общей массы поджелудочной железы. • Наибольшее количество ее находится в хвостовой части железы: в этом отделе содержится в среднем 36 островков на 1 мм 3 паренхимиы, в теле - 22, 4, в головке 19, 8 на 1 мм 3. В целом в железе насчитывается до 1800 тыс. островков.
Строение поджелудочной железы. • Островковая часть составляет у человека не более 3 % общей массы поджелудочной железы. • Наибольшее количество ее находится в хвостовой части железы: в этом отделе содержится в среднем 36 островков на 1 мм 3 паренхимиы, в теле - 22, 4, в головке 19, 8 на 1 мм 3. В целом в железе насчитывается до 1800 тыс. островков.
 Эмбриогенез. • Поджелудочная железа человека закладывается между 4 -й и 5 -й неделями внутриутробной жизни. • Островки Лангерганса появляются на 10 -11 неделе, а к 4 -5 месяцу они достигают размеров взрослого человека. Секреция инсулина и глюкагона начинается уже на 13 неделе эмбриогенеза.
Эмбриогенез. • Поджелудочная железа человека закладывается между 4 -й и 5 -й неделями внутриутробной жизни. • Островки Лангерганса появляются на 10 -11 неделе, а к 4 -5 месяцу они достигают размеров взрослого человека. Секреция инсулина и глюкагона начинается уже на 13 неделе эмбриогенеза.
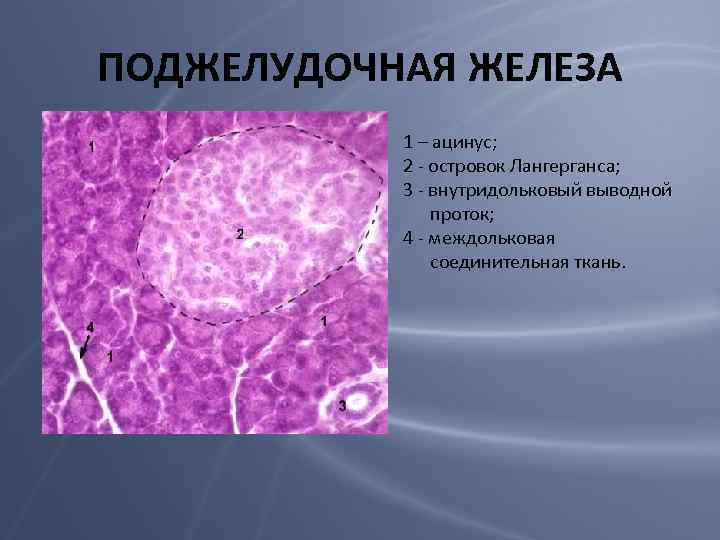 ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА 1 – ацинус; 2 - островок Лангерганса; 3 - внутридольковый выводной проток; 4 - междольковая соединительная ткань.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА 1 – ацинус; 2 - островок Лангерганса; 3 - внутридольковый выводной проток; 4 - междольковая соединительная ткань.
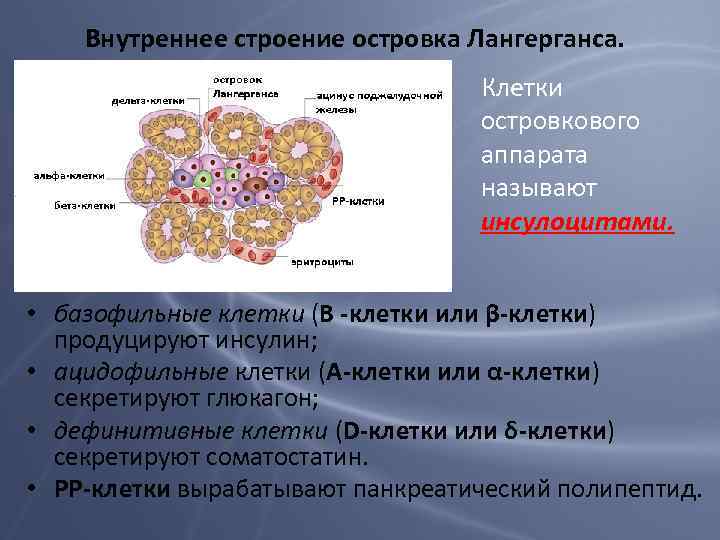 Внутреннее строение островка Лангерганса. Клетки островкового аппарата называют инсулоцитами. • базофильные клетки (В -клетки или β-клетки) продуцируют инсулин; • ацидофильные клетки (А-клетки или α-клетки) секретируют глюкагон; • дефинитивные клетки (D-клетки или δ-клетки) секретируют соматостатин. • РР-клетки вырабатывают панкреатический полипептид.
Внутреннее строение островка Лангерганса. Клетки островкового аппарата называют инсулоцитами. • базофильные клетки (В -клетки или β-клетки) продуцируют инсулин; • ацидофильные клетки (А-клетки или α-клетки) секретируют глюкагон; • дефинитивные клетки (D-клетки или δ-клетки) секретируют соматостатин. • РР-клетки вырабатывают панкреатический полипептид.
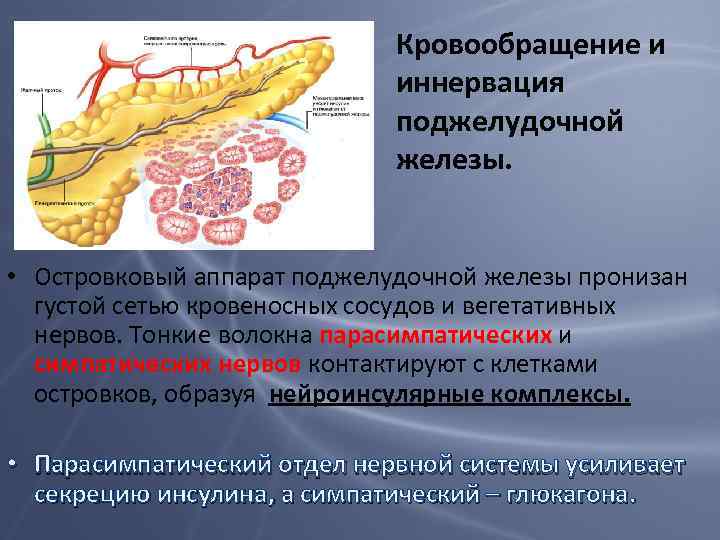 Кровообращение и иннервация поджелудочной железы. • Островковый аппарат поджелудочной железы пронизан густой сетью кровеносных сосудов и вегетативных нервов. Тонкие волокна парасимпатических и симпатических нервов контактируют с клетками островков, образуя нейроинсулярные комплексы. • Парасимпатический отдел нервной системы усиливает секрецию инсулина, а симпатический – глюкагона.
Кровообращение и иннервация поджелудочной железы. • Островковый аппарат поджелудочной железы пронизан густой сетью кровеносных сосудов и вегетативных нервов. Тонкие волокна парасимпатических и симпатических нервов контактируют с клетками островков, образуя нейроинсулярные комплексы. • Парасимпатический отдел нервной системы усиливает секрецию инсулина, а симпатический – глюкагона.
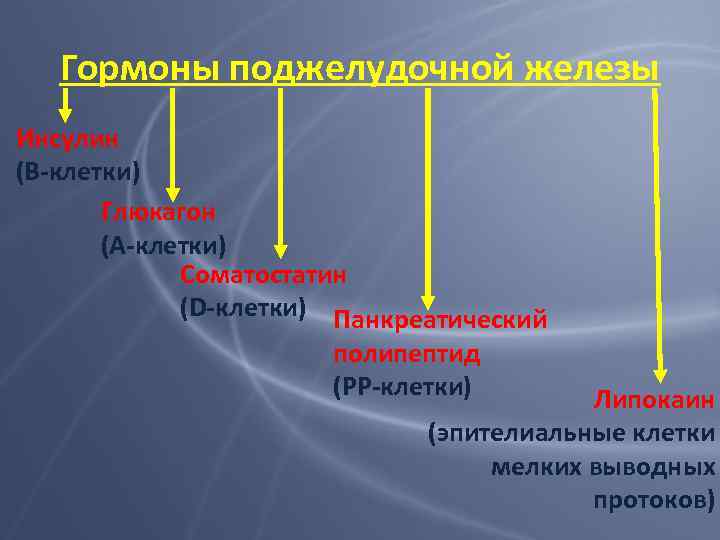 Гормоны поджелудочной железы Инсулин (В-клетки) Глюкагон (А-клетки) Соматостатин (D-клетки) Панкреатический полипептид (РР-клетки) Липокаин (эпителиальные клетки мелких выводных протоков)
Гормоны поджелудочной железы Инсулин (В-клетки) Глюкагон (А-клетки) Соматостатин (D-клетки) Панкреатический полипептид (РР-клетки) Липокаин (эпителиальные клетки мелких выводных протоков)
 В-клетки Инсулин - пептид с молекулярной массой около 6000. • Инсулин – первый белок, полученный синтетически вне организма. Молекула инсулина • Стандартизация инсулина производится в международных единицах (МЕ). • МЕ в фармакологии - это единица измерения количества вещества, основанная на биологической активности. 1 МЕ инсулина: биологический эквивалент 45, 5 мкг чистого кристаллического инсулина (точно 1/22 мг).
В-клетки Инсулин - пептид с молекулярной массой около 6000. • Инсулин – первый белок, полученный синтетически вне организма. Молекула инсулина • Стандартизация инсулина производится в международных единицах (МЕ). • МЕ в фармакологии - это единица измерения количества вещества, основанная на биологической активности. 1 МЕ инсулина: биологический эквивалент 45, 5 мкг чистого кристаллического инсулина (точно 1/22 мг).
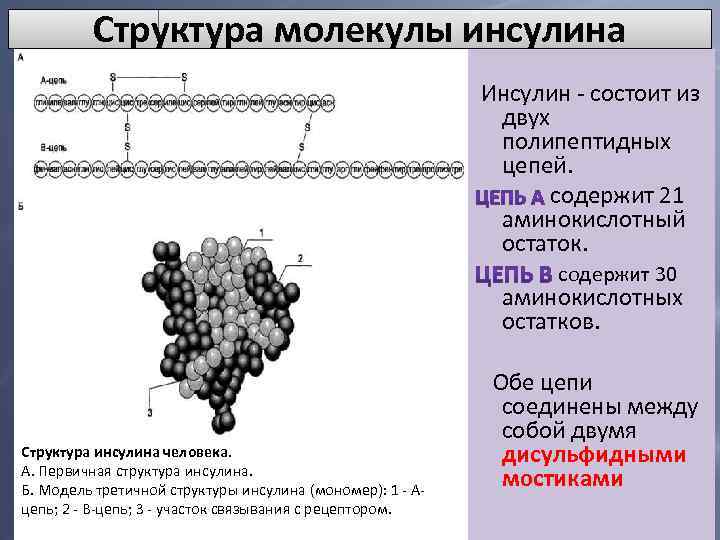 Структура молекулы инсулина Инсулин - состоит из двух полипептидных цепей. содержит 21 аминокислотный остаток. содержит 30 аминокислотных остатков. Структура инсулина человека. А. Первичная структура инсулина. Б. Модель третичной структуры инсулина (мономер): 1 - Ацепь; 2 - В-цепь; 3 - участок связывания с рецептором. Обе цепи соединены между собой двумя дисульфидными мостиками
Структура молекулы инсулина Инсулин - состоит из двух полипептидных цепей. содержит 21 аминокислотный остаток. содержит 30 аминокислотных остатков. Структура инсулина человека. А. Первичная структура инсулина. Б. Модель третичной структуры инсулина (мономер): 1 - Ацепь; 2 - В-цепь; 3 - участок связывания с рецептором. Обе цепи соединены между собой двумя дисульфидными мостиками
 • Молекула инсулина содержит также внутримолекулярный дисульфидный мостик, соединяющий шестой и одиннадцатый остатки в А-цепи. • Инсулины некоторых животных имеют значительное сходство по первичной структуре с инсулином человека.
• Молекула инсулина содержит также внутримолекулярный дисульфидный мостик, соединяющий шестой и одиннадцатый остатки в А-цепи. • Инсулины некоторых животных имеют значительное сходство по первичной структуре с инсулином человека.
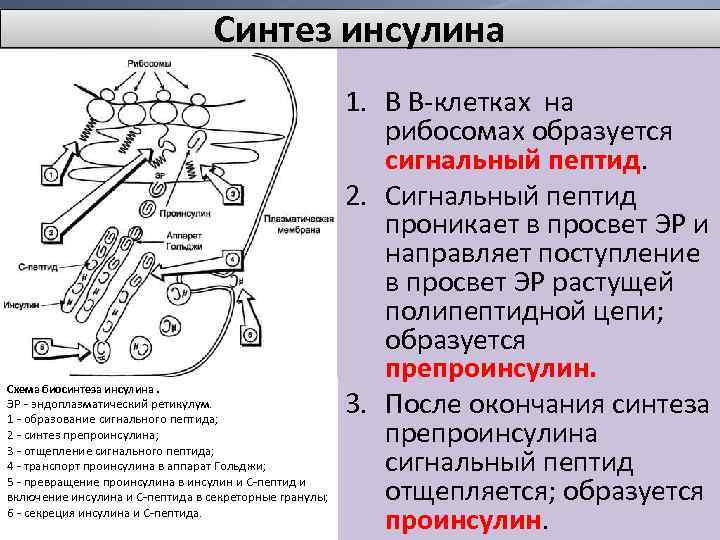 Синтез инсулина Схема биосинтеза инсулина. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида. 1. В В-клетках на рибосомах образуется сигнальный пептид. 2. Сигнальный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи; образуется препроинсулин. 3. После окончания синтеза препроинсулина сигнальный пептид отщепляется; образуется проинсулин.
Синтез инсулина Схема биосинтеза инсулина. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида. 1. В В-клетках на рибосомах образуется сигнальный пептид. 2. Сигнальный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи; образуется препроинсулин. 3. После окончания синтеза препроинсулина сигнальный пептид отщепляется; образуется проинсулин.
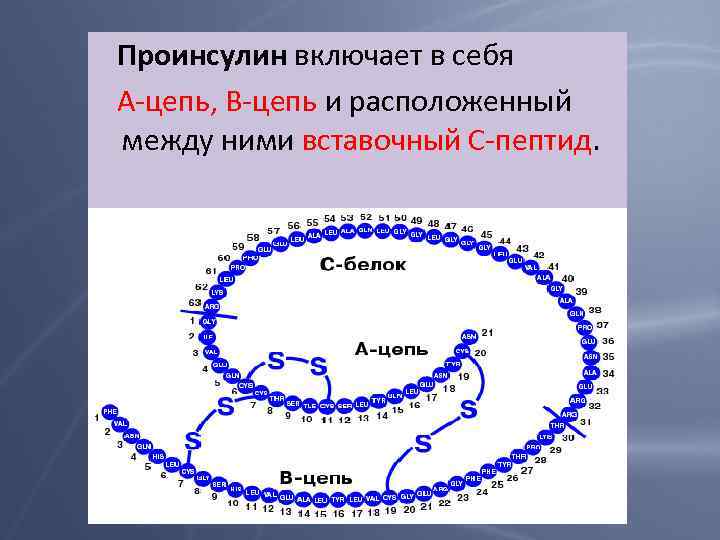 Проинсулин включает в себя А-цепь, В-цепь и расположенный между ними вставочный С-пептид.
Проинсулин включает в себя А-цепь, В-цепь и расположенный между ними вставочный С-пептид.
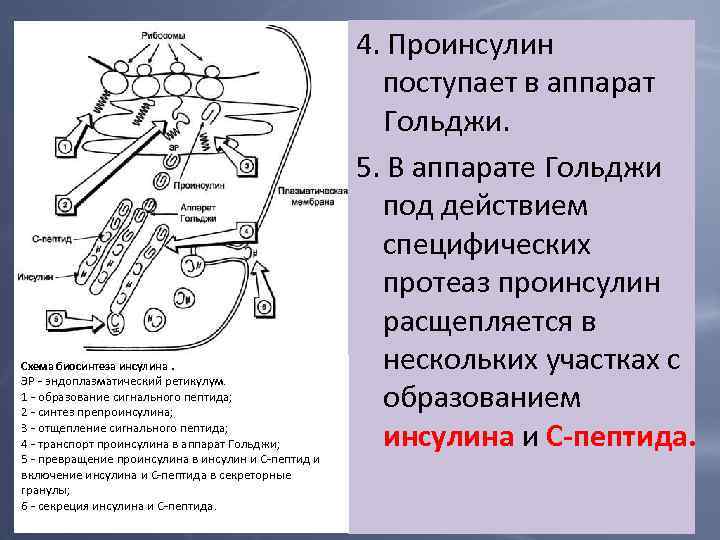 Схема биосинтеза инсулина. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида. 4. Проинсулин поступает в аппарат Гольджи. 5. В аппарате Гольджи под действием специфических протеаз проинсулин расщепляется в нескольких участках с образованием инсулина и С-пептида.
Схема биосинтеза инсулина. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида. 4. Проинсулин поступает в аппарат Гольджи. 5. В аппарате Гольджи под действием специфических протеаз проинсулин расщепляется в нескольких участках с образованием инсулина и С-пептида.
 6. Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. 7. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза, а затем в кровь.
6. Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. 7. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза, а затем в кровь.
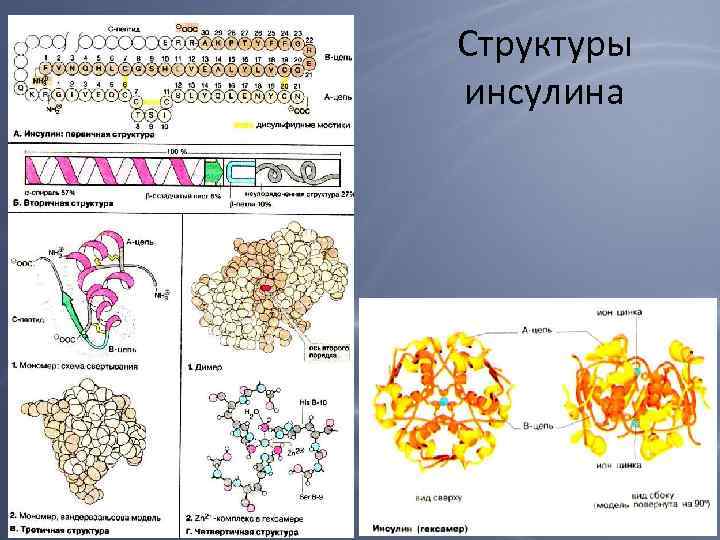 Структуры инсулина
Структуры инсулина
 связанная свободная В крови: форма = форма инсулина При повышенной потребности организма в инсулине (например, после сладкой пищи) увеличивается количество свободной фракции и уменьшается содержание связанного инсулина, а натощак преобладает связанный инсулин. Свободный инсулин действует на все инсулиночувствительные ткани (мышцы, жировую ткань, печень, мозг) Связанный инсулин действует только на жировую ткань, способную освобождать инсулин от связи с белком.
связанная свободная В крови: форма = форма инсулина При повышенной потребности организма в инсулине (например, после сладкой пищи) увеличивается количество свободной фракции и уменьшается содержание связанного инсулина, а натощак преобладает связанный инсулин. Свободный инсулин действует на все инсулиночувствительные ткани (мышцы, жировую ткань, печень, мозг) Связанный инсулин действует только на жировую ткань, способную освобождать инсулин от связи с белком.
 • У здорового человека содержание инсулина в плазме крови натощак составляет 1, 25 ± 0, 08 нг/мл. • Разрушает инсулин фермент в наибольшем количестве находящийся в печени и почках, а продукты распада выводятся с мочой. : предохраняет организм от избыточного поступления инсулина в общий круг кровообращения, предотвращая развитие гипогликемии. . ее активность значительно меньше, чем у взрослых людей. Физиологический смысл: «сберегает» инсулин для повышенных потребностей растущего организма. активность инсулиназы вновь понижается. Физиологический смысл: приспособительный механизм, направленный на поддержание постоянного уровня сахара крови при старении.
• У здорового человека содержание инсулина в плазме крови натощак составляет 1, 25 ± 0, 08 нг/мл. • Разрушает инсулин фермент в наибольшем количестве находящийся в печени и почках, а продукты распада выводятся с мочой. : предохраняет организм от избыточного поступления инсулина в общий круг кровообращения, предотвращая развитие гипогликемии. . ее активность значительно меньше, чем у взрослых людей. Физиологический смысл: «сберегает» инсулин для повышенных потребностей растущего организма. активность инсулиназы вновь понижается. Физиологический смысл: приспособительный механизм, направленный на поддержание постоянного уровня сахара крови при старении.
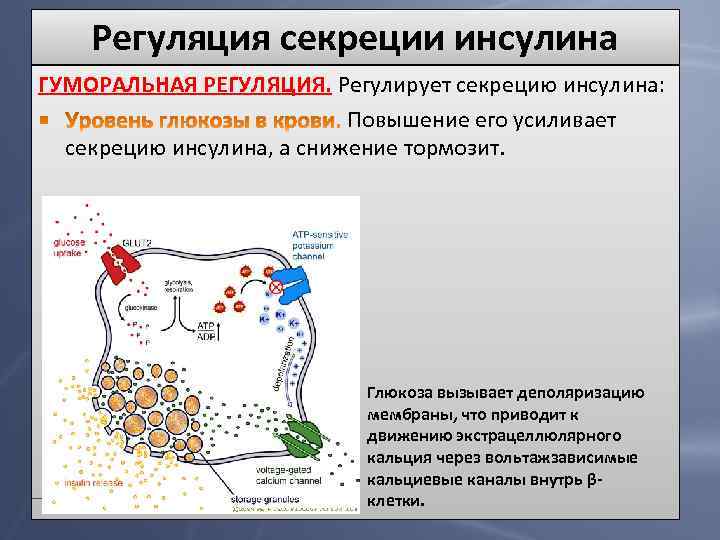 Регуляция секреции инсулина ГУМОРАЛЬНАЯ РЕГУЛЯЦИЯ. Регулирует секрецию инсулина: Повышение его усиливает секрецию инсулина, а снижение тормозит. Глюкоза вызывает деполяризацию мембраны, что приводит к движению экстрацеллюлярного кальция через вольтажзависимые кальциевые каналы внутрь βклетки.
Регуляция секреции инсулина ГУМОРАЛЬНАЯ РЕГУЛЯЦИЯ. Регулирует секрецию инсулина: Повышение его усиливает секрецию инсулина, а снижение тормозит. Глюкоза вызывает деполяризацию мембраны, что приводит к движению экстрацеллюлярного кальция через вольтажзависимые кальциевые каналы внутрь βклетки.
 Снижение его стимулирует секрецию инсулина. Т. е. запускается механизм ауторегуляции секреции инсулина. Стимулируют синтез инсулина: соматотропный гормон, кортикотропин, глюкортикоиды; тормозят – соматостатин, кальцитонин, норадреналин. Активируют секрецию инсулина – секретин, гастрин, холецистокинин-панкреозимин. НЕРВНАЯ РЕГУЛЯЦИЯ. Блуждающий нерв - стимулирует секрецию. Симпатические нервы - тормозят секрецию.
Снижение его стимулирует секрецию инсулина. Т. е. запускается механизм ауторегуляции секреции инсулина. Стимулируют синтез инсулина: соматотропный гормон, кортикотропин, глюкортикоиды; тормозят – соматостатин, кальцитонин, норадреналин. Активируют секрецию инсулина – секретин, гастрин, холецистокинин-панкреозимин. НЕРВНАЯ РЕГУЛЯЦИЯ. Блуждающий нерв - стимулирует секрецию. Симпатические нервы - тормозят секрецию.
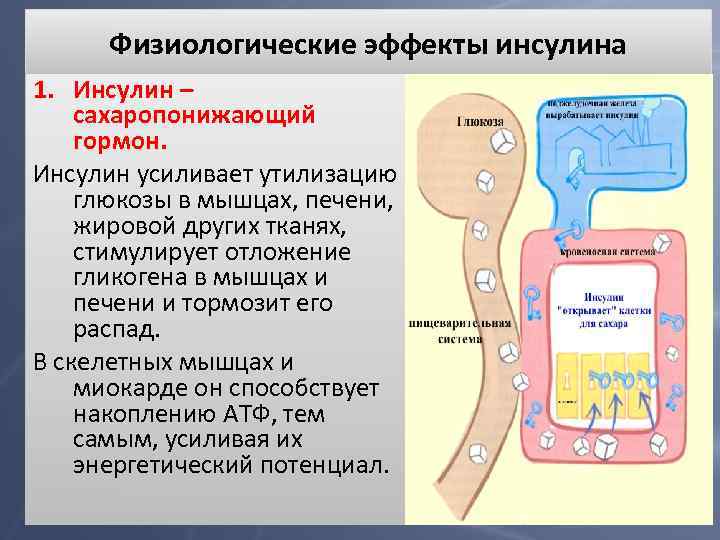 Физиологические эффекты инсулина 1. Инсулин – сахаропонижающий гормон. Инсулин усиливает утилизацию глюкозы в мышцах, печени, жировой других тканях, стимулирует отложение гликогена в мышцах и печени и тормозит его распад. В скелетных мышцах и миокарде он способствует накоплению АТФ, тем самым, усиливая их энергетический потенциал.
Физиологические эффекты инсулина 1. Инсулин – сахаропонижающий гормон. Инсулин усиливает утилизацию глюкозы в мышцах, печени, жировой других тканях, стимулирует отложение гликогена в мышцах и печени и тормозит его распад. В скелетных мышцах и миокарде он способствует накоплению АТФ, тем самым, усиливая их энергетический потенциал.
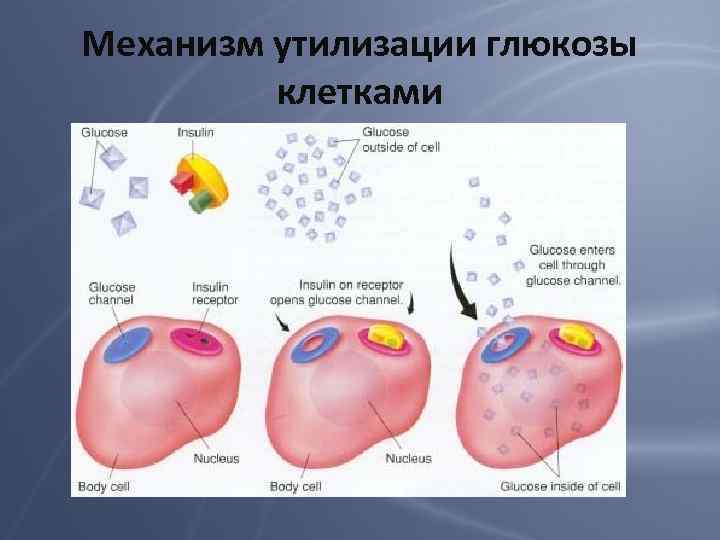 Механизм утилизации глюкозы клетками
Механизм утилизации глюкозы клетками
 2. Липидный обмен. Инсулин стимулирует образование триглицеридов и депонирование липидов в жировой ткани, тормозит липолиз. Считается, что в основе некоторых форм ожирения лежит повышенная секреция инсулина (гиперинсулинизм) или избыточное связывание инсулина жировыми клетками.
2. Липидный обмен. Инсулин стимулирует образование триглицеридов и депонирование липидов в жировой ткани, тормозит липолиз. Считается, что в основе некоторых форм ожирения лежит повышенная секреция инсулина (гиперинсулинизм) или избыточное связывание инсулина жировыми клетками.
 3. Обмен белков. • Инсулин усиливает транспорт аминокислот через мембраны клеток (особенно мышечных), стимулирует синтез белка. • Инсулин способствует реализации анаболического влияния соматотропного гормона, а также активирует его секрецию.
3. Обмен белков. • Инсулин усиливает транспорт аминокислот через мембраны клеток (особенно мышечных), стимулирует синтез белка. • Инсулин способствует реализации анаболического влияния соматотропного гормона, а также активирует его секрецию.
 А-клетки Молекула глюкагона Глюкагон – пептид, состоящий из 29 аминокислотных остатков молекулярный вес 3485 Неактивный предшественник (не обладает биологической активностью) в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной железы главный пептид - ; в клетках кишечника образуются .
А-клетки Молекула глюкагона Глюкагон – пептид, состоящий из 29 аминокислотных остатков молекулярный вес 3485 Неактивный предшественник (не обладает биологической активностью) в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной железы главный пептид - ; в клетках кишечника образуются .
 Регуляция секреции глюкагона Активируют секрецию глюкагона: • падение глюкозы в крови ниже 50 мг %; • понижение уровня свободных жирных кислот, аминокислот в крови; • холецистокинин-панкреозимин, гастрин. Тормозят секрецию глюкагона: • гастроинтестинальные гормоны – секретин, соматостатин; • повышенное содержание глюкозы в плазме крови; • повышение активности симпатического отдела вегетативной нервной системы увеличивает секрецию глюкагона и вызывает дегрануляцию А клеток.
Регуляция секреции глюкагона Активируют секрецию глюкагона: • падение глюкозы в крови ниже 50 мг %; • понижение уровня свободных жирных кислот, аминокислот в крови; • холецистокинин-панкреозимин, гастрин. Тормозят секрецию глюкагона: • гастроинтестинальные гормоны – секретин, соматостатин; • повышенное содержание глюкозы в плазме крови; • повышение активности симпатического отдела вегетативной нервной системы увеличивает секрецию глюкагона и вызывает дегрануляцию А клеток.
 • В плазме крови глюкагон не связан с каким-либо транспортным белком. • В периферической крови содержится 75 -150 пг/мл глюкагона. • Около 50 % глюкагона, попадающего с током крови в печень, подвергается деградации с помощью ферментов, близких к инсулиназе.
• В плазме крови глюкагон не связан с каким-либо транспортным белком. • В периферической крови содержится 75 -150 пг/мл глюкагона. • Около 50 % глюкагона, попадающего с током крови в печень, подвергается деградации с помощью ферментов, близких к инсулиназе.
 Физиологические эффекты глюкагона 1. Углеводный обмен. Под воздействием глюкагона активируется фермент , которая расщепляет гликоген печени до глюкозы. На гликоген мышц глюкагон не действует. Т. о. , глюкагон является антагонистом инсулина. Вместе с тем действие инсулина и глюкагона следует рассматривать как . Их общее физиологическое действие – : глюкагон способствует превращению гликогена печени в глюкозу крови, а инсулин обеспечивает последующий переход глюкозы в клетки и ее внутриклеточное потребление.
Физиологические эффекты глюкагона 1. Углеводный обмен. Под воздействием глюкагона активируется фермент , которая расщепляет гликоген печени до глюкозы. На гликоген мышц глюкагон не действует. Т. о. , глюкагон является антагонистом инсулина. Вместе с тем действие инсулина и глюкагона следует рассматривать как . Их общее физиологическое действие – : глюкагон способствует превращению гликогена печени в глюкозу крови, а инсулин обеспечивает последующий переход глюкозы в клетки и ее внутриклеточное потребление.
 2. Липидный обмен. Глюкагон стимулирует распад жира в жировой ткани с освобождением свободных жирных кислот. 3. Углеводный обмен. Глюкагон стимулирует процессы глюконеогенеза – новообразования углеводов в печени из неуглеводных компонентов, благодаря чему также оказывает гипергликемическое воздействие.
2. Липидный обмен. Глюкагон стимулирует распад жира в жировой ткани с освобождением свободных жирных кислот. 3. Углеводный обмен. Глюкагон стимулирует процессы глюконеогенеза – новообразования углеводов в печени из неуглеводных компонентов, благодаря чему также оказывает гипергликемическое воздействие.
 D-клетки островка Лангерганса Молекула соматостатина Соматостатин – полипептид, обладающий способностью тормозить секрецию соматотропина и тиреотропина. Соматостатин подавляет секрецию инсулина, глюкагона и большинства гастроинтестинальных гормонов.
D-клетки островка Лангерганса Молекула соматостатина Соматостатин – полипептид, обладающий способностью тормозить секрецию соматотропина и тиреотропина. Соматостатин подавляет секрецию инсулина, глюкагона и большинства гастроинтестинальных гормонов.
 РР-клетки Панкреатический полипептид. Стимулируют выделение: белки, блуждающий нерв и гипогликемия РР-клетки островка Лангерганса (1 — гранулы, 2 — митохондрия, 3 — ядро); × 15000. Гормон уменьшает панкреатическую экзокринную секрецию.
РР-клетки Панкреатический полипептид. Стимулируют выделение: белки, блуждающий нерв и гипогликемия РР-клетки островка Лангерганса (1 — гранулы, 2 — митохондрия, 3 — ядро); × 15000. Гормон уменьшает панкреатическую экзокринную секрецию.
 Эпителиальные клетки мелких выводных протоков Липокаин регулирует обмен жира в печени, препятствует накоплению кетоновых тел. Липокаин способствует утилизации жира в печени путем стимуляции окисления высших жирных кислот и образования фосфолипидов (лецитина), тем самым препятствуя развитию жировой инфильтрации печени.
Эпителиальные клетки мелких выводных протоков Липокаин регулирует обмен жира в печени, препятствует накоплению кетоновых тел. Липокаин способствует утилизации жира в печени путем стимуляции окисления высших жирных кислот и образования фосфолипидов (лецитина), тем самым препятствуя развитию жировой инфильтрации печени.


