подвижность_13_11_15.pptx
- Количество слайдов: 24
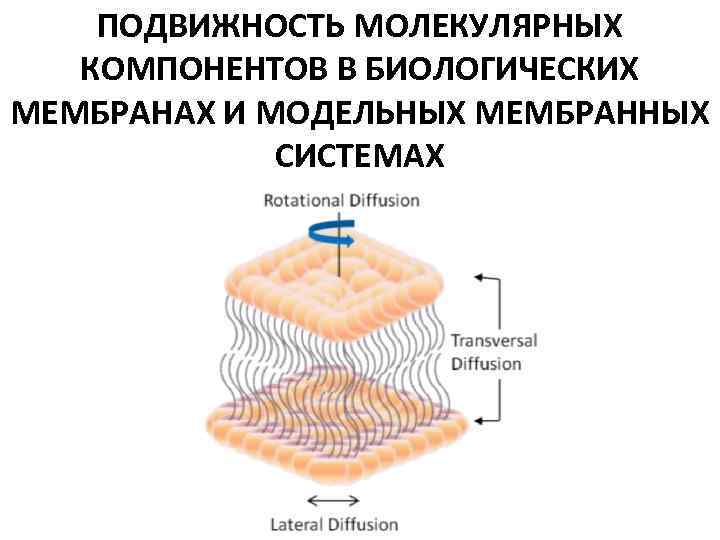
ПОДВИЖНОСТЬ МОЛЕКУЛЯРНЫХ КОМПОНЕНТОВ В БИОЛОГИЧЕСКИХ МЕМБРАНАХ И МОДЕЛЬНЫХ МЕМБРАННЫХ СИСТЕМАХ

ПОДВИЖНОСТЬ МОЛЕКУЛЯРНЫХ КОМПОНЕНТОВ В МЕМБРАНАХ Гидрофобные взаимодействия, удерживающие молекулярные компоненты в мембранах, препятствуют их выходу в водную среду. В то же время силы межмолекулярного взаимодействия не препятствуют молекулам обмениваться друг с другом местами, так как площадь контакта между водой и гидрофобными участками не изменяется. Вследствие этого молекулярные компоненты в мембранах сохраняют подвижность и могут диффундировать в пределах мембраны. 1. Общая характеристика основных типов подвижности мембранных структур (липидов и белков). 2. Их количественные характеристики (характерные времена, коэффициенты диффузии и др. ). 3. Основные биофизические методы исследования различных типов подвижности, то есть методы, позволяющие получить количественные характеристики подвижности мембранных компонентов.

ПОДВИЖНОСТЬ МОЛЕКУЛЯРНЫХ КОМПОНЕНТОВ В МЕМБРАНАХ Динамика мембранных компонентов связана с биологическими функциями мембраны. Для одних мембранных процессов важна свободная диффузия мембранных компонентов, для других – та или иная функция возможна лишь при ограниченной диффузии в пределах определенных доменов биомембран. ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН 1. Спектроскопия электронного парамагнитного резонанса (ЭПР). Метод спиновых зондов и спиновых меток. 2. Флуоресцентные методы. Метод флуоресцентных меток (зондов) и деполяризации флуоресценции. Метод восстановления флуоресценции после фотоотбеливания. Флуоресцентная корреляционная спектроскопия. 3. Спектроскопия ядерного магнитного резонанса (ЯМР).

ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН Электронный парамагнитный резонанс - явление резонансного поглощения электромагнитного излучения радиочастотного диапазона образцом парамагнитных частиц (свободными радикалами, триплетными состояниями молекул и некоторыми металлами переменной валентности – то есть частицами, имеющими неспаренные электроны), находящимися в постоянном магнитном поле. МЕТОДЫ СПИНОВЫХ ЗОНДОВ И СПИНОВЫХ МЕТОК ЭПР-сигналы дают только парамагнитные частицы (частицы, содержащие неспаренные электроны). Модельные мембранные системы, например, липосомы из липидов, не содержат парамагнитных центров. Для исследования бислоев липидов парамагнитные центры вводятся в исследуемую систему исследователем. Спиновые зонды – это стабильные свободные радикалы (в основном, нитроксильные), которые удерживаются в исследуемой системе (модельной или биологической мембране) за счет нековалентных взаимодействий. Спиновые метки – это стабильные свободные радикалы (в основном, нитроксильные), которые ковалентно связываются с компонентами исследуемой системы (например, определенными аминокислотными остатками белков). Метод спиновых меток используется, в основном, при исследовании динамики мембранных белков.

ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН Мак. Коннел Харден Мерсден (Mc. Connell Harden M. ) (р. 1927) - американский физикохимик. Основоположник применения методов спиновых зондов и спиновых меток в исследовании белков и мембранных липидов. Специалист в области радиоспектроскопии (ЭПР и ЯМР).

ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН В качестве спиновых зондов и спиновых меток используются, в основном, нитроксильные радикалы. В нитроксильных радикалах орбиталь с неспаренным электроном экранирована окружающими метильными группами, что делает нитроксильный радикал стабильным (другие свободные радикалы достаточно реакционно способны). Однако, нитроксильные фрагменты могут быть восстановлены некоторыми восстановителями, например, аскорбиновой кислотой при 0 OC, продукт восстановления не парамагнитен и не дает сигнала электронного парамагнитного резонанса. Форма спектра ЭПР спиновых зондов и меток зависит: • От характера движения зонда (метки) – изотропное или анизотропное движение; • Скорости движения; • Наличия других парамагнитных центров – другие парамагнетики приводят к уширению спектра ЭПР. 2, 2, 6, 6 -тетраметилпиперидин-1 оксил (ТЕМПО)
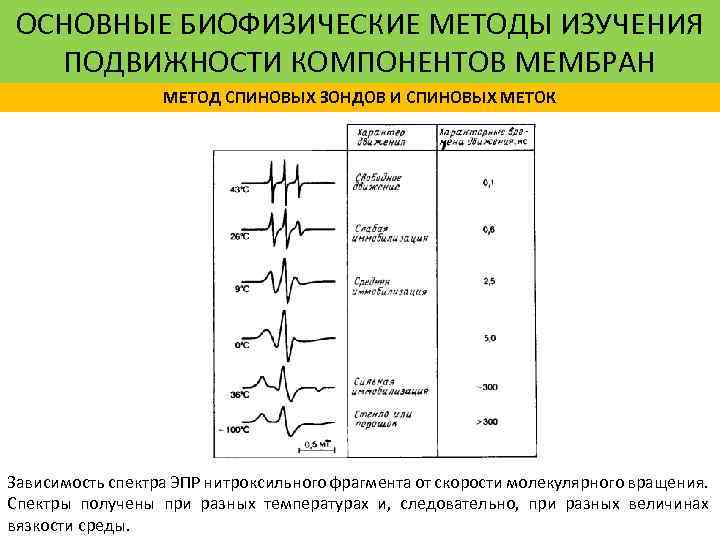
ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН МЕТОД СПИНОВЫХ ЗОНДОВ И СПИНОВЫХ МЕТОК Зависимость спектра ЭПР нитроксильного фрагмента от скорости молекулярного вращения. Спектры получены при разных температурах и, следовательно, при разных величинах вязкости среды.
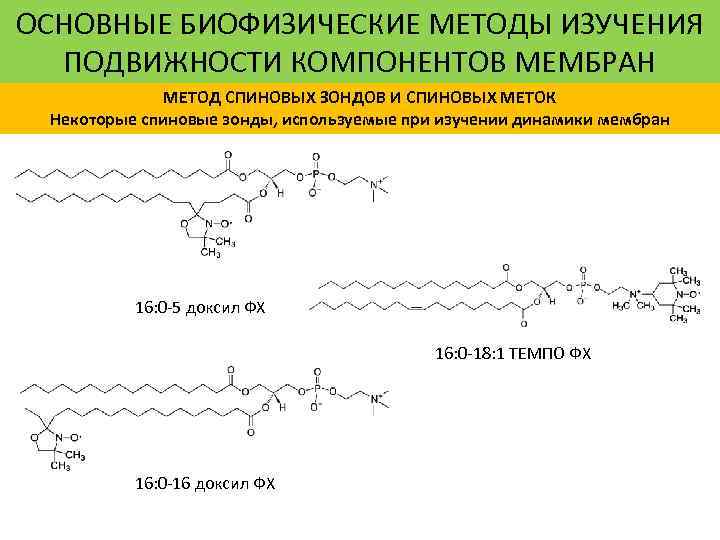
ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН МЕТОД СПИНОВЫХ ЗОНДОВ И СПИНОВЫХ МЕТОК Некоторые спиновые зонды, используемые при изучении динамики мембран 16: 0 -5 доксил ФХ 16: 0 -18: 1 ТЕМПО ФХ 16: 0 -16 доксил ФХ
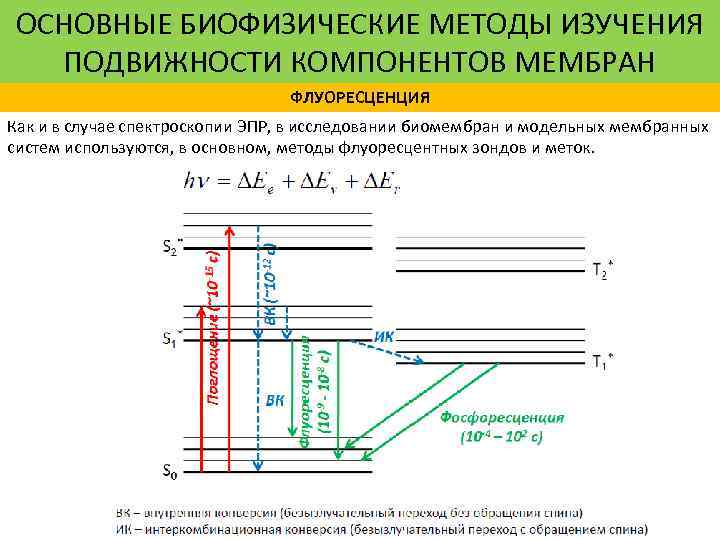
ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН ФЛУОРЕСЦЕНЦИЯ Как и в случае спектроскопии ЭПР, в исследовании биомембран и модельных мембранных систем используются, в основном, методы флуоресцентных зондов и меток.
ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН ФЛУОРЕСЦЕНЦИЯ Некоторые флуоресцентные зонды, используемые при изучении динамики мембран 18: 1 -5 дансил ФЭ пирен 6: 0 -12: 0 NBD ФХ

ОСНОВНЫЕ БИОФИЗИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ ПОДВИЖНОСТИ КОМПОНЕНТОВ МЕМБРАН МЕТОД СПЕКТРОСКОПИИ ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА Ядерный магнитный резонанс – явление резонансного поглощения электромагнитного поля радиочастотного диапазона некоторыми атомными ядрами, помещенными в постоянное магнитное поле. В биологических исследованиях наиболее важны ядра 1 H, 2 H, 13 C, 31 P. • Ширина линии сигнала ядерного магнитного резонанса зависит от подвижности молекулярных групп, содержащих парамагнитные ядра. • Наличие других парамагнитных центров приводит к уширению линий в спектре ЯМР. • Основное преимущество метода спектроскопии ЯМР по сравнению с предыдущими методами – отсутствие молекулярных групп (зондов и меток), способных исказить нативную структуру исследуемой системы.
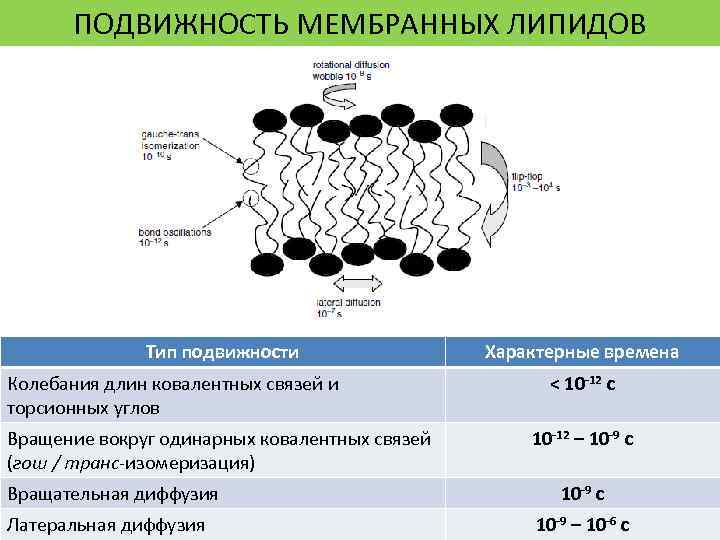
ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ Тип подвижности Колебания длин ковалентных связей и торсионных углов Вращение вокруг одинарных ковалентных связей (гош / транс-изомеризация) Вращательная диффузия Латеральная диффузия Характерные времена < 10 -12 c 10 -12 – 10 -9 с 10 -9 – 10 -6 с

ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ КОНФИГУРАЦИОННАЯ (КОНФОРМАЦИОННАЯ) ПОДВИЖНОСТЬ Конфигурационная подвижность мембранных липидов обеспечивается вращением вокруг одинарных ковалентных связей (транс / гош-изомеризацией). Основной метод исследования конформационной подвижности углеводородных остатков жирных кислот в липидах – это спектроскопия ЯМР на ядрах дейтерия. Атомы водорода 1 Н в определенных местах липидной молекулы можно заменить на дейтерий 2 H = D. О характере молекулярных движений в углеводородных цепях жирнокислотных остатков липидов говорит квадриупольное расщепление в спектрах ЯМР. Величина квадриупольного расщепления зависит от усредненной по времени ориентации вектора СD-связи (r. C-D) по отношению к нормали к бислою (rмол). Чем ниже квадриупольное расщепление – тем выше неупорядоченность в исследуемой области липидного бислоя. Количественная характеристика упорядоченности / неупорядоченности – параметр упорядоченности S: SС-D = 3/2<cos 2β> - 1/2, где <cos 2β> – усредненный по времени квадрат косинуса угла между векторами rмол и r. C-D. Если β = 0, то <cos 2β> = 1 и S = 1. Если β = 90 o, то <cos 2β> = 0 и S = -0, 5. При <cos 2β> = 1/3 и S = 0.
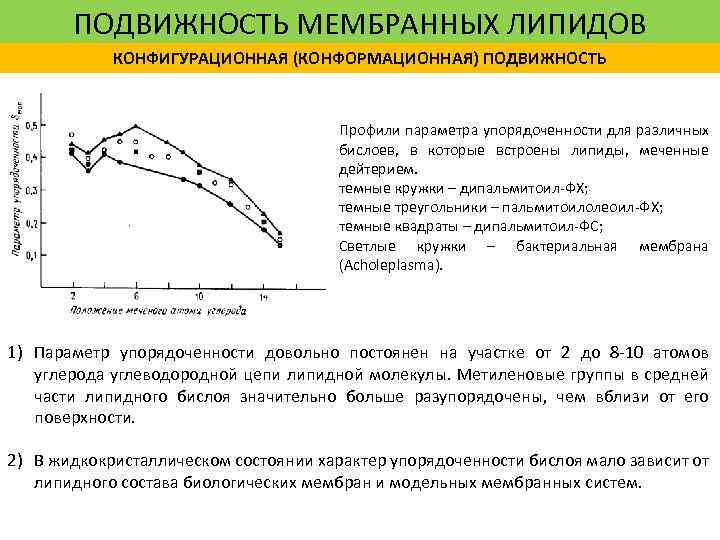
ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ КОНФИГУРАЦИОННАЯ (КОНФОРМАЦИОННАЯ) ПОДВИЖНОСТЬ Профили параметра упорядоченности для различных бислоев, в которые встроены липиды, меченные дейтерием. темные кружки – дипальмитоил-ФХ; темные треугольники – пальмитоилолеоил-ФХ; темные квадраты – дипальмитоил-ФС; Светлые кружки – бактериальная мембрана (Acholeplasma). 1) Параметр упорядоченности довольно постоянен на участке от 2 до 8 -10 атомов углерода углеводородной цепи липидной молекулы. Метиленовые группы в средней части липидного бислоя значительно больше разупорядочены, чем вблизи от его поверхности. 2) В жидкокристаллическом состоянии характер упорядоченности бислоя мало зависит от липидного состава биологических мембран и модельных мембранных систем.

ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ ВРАЩАТЕЛЬНАЯ ДИФФУЗИЯ И МИКРОВЯЗКОСТЬ МЕМБРАН Молекулы липидов совершают вращательное движение вокруг своей длинной оси. Количественная характеристика вращательного движения – время вращательной корреляции (время поворота молекулы на угол 90 O). Основные методы изучения вращательной диффузии мембранных липидов – это ЭПРспектроскопия (спиновые метки и зонды) и флуоресцентная спектроскопия (флуоресцентные метки и зонды). Время корреляции вращательного движения липидных молекул в бислоях, находящихся в жидкокристаллическом состоянии составляет t ~ 10 -9 с. Вращательная подвижность липидов остается сравнительно высокой и при температуре ниже фазового перехода (t ~ 10 -8 с). Константы вращательной диффузии мембранных липидов свидетельствуют, что при физиологических условиях мембранные системы проявляют свойства двумерной жидкости. Вязкость жидкости можно определить исходя из уравнения Стокса-Эйнштейна:

ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ ВРАЩАТЕЛЬНАЯ ДИФФУЗИЯ И МИКРОВЯЗКОСТЬ МЕМБРАН Вязкость можно рассчитать по времени корреляции вращательного движения спиновых и флуоресцентных зондов в мембранах: Вязкость мембран, измеренная с помощью парамагнитных и флуоресцентных зондов составляет в среднем ~ 1 П. Эта величина близка к вязкости оливкового масла. Однако: понятие «вязкость» не вполне точно, когда речь идет о подвижности зондов в ассиметричной, сложной по химической организации системе, какой являются биологические мембраны. Скорость вращения зонда определяется микроструктурой его непосредственного окружения в мембране, поэтому часто пользуются термином «микровязкость» . Практически микровязкость соответствует вязкости однородной среды, в которой зонд двигался бы с той же скоростью, с которой он движется в мембране.

ВРАЩЕНИЕ МЕМБРАННЫХ БЕЛКОВ 1. Большинство мембранных белков могут вращаться в мембране вокруг собственной оси. 2. Времена корреляции вращательного движения варьируют для различных мембранных белков в диапазоне от 1 до 100 мкс. 3. Некоторые белки вообще не вращаются в биомембранах (например, бактериородопсин в мембранах пурпурных бактерий). 4. Так как характерное время вращения мембранных белков составляет мкс, методы, используемые при исследовании вращения липидов, для белков неприменимы. Основные методы оценки времен вращательной корреляции мембранных белков – это метод фосфоресцентных меток (например, эозина) и метод спиновых меток (ЭПР с переносом насыщения).
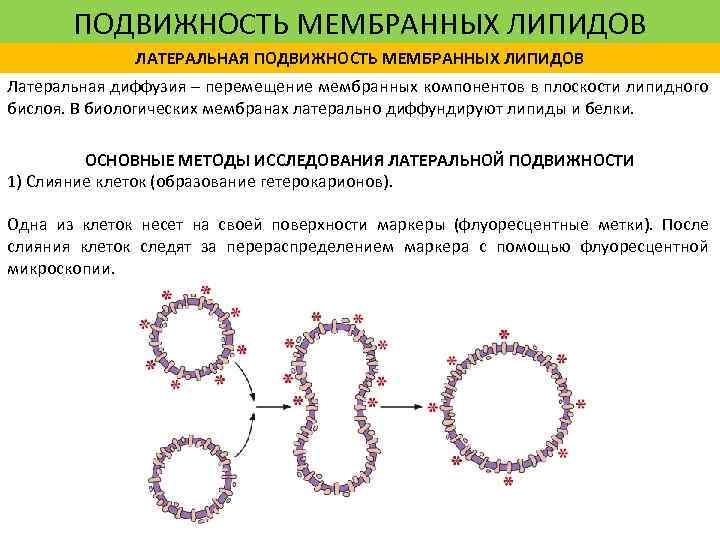
ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ Латеральная диффузия – перемещение мембранных компонентов в плоскости липидного бислоя. В биологических мембранах латерально диффундируют липиды и белки. ОСНОВНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЛАТЕРАЛЬНОЙ ПОДВИЖНОСТИ 1) Слияние клеток (образование гетерокарионов). Одна из клеток несет на своей поверхности маркеры (флуоресцентные метки). После слияния клеток следят за перераспределением маркера с помощью флуоресцентной микроскопии.
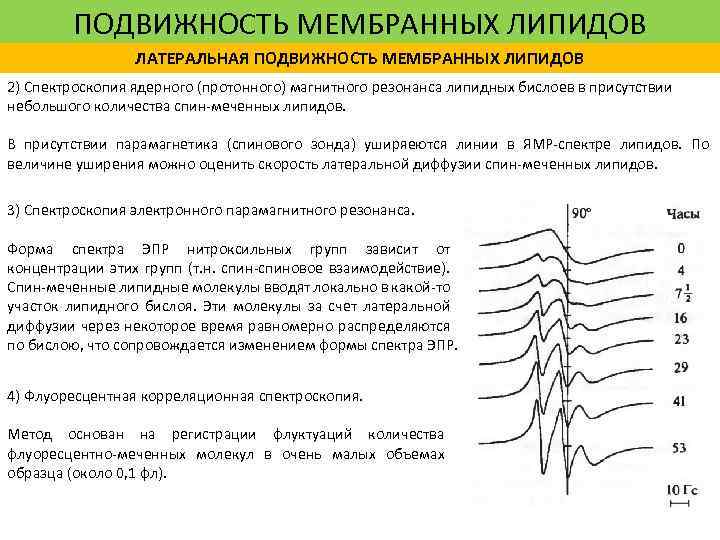
ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ 2) Спектроскопия ядерного (протонного) магнитного резонанса липидных бислоев в присутствии небольшого количества спин-меченных липидов. В присутствии парамагнетика (спинового зонда) уширяеются линии в ЯМР-спектре липидов. По величине уширения можно оценить скорость латеральной диффузии спин-меченных липидов. 3) Спектроскопия электронного парамагнитного резонанса. Форма спектра ЭПР нитроксильных групп зависит от концентрации этих групп (т. н. спин-спиновое взаимодействие). Спин-меченные липидные молекулы вводят локально в какой-то участок липидного бислоя. Эти молекулы за счет латеральной диффузии через некоторое время равномерно распределяются по бислою, что сопровождается изменением формы спектра ЭПР. 4) Флуоресцентная корреляционная спектроскопия. Метод основан на регистрации флуктуаций количества флуоресцентно-меченных молекул в очень малых объемах образца (около 0, 1 фл).
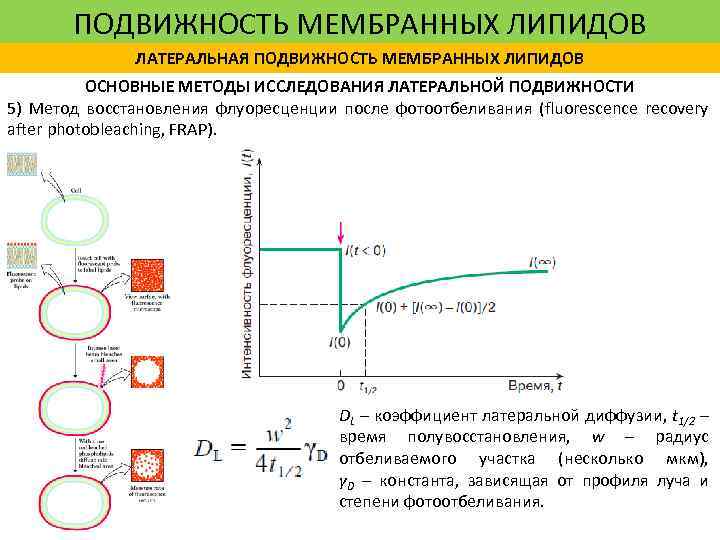
ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ ОСНОВНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЛАТЕРАЛЬНОЙ ПОДВИЖНОСТИ 5) Метод восстановления флуоресценции после фотоотбеливания (fluorescence recovery after photobleaching, FRAP). DL – коэффициент латеральной диффузии, t 1/2 – время полувосстановления, w – радиус отбеливаемого участка (несколько мкм), γD – константа, зависящая от профиля луча и степени фотоотбеливания.

ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ 1) Коэффициенты латеральной диффузии меченных аналогов липидов в модельных мембранных системах составляет ~10 -8 см 2 / с. 2) В природных мембранах коэффициент латеральной диффузии обычно на порядок ниже (из-за присутствия мембранных белков). <x>2 = 4 Dt, <x> - среднее расстояние, которое молекула проходит вдоль мембраны за время t. Среднее расстояние, которое проходит липидная молекула за 1 секунду составляет около 5 мкм, что сравнимо с размерами бактериальных клеток и эритроцитов. 3) Коэффициент латеральной диффузии липидов практически не зависит от полярной головки молекулы. 4) Коэффициент латеральной диффузии липидов в бислоях в состоянии геля примерно на 2 порядка ниже, чем в бислоях в жидкокристаллическом состоянии (D < 10 -10 см 2 / с).

ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ МЕМБРАННЫХ БЕЛКОВ 1. Многие мембранные белки способны к латеральной диффузии. 2. Основные методы определения коэффициентов латеральной диффузии мембранных белков – это восстановление флуоресценции после фотоотбеливания и флуоресцентная корреляционная спектроскопия. 3. В модельных мембранах коэффициенты латеральной диффузии белков примерно на порядок ниже, чем коэффициенты диффузии липидов (D ~ 10 -9 см 2 / с). 4. В биомембранах коэффициенты латеральной диффузии белков обычно на 2 – 3 порядка меньше, чем в модельных мембранных системах. 5. В экспериментах FRAP для некоторых мембранных белков обнаруживается не полное восстановление флуоресценции после фотоотбеливания. То есть, часть белков неподвижна (D < 10 -12 см 2 / с). Эти белки связаны с цитоскелетом или внеклеточным матриксом.
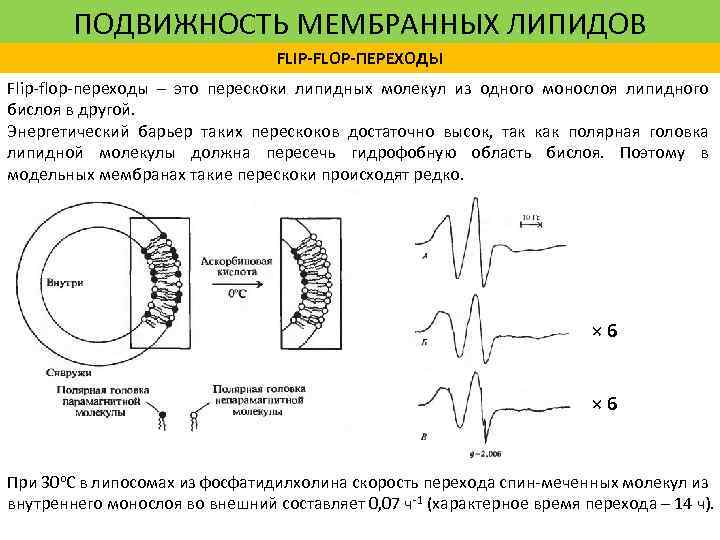
ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ FLIP-FLOP-ПЕРЕХОДЫ Flip-flop-переходы – это перескоки липидных молекул из одного монослоя липидного бислоя в другой. Энергетический барьер таких перескоков достаточно высок, так как полярная головка липидной молекулы должна пересечь гидрофобную область бислоя. Поэтому в модельных мембранах такие перескоки происходят редко. × 6 При 30 o. C в липосомах из фосфатидилхолина скорость перехода спин-меченных молекул из внутреннего монослоя во внешний составляет 0, 07 ч-1 (характерное время перехода – 14 ч).
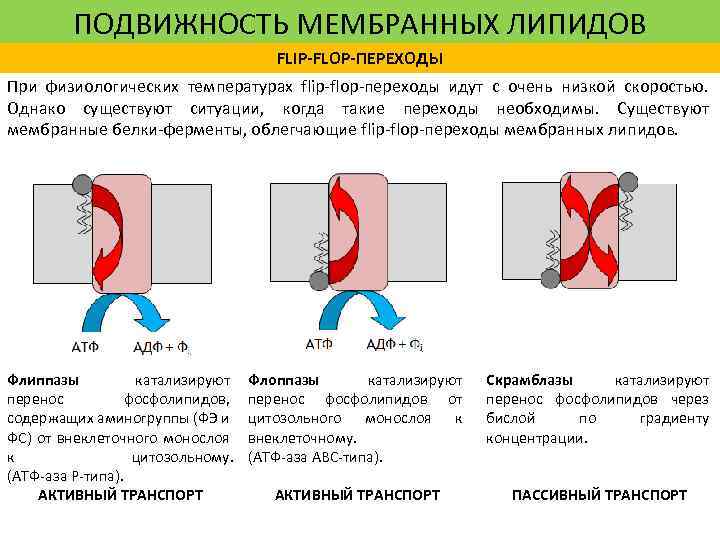
ПОДВИЖНОСТЬ МЕМБРАННЫХ ЛИПИДОВ FLIP-FLOP-ПЕРЕХОДЫ При физиологических температурах flip-flop-переходы идут с очень низкой скоростью. Однако существуют ситуации, когда такие переходы необходимы. Существуют мембранные белки-ферменты, облегчающие flip-flop-переходы мембранных липидов. Флиппазы катализируют перенос фосфолипидов, содержащих аминогруппы (ФЭ и ФС) от внеклеточного монослоя к цитозольному. (АТФ-аза Р-типа). АКТИВНЫЙ ТРАНСПОРТ Флоппазы катализируют перенос фосфолипидов от цитозольного монослоя к внеклеточному. (АТФ-аза АВС-типа). Скрамблазы катализируют перенос фосфолипидов через бислой по градиенту концентрации. АКТИВНЫЙ ТРАНСПОРТ ПАССИВНЫЙ ТРАНСПОРТ
подвижность_13_11_15.pptx