Презентация Microsoft Office PowerPoint.ppt
- Количество слайдов: 24
 Подгруппа ванадия
Подгруппа ванадия
 Члены этой подгруппы – ванадий, ниобий и тантал – похожи друг на друга. Химические элементы 5 -й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы V группы). На основании электронной конфигурации атома к этой же группе относится и элемент дубний Db.
Члены этой подгруппы – ванадий, ниобий и тантал – похожи друг на друга. Химические элементы 5 -й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы V группы). На основании электронной конфигурации атома к этой же группе относится и элемент дубний Db.
 Как и в других группах, члены этого семейства элементов проявляют закономерности электронной конфигурации, особенно внешних оболочек, хотя, как ни странно, ниобий не следует этому тренду. Тем не менее, у элементов этой группы тоже проявляется сходство физических свойств и химического поведения.
Как и в других группах, члены этого семейства элементов проявляют закономерности электронной конфигурации, особенно внешних оболочек, хотя, как ни странно, ниобий не следует этому тренду. Тем не менее, у элементов этой группы тоже проявляется сходство физических свойств и химического поведения.
 Содержание ниобия (2· 10– 4 %) и тантала (2· 10– 5 %) в земной коре значительно меньше, чем ванадия. Встречаются они главным образом в виде минералов колумбита [Fe(Nb. O 3 )2 ] и танталита [Fe(Ta. O 3 )2 ], которые обычно смешаны друг с другом. Технологическая переработка руд V, Nb и Та довольно сложна. Для получения свободных элементов может быть использовано взаимодействие их окислов Э 2 О 5 с алюминием по схеме: ЗЭ 2 О 5 + 10 Al = 5 Аl 2 О 3 + 6 Э Реакция начинается при нагревании исходной смеси и протекает с большим выделением тепла. Ванадий, ниобий и тантал представляют собой не изменяющиеся на воздухе серые блестящие металлы, хорошо поддающиеся механической обработке.
Содержание ниобия (2· 10– 4 %) и тантала (2· 10– 5 %) в земной коре значительно меньше, чем ванадия. Встречаются они главным образом в виде минералов колумбита [Fe(Nb. O 3 )2 ] и танталита [Fe(Ta. O 3 )2 ], которые обычно смешаны друг с другом. Технологическая переработка руд V, Nb и Та довольно сложна. Для получения свободных элементов может быть использовано взаимодействие их окислов Э 2 О 5 с алюминием по схеме: ЗЭ 2 О 5 + 10 Al = 5 Аl 2 О 3 + 6 Э Реакция начинается при нагревании исходной смеси и протекает с большим выделением тепла. Ванадий, ниобий и тантал представляют собой не изменяющиеся на воздухе серые блестящие металлы, хорошо поддающиеся механической обработке.
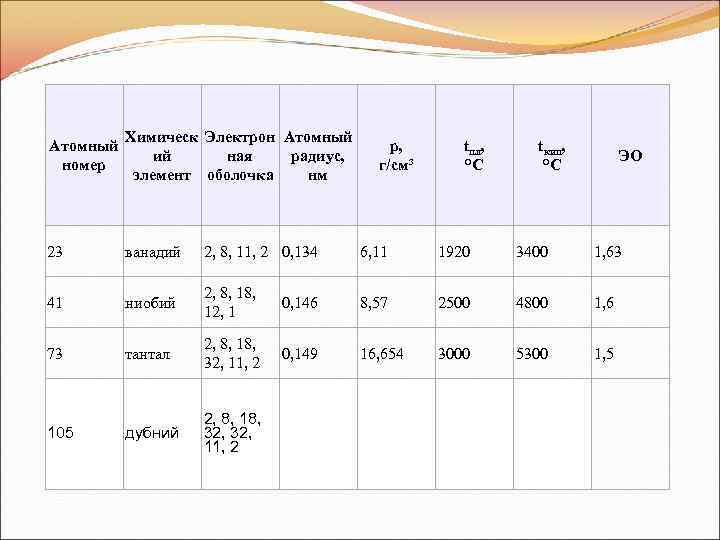 Атомный номер Химическ Электрон Атомный ий ная радиус, элемент оболочка нм 23 ванадий 2, 8, 11, 2 0, 134 6, 11 1920 3400 1, 63 41 ниобий 2, 8, 12, 1 0, 146 8, 57 2500 4800 1, 6 73 тантал 2, 8, 18, 32, 11, 2 0, 149 16, 654 3000 5300 1, 5 дубний 2, 8, 18, 32, 11, 2 105 p, г/см³ tпл, °C tкип, °C ЭО
Атомный номер Химическ Электрон Атомный ий ная радиус, элемент оболочка нм 23 ванадий 2, 8, 11, 2 0, 134 6, 11 1920 3400 1, 63 41 ниобий 2, 8, 12, 1 0, 146 8, 57 2500 4800 1, 6 73 тантал 2, 8, 18, 32, 11, 2 0, 149 16, 654 3000 5300 1, 5 дубний 2, 8, 18, 32, 11, 2 105 p, г/см³ tпл, °C tкип, °C ЭО
 В компактном состоянии все три металла весьма устойчивы по отношению к различным химическим воздействиям. Особенно характерно это для Nb и Та, которые нерастворимы во всех обычных кислотах и их смесях. Исключением является смесь HF + HNO 3 , растворяющая оба металла по схеме: ЗЭ + 5 HNO 3 + 21 HF = 3 H 2 [ЭF 7 ] + 5 NO + 10 H 2 O Растворы щелочей на рассматриваемые металлы не действуют. По размеру, как атомов, так и ионов ниобий и тантал близки друг к другу, поэтому их свойства как элементов целесообразно рассмотреть одновременно. Одинаковые объемы атомов объясняются тем, что член VI периода — тантал следует в этом периоде почти сразу же за лантаноидами, у которых происходит заполнение электронами не внешнего, а третьего снаружи слоя. Это приводит к так называемому лантаноидному сжатию — увеличивающееся количество внутренних отрицательно заряженных электронов сильнее притягивается положительно заряженным ядром. Вследствие этого радиус атома с увеличением порядкового номера элемента не только не увеличивается, но даже несколько уменьшается. По сравнению со свойствами ванадия характер элементов сдвигается заметно в сторону усиления металлических качеств. Степени окисления меняют свой характер и устойчивость. Низшие положительные степени окисления нестабильны, поэтому их соединения малочисленны и плохо изучены. Отличие от ванадия состоит и в том, что их единственным стабильным состоянием является не +4 (как у V), а. +. 5. Причем характер соединений в этом случае для ниобия и тантала несколько различается (например, по кислотным свойствам оксидов).
В компактном состоянии все три металла весьма устойчивы по отношению к различным химическим воздействиям. Особенно характерно это для Nb и Та, которые нерастворимы во всех обычных кислотах и их смесях. Исключением является смесь HF + HNO 3 , растворяющая оба металла по схеме: ЗЭ + 5 HNO 3 + 21 HF = 3 H 2 [ЭF 7 ] + 5 NO + 10 H 2 O Растворы щелочей на рассматриваемые металлы не действуют. По размеру, как атомов, так и ионов ниобий и тантал близки друг к другу, поэтому их свойства как элементов целесообразно рассмотреть одновременно. Одинаковые объемы атомов объясняются тем, что член VI периода — тантал следует в этом периоде почти сразу же за лантаноидами, у которых происходит заполнение электронами не внешнего, а третьего снаружи слоя. Это приводит к так называемому лантаноидному сжатию — увеличивающееся количество внутренних отрицательно заряженных электронов сильнее притягивается положительно заряженным ядром. Вследствие этого радиус атома с увеличением порядкового номера элемента не только не увеличивается, но даже несколько уменьшается. По сравнению со свойствами ванадия характер элементов сдвигается заметно в сторону усиления металлических качеств. Степени окисления меняют свой характер и устойчивость. Низшие положительные степени окисления нестабильны, поэтому их соединения малочисленны и плохо изучены. Отличие от ванадия состоит и в том, что их единственным стабильным состоянием является не +4 (как у V), а. +. 5. Причем характер соединений в этом случае для ниобия и тантала несколько различается (например, по кислотным свойствам оксидов).
 Разница в химических свойствах ниобия и тантала основывается на различной структуре электронных оболочек их атомов. На внешнем слое у ниобия один электрон, а у тантала — два: Nb 4 d 45 s 1 Та 5 d 3 6 s 2 Следовательно, у ниобия наблюдается отклонение от обычной последовательности заполнения электронами энергетических орбиталей. Один из двух электронов, имевшихся на внешнем слое у идущего перед ниобием элемента (циркония), переходит на 4 dорбиталь внутреннего второго снаружи слоя. Связь электронов с ядром в ячейках 4 d 4 и 5 s 1 примерно одинакова: разница составляет всего около 7 э. В. К тому же расположение электронов позволяет им иметь одинаково направленные спины. Эти особенности облегчают атому ниобия возможность использования всех своих пяти валентных электронов при химических реакциях. Тантал находится в 5 d-группе переходных металлов. Структура его атома такова, что в ней сохраняется два электрона на внешнем уровне. При химических взаимодействиях нужно затратить энергию, чтобы произошел переход одного из двух электронов с 6 s 2 -орбитали на р- или d-орбиталь соответственно внешнего или предвнешнего энергетического слоя. Необходимостью дополнительной энергии и объясняется химическая инертность тантала по сравнению с ниобием. Ниобий и в виде металла химически более активен, и его высший оксид обладает более выраженными кислотными свойствами, чем оксид тантала. В водных растворах ионы ниобия сравнительно легче восстанавливаются, тогда как у тантала все эти качества обнаруживаются в меньшей степени. В исследованиях по химии этих двух элементов указывается на существование состояний окисления +5, +4, +3, +2 и даже +1. Однако во всех работах отмечается, что соединения ниобия и тантала низших степеней окисления образуются с. трудом и не имеют большого значения в практическом использовании элементов
Разница в химических свойствах ниобия и тантала основывается на различной структуре электронных оболочек их атомов. На внешнем слое у ниобия один электрон, а у тантала — два: Nb 4 d 45 s 1 Та 5 d 3 6 s 2 Следовательно, у ниобия наблюдается отклонение от обычной последовательности заполнения электронами энергетических орбиталей. Один из двух электронов, имевшихся на внешнем слое у идущего перед ниобием элемента (циркония), переходит на 4 dорбиталь внутреннего второго снаружи слоя. Связь электронов с ядром в ячейках 4 d 4 и 5 s 1 примерно одинакова: разница составляет всего около 7 э. В. К тому же расположение электронов позволяет им иметь одинаково направленные спины. Эти особенности облегчают атому ниобия возможность использования всех своих пяти валентных электронов при химических реакциях. Тантал находится в 5 d-группе переходных металлов. Структура его атома такова, что в ней сохраняется два электрона на внешнем уровне. При химических взаимодействиях нужно затратить энергию, чтобы произошел переход одного из двух электронов с 6 s 2 -орбитали на р- или d-орбиталь соответственно внешнего или предвнешнего энергетического слоя. Необходимостью дополнительной энергии и объясняется химическая инертность тантала по сравнению с ниобием. Ниобий и в виде металла химически более активен, и его высший оксид обладает более выраженными кислотными свойствами, чем оксид тантала. В водных растворах ионы ниобия сравнительно легче восстанавливаются, тогда как у тантала все эти качества обнаруживаются в меньшей степени. В исследованиях по химии этих двух элементов указывается на существование состояний окисления +5, +4, +3, +2 и даже +1. Однако во всех работах отмечается, что соединения ниобия и тантала низших степеней окисления образуются с. трудом и не имеют большого значения в практическом использовании элементов
 Нио бий — В свободном состоянии ниобий представляет собой тугоплавкий металл, твердый, но не хрупкий, хорошо поддается механической обработке. Устойчив во многих агрессивных средах. Ниобий — один из основных компонентов жаропрочных и коррозионностойких сплавов. Его вводят также в нержавеющие стали. Он резко улучшает их механические свойства и сопротивляемость коррозии.
Нио бий — В свободном состоянии ниобий представляет собой тугоплавкий металл, твердый, но не хрупкий, хорошо поддается механической обработке. Устойчив во многих агрессивных средах. Ниобий — один из основных компонентов жаропрочных и коррозионностойких сплавов. Его вводят также в нержавеющие стали. Он резко улучшает их механические свойства и сопротивляемость коррозии.
 Физические свойства Кристаллическая решетка Чистый Ниобий легко обрабатывается давлением на холоду и сохраняет удовлетворительные механические свойства при высоких температурах. Примеси некоторых элементов, особенно водорода, азота, углерода и кислорода, сильно ухудшают пластичность и повышают твердость Ниобия. Элементарный ниобий – чрезвычайно тугоплавкий (2468°C) и высококипящий (4927°C) металл, очень стойкий во многих агрессивных средах. Все кислоты, за исключением плавиковой, не действуют на него. Кислоты-окислители «пассивируют» ниобий, покрывая его защитной окисной пленкой. Но при высоких температурах химическая активность ниобия повышается. Если при 150. . . 200°C окисляется лишь небольшой поверхностный слой металла, то при 900. . . 1200°C толщина окисной пленки значительно увеличивается.
Физические свойства Кристаллическая решетка Чистый Ниобий легко обрабатывается давлением на холоду и сохраняет удовлетворительные механические свойства при высоких температурах. Примеси некоторых элементов, особенно водорода, азота, углерода и кислорода, сильно ухудшают пластичность и повышают твердость Ниобия. Элементарный ниобий – чрезвычайно тугоплавкий (2468°C) и высококипящий (4927°C) металл, очень стойкий во многих агрессивных средах. Все кислоты, за исключением плавиковой, не действуют на него. Кислоты-окислители «пассивируют» ниобий, покрывая его защитной окисной пленкой. Но при высоких температурах химическая активность ниобия повышается. Если при 150. . . 200°C окисляется лишь небольшой поверхностный слой металла, то при 900. . . 1200°C толщина окисной пленки значительно увеличивается.
 Химические свойства Ниобий активно реагирует со многими неметаллами. С ним образуют соединения галогены, азот, водород, углерод, сера. При этом ниобий может проявлять разные валентности – от двух до пяти. Но главная валентность этого элемента 5+. Пятивалентный ниобий может входить в состав соли и как катион, и как один из элементов аниона, что свидетельствует об амфотерном характере элемента № 41. Соли ниобиевых кислот называют ниобатами. Их получают в результате обменных реакций после сплавления пятиокиси ниобия с содой: Nb 2 O 5 + 3 Na 2 CO 4 = 2 Na 3 Nb. О 4 + 3 CO 2. Довольно хорошо изучены соли нескольких ниобиевых кислот, в первую очередь метаниобиевой HNb. O 3, а также диниобаты и пентаниобаты (K 4 Nb 2 O 7, К 7 Nb 5 О 16 · m. H 2 O). А соли, в которых элемент № 41 выступает как катион, обычно получают прямым взаимодействием простых веществ, например 2 Nb + 5 Cl 2 = 2 Nb. Cl 5. Ярко окрашенные игольчатые кристаллы пентагалогенидов ниобия (Nb. Cl – желтого цвета, Nb. Br 5 – пурпурно-красного) легко растворяются в органических растворителях – хлороформе, эфире, спирте. Но при растворении в воде эти соединения полностью разлагаются, гидролизуются с образованием ниобатов: Nb. Cl 5 + 4 Н 2 О = 5 HCl + Н 3 Nb. O 4.
Химические свойства Ниобий активно реагирует со многими неметаллами. С ним образуют соединения галогены, азот, водород, углерод, сера. При этом ниобий может проявлять разные валентности – от двух до пяти. Но главная валентность этого элемента 5+. Пятивалентный ниобий может входить в состав соли и как катион, и как один из элементов аниона, что свидетельствует об амфотерном характере элемента № 41. Соли ниобиевых кислот называют ниобатами. Их получают в результате обменных реакций после сплавления пятиокиси ниобия с содой: Nb 2 O 5 + 3 Na 2 CO 4 = 2 Na 3 Nb. О 4 + 3 CO 2. Довольно хорошо изучены соли нескольких ниобиевых кислот, в первую очередь метаниобиевой HNb. O 3, а также диниобаты и пентаниобаты (K 4 Nb 2 O 7, К 7 Nb 5 О 16 · m. H 2 O). А соли, в которых элемент № 41 выступает как катион, обычно получают прямым взаимодействием простых веществ, например 2 Nb + 5 Cl 2 = 2 Nb. Cl 5. Ярко окрашенные игольчатые кристаллы пентагалогенидов ниобия (Nb. Cl – желтого цвета, Nb. Br 5 – пурпурно-красного) легко растворяются в органических растворителях – хлороформе, эфире, спирте. Но при растворении в воде эти соединения полностью разлагаются, гидролизуются с образованием ниобатов: Nb. Cl 5 + 4 Н 2 О = 5 HCl + Н 3 Nb. O 4.
 Гидролиз можно предотвратить, если в водный раствор добавить какую-либо сильную кислоту. В таких растворах пентагалогениды ниобия растворяются, не гидролизуясь. Ниобий образует двойные соли и комплексные соединения, наиболее легко – фтористые. Фторниобаты – так называются эти двойные соли. Они получаются, если в раствор ниобцевой и плавиковой кислот добавить фторид какого-либо металла. Состав комплексного соединения зависит от соотношения реагирующих в растворе компонентов. Рентгенометрический анализ одного из этих соединений показал строение, отвечающее формуле K 2 Nb. F 7. Могут образоваться и оксосоединения ниобия, например оксофторнпобат калия K 2 Nb. OF 5 · H 2 O. Химическая характеристика элемента не исчерпывается, конечно, этими сведениями. Сегодня самые важные из соединений элемента № 41 – это его соединения с другими металлами. Удивительное явление сверхпроводимости, когда при понижении температуры проводника в нем происходит скачкообразное исчезновение электрического сопротивления, впервые наблюдал голландский физик Г. Камерлинг-Оннес в 1911 г. Первым сверхпроводником оказалась ртуть, но не ей, а ниобию и некоторым интерметаллическим соединениям ниобия суждено было стать первыми технически важными сверхпроводящими материалами. Практически важны две характеристики сверхпроводников: величина критической температуры, при которой происходит переход в состояние сверхпроводимости, и критического магнитного поля (еще Камерлинг-Оннес наблюдал утрату сверхпроводником сверхпроводимости при воздействии на него достаточно сильного магнитного поля). По состоянию на 1 января 1975 г. сверхпроводником – «рекордсменом» по величине критической температуры было интерметаллическое соединение ниобия и германия состава Nb 3 Ge. Его критическая температура 23, 2°К; это выше температуры кипения водорода. (Большинство известных сверхпроводников становятся сверхпроводниками лишь при температуре жидкого гелия). Способность переходить в состояние сверхпроводимости свойственна также стапниду ниобия Nb 3 Sn, сплавам ниобия с алюминием и германием или с титаном и цирконием. Все эти сплавы и соединения уже используются для изготовления сверхпроводящих соленоидов, а также некоторых других важных технических устройств.
Гидролиз можно предотвратить, если в водный раствор добавить какую-либо сильную кислоту. В таких растворах пентагалогениды ниобия растворяются, не гидролизуясь. Ниобий образует двойные соли и комплексные соединения, наиболее легко – фтористые. Фторниобаты – так называются эти двойные соли. Они получаются, если в раствор ниобцевой и плавиковой кислот добавить фторид какого-либо металла. Состав комплексного соединения зависит от соотношения реагирующих в растворе компонентов. Рентгенометрический анализ одного из этих соединений показал строение, отвечающее формуле K 2 Nb. F 7. Могут образоваться и оксосоединения ниобия, например оксофторнпобат калия K 2 Nb. OF 5 · H 2 O. Химическая характеристика элемента не исчерпывается, конечно, этими сведениями. Сегодня самые важные из соединений элемента № 41 – это его соединения с другими металлами. Удивительное явление сверхпроводимости, когда при понижении температуры проводника в нем происходит скачкообразное исчезновение электрического сопротивления, впервые наблюдал голландский физик Г. Камерлинг-Оннес в 1911 г. Первым сверхпроводником оказалась ртуть, но не ей, а ниобию и некоторым интерметаллическим соединениям ниобия суждено было стать первыми технически важными сверхпроводящими материалами. Практически важны две характеристики сверхпроводников: величина критической температуры, при которой происходит переход в состояние сверхпроводимости, и критического магнитного поля (еще Камерлинг-Оннес наблюдал утрату сверхпроводником сверхпроводимости при воздействии на него достаточно сильного магнитного поля). По состоянию на 1 января 1975 г. сверхпроводником – «рекордсменом» по величине критической температуры было интерметаллическое соединение ниобия и германия состава Nb 3 Ge. Его критическая температура 23, 2°К; это выше температуры кипения водорода. (Большинство известных сверхпроводников становятся сверхпроводниками лишь при температуре жидкого гелия). Способность переходить в состояние сверхпроводимости свойственна также стапниду ниобия Nb 3 Sn, сплавам ниобия с алюминием и германием или с титаном и цирконием. Все эти сплавы и соединения уже используются для изготовления сверхпроводящих соленоидов, а также некоторых других важных технических устройств.
 Получение Металлический ниобий можно получить восстановлением его соединений, например хлорида ниобия или фтор-ниобата калия, при высокой температуре: K 2 Nb. F 7 + 5 Na > Nb + 2 KF + 5 Na. F. Но прежде чем достигнуть этой в сущности последней стадии производства, ниобиевая руда проходит множество этапов переработки. Первый из них – обогащение руды, получение концентратов. Концентрат сплавляют с различными плавнями: едким натром или содой. Полученный сплав выщелачивают. Но растворяется он не полностью. Нерастворимый осадок и есть ниобий. Правда, он здесь еще в составе гидроокиси, не разделен со своим аналогом по подгруппе – танталом – и не очищен от некоторых примесей. До 1866 г. не было известно ни одного пригодного для производственных условий способа разделения тантала и ниобия. Первым метод разделения этих чрезвычайно похожих элементов предложил Жан Шарль Галиссар де Мариньяк. Метод основан на разной растворимости комплексных соединений этих металлов и называется фторидным. Комплексный фторид тантала нерастворим в воде, а аналогичное соединение ниобия растворимо. Фторидный метод сложен и не позволяет полностью разделить ниобий и тантал. Поэтому в наши дни он почти не применяется. На смену ему пришли методы избирательной экстракции, ионного обмена, ректификации галогенидов и др. Этими методами получают окисел и хлорид пятивалентного ниобия. После разделения ниобия и тантала идет основная операция – восстановление. Пятиокись ниобия Nb 2 O 5 восстанавливают алюминием, натрием, сажей или карбидом ниобия, полученным при взаимодействии Nb 2 O 5 с углеродом; пентахлорид ниобия восстанавливают металлическим натрием или амальгамой натрия. Так получают порошкообразный ниобий, который нужно затем превратить в монолит, сделать пластичным, компактным, пригодным для обработки. Как и другие тугоплавкие металлы, ниобий-монолит получают методами порошковой металлургии, суть которой в следующем. Из полученного металлического порошка под большим давлением (1 т/см 2) прессуют так называемые штабики прямоугольного или квадратного сечения. В вакууме при 2300°C эти штабики спекают, соединяют в пруты, которые плавят в вакуумных дуговых печах, причем пруты в этих печах выполняют роль электрода. Такой процесс называется плавкой с расходуемым электродом. Монокристаллический пластичный ниобий получают методом бестигельной зонной электронно-лучевой плавки. Суть его в том, что на порошкообразный ниобий (операции прессования и спекания исключены!) направляют мощный пучок электронов, который плавит порошок. Капли металла стекают на ниобиевый слиток, который постепенно растет и выводится из рабочей камеры. Как видите, путь ниобия от руды до тугоплавкого металла в любом случае довольно долог, а способы производства сложны.
Получение Металлический ниобий можно получить восстановлением его соединений, например хлорида ниобия или фтор-ниобата калия, при высокой температуре: K 2 Nb. F 7 + 5 Na > Nb + 2 KF + 5 Na. F. Но прежде чем достигнуть этой в сущности последней стадии производства, ниобиевая руда проходит множество этапов переработки. Первый из них – обогащение руды, получение концентратов. Концентрат сплавляют с различными плавнями: едким натром или содой. Полученный сплав выщелачивают. Но растворяется он не полностью. Нерастворимый осадок и есть ниобий. Правда, он здесь еще в составе гидроокиси, не разделен со своим аналогом по подгруппе – танталом – и не очищен от некоторых примесей. До 1866 г. не было известно ни одного пригодного для производственных условий способа разделения тантала и ниобия. Первым метод разделения этих чрезвычайно похожих элементов предложил Жан Шарль Галиссар де Мариньяк. Метод основан на разной растворимости комплексных соединений этих металлов и называется фторидным. Комплексный фторид тантала нерастворим в воде, а аналогичное соединение ниобия растворимо. Фторидный метод сложен и не позволяет полностью разделить ниобий и тантал. Поэтому в наши дни он почти не применяется. На смену ему пришли методы избирательной экстракции, ионного обмена, ректификации галогенидов и др. Этими методами получают окисел и хлорид пятивалентного ниобия. После разделения ниобия и тантала идет основная операция – восстановление. Пятиокись ниобия Nb 2 O 5 восстанавливают алюминием, натрием, сажей или карбидом ниобия, полученным при взаимодействии Nb 2 O 5 с углеродом; пентахлорид ниобия восстанавливают металлическим натрием или амальгамой натрия. Так получают порошкообразный ниобий, который нужно затем превратить в монолит, сделать пластичным, компактным, пригодным для обработки. Как и другие тугоплавкие металлы, ниобий-монолит получают методами порошковой металлургии, суть которой в следующем. Из полученного металлического порошка под большим давлением (1 т/см 2) прессуют так называемые штабики прямоугольного или квадратного сечения. В вакууме при 2300°C эти штабики спекают, соединяют в пруты, которые плавят в вакуумных дуговых печах, причем пруты в этих печах выполняют роль электрода. Такой процесс называется плавкой с расходуемым электродом. Монокристаллический пластичный ниобий получают методом бестигельной зонной электронно-лучевой плавки. Суть его в том, что на порошкообразный ниобий (операции прессования и спекания исключены!) направляют мощный пучок электронов, который плавит порошок. Капли металла стекают на ниобиевый слиток, который постепенно растет и выводится из рабочей камеры. Как видите, путь ниобия от руды до тугоплавкого металла в любом случае довольно долог, а способы производства сложны.
 НИОБИЯ ОКСИДЫ Наиболее известны монооксид Nb. O, диоксид Nb. O 2, оксид Nb(V) (пентаоксид диниобия) Nb 2 O 5 с узкими областями гомогенности. Кроме того, существует несколько метастабильных оксидов (их свойства мало изучены) Nb. Ox (x ~ 1/6 — 1/2), которые образуются в виде пленок на начальных стадиях окисления Nb и при распаде пересыщ. твердых растворов кислорода в ниобии. Найдено также несколько оксидов состава Nb. O 2, 42 _ 2, 50. При нагревании на воздухе или в среде О 2 все низшие оксиды окисляются до Nb 2 O 5.
НИОБИЯ ОКСИДЫ Наиболее известны монооксид Nb. O, диоксид Nb. O 2, оксид Nb(V) (пентаоксид диниобия) Nb 2 O 5 с узкими областями гомогенности. Кроме того, существует несколько метастабильных оксидов (их свойства мало изучены) Nb. Ox (x ~ 1/6 — 1/2), которые образуются в виде пленок на начальных стадиях окисления Nb и при распаде пересыщ. твердых растворов кислорода в ниобии. Найдено также несколько оксидов состава Nb. O 2, 42 _ 2, 50. При нагревании на воздухе или в среде О 2 все низшие оксиды окисляются до Nb 2 O 5.
 О к с и д н и о б и я(V) Nb 2 O 5
О к с и д н и о б и я(V) Nb 2 O 5
 О к с и д н и о б и я(V) Nb 2 O 5 Бесцветные кристаллы; для него описано не менее 10 кристаллических модификаций (см. табл) температура плавления 1510°С; плотность 4, 55 г/см 3; давление пара при 1720; полупроводник. Nb 2 O 5 не растворим в воде и почти не растворим в кислотах, кроме фтористоводородной, с которой образует H 2 Nb. F 7 или H 2 Nb. OF 5. Водородом восстанавливается до низших оксидов, с NH 3 при 530 -830 °С образует Nb. N, с Сl 2 при 1000 -1060 °С и с ССl 4 при 230 °С - оксихлориды и пентахлорид Nb. При нагревании Nb 2 O 5 с другими оксидами получают многочисленные ниобаты, а также двойные оксиды со структурами, близкими к b-Nb 2 O 5, которые считались ранее твердыми растворами (Ti 2 Nb 10 O 29, Fe. Nb 49 O 124 и т. д. ). Получают Nb 2 O 5 прокаливанием гидроксида Nb(V) при 600 -1000 °С, гидролизом Nb. Cl 5, сжиганием Nb или его карбида в кислороде. Nb 2 О 5 промежуточные продукт при получении Nb, его сплавов, Nb. C, ниобатов и др. соединение, компонент огнеупоров, керметов, керамики, стекол с высоким коэффициент преломления, не пропускающих ИК излучение.
О к с и д н и о б и я(V) Nb 2 O 5 Бесцветные кристаллы; для него описано не менее 10 кристаллических модификаций (см. табл) температура плавления 1510°С; плотность 4, 55 г/см 3; давление пара при 1720; полупроводник. Nb 2 O 5 не растворим в воде и почти не растворим в кислотах, кроме фтористоводородной, с которой образует H 2 Nb. F 7 или H 2 Nb. OF 5. Водородом восстанавливается до низших оксидов, с NH 3 при 530 -830 °С образует Nb. N, с Сl 2 при 1000 -1060 °С и с ССl 4 при 230 °С - оксихлориды и пентахлорид Nb. При нагревании Nb 2 O 5 с другими оксидами получают многочисленные ниобаты, а также двойные оксиды со структурами, близкими к b-Nb 2 O 5, которые считались ранее твердыми растворами (Ti 2 Nb 10 O 29, Fe. Nb 49 O 124 и т. д. ). Получают Nb 2 O 5 прокаливанием гидроксида Nb(V) при 600 -1000 °С, гидролизом Nb. Cl 5, сжиганием Nb или его карбида в кислороде. Nb 2 О 5 промежуточные продукт при получении Nb, его сплавов, Nb. C, ниобатов и др. соединение, компонент огнеупоров, керметов, керамики, стекол с высоким коэффициент преломления, не пропускающих ИК излучение.
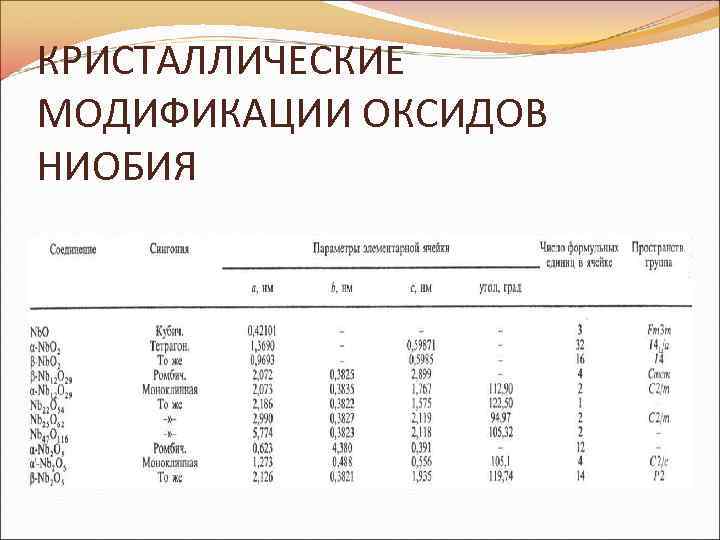 КРИСТАЛЛИЧЕСКИЕ МОДИФИКАЦИИ ОКСИДОВ НИОБИЯ
КРИСТАЛЛИЧЕСКИЕ МОДИФИКАЦИИ ОКСИДОВ НИОБИЯ
 М о н о о к с и д Nb. O Серые кристаллы со структурой типа Na. Cl с упорядоченным расположением вакансий ниобия и кислорода; т. пл. 1945°С; плотн. 7, 26 г/см 3; обладает металлич. проводимостью, интенсивно испаряется с диспропорционированием на Nb и О 2, что используется при рафинировании Nb методом электроннолучевой плавки; получают восстановлением Nb 2 O 5 водородом ок. 1030°С или спеканием смеси Nb 2 O 5 в вакууме при 1130 -1330 °С.
М о н о о к с и д Nb. O Серые кристаллы со структурой типа Na. Cl с упорядоченным расположением вакансий ниобия и кислорода; т. пл. 1945°С; плотн. 7, 26 г/см 3; обладает металлич. проводимостью, интенсивно испаряется с диспропорционированием на Nb и О 2, что используется при рафинировании Nb методом электроннолучевой плавки; получают восстановлением Nb 2 O 5 водородом ок. 1030°С или спеканием смеси Nb 2 O 5 в вакууме при 1130 -1330 °С.
 Д и о к с и д Nb. O 2 Черные кристаллы. Низкотемпературная a-форма имеет искаженную структуру рутила (из-за образования связей Nb—Nb); т. пл. 1917 °С; плотн. 5, 98 г/см 3; давление пара 1, 49 Па. Полупроводник. При 797 °С a-форма переходит в модификацию с неискаженной структурой рутила и металлич. Проводимостью. В системе Nb-O с областью гомогенности Nb. O 2, 42 -2, 50 обнаружено неск. оксидов сложного состава, разлагающихся по перитектич. реакциям. Они имеют структуру, родственную b-Nb 2 O 5, и ранее принимались за одну фазу переменного состава Nb 2 O 5 -х. В системе Nb-O найдены три эвтектики: раствор О 2 в Nb-Nb. O, температура 1915 °С; Nb. O-Nb. O 2, температура 1810 °С; Nb. O 2 -Nb 2 O 5, температура 1510 °С.
Д и о к с и д Nb. O 2 Черные кристаллы. Низкотемпературная a-форма имеет искаженную структуру рутила (из-за образования связей Nb—Nb); т. пл. 1917 °С; плотн. 5, 98 г/см 3; давление пара 1, 49 Па. Полупроводник. При 797 °С a-форма переходит в модификацию с неискаженной структурой рутила и металлич. Проводимостью. В системе Nb-O с областью гомогенности Nb. O 2, 42 -2, 50 обнаружено неск. оксидов сложного состава, разлагающихся по перитектич. реакциям. Они имеют структуру, родственную b-Nb 2 O 5, и ранее принимались за одну фазу переменного состава Nb 2 O 5 -х. В системе Nb-O найдены три эвтектики: раствор О 2 в Nb-Nb. O, температура 1915 °С; Nb. O-Nb. O 2, температура 1810 °С; Nb. O 2 -Nb 2 O 5, температура 1510 °С.
 Тантал Плотность: 16, 6 г/см 3 Температура плавления: 3014°С В свободном состоянии тантал — это тугоплавкий металл, твeрдый, но не хрупкий, хорошо поддаeтся механической обработке. Тантал является химическим элементом V гр. периодической системы Менделеева. Назван по имени героя греч. мифологии Тантала. Светло-серый с синеватым отливом металл, тяжелый и тугоплавкий. Химически стоек. В природе встречается совместно с ниобием. Используется в металлургии (компонент коррозионностойких, жаропрочных и твердых сплавов), в ядерной энергетике, медицине (наложение швов, скрепление костей и сосудов), ювелирном деле (вместо платины). Открыл А. Г. Экеберг в 1802 г. Содержание в земной коре 2, 5· 10 -4 % по массе.
Тантал Плотность: 16, 6 г/см 3 Температура плавления: 3014°С В свободном состоянии тантал — это тугоплавкий металл, твeрдый, но не хрупкий, хорошо поддаeтся механической обработке. Тантал является химическим элементом V гр. периодической системы Менделеева. Назван по имени героя греч. мифологии Тантала. Светло-серый с синеватым отливом металл, тяжелый и тугоплавкий. Химически стоек. В природе встречается совместно с ниобием. Используется в металлургии (компонент коррозионностойких, жаропрочных и твердых сплавов), в ядерной энергетике, медицине (наложение швов, скрепление костей и сосудов), ювелирном деле (вместо платины). Открыл А. Г. Экеберг в 1802 г. Содержание в земной коре 2, 5· 10 -4 % по массе.
 Физические свойства Тантал имеет кубическую объёмно-центрированную решётку (а = 3, 296 ); атомный радиус 1, 46 , ионные радиусы Та 2+ 0, 88 А, Та 5+0, 66 А; плотность 16, 6 г/см 3 при 20 °C; tпл 2996 °C; tкип 5300 °C; удельная теплоёмкость при 0 -100 °C 0, 142 кдж/(кг x К) [0, 034 кал/(г x °C)]; теплопроводность при 20 -100 °C 54, 47 вт/(м x К) [0, 13 кал/ (см x сек x °C)]. удельное электросопротивление при 0°C 13, 2 x 10 -8 ом x м, при 2000 °C 87 x 10 -8 ом x м. При 4, 38 К становится сверхпроводником. Тантал парамагнитен, удельная магнитная восприимчивость 0, 849 x 10 -6 (18 °C). Чистый тантал - пластичный металл, обрабатывается давлением на холоду без значительного наклёпа. Его можно деформировать со степенью обжатия 99% без промежуточного отжига. Переход тантала из пластичного в хрупкое состояние при охлаждении до -196 °C не обнаружен. Модуль упругости тантала 190 Гн/м 2 (190 x 102 кгс/мм 2) при 25 °C. Предел прочности при растяжении отожжённого тантала высокой чистоты 206 Мн/м 2(20, 6 кгс/мм 2) при 27 °C и 190 Мн/м 2(19 кгс/мм 2) при 490 °C; относительное удлинение 36% (27 °C) и 20% (490 °C). Твёрдость по Бринеллю чистого рекристаллизованного тантала 500 Мн/м 2 (50 кгс/мм 2). Свойства тантала в большой степени зависят от его чистоты; примеси водорода, азота, кислорода и углерода делают металл хрупким.
Физические свойства Тантал имеет кубическую объёмно-центрированную решётку (а = 3, 296 ); атомный радиус 1, 46 , ионные радиусы Та 2+ 0, 88 А, Та 5+0, 66 А; плотность 16, 6 г/см 3 при 20 °C; tпл 2996 °C; tкип 5300 °C; удельная теплоёмкость при 0 -100 °C 0, 142 кдж/(кг x К) [0, 034 кал/(г x °C)]; теплопроводность при 20 -100 °C 54, 47 вт/(м x К) [0, 13 кал/ (см x сек x °C)]. удельное электросопротивление при 0°C 13, 2 x 10 -8 ом x м, при 2000 °C 87 x 10 -8 ом x м. При 4, 38 К становится сверхпроводником. Тантал парамагнитен, удельная магнитная восприимчивость 0, 849 x 10 -6 (18 °C). Чистый тантал - пластичный металл, обрабатывается давлением на холоду без значительного наклёпа. Его можно деформировать со степенью обжатия 99% без промежуточного отжига. Переход тантала из пластичного в хрупкое состояние при охлаждении до -196 °C не обнаружен. Модуль упругости тантала 190 Гн/м 2 (190 x 102 кгс/мм 2) при 25 °C. Предел прочности при растяжении отожжённого тантала высокой чистоты 206 Мн/м 2(20, 6 кгс/мм 2) при 27 °C и 190 Мн/м 2(19 кгс/мм 2) при 490 °C; относительное удлинение 36% (27 °C) и 20% (490 °C). Твёрдость по Бринеллю чистого рекристаллизованного тантала 500 Мн/м 2 (50 кгс/мм 2). Свойства тантала в большой степени зависят от его чистоты; примеси водорода, азота, кислорода и углерода делают металл хрупким.
 Химические свойства Конфигурация внешних электронов атома Та 5 d 36 s 2. Наиболее характерная степень окисления тантала + 5; известны соединения с низшей степенью окисления (например, Ta. Cl 4, Тa. Clз, Ta. Cl 2), однако их образование для тантала менее характерно, чем для ниобия. В химическом отношении тантал при обычных условиях малоактивен (сходен с ниобием). На воздухе чистый компактный тантал устойчив; окисляться начинает при 280 °C. Имеет лишь один стабильный окисел - пятиокись Ta 2 O 5, которая существует в двух модификациях: aформе белого цвета ниже 1320 °C и b-форме серого цвета выше 1320 °C; имеет кислотный характер. С водородом при температуре около 250 °C тантал образует твёрдый раствор, содержащий до 20 атомных % водорода при 20 °C; при этом тантал становится хрупким; при 800 -1200 °C в высоком вакууме водород выделяется из металла и его пластичность восстанавливается. С азотом при температуре около 300 °C образует твёрдый раствор и нитриды Ta 2 N и Ta. N; в глубоком вакууме выше 2200 °C поглощённый азот вновь выделяется из металла. В системе Та - С при температуре до 2800 °C установлено существование трёх фаз: твёрдого раствора углерода в тантале, низшего карбида Т 2 С и высшего карбида Ta. C. тантал реагирует с галогенами при температуре выше 250 °C (с фтором при комнатной температуре), образуя галогениды преимущественно типа Ta. X 5 (где Х = F, Cl, Вг, I), При нагревании Та взаимодействует с С, В, Si, Р, Se, Те, водой, CO 2, NO, HCI, H 2 S. Чистый тантал исключительно устойчив к действию многих жидких металлов: Na, К и их сплавов, Li, Pb и др. , а также сплавов U - Mg и Pu - Mg. тантал характеризуется чрезвычайно высокой коррозионной устойчивостью к действию большинства неорганических и органических кислот: азотной, соляной, серной, хлорной и др. , царской водки, а также многих др. агрессивных сред. Действуют на тантал фтор, фтористый водород, плавиковая кислота и её смесь с азотной кислотой, растворы и расплавы щелочей. Известны соли танталовых кислот - танталаты общей формулы x. Me 2 O x у. Та 2 О 5 x Н 2 О: метатанталаты Me. Ta. O 3, ортотанталаты Me 3 Ta. O 4, соли типа Me 5 Ta. O 5, где Me - щелочной металл; в присутствии перекиси водорода образуются также пертанталаты. Наиболее важны танталаты щелочных металлов - KTa. O 3 и Na. Ta. O 3; эти соли - сегнетоэлектрики.
Химические свойства Конфигурация внешних электронов атома Та 5 d 36 s 2. Наиболее характерная степень окисления тантала + 5; известны соединения с низшей степенью окисления (например, Ta. Cl 4, Тa. Clз, Ta. Cl 2), однако их образование для тантала менее характерно, чем для ниобия. В химическом отношении тантал при обычных условиях малоактивен (сходен с ниобием). На воздухе чистый компактный тантал устойчив; окисляться начинает при 280 °C. Имеет лишь один стабильный окисел - пятиокись Ta 2 O 5, которая существует в двух модификациях: aформе белого цвета ниже 1320 °C и b-форме серого цвета выше 1320 °C; имеет кислотный характер. С водородом при температуре около 250 °C тантал образует твёрдый раствор, содержащий до 20 атомных % водорода при 20 °C; при этом тантал становится хрупким; при 800 -1200 °C в высоком вакууме водород выделяется из металла и его пластичность восстанавливается. С азотом при температуре около 300 °C образует твёрдый раствор и нитриды Ta 2 N и Ta. N; в глубоком вакууме выше 2200 °C поглощённый азот вновь выделяется из металла. В системе Та - С при температуре до 2800 °C установлено существование трёх фаз: твёрдого раствора углерода в тантале, низшего карбида Т 2 С и высшего карбида Ta. C. тантал реагирует с галогенами при температуре выше 250 °C (с фтором при комнатной температуре), образуя галогениды преимущественно типа Ta. X 5 (где Х = F, Cl, Вг, I), При нагревании Та взаимодействует с С, В, Si, Р, Se, Те, водой, CO 2, NO, HCI, H 2 S. Чистый тантал исключительно устойчив к действию многих жидких металлов: Na, К и их сплавов, Li, Pb и др. , а также сплавов U - Mg и Pu - Mg. тантал характеризуется чрезвычайно высокой коррозионной устойчивостью к действию большинства неорганических и органических кислот: азотной, соляной, серной, хлорной и др. , царской водки, а также многих др. агрессивных сред. Действуют на тантал фтор, фтористый водород, плавиковая кислота и её смесь с азотной кислотой, растворы и расплавы щелочей. Известны соли танталовых кислот - танталаты общей формулы x. Me 2 O x у. Та 2 О 5 x Н 2 О: метатанталаты Me. Ta. O 3, ортотанталаты Me 3 Ta. O 4, соли типа Me 5 Ta. O 5, где Me - щелочной металл; в присутствии перекиси водорода образуются также пертанталаты. Наиболее важны танталаты щелочных металлов - KTa. O 3 и Na. Ta. O 3; эти соли - сегнетоэлектрики.
 Получение Земная кора содержит всего лишь 0, 0002% тантала , но минералов его известно много – свыше 130. Тантал в этих минералах, как правило, неразлучен с ниобием, что объясняется чрезвычайным химическим сходством элементов и почти одинаковыми размерами их ионов. Трудность разделения этих металлов долгое время тормозила развитие промышленности тантала и ниобия. До недавних пор их выделяли лишь способом, предложенным еще в 1866 г. швейцарским химиком Мариньяком, который воспользовался различной растворимостью фтортанталата и фторниобата калия в разбавленной плавиковой кислоте. В последние годы важное значение приобрели также экстракционные методы выделения тантала, основанные на различной растворимости солей тантала и ниобия в некоторых органических растворителях. Опыт показал, что наилучшими экстракционными свойствами обладают метилизобутилкетон и циклогексанон. В наши дни основной способ производства металлического тантала – электролиз расплавленного фтортанталата калия в графитовых, чугунных или никелевых тиглях, служащих по совместительству катодами. Танталовый порошок осаждается на стенках тигля. Извлеченный из тигля, этот порошок подвергают сначала прессованию в пластины прямоугольного сечения (если заготовка предназначена для прокатки в листы) либо в штабики квадратного сечения (для волочения проволоки), а затем – спеканию. Некоторое применение находит также натриетермический способ получения тантала. В этом процессе взаимодействуют фтортанталат калия и металлический натрий: K 2 Ta. F 7 + 5 Na > Ta + 2 KF + 5 Na. F. Конечный продукт реакции – порошкообразный тантал, который затем спекают. В последние два десятилетия стали применять и другие методы обработки порошка – дуговую или индукционную плавку в вакууме и электронно-лучевую плавку.
Получение Земная кора содержит всего лишь 0, 0002% тантала , но минералов его известно много – свыше 130. Тантал в этих минералах, как правило, неразлучен с ниобием, что объясняется чрезвычайным химическим сходством элементов и почти одинаковыми размерами их ионов. Трудность разделения этих металлов долгое время тормозила развитие промышленности тантала и ниобия. До недавних пор их выделяли лишь способом, предложенным еще в 1866 г. швейцарским химиком Мариньяком, который воспользовался различной растворимостью фтортанталата и фторниобата калия в разбавленной плавиковой кислоте. В последние годы важное значение приобрели также экстракционные методы выделения тантала, основанные на различной растворимости солей тантала и ниобия в некоторых органических растворителях. Опыт показал, что наилучшими экстракционными свойствами обладают метилизобутилкетон и циклогексанон. В наши дни основной способ производства металлического тантала – электролиз расплавленного фтортанталата калия в графитовых, чугунных или никелевых тиглях, служащих по совместительству катодами. Танталовый порошок осаждается на стенках тигля. Извлеченный из тигля, этот порошок подвергают сначала прессованию в пластины прямоугольного сечения (если заготовка предназначена для прокатки в листы) либо в штабики квадратного сечения (для волочения проволоки), а затем – спеканию. Некоторое применение находит также натриетермический способ получения тантала. В этом процессе взаимодействуют фтортанталат калия и металлический натрий: K 2 Ta. F 7 + 5 Na > Ta + 2 KF + 5 Na. F. Конечный продукт реакции – порошкообразный тантал, который затем спекают. В последние два десятилетия стали применять и другие методы обработки порошка – дуговую или индукционную плавку в вакууме и электронно-лучевую плавку.
 Нахождение в природе Тантал почти всегда сопутствует ниобию в танталитах и ниобитах. Земная кора содержит лишь 0, 0002% тантала, однако природа сравнительно богата его минералами - их насчитывается более 130 (как правило, тантал в этих минералах неразлучен с ниобием). Наиболее важное сырье для получения тантала - танталит и колумбит. Основные месторождения танталита находятся в Финляндии, Скандинавии и в Северной Америке. Большие месторождения танталита и колумбита имеются в Африке и Южной Америке. Характерный элемент гранитной и осадочной оболочек (среднее содержание достигает 3, 5· 10 -4%); в глубинных частях земной коры и особенно в верх, мантии тантал мало (в ультраосновных породах 1, 8· 10 -6%). В большинстве магматических пород и биосфере тантал рассеян; его содержание в гидросфере и организмах не установлено. Известно 17 собственных минералов тантал и более 60 танталсодержащих минералов; все они образовались в связи с магматической деятельностью (танталит, колумбит, лопарит, пирохлор и другие). В минералах тантал находится совместно с ниобием вследствие сходства их физических и химических свойств. Руды тантала известны в пегматитах гранитных и щелочных пород, карбонатитах, в гидротермальных жилах, а также в россыпях, которые имеют наибольшее практическое значение. Как примесь содержится в касситерите.
Нахождение в природе Тантал почти всегда сопутствует ниобию в танталитах и ниобитах. Земная кора содержит лишь 0, 0002% тантала, однако природа сравнительно богата его минералами - их насчитывается более 130 (как правило, тантал в этих минералах неразлучен с ниобием). Наиболее важное сырье для получения тантала - танталит и колумбит. Основные месторождения танталита находятся в Финляндии, Скандинавии и в Северной Америке. Большие месторождения танталита и колумбита имеются в Африке и Южной Америке. Характерный элемент гранитной и осадочной оболочек (среднее содержание достигает 3, 5· 10 -4%); в глубинных частях земной коры и особенно в верх, мантии тантал мало (в ультраосновных породах 1, 8· 10 -6%). В большинстве магматических пород и биосфере тантал рассеян; его содержание в гидросфере и организмах не установлено. Известно 17 собственных минералов тантал и более 60 танталсодержащих минералов; все они образовались в связи с магматической деятельностью (танталит, колумбит, лопарит, пирохлор и другие). В минералах тантал находится совместно с ниобием вследствие сходства их физических и химических свойств. Руды тантала известны в пегматитах гранитных и щелочных пород, карбонатитах, в гидротермальных жилах, а также в россыпях, которые имеют наибольшее практическое значение. Как примесь содержится в касситерите.
 Интересные факты В литературе описан случай, когда из танталовой пластинки было сделано искусственное ухо, причем пересаженная с бедра кожа при этом настолько хорошо прижилась, что вскоре танталовое ухо трудно было отличить от настоящего. Замена платины танталом, как правило, весьма выгодна – он дешевле ее в несколько раз. Поиски танталового сырья продолжаются и в наши дни. Ценные элементы, в том числе тантал, есть в обычных гранитах. В Бразилии уже пробовали добывать тантал из гранитов. Правда, промышленного значения этот процесс получения тантала и других элементов пока не имеет – он весьма сложен и дорог, но получить тантал из такого необычного сырья сумели. В последнее время тантал начали использовать и в ювелирном деле: во многих случаях ему удается успешно заменять платину. Ювелирной деятельности этого металла способствует его свойство покрываться тончайшей пленкой окиси красивых радужных цветов. Тантал используют для изготовления часов, браслетов, различных украшений.
Интересные факты В литературе описан случай, когда из танталовой пластинки было сделано искусственное ухо, причем пересаженная с бедра кожа при этом настолько хорошо прижилась, что вскоре танталовое ухо трудно было отличить от настоящего. Замена платины танталом, как правило, весьма выгодна – он дешевле ее в несколько раз. Поиски танталового сырья продолжаются и в наши дни. Ценные элементы, в том числе тантал, есть в обычных гранитах. В Бразилии уже пробовали добывать тантал из гранитов. Правда, промышленного значения этот процесс получения тантала и других элементов пока не имеет – он весьма сложен и дорог, но получить тантал из такого необычного сырья сумели. В последнее время тантал начали использовать и в ювелирном деле: во многих случаях ему удается успешно заменять платину. Ювелирной деятельности этого металла способствует его свойство покрываться тончайшей пленкой окиси красивых радужных цветов. Тантал используют для изготовления часов, браслетов, различных украшений.


