подгруппа галия.ppt
- Количество слайдов: 13
 ПОДГРУППА ГАЛЛИЯ На свойствах галлия и его аналогов сказывается d-сжатие. От А 1 к Ga атомный радиус уменьшается, а энергия ионизации возрастает. На свойствах таллия сказывается и f-сжатие. От In к Т 1 размер атома и иона увеличивается незначительно, а энергия ионизации несколько увеличивается. Остальные свойства изменяются аналогично другим подгруппам р - элементов. Для галлия наиболее характерна с. о. +3, для Т 1 +1 (эффект инертной 6 s 2 электронной пары). Малораспространенные элементы, содержание в земной коре: галлий (4· 10 -4%) – индий (2· 10 -6%) – таллий (8· 10 -7%) уменьшается. Галлий сопутствует алюминию. Валентность галлия и индия равна 3. Известны малоустойчивые производные одно- и двухвалентных элементов. Таллий трех- и одновалентен. Соединения всех трех элементов очень ядовиты.
ПОДГРУППА ГАЛЛИЯ На свойствах галлия и его аналогов сказывается d-сжатие. От А 1 к Ga атомный радиус уменьшается, а энергия ионизации возрастает. На свойствах таллия сказывается и f-сжатие. От In к Т 1 размер атома и иона увеличивается незначительно, а энергия ионизации несколько увеличивается. Остальные свойства изменяются аналогично другим подгруппам р - элементов. Для галлия наиболее характерна с. о. +3, для Т 1 +1 (эффект инертной 6 s 2 электронной пары). Малораспространенные элементы, содержание в земной коре: галлий (4· 10 -4%) – индий (2· 10 -6%) – таллий (8· 10 -7%) уменьшается. Галлий сопутствует алюминию. Валентность галлия и индия равна 3. Известны малоустойчивые производные одно- и двухвалентных элементов. Таллий трех- и одновалентен. Соединения всех трех элементов очень ядовиты.
 Простые вещества: Легкоплавкие, серебристо-белые металлы.
Простые вещества: Легкоплавкие, серебристо-белые металлы.
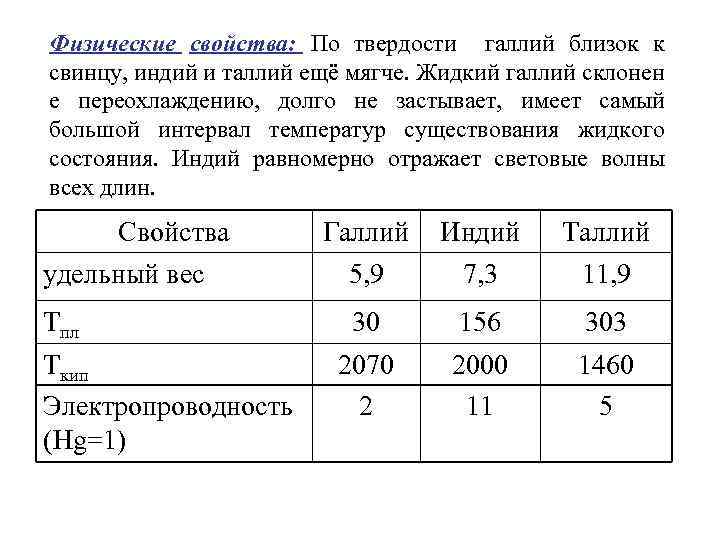 Физические свойства: По твердости галлий близок к свинцу, индий и таллий ещё мягче. Жидкий галлий склонен е переохлаждению, долго не застывает, имеет самый большой интервал температур существования жидкого состояния. Индий равномерно отражает световые волны всех длин. Свойства удельный вес Тпл Ткип Электропроводность (Нg=1) Галлий 5, 9 Индий 7, 3 Таллий 11, 9 30 156 303 2070 2 2000 11 1460 5
Физические свойства: По твердости галлий близок к свинцу, индий и таллий ещё мягче. Жидкий галлий склонен е переохлаждению, долго не застывает, имеет самый большой интервал температур существования жидкого состояния. Индий равномерно отражает световые волны всех длин. Свойства удельный вес Тпл Ткип Электропроводность (Нg=1) Галлий 5, 9 Индий 7, 3 Таллий 11, 9 30 156 303 2070 2 2000 11 1460 5
 Получение: 1) Химическая переработка полиметаллических руд: – выделяют их оксиды или хлориды, - химическим или электрохимическим способом восстанавливают до металлов. Применение: 1) Галлий - жидкость в термометрах для измерения высоких температур. 2) Индий - для изготовления зеркал.
Получение: 1) Химическая переработка полиметаллических руд: – выделяют их оксиды или хлориды, - химическим или электрохимическим способом восстанавливают до металлов. Применение: 1) Галлий - жидкость в термометрах для измерения высоких температур. 2) Индий - для изготовления зеркал.
 Химические свойства: 1) Галлий и индий на воздухе покрываются оксидной пленкой и далее не окисляются. Таллий медленно окисляется. 2) При прокаливании все элементы соединяются с кислородом и серой. 3) С хлором и бромом взаимодействие происходит при обычной температуре, с йодом – при нагревании. 4) В ряду напряжений галлий, индий, таллий стоят около железа. Растворяются в кислотах не окислителях. Таллий образует соединения со с. о. +1. Таллий в НС 1 пассивируется за счет образования нерастворимого в воде Т 1 С 1.
Химические свойства: 1) Галлий и индий на воздухе покрываются оксидной пленкой и далее не окисляются. Таллий медленно окисляется. 2) При прокаливании все элементы соединяются с кислородом и серой. 3) С хлором и бромом взаимодействие происходит при обычной температуре, с йодом – при нагревании. 4) В ряду напряжений галлий, индий, таллий стоят около железа. Растворяются в кислотах не окислителях. Таллий образует соединения со с. о. +1. Таллий в НС 1 пассивируется за счет образования нерастворимого в воде Т 1 С 1.
 5) Галлий растворяется в щелочах: 2 Gа + 6 Н 2 О + 6 КОН = 3 Н 2 + 2 К 3[Gа(ОН)6] 6) Индий и таллий в отсутствии сильных окислителей к щелочам устойчивы. 7) С водородом не взаимодействуют. Гидриды получают косвенно. In. Н 3 - полимер, Gа. Н 3 и неустойчивый Т 1 Н 3 – димеры. Они кислотные соединения. 4 Li. Н + Gа. С 13 = Li[Gа. Н 4] + 3 Li. С 13 В ряду ВН 4 - - А 1 Н 4 - - Gа. Н 4 - устойчивость падает. Ион ВН 4 - устойчив в водном растворе, а соли А 1 Н 4 и Gа. Н 4 - гидролизуются (иногда со взрывом): ЭН 4 - + 4 Н 2 О = 4 Н 2 + Э(ОН)3 + ОН-
5) Галлий растворяется в щелочах: 2 Gа + 6 Н 2 О + 6 КОН = 3 Н 2 + 2 К 3[Gа(ОН)6] 6) Индий и таллий в отсутствии сильных окислителей к щелочам устойчивы. 7) С водородом не взаимодействуют. Гидриды получают косвенно. In. Н 3 - полимер, Gа. Н 3 и неустойчивый Т 1 Н 3 – димеры. Они кислотные соединения. 4 Li. Н + Gа. С 13 = Li[Gа. Н 4] + 3 Li. С 13 В ряду ВН 4 - - А 1 Н 4 - - Gа. Н 4 - устойчивость падает. Ион ВН 4 - устойчив в водном растворе, а соли А 1 Н 4 и Gа. Н 4 - гидролизуются (иногда со взрывом): ЭН 4 - + 4 Н 2 О = 4 Н 2 + Э(ОН)3 + ОН-
 СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +3 Оксиды Gа 2 О 3 – белый, In 2 О 3 - желтый, Т 12 О 3 коричневый – в воде не растворимы. Это студенистые осадки, легко растворяются в кислотах. В ряду Gа 2 О 3 – In 2 О 3 – Т 12 О 3 возрастает растворимость в кислотах. Например, для реакции : Э 2 О 3 (т) + 6 НС 1(р) = ЭС 13(р) + 3 Н 2 О(ж) ΔG Gа 2 О 3 = +71 к. Дж/моль, In 2 О 3 = -25 к. Дж/моль, Т 12 О 3 = - 199 к. Дж/моль. Gа 2 О 3 - амфотерный оксид, In 2 О 3 – основной оксид с признаком амфотерности, Т 12 О 3 – щелочной характер.
СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +3 Оксиды Gа 2 О 3 – белый, In 2 О 3 - желтый, Т 12 О 3 коричневый – в воде не растворимы. Это студенистые осадки, легко растворяются в кислотах. В ряду Gа 2 О 3 – In 2 О 3 – Т 12 О 3 возрастает растворимость в кислотах. Например, для реакции : Э 2 О 3 (т) + 6 НС 1(р) = ЭС 13(р) + 3 Н 2 О(ж) ΔG Gа 2 О 3 = +71 к. Дж/моль, In 2 О 3 = -25 к. Дж/моль, Т 12 О 3 = - 199 к. Дж/моль. Gа 2 О 3 - амфотерный оксид, In 2 О 3 – основной оксид с признаком амфотерности, Т 12 О 3 – щелочной характер.
 Gа 2 О 3 плавится без разложения, In 2 О 3 при 8500 С начинается переходить в In. O·In 2 O 3, а Т 12 О 3 отщепляется кислород и превращается в Т 12 О при 900 С. Кристаллическая модификация Gа 2 О 3 нерастворима и в кислотах, а в щелочах она растворяется с трудом при длительном нагревании. Получение: 1) Прямой синтез: 4 Ga+3 O 2= 2 Gа 2 О 3 4 In+3 O 2=2 In 2 О 3 2) Т 12 О 3 окислением соединений Т 1+ озоном: 2 T 12 О + 2 O 3=2 Ti 2 O 3 +О 2 Применение: Gа 2 О 3 1) изолятор в радиолампах; 2) производство оптических стекол.
Gа 2 О 3 плавится без разложения, In 2 О 3 при 8500 С начинается переходить в In. O·In 2 O 3, а Т 12 О 3 отщепляется кислород и превращается в Т 12 О при 900 С. Кристаллическая модификация Gа 2 О 3 нерастворима и в кислотах, а в щелочах она растворяется с трудом при длительном нагревании. Получение: 1) Прямой синтез: 4 Ga+3 O 2= 2 Gа 2 О 3 4 In+3 O 2=2 In 2 О 3 2) Т 12 О 3 окислением соединений Т 1+ озоном: 2 T 12 О + 2 O 3=2 Ti 2 O 3 +О 2 Применение: Gа 2 О 3 1) изолятор в радиолампах; 2) производство оптических стекол.
 Гидроксиды - студенистые осадки, нерастворимые в воде. В ряду Gа(ОН)3 – In(ОН)3 – Т 1(ОН)3 усиливаются основные свойства. В кислотах Э(ОН)3 и Э 2 О 3 образуются аквакомплексы: Gа(ОН)3 + 3 ОН 3+ = [Gа(Н 2 О)6]3+ Соединения Gа(III) In(III) Т 1(III) из водных растворов всегда выделяются в виде кристаллогидратов, например ЭНа 13 · 6 Н 2 О Гидроксиды галлия и теллура растворяются в щелочах: Gа(ОН)3 + 3 ОН- = [Gа(ОН)6]3 Образуются галлаты и индаты. Т 1(ОН)3 в щелочах не растворяется. Gа(ОН)3 растворим в крепких растворах NН 4 ОН. Получение: реакциям обмена. Применение: Gа 2(SО 4)3 - изготовление люминесцентных материалов. Ga. As, In 2 S 3, In. S в полупроводниковой технике.
Гидроксиды - студенистые осадки, нерастворимые в воде. В ряду Gа(ОН)3 – In(ОН)3 – Т 1(ОН)3 усиливаются основные свойства. В кислотах Э(ОН)3 и Э 2 О 3 образуются аквакомплексы: Gа(ОН)3 + 3 ОН 3+ = [Gа(Н 2 О)6]3+ Соединения Gа(III) In(III) Т 1(III) из водных растворов всегда выделяются в виде кристаллогидратов, например ЭНа 13 · 6 Н 2 О Гидроксиды галлия и теллура растворяются в щелочах: Gа(ОН)3 + 3 ОН- = [Gа(ОН)6]3 Образуются галлаты и индаты. Т 1(ОН)3 в щелочах не растворяется. Gа(ОН)3 растворим в крепких растворах NН 4 ОН. Получение: реакциям обмена. Применение: Gа 2(SО 4)3 - изготовление люминесцентных материалов. Ga. As, In 2 S 3, In. S в полупроводниковой технике.
 Ионы Gа 3+, In 3+ - бесцветны, Т 13+ желтоватый. Производные этих ионов и сильных кислот хорошо растворимы в воде, но гидролизованы, имеют кислую среду. Растворимые соли слабых кислот подвергаются полному гидролизу. Галогениды Физические свойства: ЭF 3 - координационная решетка, ЭС 13 молекулярную, составленную из димерных молекул ЭНа 13.
Ионы Gа 3+, In 3+ - бесцветны, Т 13+ желтоватый. Производные этих ионов и сильных кислот хорошо растворимы в воде, но гидролизованы, имеют кислую среду. Растворимые соли слабых кислот подвергаются полному гидролизу. Галогениды Физические свойства: ЭF 3 - координационная решетка, ЭС 13 молекулярную, составленную из димерных молекул ЭНа 13.
 ЭF 3 - тугоплавок, Э 2 На 16 – легкоплавок. соединение tпл In. F 3 1170 In. C 13 586 In. Br 3 420 In. I 3 207 Химические свойства: ЭНа 13 – кислотные соединения. Образуют комплексные галогениды: 3 КНа 1 + ЭНа 13 = К 3[ЭНа 16] Для таллия устойчивы производные со с. о. +1. Соединения Т 1+3 - окислители: Т 1+3 + 2 е = Т 1+; Е 2980 = 1, 25 В С р-элементами V группы образуют соединения типа АIIIВV. Эти соединения изоэлектронны соответствующим простым веществам р-элементов IV группы.
ЭF 3 - тугоплавок, Э 2 На 16 – легкоплавок. соединение tпл In. F 3 1170 In. C 13 586 In. Br 3 420 In. I 3 207 Химические свойства: ЭНа 13 – кислотные соединения. Образуют комплексные галогениды: 3 КНа 1 + ЭНа 13 = К 3[ЭНа 16] Для таллия устойчивы производные со с. о. +1. Соединения Т 1+3 - окислители: Т 1+3 + 2 е = Т 1+; Е 2980 = 1, 25 В С р-элементами V группы образуют соединения типа АIIIВV. Эти соединения изоэлектронны соответствующим простым веществам р-элементов IV группы.
 В ряду соединений ВN – А 1 Р – Gа. Аs- In. Sb – Т 1 Вi прочность ковалентной связи уменьшается, а возможность её делокализации возрастает, падают температуры плавления и твердость, уменьшается ширина запрещенной зоны. Алмазоподобные соединения – полупроводники. Применение: 1) выпрямители переменного тока, фотоэлементы, усилители и т. д. Конкурируют с полупроводниками германия и кремния.
В ряду соединений ВN – А 1 Р – Gа. Аs- In. Sb – Т 1 Вi прочность ковалентной связи уменьшается, а возможность её делокализации возрастает, падают температуры плавления и твердость, уменьшается ширина запрещенной зоны. Алмазоподобные соединения – полупроводники. Применение: 1) выпрямители переменного тока, фотоэлементы, усилители и т. д. Конкурируют с полупроводниками германия и кремния.
 СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +1 Соединения галлия и индия неустойчивы и являются сильными восстановителями. Ион Т 1+ имеет радиус , близкий к радиусу ионов щелочных металлов. Его соединения ионные, растворяются в воде, кроме Т 1 С 1, Т 1 Вr, Т 1 I, Т 12 S. По химическим свойствам – основные, не гидролизуются или при гидролизе образуют щелочную среду. Получение: Т 12 О образуется прямым синтезом при нагревании. Физические свойства: Это черный гигроскопичный порошок. Химические свойства: С водой образует Т 1 ОН – желтого цвета: Т 12 О + Н 2 О = 2 Т 1 ОН – сильное основание, но в отличии от Nа. ОН и Rb. ОН отщепляет воду при нагревании до 1000 С: 2 Т 1 ОН(к) = Т 12 О + Н 2 О(г), G=5 к. Дж 2 Rb. ОН(к) = Rb 2 О + Н 2 О(г), G = 206 к. Дж Т 1 ОН растворим в воде. Соли бесцветны и кристаллизуются без воды. Сильные окислители (хлорная вода) окисляются Т 1+ до Т 13+. Т 1(I) комплексообразование не характерно; он переходит во внешнюю сферу: 3 Т 1 С 1 + Т 1 С 13 = Т 13[Т 1 С 16] осн. кисл Соединения Т 1+ обладают высокой светочуствительностью: при освещении они разлагаются. Соединения галлия, индия, таллия – ядовиты.
СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +1 Соединения галлия и индия неустойчивы и являются сильными восстановителями. Ион Т 1+ имеет радиус , близкий к радиусу ионов щелочных металлов. Его соединения ионные, растворяются в воде, кроме Т 1 С 1, Т 1 Вr, Т 1 I, Т 12 S. По химическим свойствам – основные, не гидролизуются или при гидролизе образуют щелочную среду. Получение: Т 12 О образуется прямым синтезом при нагревании. Физические свойства: Это черный гигроскопичный порошок. Химические свойства: С водой образует Т 1 ОН – желтого цвета: Т 12 О + Н 2 О = 2 Т 1 ОН – сильное основание, но в отличии от Nа. ОН и Rb. ОН отщепляет воду при нагревании до 1000 С: 2 Т 1 ОН(к) = Т 12 О + Н 2 О(г), G=5 к. Дж 2 Rb. ОН(к) = Rb 2 О + Н 2 О(г), G = 206 к. Дж Т 1 ОН растворим в воде. Соли бесцветны и кристаллизуются без воды. Сильные окислители (хлорная вода) окисляются Т 1+ до Т 13+. Т 1(I) комплексообразование не характерно; он переходит во внешнюю сферу: 3 Т 1 С 1 + Т 1 С 13 = Т 13[Т 1 С 16] осн. кисл Соединения Т 1+ обладают высокой светочуствительностью: при освещении они разлагаются. Соединения галлия, индия, таллия – ядовиты.


