2011_inorg_medbiol_11.ppt
- Количество слайдов: 31

Побочная подгруппа IV группы периодической системы 1

Содержание в земной коре и минералы • Ti – 9 место, Ti. O 2 (рутил), Fe. Ti. O 3 (ильменит), Ca. Ti. O 3 • Zr – 21 место, рассеян и редкий, Zr. O 2 (бадделеит), Zr. Si. O 4 (циркон) • Hf – 52 место, нет собственных минералов, 2% в минералах Zr Свойства Zr и Hf очень похожи. 2

Открытие элементов • Ti – 1789 г. , англ. Грегор, 1795 г. , нем. Клапрот. Титаны – в гр. Мифологии дети богини Земли Геи и бога неба Зевса • Zr – 1789 г. нем. Клапрот из полудрагоценного камня циркон, золотистый (персидский) • Нf – 1922 г. В Копенгагене Костерн и Хевеши, лат. «Hafnia» - название столицы Дании. 3

Простые вещества Тпл. , о. С Ti Zr Hf Ткип. , о. С D, г/см 3 1800 1857 2227 3330 4340 4620 4, 5 6, 5 13, 1 Получение сложное, проблема разделения Zr и Hf MO 2 + 2 Cl 2 = MCl 4 + 2 CO MCl 4 + 2 Mg = M + 2 Mg. Cl 2 (900 o. C, Ar) Сплавы, покрытия, конструкционные материалы 4

Свойства простых веществ Ti+ O 2 = Ti. O 2 (при Т > 550 o. C(порошок)) Ti + 2 Г = Ti. Г 4 (Г = F(150 o. C), Cl(300 o. C), Br(360 o. C), J(550 o. C)) 2 Ti + 6 HCl = 2 Ti. Cl 3 + 3 H 2 (при нагревании) Ti. Cl 3 + «H» = Ti. Cl 2 + HCl (Ti 2+ оч. неустойчив) Ti + 2 Na. OHконц. + H 2 O = Na 2 Ti. O 3 + 2 H 2 Ti + 4 HNO 3 конц. + (x-2)H 2 O = Ti. O 2. x. H 2 O↓( ) + 4 NO 2 -титановые кислоты, не растворимы в кислотах и щелочах 5

Свойства простых веществ (Zr и Hf) (комплексообразование) M + 6 HF = H 2[MF 6] + 3 H 2 M + 5 H 2 SO 4 конц. = H 2[M(SO 4)3] + 2 SO 2 + 4 H 2 O 3 M + 4 HNO 3 + 18 HCl = 3 H 2[MCl 6] + 4 NO + 8 H 2 O M + 4 CH 3 COOH + 6 F- = [MF 6]2 - + 4 CH 3 COO- + 2 H 2 6
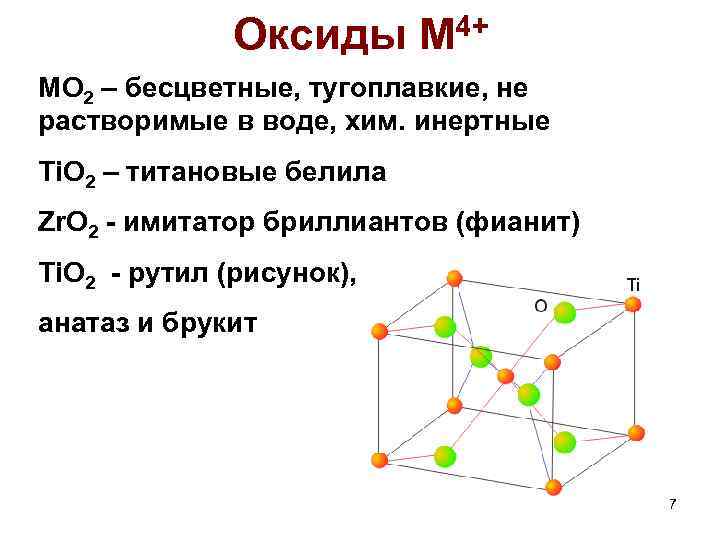
Оксиды М 4+ MO 2 – бесцветные, тугоплавкие, не растворимые в воде, хим. инертные Ti. O 2 – титановые белила Zr. O 2 - имитатор бриллиантов (фианит) Ti. O 2 - рутил (рисунок), анатаз и брукит 7

«Кислоты» и «соли» М 4+ Ca. O + Ti. O 2 = Ca. Ti. O 3 (перовскит, рисунок) Ti. O 2 + K 2 CO 3 = K 2 Ti. O 3 + CO 2 Титанаты, цирконаты, гафнаты: MI 2 ЭО 3, MI 4 ЭO 4 Титанаты полностью гидролизуются: K 2 Ti. O 3 + (n+1)H 2 O = Ti. O 2. n. H 2 O↓( ) + 2 KOH a --- (при стоянии, при Т) a -форма растворима в кислотах и в щелочах 8
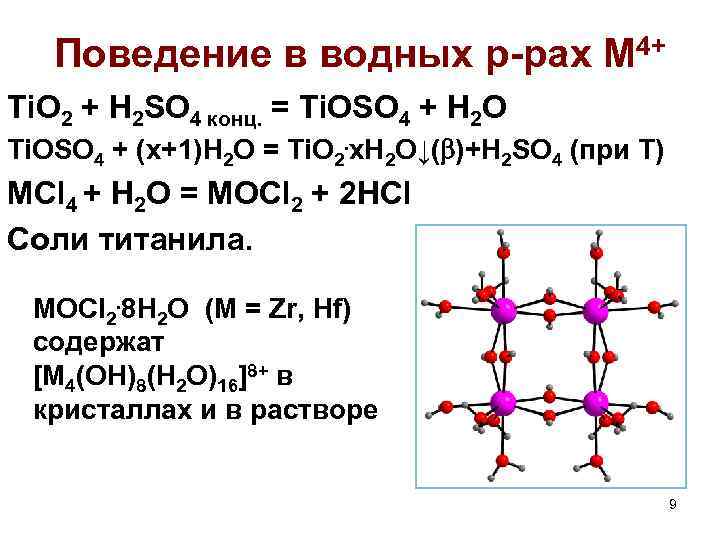
Поведение в водных р-рах M 4+ Ti. O 2 + H 2 SO 4 конц. = Ti. OSO 4 + H 2 O Ti. OSO 4 + (x+1)H 2 O = Ti. O 2. x. H 2 O↓( )+H 2 SO 4 (при Т) МCl 4 + H 2 O = MOCl 2 + 2 HCl Соли титанила. MOCl 2. 8 H 2 O (M = Zr, Hf) содержат [M 4(OH)8(H 2 O)16]8+ в кристаллах и в растворе 9

Пероксосоединения Получаются при действии H 2 O 2 Ti 4+: p. H<2 [Ti(O 2)(H 2 O)x]2+ (оранжевый) и [Ti(O 2)2(H 2 O)x] (б/цв) p. H>7: [Ti(O 2)4]4 - (красный) K 4[M(O 2)4] (M = Zr, Hf) - б/цв, сильные окислители 10
Галогениды M + 2 X 2 = MX 4 (M = Ti, Zr, Hf; X = F, Cl, Br, I) – молекулярные структуры (кроме фторидов), поэтому легко летучи Ti. Cl 4 образует устойчивые аэрозоли Ti. Cl 4 + 2 H 2 O = Ti. O 2 + 4 HCl Ti. Cl 4 + 2 HClконц. = H 2[Ti. Cl 6] 2 Ti. Cl 4 + H 2 = 2 Ti. Cl 3 + 2 HCl (при Т) 11
![Комплексы Фторидные комплексы: [MF 6]2[MF 7]3 -, [MF 8]4 - для Zr и Hf Комплексы Фторидные комплексы: [MF 6]2[MF 7]3 -, [MF 8]4 - для Zr и Hf](https://present5.com/presentation/181398164_157984010/image-12.jpg)
Комплексы Фторидные комплексы: [MF 6]2[MF 7]3 -, [MF 8]4 - для Zr и Hf [M(acac)4] – летучие соединения (MO CVD) [Hf(ox)4]4 - 12

Zn + Pb(OAc)2 = Pb + Zn(OAc)2 Pb 2+ + 2 I- = Pb. I 2↓ Pb. S + 4 H 2 O 2 = Pb. SO 4 + 4 H 2 O Ti. Cl 4 + 2 H 2 O 2 = Ti(O 2)Cl 2 + 2 HCl 2 Ti. Cl 4 + Zn = 2 Ti. Cl 3 + Zn. Cl 2 13

III группа периодической системы 14
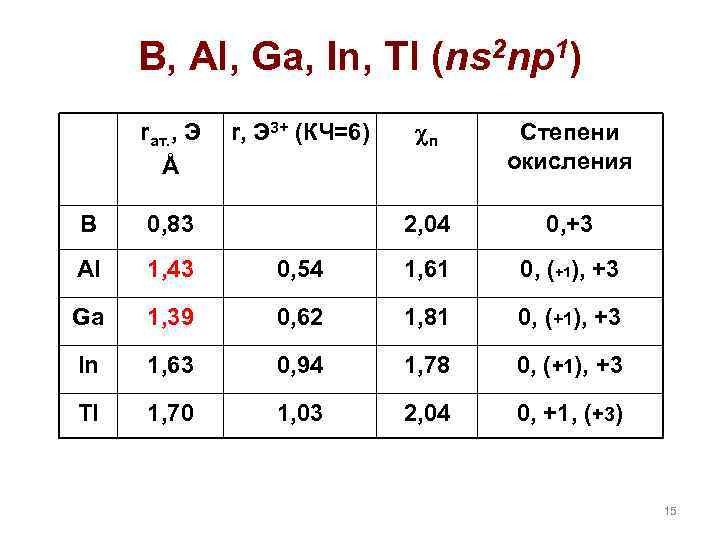
B, Al, Ga, In, Tl (ns 2 np 1) rат. , Э Å п Степени окисления 2, 04 r, Э 3+ (КЧ=6) 0, +3 B 0, 83 Al 1, 43 0, 54 1, 61 0, (+1), +3 Ga 1, 39 0, 62 1, 81 0, (+1), +3 In 1, 63 0, 94 1, 78 0, (+1), +3 Tl 1, 70 1, 03 2, 04 0, +1, (+3) 15

Распространенность в земной коре и минералы В – 28 место, 9· 10 -4 мас. % H 3 BO 3 (сассолит), Na 2 B 4 O 7. 10 H 2 O (бура), боросиликаты Al – 3 место, 8, 3 мас. % x. Al(OH)3. y. Al. O(OH) (бокситы) – основной источник Al, Al 2 O 3. 2 Si. O 2. 2 H 2 O (каолинит), Na 3 K[Al. Si. O 4] (алюмосиликаты) Na 3 Al. F 6 (криолит) 16

Распространенность в земной коре и минералы Ga – редкий и рассеянный, 4, 6· 10 -4 мас. %, примерно 60 -70 место, Cu. Ga. S 2 (галлит), сопутствует Al в бокситах In – редкий и рассеянный, 2· 10 -6 мас. %, примерно 70 -75 место, примесь к сульфидным рудам Tl – редкий и рассеянный, 8· 10 -7 мас. %, , примерно 75 -80 место, примесь к сульфидным рудам, сопутствует K в алюмосиликатах 17

Открытие элементов • B – 1808 г. , фр. Гей-Люссак и Тенар. B 2 O 3 + 6 K = 2 B + 3 K 2 O , от лат. Borax – бура. • Al – 1825 г. , дат. Эрстед, Al. Cl 3 + 3 K(Hg) = Al +3 KCl + Hg от лат. Alumen или Alumin - квасцы • Ga - предсказан Менделеевым в 1871 г. , открыт фр. Лекок де Буабодран в 1875 г. , в честь Франции, лат. Gallia. • In – 1863 г. , нем. Рейх и Рихтез, от синей краски индиго (две синие линии в спектре полимет. руд) • Tl – 1861 г. , анг. Крукс, от гр. «таллос» - молодая зеленая ветвь (зеленая линия в спектре отходов производства серной к-ты) 18

Бор Коричневый, полупроводник, анамально высокая Тпл. = 2075 о. С Получение: 2 H 3 BO 3 = B 2 O 3 + 3 H 2 O (при Т) Икосаэдр B 2 O 3 + 3 Mg = 3 Mg. O + 2 B далее обр. НСl → → B↓ + Mg. Cl 2 + H 2 O БОР ХИМИЧЕСКИ ИНЕРТЕН 19
![Бор [H+]: H 3 BO 3 + 3 H+ + 3 e = B Бор [H+]: H 3 BO 3 + 3 H+ + 3 e = B](https://present5.com/presentation/181398164_157984010/image-20.jpg)
Бор [H+]: H 3 BO 3 + 3 H+ + 3 e = B + 3 H 2 O E 0 = -0, 87 B [OH-]: [B(OH)4]- + 3 e = B + 4 OH- E 0 = -1, 79 B Кинетические затруднения, нет реакции с жидкой водой 2 B + 3 H 2 O = B 2 O 3 + 3 H 2 (800 o. C) 2 B + 3 X 2 = 2 BX 3 (X = F, Cl, Br, I) 4 B + 3 O 2 = 2 B 2 O 3 (горение) 2 B + N 2 = BN (1200 о. С) B + 3 HNO 3 (к. ) = H 3 BO 3 + 3 NO 2 (нагрев) 20
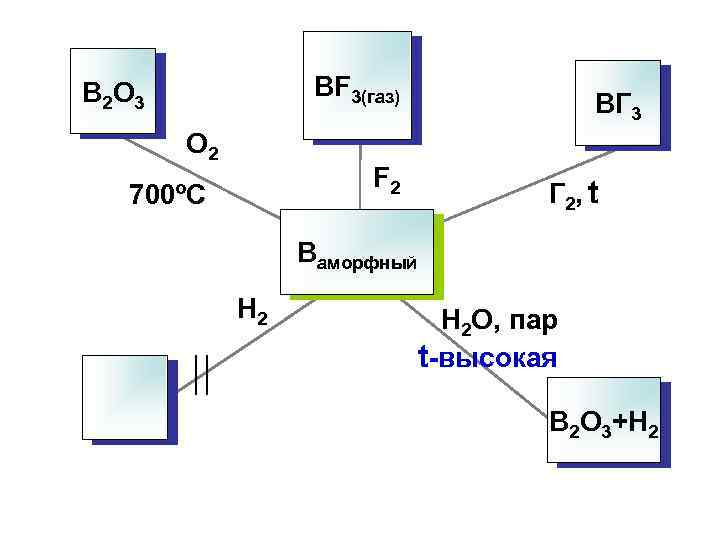
BF 3(газ) B 2 O 3 O 2 F 2 700ºC BГ 3 Г 2, t Bаморфный H 2 O, пар t-высокая B 2 O 3+H 2
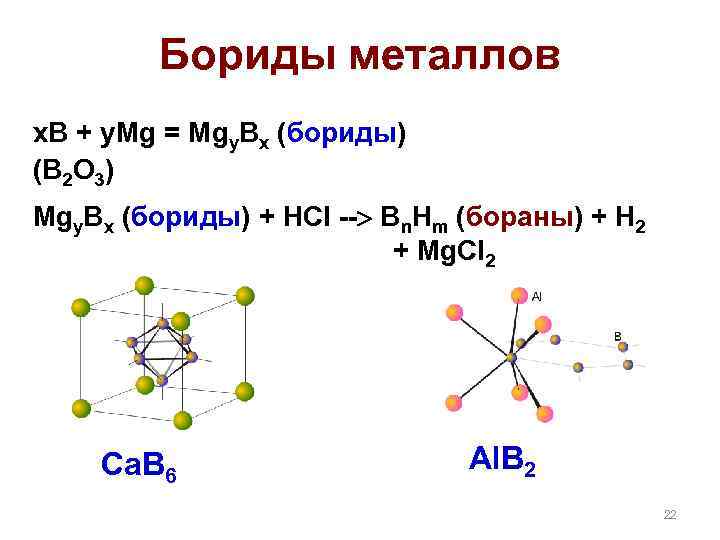
Бориды металлов x. B + y. Mg = Mgy. Bx (бориды) (B 2 O 3) Mgy. Bx (бориды) + НCl -- Bn. Hm (бораны) + H 2 + Mg. Cl 2 Ca. B 6 Al. B 2 22
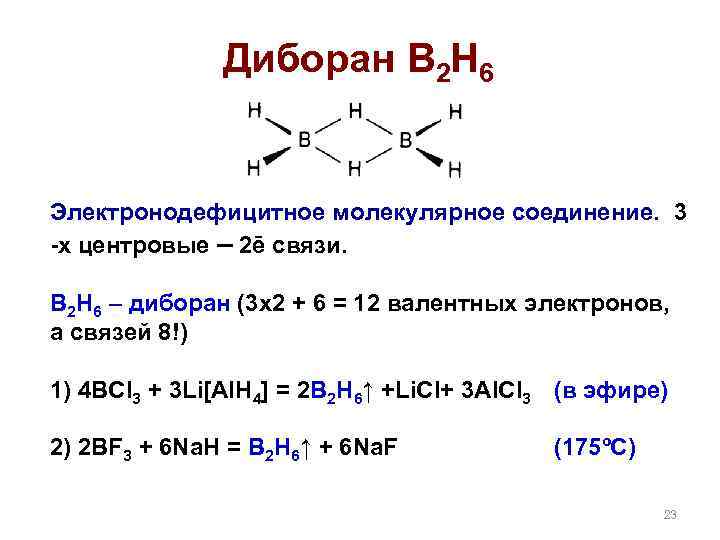
Диборан B 2 H 6 Электронодефицитное молекулярное соединение. 3 -х центровые – 2ē связи. B 2 H 6 – диборан (3 х2 + 6 = 12 валентных электронов, а связей 8!) 1) 4 BCl 3 + 3 Li[Al. H 4] = 2 B 2 H 6↑ +Li. Cl+ 3 Al. Cl 3 (в эфире) 2) 2 BF 3 + 6 Na. H = B 2 H 6↑ + 6 Na. F (175ºC) 23
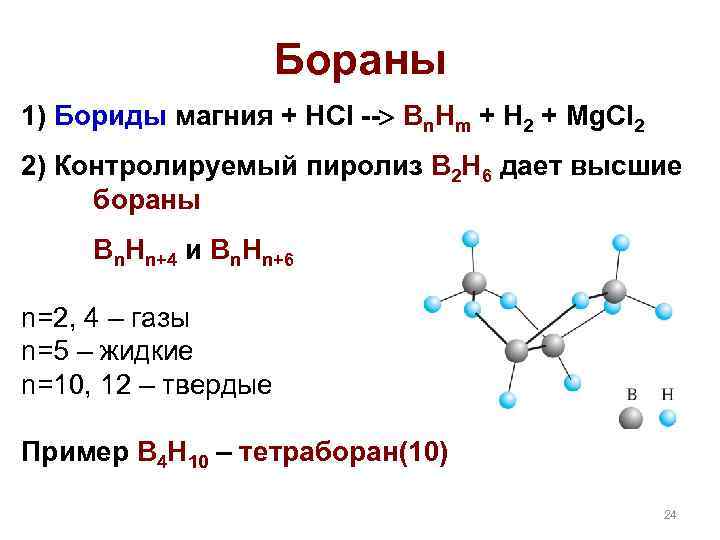
Бораны 1) Бориды магния + НCl -- Bn. Hm + H 2 + Mg. Cl 2 2) Контролируемый пиролиз B 2 H 6 дает высшие бораны Bn. Hn+4 и Bn. Hn+6 n=2, 4 – газы n=5 – жидкие n=10, 12 – твердые Пример B 4 H 10 – тетраборан(10) 24

Химические свойства диборана (похожи на свойства силана) 1) B 2 H 6 + 3 O 2 = B 2 O 3 + 3 H 2 O Δr. H = -2000 к. Дж/моль (ракетное топливо) 2) B 2 H 6 + 6 H 2 O = 2 H 3 BO 3 + 6 H 2 (полный гидролиз) 3) B 2 H 6 + 2 Na. H = 2 Na[BH 4] – борогидрид удобный восстановитель (не в воде) Na[BH 4] + 4 H 2 O = 4 H 2 + H 3 BO 3 + Na. OH 25

Галогениды бора BF 3 ( f. G 0 = -1112 к. Дж/моль), BCl 3 – газы, BBr 3 – жидкий, BJ 3 – твердый ( f. G 0 =+21 к. Дж/моль) Получение: 2 B + 3 X 2 = 2 BX 3 (X = F, Cl, Br) B 2 O 3 + 3 Ca. F 2 + 3 H 2 SO 4 = 2 BF 3↑+3 Ca. SO 4 +H 2 O 26
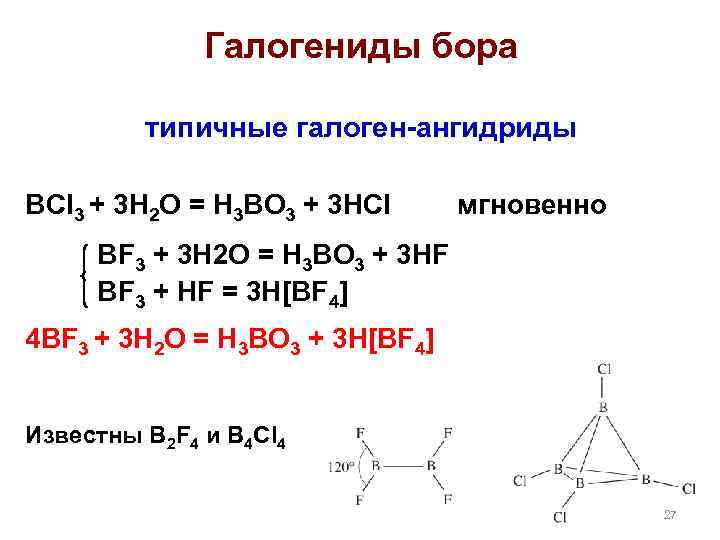
Галогениды бора типичные галоген-ангидриды BCl 3 + 3 H 2 O = H 3 BO 3 + 3 HCl мгновенно BF 3 + 3 H 2 O = H 3 BO 3 + 3 HF BF 3 + HF = 3 H[BF 4] 4 BF 3 + 3 H 2 O = H 3 BO 3 + 3 H[BF 4] Известны B 2 F 4 и B 4 Cl 4 27
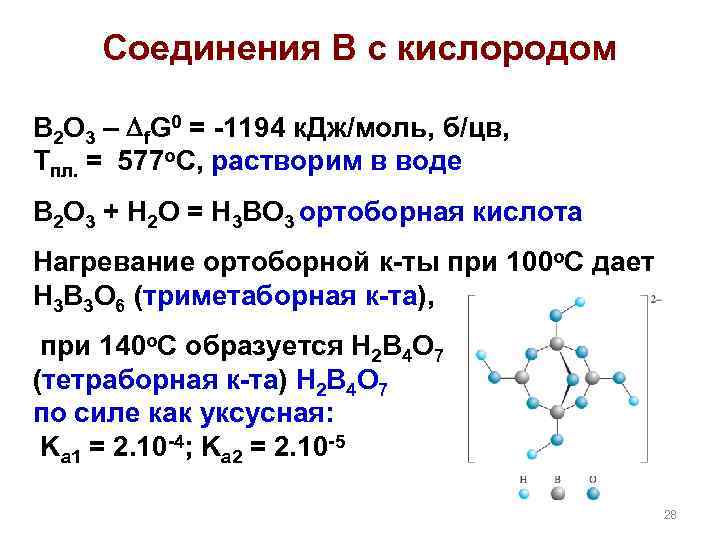
Соединения В с кислородом B 2 O 3 – f. G 0 = -1194 к. Дж/моль, б/цв, Тпл. = 577 о. С, растворим в воде B 2 O 3 + H 2 O = H 3 BO 3 ортоборная кислота Нагревание ортоборной к-ты при 100 o. C дает H 3 B 3 O 6 (триметаборная к-та), при 140 о. С образуется H 2 B 4 O 7 (тетраборная к-та) H 2 B 4 O 7 по силе как уксусная: Ka 1 = 2. 10 -4; Ka 2 = 2. 10 -5 28

Борная кислота - H 3 BO 3 ОДНООСНОВНАЯ И СЛАБАЯ, p. Ka = 9, 2 B(OH)3 + 2 H 2 O = H 3 O+ + [B(OH)4]- - солей с таким анионом нет, есть тетрабораты. 4 H 3 BO 3 + 2 Na. OH = Na 2 B 4 O 7 + 7 H 2 O Na 2 B 4 O 7 + H 2 SO 4(р-р) + 5 H 2 O = 4 H 3 BO 3 + Na 2 SO 4 OH 4 H 3 BO 3 + 2 OH- H+ B 4 O 72 - + 7 H 2 O 29
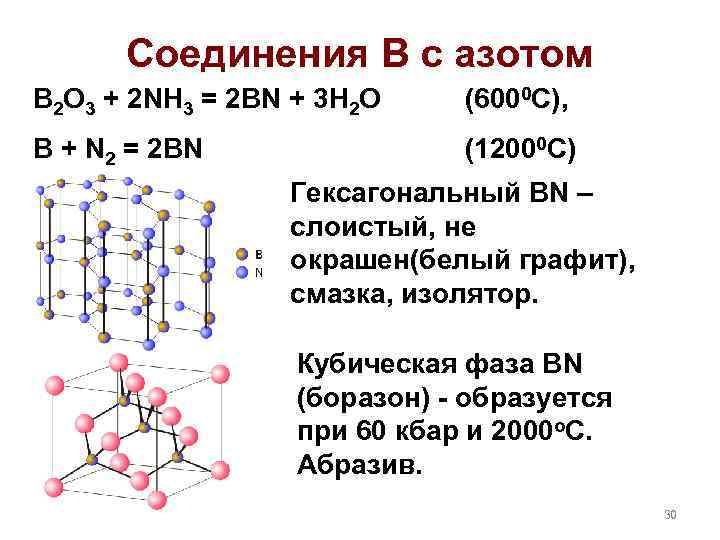
Соединения В с азотом B 2 O 3 + 2 NH 3 = 2 BN + 3 H 2 O (6000 C), B + N 2 = 2 BN (12000 C) Гексагональный BN – слоистый, не окрашен(белый графит), смазка, изолятор. Кубическая фаза BN (боразон) - образуется при 60 кбар и 2000 о. С. Абразив. 30
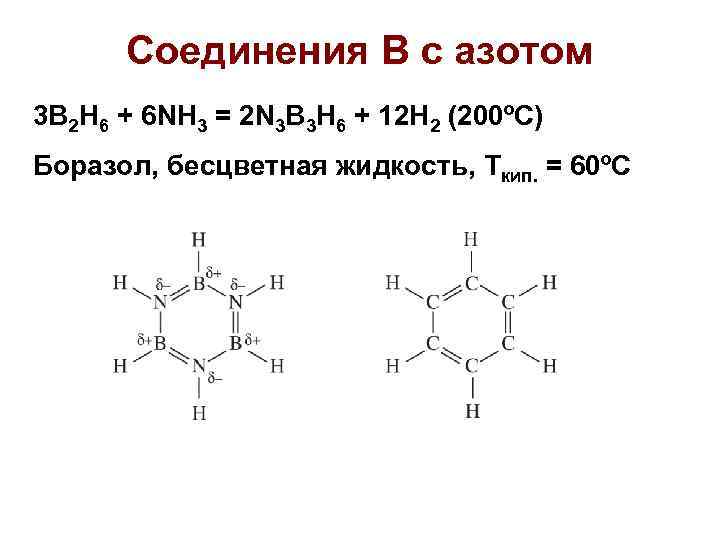
Соединения В с азотом 3 B 2 H 6 + 6 NH 3 = 2 N 3 B 3 H 6 + 12 H 2 (200ºС) Боразол, бесцветная жидкость, Ткип. = 60ºС
2011_inorg_medbiol_11.ppt