e9cc14c78d5ce00f977d7b5220952489.ppt
- Количество слайдов: 34

ПЛЕНАРНОЕ ЗАСЕДАНИЕ «БИОТЕХНОЛОГИИ БУДУЩЕГО ВО ФТИЗИАТРИИ» АЛЬТЕРНАТИВНЫЕ НАПРАВЛЕНИЯ ЛЕЧЕНИЯ ТУБЕРКУЛЁЗА: ПОИСК ВОЗМОЖНОСТЕЙ Г. С. БАЛАСАНЯНЦ
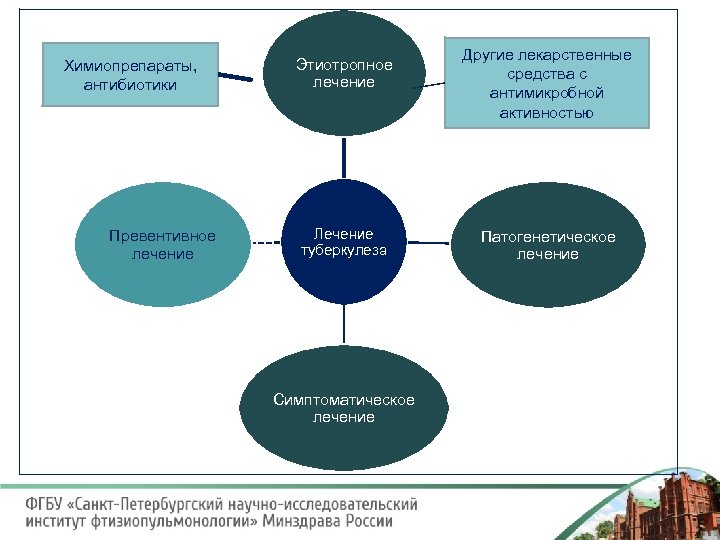
Химиопрепараты, антибиотики Превентивное лечение Этиотропное лечение Лечение туберкулеза Симптоматическое лечение Другие лекарственные средства с антимикробной активностью Патогенетическое лечение
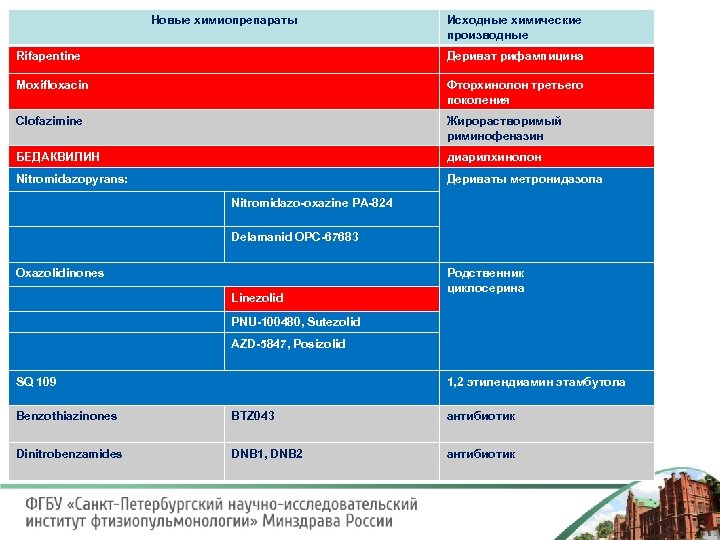
Новые химиопрепараты Исходные химические производные Rifapentine Дериват рифампицина Moxifloxacin Фторхинолон третьего поколения Clofazimine Жирорастворимый риминофеназин БЕДАКВИЛИН диарилхинолон Nitromidazopyrans: Дериваты метронидазола Nitromidazo-oxazine PA-824 Delamanid OPC-67683 Oxazolidinones Linezolid Родственник циклосерина PNU-100480, Sutezolid AZD-5847, Posizolid SQ 109 1, 2 этилендиамин этамбутола Benzothiazinones BTZ 043 антибиотик Dinitrobenzamides DNB 1, DNB 2 антибиотик

В последние годы все больше обращается внимание на поиск новых веществ с антимикробным потенциалом, лишенных недостатков традиционных антибиотиков. В этом плане сегодня высок интерес к использованию пробиотических бактерий, бактериофагов и бактериоцинов

q Пробиотики молочнокислые бактерии, бифидобактерии, дрожжи, кишечная палочка и стрептококки рассматриваются как реальные терапевтические средства, которые способные избирательно контролировать микроорганизмы, поступающие в наш организм. Наиболее известная антимикробная активность пробиотиков реализуется за счет секреции ряда антибактериальных веществ неспецифического действия, таких как короткоцепочечные жирные кислоты и перекись водорода v Бактериофаги, в отличие от пробиотиков, являются в высшей степени специфичными и могут быть активными даже против единичного штамма бактерий. Поэтому, специально подобранные бактериофаги предлагались как средство против определенных групп бактерий, обитающих на слизистых поверхностях организма. К недостаткам метода фаготерапии относят: сложность подбора и размножения бактериофагов, высокая изменчивость бактерий, что приводит к относительно быстрой потере специфичности фагов, наличие реакции иммунной системы на лечение фагами и т. д. Ø Бактериоцины, в отличие от классических антибиотиков, синтезируются на рибосомах и имеют относительно узкий спектр антимикробного действия . По химической природе это низкомолекулярные белки, разнообразные по размеру, спектру и механизму микробного поражения, продуцентам и механизмам иммунитета. Значительная часть бактериоцинов производится грамотрицательными и грамположительными бактериями. Обращает на себя внимание существование сходного принципа строения бактериальных цитолитических токсинов и белков врожденного иммунитета

Бактериоцины — специфические белки, вырабатываемые некоторыми бактериями и подавляющие жизнедеятельность клеток других штаммов того же вида или родственных видов бактерий. Бактериоцины обозначаются в соответствии с видовым названием, например «Escherichia coli» образует так называемые колицины, Pasteurella pestis — пестицины. ТУБЕРКУЛОЦИНЫ!! Механизм действия бактериоцинов связан с повреждением цитоплазматических мембран, нарушением синтеза ДНК, РНК и белка. Спектр активности бактериоцинов в отличие от антибиотиков узок и определяется наличием рецепторов у бактерий для их адсорбции.

q Растущий интерес исследователей к классу пороформирующих пептидов отражает чрезвычайно важную роль этих соединений в биологических системах. q Практически все живые существа от вирусов до млекопитающих (включая человека) синтезируют в своем организме эти соединения и активно используют их для выживания. q Особенно следует отметить, что порообразующие белки являются важным компонентом иммунной системы. Например, пороформирующие цитотоксические вещества, продуцируемые лейкоцитами, перфорины и дефенсины, являются эффективной первоначальной защитой от проникновения чужеродных организмов q. Низкомолекулярные катионные пептиды становятся реальными кандидатами на роль антибиотиков нового поколения (Zasloff, M. , 2002)
![Антибиотики (antibiotics) [греч. anti — против и bios (biotikos) — жизнь] — органические вещества Антибиотики (antibiotics) [греч. anti — против и bios (biotikos) — жизнь] — органические вещества](https://present5.com/presentation/e9cc14c78d5ce00f977d7b5220952489/image-8.jpg)
Антибиотики (antibiotics) [греч. anti — против и bios (biotikos) — жизнь] — органические вещества микробного, животного или растительного происхождения, а также получаемые синтетическим путем, способные подавлять рост микроорганизмов или вызывать их гибель, напр. , у грибов — пенициллины, у высших растений — фитонциды , у животных — дефензины. Дефензины (от англ. defense — защита) — катионные пептиды иммунной системы, активные в отношении бактерий, грибов и многих оболочечных и безоболочечных вирусов. Состоят из 18 45 аминокислот, в том числе 6 8 цистеиновых эволюционно консервативных остатков. Иммунные клетки используют дефензины для уничтожения бактерий, поглощённых при фагоцитозе. Обычно дефензины присоединяются к клеточной мембране микроба и углубляются в неё, формируя порообразные разрывы.

q Дефензины обладают мощным провоспалительным действием. Интратрахеальное введение миелоидных a дефензинов в дозе 5– 30 мкг/кг экспериментальным мышам приводит к быстрому развитию танатогенного воспалительного процесса в легких. Через пять часов после введения дефензинов в бронхоальвеолярном лаваже увеличивается количество нейтрофилов, моноцитов и достоверно повышается концентрация эластазы, TNF a, CXCL 2/MIP 2, CCL 2/MCP 1. q Провоспалительное действие дефензины реализуют через активацию TLR, рекрутирование провоспалительных клеток в регион поражения ткани, возбуждение эпителиоцитов, эндотелиоцитов, дендритных клеток, моноцитов, макрофагов, нейтрофилов, тучных клеток. q Различные дефензины в наномолярных концентрациях могут с некоторой селективностью рекрутировать разные типы клеток в процесс воспалительного ответа. Так, HNP 1, HNP 2, HNP 3 и HBD 1 являются хемоаттрактантами для моноцитов, а HBD 2 — ля нейтрофилов, HBD 2, BD 3, д H HBD 4 — для макрофагов

q Дефензины непосредственно активируют несколько типов клеток, в том числе эпителиоциты, кератиноциты, эндотелиоциты, нейтрофилы, фибробласты, дендритные клетки, т лимфоциты, моноциты, тучные клетки, функционирование которых приводит к экспрессии и секреции цитокинов, хемокинов и других биологически активных веществ q Человеческие дефензины имеют выраженные свойства иммуноадъювантов, которые могут усиливать активность гуморального и клеточного иммунного ответа, направленного против различных антигенов инфекционных возбудителей, протеинов злокачественных новообразований q Jamil Aarbiou и соавт. , используя в качестве модели эпителиальные клетки респираторного тракта линий NCI H 292, становили, что HNP при у низких концентрациях (< 10 мкг/мл) ускоряют процесс репарации поврежденного эпителия.
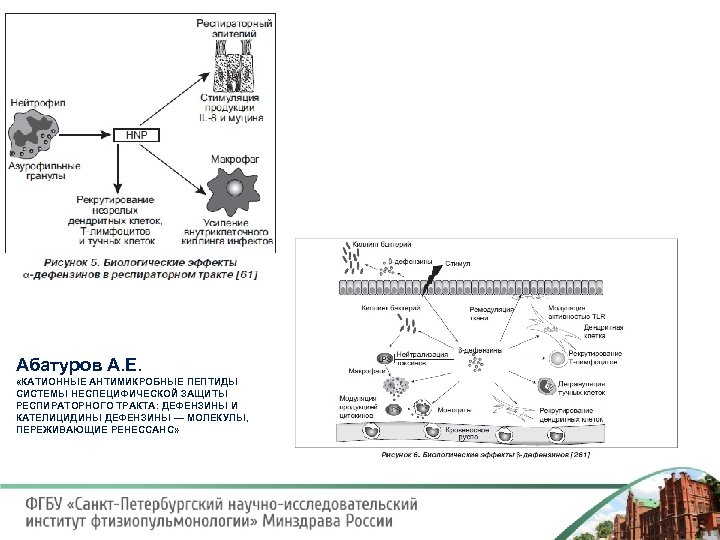
Абатуров А. Е. «КАТИОННЫЕ АНТИМИКРОБНЫЕ ПЕПТИДЫ СИСТЕМЫ НЕСПЕЦИФИЧЕСКОЙ ЗАЩИТЫ РЕСПИРАТОРНОГО ТРАКТА: ДЕФЕНЗИНЫ И КАТЕЛИЦИДИНЫ ДЕФЕНЗИНЫ — МОЛЕКУЛЫ, ПЕРЕЖИВАЮЩИЕ РЕНЕССАНС»

Martineau и соавт. (2007) пришли к заключению, что существенная роль физиологической реакции нейтрофилов при врожденной устойчивости к туберкулезной инфекции связана с их способностью продуцировать катионные антимикробные пептиды (КАП), которые относятся к факторам естественного иммунитета и способны модулировать цитостатический эффект макрофагов и нейтрофилов в отношении Mycobacterium tuberculosis. Пептидные фрагменты КАП с преобладающей иммуномодулирующей активностью получили обозначение– IDR (сокращение от innate defense regulator) регуляторы естественного иммунитета IDR характеризует отсутствие прямого противомикробного действия, однако они способны модулировать цитостатический эффект макрофагов и нейтрофилов в отношении Mycobacterium tuberculosis. IDR в фармакологических решениях рассматриваются как препараты, проявляющие защитный эффект без непосредственного противомикробного действия

Patricia Mendez-Samperio, Mexico, 2008 Описан прогресс в понимании роли антимикробных пептидов как потенциальных кандидатов для развития альтернативной стратегии лечения туберкулеза, особенно в контексте МЛУ ТБ. • • • Маленький катионный дефензин (3 5 k. Da) представляет важную семью пептидов среди противомикробных пептидов. β дефензин HBD 2 выделяется эпителием и индуцирует выработку ФНО α, ИЛ 1 β, в т. ч. в присутствии МБТ bovis BCG Основная роль дефензинов – прямой лизис МБТ посредством разрушения клеточной мембраны. Это происходит за счет взаимодействия катионного белка – дефензина и анионных фосфолипидов клетки МБТ, следствием такого взаимодействия является нарушения клеточного метаболизма Кроме того, дефензины способны внутриклеточно связывать полианионные молекулы ДНК. Следствие разрушение МБТ и др. микроорганизмов Антимикробная активность дефензинов делает их важными кандидатами для лечения туберкулеза как непосредственно, так и через процесс хемотаксиса и продукцию провоспалительных цитокинов, что доказано in vitro и in vivo на мышах.

Bruno Rivas-Santiago, Stephan K. Schwander, Carmen Sarabia, Gill Diamond, 4 Marcia E. Klein-Patel, Rogelio Hernandez-Pando, Jerrold J. Ellner, and Eduardo Sada (2005) Human -Defensin 2 Is Expressed and Associated with Mycobacterium tuberculosis during Infection of Human Alveolar Epithelial Cells • Определена роль человеческого β дефензина 2(HBD 2) в развитии туберкулеза. Выделение этого дефензина определяли для эпителиальных клеток, альвеолярных макрофагов и моноцитов крови. • Эпителиальные клетки выделяют HBD 2 при различных вариантах микобактериозов • Альвеолярные макрофаги только в присутствии МБТ • Моноциты не выделяют HBD 2 • Показано, что альвеолярные макрофаги выделяют HBD 2 только после прилипания к МБТ

SUDHIR SHARMA, INDU VERMA, AND G. K. KHULLER* Department of Biochemistry, Postgraduate Institute of Medical Education & Research, Chandigarh, India Therapeutic Potential of Human Neutrophil Peptide 1 against Experimental Tuberculosis • Антимикробные пептиды- альтернатива антибиотикам вследствие их антимикробной активности • Дефензины семья маленьких пептидов с шестью цистеиновыми аминокислотами • HNP 1 in vitro и in vivo обнаружил антимикробную активность против различных микроорганизмов, включая МБТ • HNP 1 обладает свойством хемотаксиса по отношению к Т лимфоцитам и моноцитам и продуцирует ИЛ 8

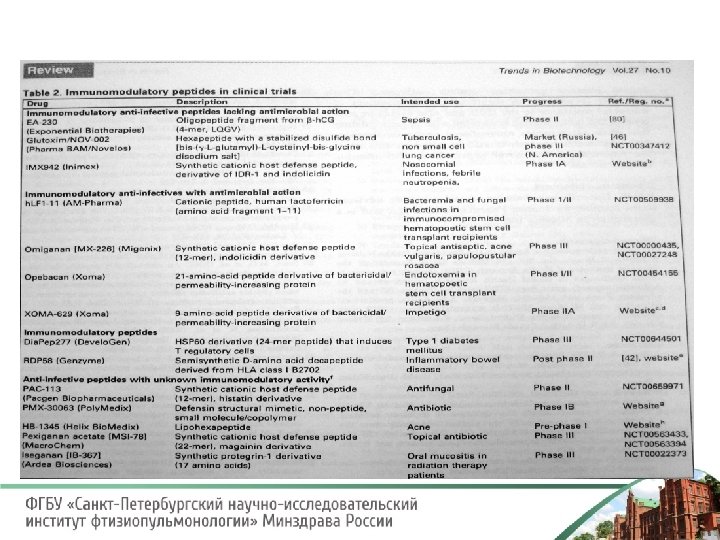
Изучение АМП с многообещающим будущим в качестве биотехнологических инструментов представляет особую значимость для создания новых лекарств из «естественных антибиотиков» Андреева-Ковалевская Ж. И. и соавт. , 2008, Marshall S. H. , Arenas G. , 2003, Nes IF, Yoon S-S & Diep DB. , 2007 Первые шаги в этом направлении уже сделаны. Для лечения хронических инфекций и злокачественных новообразований в Украине в последние годы применяется препарат Пропес, который содержит биологически активные регуляторные пептиды – альфа и бета дефензины, полученные путем контролируемого протеолиза из эмбриональной ткани животных. Накопленный опыт свидетельствует о способности Пропеса индуцировать антиген специфичный иммунный ответ в отношении возбудителей хронических нейроинфекций. Пропес продемонстрировал способность улучшать эффективность комплексной терапии и увеличивать продолжительность жизни онкологических больных Глутоксим - один из первых, разрешенных к клиническому применению в России синтетических препаратов, отнесенных в группу IDR. [Easton D. M. , Nijnik A. , ].
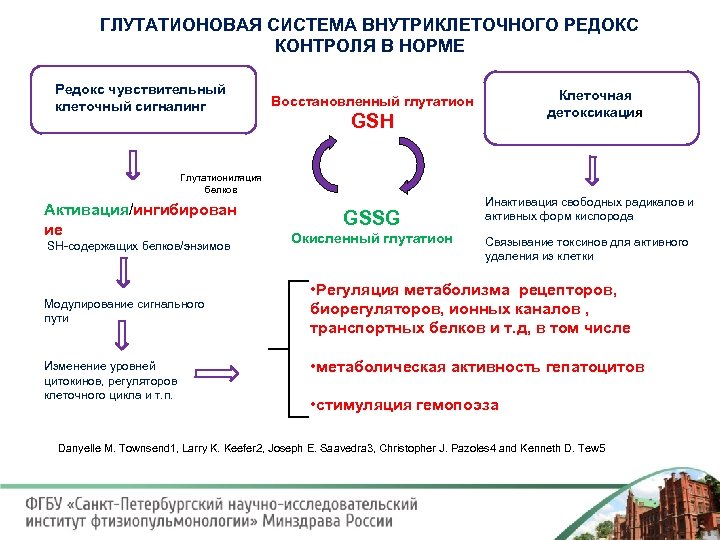
ГЛУТАТИОНОВАЯ СИСТЕМА ВНУТРИКЛЕТОЧНОГО РЕДОКС КОНТРОЛЯ В НОРМЕ Редокс чувствительный клеточный сигналинг GSH Глутатиониляция белков Активация/ингибирован ие SH содержащих белков/энзимов Модулирование сигнального пути Изменение уровней цитокинов, регуляторов клеточного цикла и т. п. Клеточная детоксикация Восстановленный глутатион GSSG Окисленный глутатион Инактивация свободных радикалов и активных форм кислорода Связывание токсинов для активного удаления из клетки • Регуляция метаболизма рецепторов, биорегуляторов, ионных каналов , транспортных белков и т. д, в том числе • метаболическая активность гепатоцитов • стимуляция гемопоэза Danyelle M. Townsend 1, Larry K. Keefer 2, Joseph E. Saavedra 3, Christopher J. Pazoles 4 and Kenneth D. Tew 5
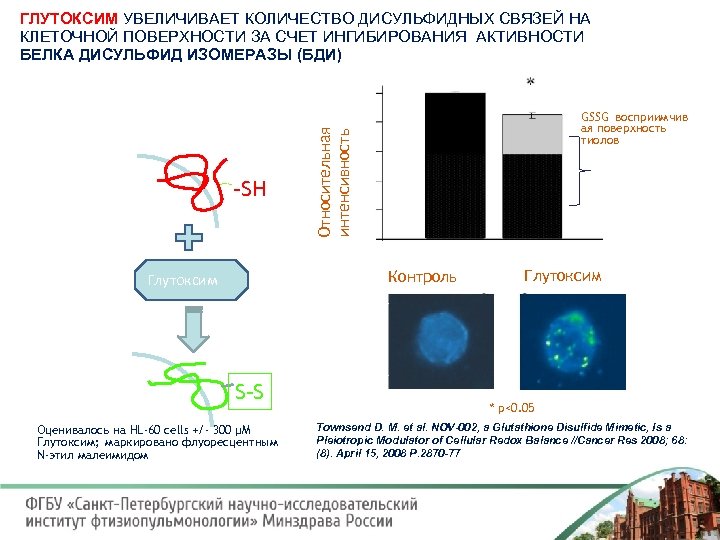
ГЛУТОКСИМ УВЕЛИЧИВАЕТ КОЛИЧЕСТВО ДИСУЛЬФИДНЫХ СВЯЗЕЙ НА КЛЕТОЧНОЙ ПОВЕРХНОСТИ ЗА СЧЕТ ИНГИБИРОВАНИЯ АКТИВНОСТИ БЕЛКА ДИСУЛЬФИД ИЗОМЕРАЗЫ (БДИ) Относительная интенсивность -SH GSSG восприимчив ая поверхность тиолов Контроль Глутоксим S-S Оценивалось на HL-60 cells +/- 300 µM Глутоксим; маркировано флуоресцентным N-этил малеимидом Глутоксим * p<0. 05 Townsend D. M. et al. NOV-002, a Glutathione Disulfide Mimetic, Is a Pleiotropic Modulator of Cellular Redox Balance //Cancer Res 2008; 68: (8). April 15, 2008 P. 2870 -77

• • В ЦНИИТ РАМН была выполнена работа по изучению способности препарата ГЛУТОКСИМ модулировать цитостатический эффект макрофагов и нейтрофилов чувствительных и резистентных к туберкулезу мышей в отношении Mycobacterium tuberculosis. В экспериментах использованы макрофаги и нейтрофилы, выращенные из костного мозга, полученного от инбредных линий мышей I/St. Sn. Eg. YCit (I/St) и C 57 BL/6 (B 6) Были изучены следующие комбинации: 1. M. tuberculosis per se; 2. M. tuberculosis + Глутоксим; 3. M. tuberculosis + макрофаги; 4. M. tuberculosis + макрофаги + Глутоксим; 5. M. tuberculosis+ нейтрофилы; 6. M. tuberculosis + нейтрофилы +Глутоксим; 7. M. tuberculosis + макрофаги + нейтрофилы; 8. M. tuberculosis + макрофаги + нейтрофилы + Глутоксим. Подобные комбинации были использованы в отношении клеток обеих линий
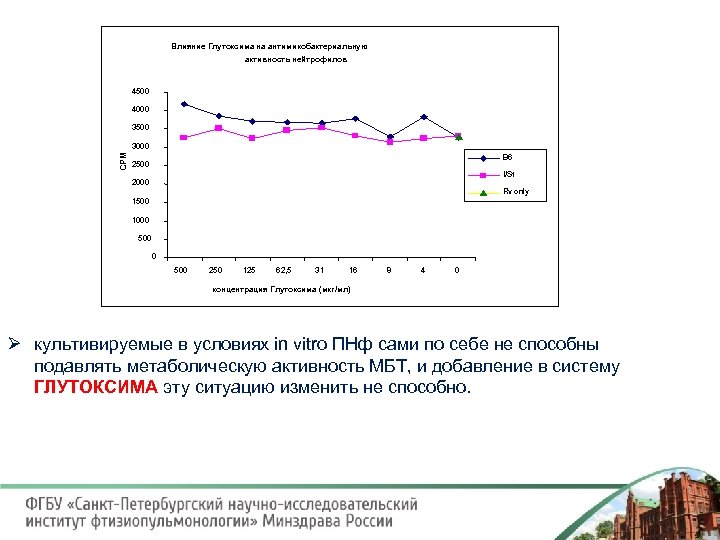
Влияние Глутоксима на антимикобактериальную активность нейтрофилов 4500 4000 3500 СРМ 3000 B 6 2500 I/St 2000 Rv only 1500 1000 500 250 125 62, 5 31 16 8 4 0 концентрация Глутоксима (мкг/мл) Ø культивируемые в условиях in vitro ПНф сами по себе не способны подавлять метаболическую активность МБТ, и добавление в систему ГЛУТОКСИМА эту ситуацию изменить не способно.
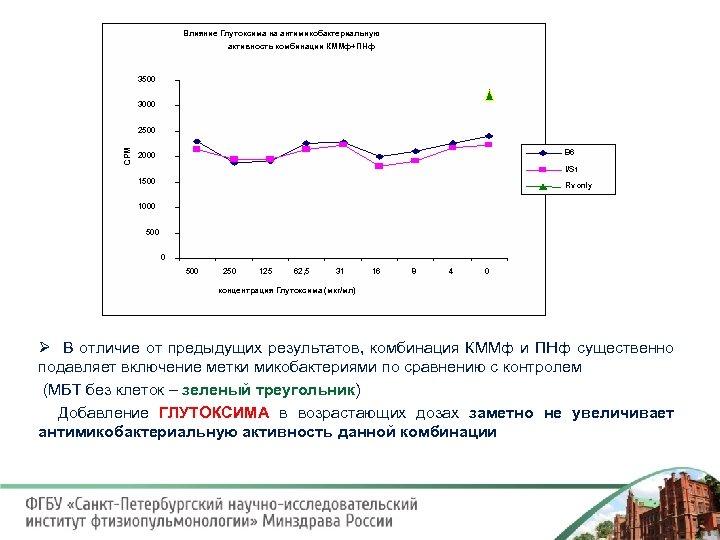
Влияние Глутоксима на антимикобактериальную активность комбинации КММф+ПНф 3500 3000 СРМ 2500 B 6 2000 I/St 1500 Rv only 1000 500 250 125 62, 5 31 16 8 4 0 концентрация Глутоксима (мкг/мл) Ø В отличие от предыдущих результатов, комбинация КММф и ПНф существенно подавляет включение метки микобактериями по сравнению с контролем (МБТ без клеток – зеленый треугольник) Добавление ГЛУТОКСИМА в возрастающих дозах заметно не увеличивает антимикобактериальную активность данной комбинации
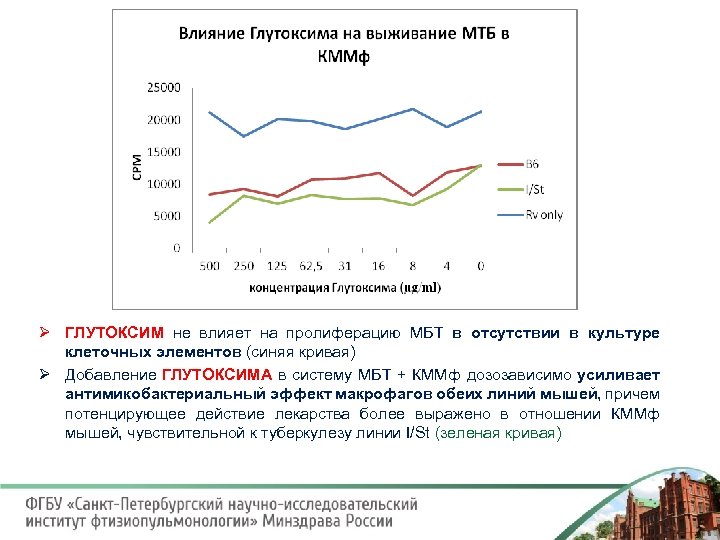
Ø ГЛУТОКСИМ не влияет на пролиферацию МБТ в отсутствии в культуре клеточных элементов (синяя кривая) Ø Добавление ГЛУТОКСИМА в систему МБТ + КММф дозозависимо усиливает антимикобактериальный эффект макрофагов обеих линий мышей, причем потенцирующее действие лекарства более выражено в отношении КММф мышей, чувствительной к туберкулезу линии I/St (зеленая кривая)
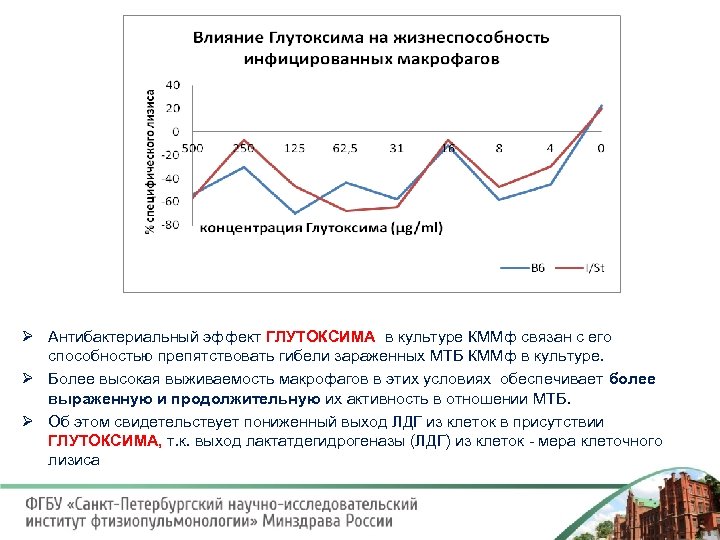
Ø Антибактериальный эффект ГЛУТОКСИМА в культуре КММф связан с его способностью препятствовать гибели зараженных МТБ КММф в культуре. Ø Более высокая выживаемость макрофагов в этих условиях обеспечивает более выраженную и продолжительную их активность в отношении МТБ. Ø Об этом свидетельствует пониженный выход ЛДГ из клеток в присутствии ГЛУТОКСИМА, т. к. выход лактатдегидрогеназы (ЛДГ) из клеток мера клеточного лизиса
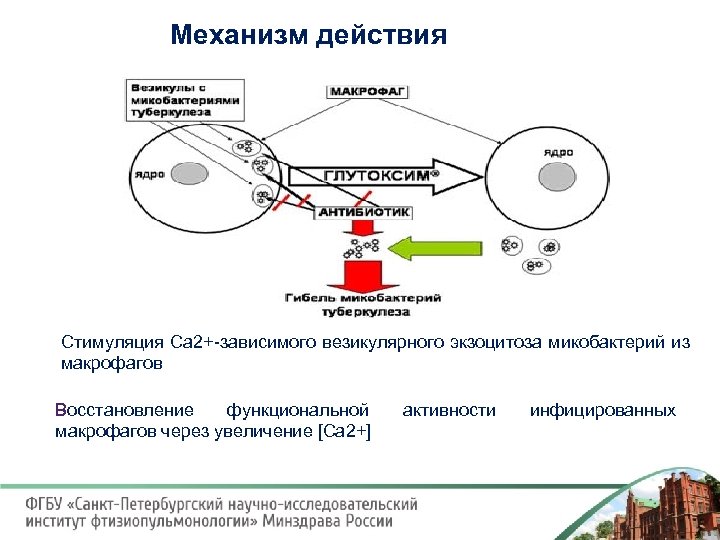
Механизм действия Стимуляция Са 2+ зависимого везикулярного экзоцитоза микобактерий из макрофагов Восстановление функциональной макрофагов через увеличение [Ca 2+] активности инфицированных

Механизм действия Стимуляция конвертации неактивного изониазида в активную изоникотиновую кислоту независимо от каталазы пероксидазы
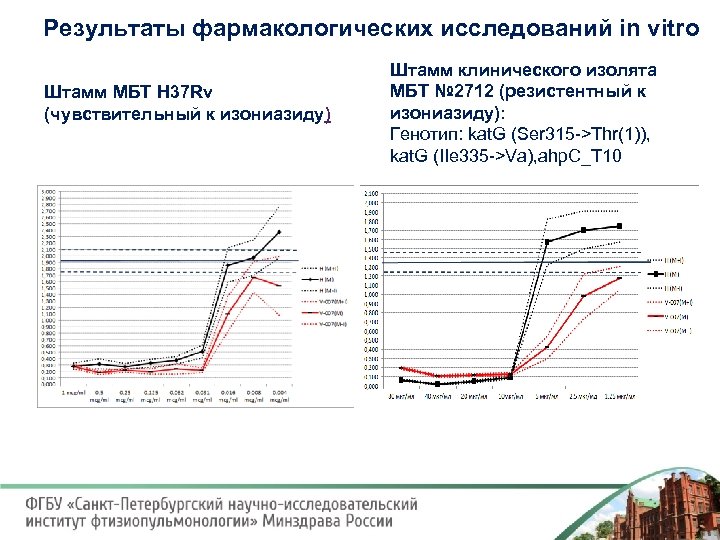
Результаты фармакологических исследований in vitro Штамм МБТ H 37 Rv (чувствительный к изониазиду) Штамм клинического изолята МБТ № 2712 (резистентный к изониазиду): Генотип: kat. G (Ser 315 >Thr(1)), kat. G (IIe 335 >Va), ahp. C_T 10

Результаты фармакологических исследований in vitro Штамм клинического изолята МБТ № 5307 (резистентный к изониазиду): Генотип: мутация в гене inh. A Штамм клинического изолята МБТ № 5227 (резистентный к изониазиду): Генотип: kat. G (Ser 315 >Thr(1)), ahp. C_A 10
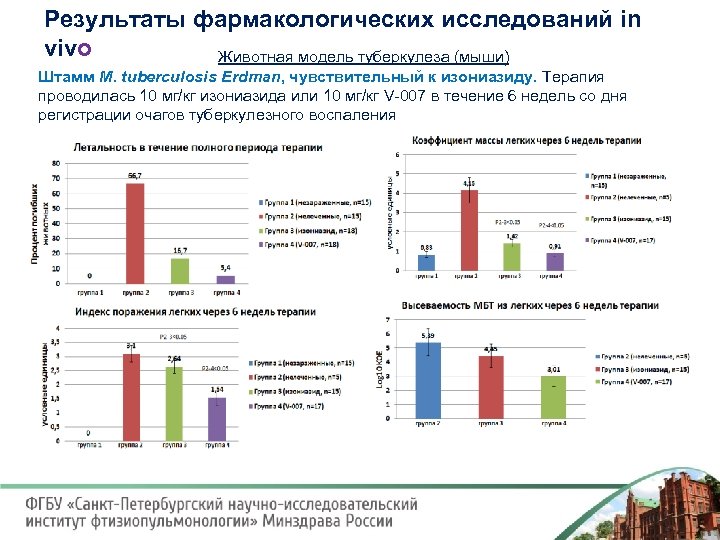
Результаты фармакологических исследований in vivo Животная модель туберкулеза (мыши) Штамм М. tuberculosis Erdman, чувствительный к изониазиду. Терапия проводилась 10 мг/кг изониазида или 10 мг/кг V 007 в течение 6 недель со дня регистрации очагов туберкулезного воспаления
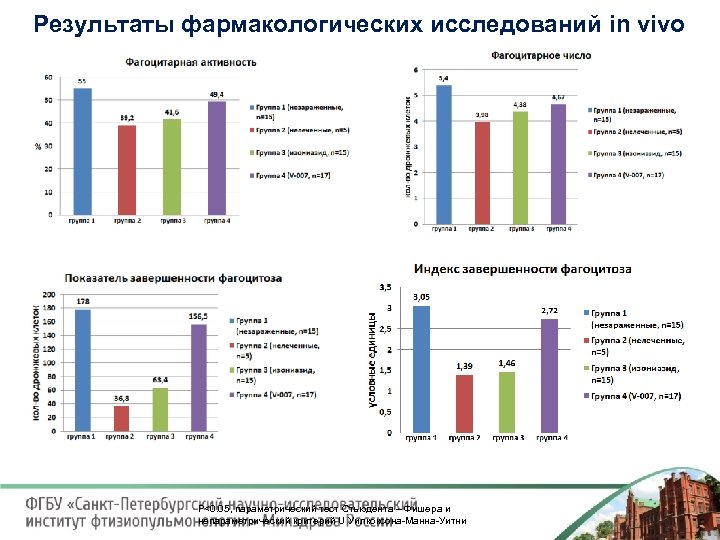
Результаты фармакологических исследований in vivo P<0. 05, параметрический тест Стьюдента – Фишера и непараметрический критерий U Уилкоксона Манна Уитни
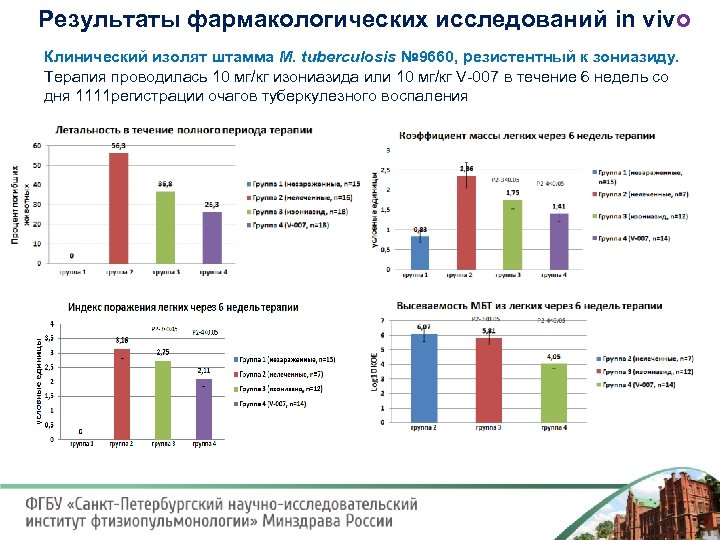
Результаты фармакологических исследований in vivo Клинический изолят штамма М. tuberculosis № 9660, резистентный к зониазиду. Терапия проводилась 10 мг/кг изониазида или 10 мг/кг V 007 в течение 6 недель со дня 1111 регистрации очагов туберкулезного воспаления

ИНСТРУКЦИЯ по медицинскому применению препарата ГЛУТОКСИМ Регистрационный номер Р N 002010/01 (GLUTOXIM ) Торговое название препарата: Глутоксим. Международное непатентованное название или группировочное название: Глутамил Цистеинил Глицин динатрия&. Химическое название: бис (гамма L-глутамил)-L-цистеинил-бис-глицин динатриевая соль. Лекарственная форма: раствор для инъекций. Состав: Активное вещество: Глутамил-Цистеинил-Глицин динатрия 5 мг, 10 мг или 30 мг в 1 мл. Вспомогательные вещества: натрия ацетат, кислота уксусная разведенная, вода для инъекций. Описание: Прозрачная бесцветная или слабо окрашенная жидкость без запаха или со слабым запахом уксусной кислоты. Фармакотерапевтическая группа: иммуностимулирующее средство. Код АТХ [L 03 АХ] ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ Фармакодинамика ……Глутоксим® оказывает прямое ингибирующее действие на активность фактора множественной лекарственной устойчивости опухолевых клеток белок Р гликопротеин (Рgp), который определяет устойчивость опухолевых клеток к действию средств химиотерапии, включая антрациклиновые антибиотики, препараты алкилирующего действия. Глутоксим® инициирует реакцию трансформации изониазида – пролекарство, в фармакологически активную форму – изоникотиновую кислоту, обладающую бактериостатическим действием на Micobacterium tuberculosis, что позволяет преодолеть лекарственную резистентность Micobacterium tuberculosis, обусловленную негативной трансформацией генов kat. G (ген каталазы-пероксидазы) и inh. A (ген енол-АПБ-редуктазы). Глутоксим® стимулирует процессы экзоцитоза везикул из макрофагов с внутриклеточно паразитирующими микроорганизмами, включая Micobacterium tuberculosis, обеспечивая их удаление из фармакологического убежища и делая доступными для действия антибактериальных препаратов, включая изониазид, рифампицин, рифабутин, циклосерин, капреомицин, левофлоксацин. Глутоксим® усиливает секрецию катионных пептидов – дефенсинов и каталецидинов макрофагами, стимулирует их поглощение микобактериями туберкулеза, определяя опосредованное антибактериальное действие препарата.

ТАК, ВСЕ-ТАКИ, ПРОИЗОЙДЕТ ЛИ В БЛИЖАЙШИЕ ГОДЫ «БАКТЕРИОЦИНОВАЯ» РЕВОЛЮЦИЯ? Движущими силами ее наступления являются: q необходимость в снижении удельного веса применения антибиотиков, чтобы приостановить стремительное распространение резистентных к ним форм бактерий, q научно доказанная возможность создания нового класса антимикробных средств, лишенных недостатка традиционных антибиотиков, q энтузиазм исследователей, направленный на разработку лекарственных средств класса природных антибиотиков.

Благодарю за внимание! Баласанянц Г. С.
e9cc14c78d5ce00f977d7b5220952489.ppt