Платиновые металлы 8, 9, 10 группы 5, 6


































- Размер: 3 Mегабайта
- Количество слайдов: 40
Описание презентации Платиновые металлы 8, 9, 10 группы 5, 6 по слайдам
 Платиновые металлы 8, 9, 10 группы 5, 6 период
Платиновые металлы 8, 9, 10 группы 5, 6 период

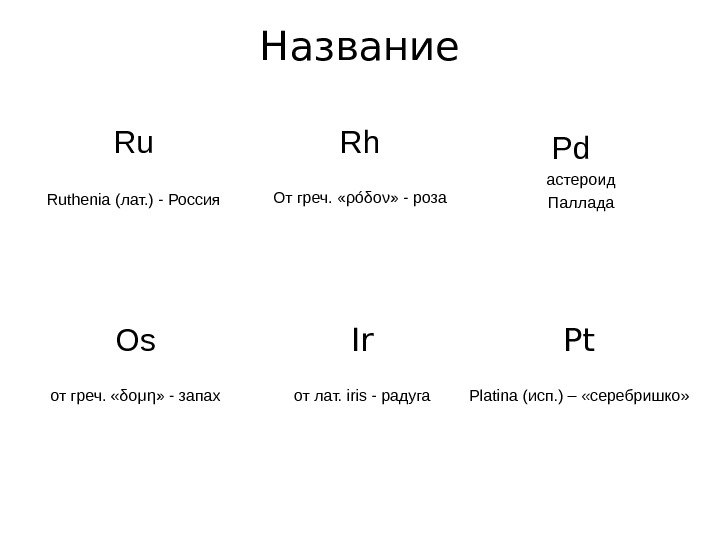
 Название Ru Ruthenia (лат. ) — Россия Rh От греч. « ρ ó δ o ν » — роза Os от греч. « δ o μη » — запах Pd астероид Паллада Ir от лат. iris — радуга Pt Platina ( исп. ) – «серебришко»
Название Ru Ruthenia (лат. ) — Россия Rh От греч. « ρ ó δ o ν » — роза Os от греч. « δ o μη » — запах Pd астероид Паллада Ir от лат. iris — радуга Pt Platina ( исп. ) – «серебришко»
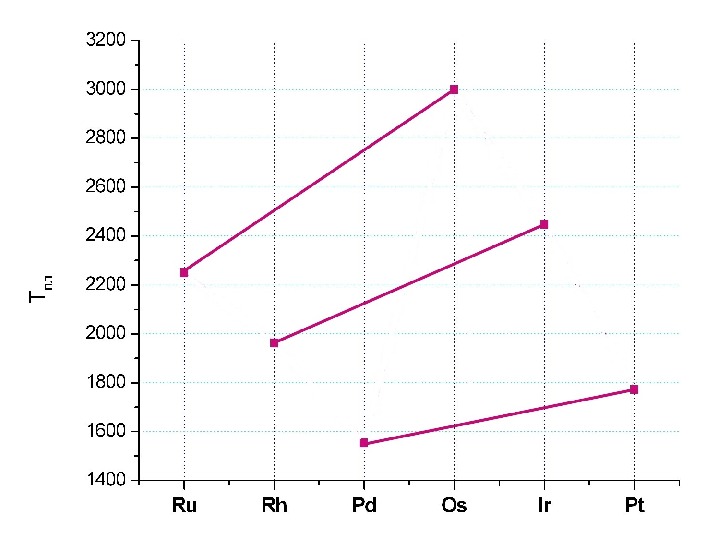
 Некоторые характеристики Ru Rh Pd Os Ir Pt Электрон. конфиг. 4 d 7 5 s 1 4 d 8 5 s 1 4 d 10 5 s 0 5 d 6 6 s 2 5 d 7 6 s 2 5 d 9 6 s 1 Решетка ГПУ ГЦК ГЦК ρ , г / см 3 12. 4 12. 0 22. 6 22. 4 21. 5 Легкие Тяжелые
Некоторые характеристики Ru Rh Pd Os Ir Pt Электрон. конфиг. 4 d 7 5 s 1 4 d 8 5 s 1 4 d 10 5 s 0 5 d 6 6 s 2 5 d 7 6 s 2 5 d 9 6 s 1 Решетка ГПУ ГЦК ГЦК ρ , г / см 3 12. 4 12. 0 22. 6 22. 4 21. 5 Легкие Тяжелые
 Степени окисления Ru 0 , +2, +3, +4 , +5, +6, +7, +8 Rh 0 , +1, +2 , +3 , +4, +6 Pd 0 , +2 , +3, +4 Os 0 , +2, +3, +4, +5, +6, +8 Ir 0 , +1, +2, +3 , +4 , +5, +6 Pt 0 , +1, +2 , +3, +4 , +5, +
Степени окисления Ru 0 , +2, +3, +4 , +5, +6, +7, +8 Rh 0 , +1, +2 , +3 , +4, +6 Pd 0 , +2 , +3, +4 Os 0 , +2, +3, +4, +5, +6, +8 Ir 0 , +1, +2, +3 , +4 , +5, +6 Pt 0 , +1, +2 , +3, +4 , +5, +


 Распространенность в земной коре, в % Ru Rh Pd Os Ir Pt 5 · 10 — 6 1 · 10 — 6 8 · 10 — 6 5 · 10 — 6 1 · 10 — 6 5 · 10 —
Распространенность в земной коре, в % Ru Rh Pd Os Ir Pt 5 · 10 — 6 1 · 10 — 6 8 · 10 — 6 5 · 10 — 6 1 · 10 — 6 5 · 10 —
 Основные минералы • Поликсен (Pt, Fe) : Pt 80 — 88% • Ферроплатина: Pt 84 — 81% • Палладистая платина: Pd 7 — 40% • Невьянскит : Ir 4 7 — 77 % Os 49 — 21% • Р одиевый невьянскит : Ir 70 %, Os 17 %, Rh 11 % • Высоцкит (Pd, Ni , Pt )5 S (Pd 60 %, Ni 14%, Pt 5 %) Аллювиальные месторождения
Основные минералы • Поликсен (Pt, Fe) : Pt 80 — 88% • Ферроплатина: Pt 84 — 81% • Палладистая платина: Pd 7 — 40% • Невьянскит : Ir 4 7 — 77 % Os 49 — 21% • Р одиевый невьянскит : Ir 70 %, Os 17 %, Rh 11 % • Высоцкит (Pd, Ni , Pt )5 S (Pd 60 %, Ni 14%, Pt 5 %) Аллювиальные месторождения
 Динамика цен на платиновые металлы
Динамика цен на платиновые металлы
 Скачок цен на Rh
Скачок цен на Rh
 Получение аффинаж • Смесь + «царская водка» = H 2 [ ЭС l 6 ], Os, Ir не растворяются • 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2 [Pt. Cl 6 ] + 4 NO + 8 H 2 O • H 2 [Pt. Cl 6 ] + 2 NH 3 = (NH 4 )2 [Pt. Cl 6 ] • (NH 4 )2 [Pt. Cl 6 ] = Pt + 2 NH 3 + 2 HCl + 2 Cl 2 ° T • Из «осмиридия» и раствора, оставщегося после отделения (NH 4 )2 [Pt. Cl 6 ] другие платиновые Mē
Получение аффинаж • Смесь + «царская водка» = H 2 [ ЭС l 6 ], Os, Ir не растворяются • 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2 [Pt. Cl 6 ] + 4 NO + 8 H 2 O • H 2 [Pt. Cl 6 ] + 2 NH 3 = (NH 4 )2 [Pt. Cl 6 ] • (NH 4 )2 [Pt. Cl 6 ] = Pt + 2 NH 3 + 2 HCl + 2 Cl 2 ° T • Из «осмиридия» и раствора, оставщегося после отделения (NH 4 )2 [Pt. Cl 6 ] другие платиновые Mē
 Химические свойства простых веществ Взаимодействие с кислотами — окислителями: Pd + 2 H 2 SO 4 = Pd. SO 4 + SO 2 + 2 H 2 O 2 Pd + 6 HNO 3 = 2 Pd(NO 3 )2 + 2 NO 2 + 3 H 2 O Pt Ru, Rh, Os и Ir в виде слитка не взаимодействуют Os + 8 HNO 3 = Os. O 4 + 8 NO 2 + 4 H 2 OЭ Ru Rh Pd Os Ir Pt Е (Э 2+ / Э 0 ), В +0. 45 +0. 6 +0. 99 +0. 85 +1. 1 +1. 2 ИНЕРТНОСТЬ
Химические свойства простых веществ Взаимодействие с кислотами — окислителями: Pd + 2 H 2 SO 4 = Pd. SO 4 + SO 2 + 2 H 2 O 2 Pd + 6 HNO 3 = 2 Pd(NO 3 )2 + 2 NO 2 + 3 H 2 O Pt Ru, Rh, Os и Ir в виде слитка не взаимодействуют Os + 8 HNO 3 = Os. O 4 + 8 NO 2 + 4 H 2 OЭ Ru Rh Pd Os Ir Pt Е (Э 2+ / Э 0 ), В +0. 45 +0. 6 +0. 99 +0. 85 +1. 1 +1. 2 ИНЕРТНОСТЬ
 Химические свойства простых веществ Окисление, сопровождающееся комплексообразованием: 3 Pt(Pd) + 4 HNO 3 + 18 HCl = 3 H 2 [Pt. Cl 6 ] + 4 NO + 8 H 2 O Rh + HNO 3 + 6 HCl = H 3 [Rh. Cl 6 ] + NO + 2 H 2 O Os, Ir с «царской водкой» не взаимодействуют Pt + 6 HCl + O 2 = H 2 [Pt. Cl 6 ] + 2 H 2 O Pt + KCN + H 2 O = K 2 [Pt(CN)4 ] + 2 KOH + H
Химические свойства простых веществ Окисление, сопровождающееся комплексообразованием: 3 Pt(Pd) + 4 HNO 3 + 18 HCl = 3 H 2 [Pt. Cl 6 ] + 4 NO + 8 H 2 O Rh + HNO 3 + 6 HCl = H 3 [Rh. Cl 6 ] + NO + 2 H 2 O Os, Ir с «царской водкой» не взаимодействуют Pt + 6 HCl + O 2 = H 2 [Pt. Cl 6 ] + 2 H 2 O Pt + KCN + H 2 O = K 2 [Pt(CN)4 ] + 2 KOH + H
 Окислительное сплавление Na. Cl. O 2 , O 2 +KOH, KCl. O 3 , KNO 3 , K 2 O 2 , Cl 2 Pt + 2 KCl. O 3 + KOH = K 2 Pt. O 3 + KCl + H 2 O Pd Os + KCl. O 3 + KOH = K 2 Os. O 4 + KCl + H 2 O Rh + KCl. O 3 = Rh 2 O 3 + KCl Ir + Cl 2 + Na. Cl = Na 2 Ir. Cl 6 Э + Na. OH + [O]
Окислительное сплавление Na. Cl. O 2 , O 2 +KOH, KCl. O 3 , KNO 3 , K 2 O 2 , Cl 2 Pt + 2 KCl. O 3 + KOH = K 2 Pt. O 3 + KCl + H 2 O Pd Os + KCl. O 3 + KOH = K 2 Os. O 4 + KCl + H 2 O Rh + KCl. O 3 = Rh 2 O 3 + KCl Ir + Cl 2 + Na. Cl = Na 2 Ir. Cl 6 Э + Na. OH + [O]
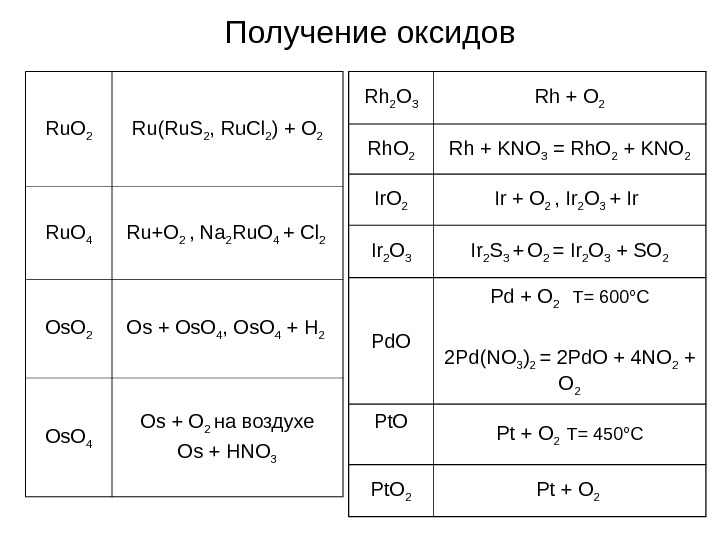
 Получение оксидов Ru. O 2 Ru(Ru. S 2 , Ru. Cl 2 ) + O 2 Ru. O 4 Ru+O 2 , Na 2 Ru. O 4 + Cl 2 Os. O 2 Os + Os. O 4 , Os. O 4 + H 2 Os. O 4 Os + O 2 на воздухе Os + HNO 3 Rh 2 O 3 Rh + O 2 Rh + KNO 3 = Rh. O 2 + KNO 2 Ir + O 2 , Ir 2 O 3 + Ir 2 O 3 Ir 2 S 3 + O 2 = Ir 2 O 3 + SO 2 Pd. O Pd + O 2 T= 600 ° C 2 Pd(NO 3 ) 2 = 2 Pd. O + 4 NO 2 + O 2 Pt. O Pt + O 2 T= 450 ° C Pt. O 2 Pt + O
Получение оксидов Ru. O 2 Ru(Ru. S 2 , Ru. Cl 2 ) + O 2 Ru. O 4 Ru+O 2 , Na 2 Ru. O 4 + Cl 2 Os. O 2 Os + Os. O 4 , Os. O 4 + H 2 Os. O 4 Os + O 2 на воздухе Os + HNO 3 Rh 2 O 3 Rh + O 2 Rh + KNO 3 = Rh. O 2 + KNO 2 Ir + O 2 , Ir 2 O 3 + Ir 2 O 3 Ir 2 S 3 + O 2 = Ir 2 O 3 + SO 2 Pd. O Pd + O 2 T= 600 ° C 2 Pd(NO 3 ) 2 = 2 Pd. O + 4 NO 2 + O 2 Pt. O Pt + O 2 T= 450 ° C Pt. O 2 Pt + O
 Поведение оксидов при нагревании Ru. O 2 = Ru + O 2 T= >700 ° C Ru. O 2 = Ru + Ru. O 4 T= 1 2 00 ° C Ir. O 2 = Ir + O 2 T= >1100 ° C Ir 2 O 3 2 Ir 2 O 3 = 3 Ir. O 2 + Ir Pd. O 2 Pd. O = Pd + O 2 T= >875 ° C Pt. O 2 Pt. O = 2 Pt + O 2 Pt. O 2 = Pt + O 2 T= >200 °
Поведение оксидов при нагревании Ru. O 2 = Ru + O 2 T= >700 ° C Ru. O 2 = Ru + Ru. O 4 T= 1 2 00 ° C Ir. O 2 = Ir + O 2 T= >1100 ° C Ir 2 O 3 2 Ir 2 O 3 = 3 Ir. O 2 + Ir Pd. O 2 Pd. O = Pd + O 2 T= >875 ° C Pt. O 2 Pt. O = 2 Pt + O 2 Pt. O 2 = Pt + O 2 T= >200 °
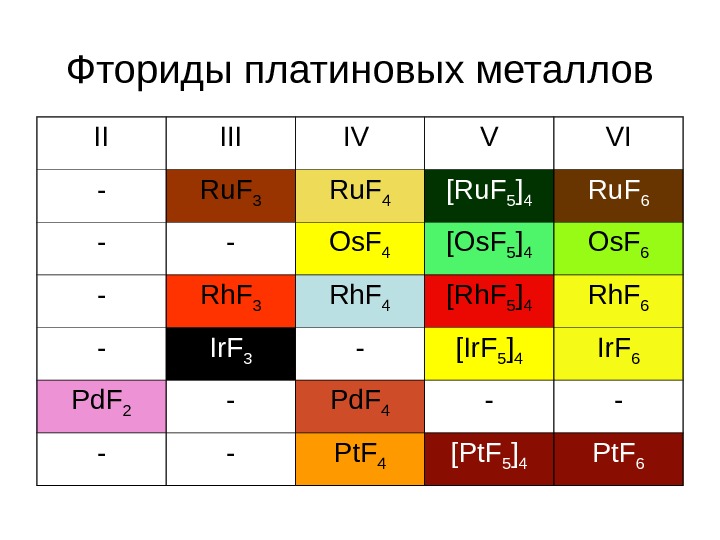
 Фториды платиновых металлов II IV V VI — Ru. F 3 Ru. F 4 [Ru. F 5 ] 4 Ru. F 6 — — Os. F 4 [Os. F 5 ] 4 Os. F 6 — Rh. F 3 Rh. F 4 [Rh. F 5 ] 4 Rh. F 6 — Ir. F 3 — [Ir. F 5 ] 4 Ir. F 6 Pd. F 2 — Pd. F 4 — — Pt. F 4 [Pt. F 5 ] 4 Pt.
Фториды платиновых металлов II IV V VI — Ru. F 3 Ru. F 4 [Ru. F 5 ] 4 Ru. F 6 — — Os. F 4 [Os. F 5 ] 4 Os. F 6 — Rh. F 3 Rh. F 4 [Rh. F 5 ] 4 Rh. F 6 — Ir. F 3 — [Ir. F 5 ] 4 Ir. F 6 Pd. F 2 — Pd. F 4 — — Pt. F 4 [Pt. F 5 ] 4 Pt.
 Фториды платиновых металлов Сильные окислители Pt. F 6 самый сильный окислитель: O 2 + Pt. F 6 = O 2 + [Pt. F] 6 — Xe + Pt. F 6 = Xe[Pt. F 6 ] 2 Rh. F 6 + 3 Cl 2 = 2 Rh. F 3 + 6 Cl. F Ir. F 6 + 2 NO = (NO + ) 2 [Ir. F 6 ] 2 Ir. F 6 + 9 H 2 O = 2 Ir(OH) 3 + 12 HF + 3 O 2 диоксигенил- ио н
Фториды платиновых металлов Сильные окислители Pt. F 6 самый сильный окислитель: O 2 + Pt. F 6 = O 2 + [Pt. F] 6 — Xe + Pt. F 6 = Xe[Pt. F 6 ] 2 Rh. F 6 + 3 Cl 2 = 2 Rh. F 3 + 6 Cl. F Ir. F 6 + 2 NO = (NO + ) 2 [Ir. F 6 ] 2 Ir. F 6 + 9 H 2 O = 2 Ir(OH) 3 + 12 HF + 3 O 2 диоксигенил- ио н
 Ru, Os (+8) Слабые кислотные свойства : Os. O 4 + H 2 O = H 2 [Os. O 4 (OH)2 ] K 1 = 10 -12 Os. O 4 + KOH = K 2 [Os. O 4 (OH)2 ] 4 Ru. O 4 + 4 Na. OH = 4 Na 2 Ru. O 4 + O 2 + H 2 O
Ru, Os (+8) Слабые кислотные свойства : Os. O 4 + H 2 O = H 2 [Os. O 4 (OH)2 ] K 1 = 10 -12 Os. O 4 + KOH = K 2 [Os. O 4 (OH)2 ] 4 Ru. O 4 + 4 Na. OH = 4 Na 2 Ru. O 4 + O 2 + H 2 O
 Ru, Os (+8) Os. O 4 , Ru. O 4 Os. O 4 + HCl(конц. ) = H 2 [Os. Cl 6 ]+Cl 2 +H 2 O Os. O 4 + HCl(разб. ) = Ru. O 4 + HCl(разб. ) = H 2 [Ru. Cl 6 ]+Cl 2 +H 2 O Ru. O 4 + C 2 H 5 OH = 2 CO 2 + Ru. O 2 + 3 H 2 O Os. O 4 + C 2 H 5 OH = CH 3 COH + Os. O 2 + H 2 O C 2 H 4 + Os. O 4 + 2 H 2 O = HOCH 2 OH + H 2 Os. O 4 = Os. O 2 + H 2 O + Os. O 4 запах хлора озона
Ru, Os (+8) Os. O 4 , Ru. O 4 Os. O 4 + HCl(конц. ) = H 2 [Os. Cl 6 ]+Cl 2 +H 2 O Os. O 4 + HCl(разб. ) = Ru. O 4 + HCl(разб. ) = H 2 [Ru. Cl 6 ]+Cl 2 +H 2 O Ru. O 4 + C 2 H 5 OH = 2 CO 2 + Ru. O 2 + 3 H 2 O Os. O 4 + C 2 H 5 OH = CH 3 COH + Os. O 2 + H 2 O C 2 H 4 + Os. O 4 + 2 H 2 O = HOCH 2 OH + H 2 Os. O 4 = Os. O 2 + H 2 O + Os. O 4 запах хлора озона
 Ru, Os ( +6 ) Оксидов нет Me 2 Ru. O 4 • H 2 O , Me 2 Os. O 4 • 2 H 2 O Э+ 3 KNO 3 + 2 KOH = K 2 Э O 4 + 3 KNO 2 + H 2 O Э = Ru, Os K 2 [Os. O 2 (OH)4 ]+4 HHal = K 2 [Os. O 2 Hal 4 ]+4 H 2 O
Ru, Os ( +6 ) Оксидов нет Me 2 Ru. O 4 • H 2 O , Me 2 Os. O 4 • 2 H 2 O Э+ 3 KNO 3 + 2 KOH = K 2 Э O 4 + 3 KNO 2 + H 2 O Э = Ru, Os K 2 [Os. O 2 (OH)4 ]+4 HHal = K 2 [Os. O 2 Hal 4 ]+4 H 2 O
 Ru, Os ( +6 ) Ru+6 окислители: 2 K 2 Ru. O 4 + 12 HCl = 2 K 2 [Ru. Cl 6 ] + Cl 2 + 6 H 2 O K 2 Ru. O 4 + H 2 SO 4 = O 2 + Ru. O 2 + H 2 O + K 2 SO 4 Os +6 восстановители: K 2 [Os. O 2 (OH)4 ]+O 2 = Os. O 4 + KOH + H 2 O 2 H 2 Os. O 4 = Os. O 2 + 2 H 2 O + Os. O 4 K 2 Os. O 4 + H 2 SO 4 = Os. O 2 + H 2 O + Os. O 4 + K 2 SO 4 K 2 Os. O 4 + 3 H 2 = Os + 2 KOH + 2 H 2 O
Ru, Os ( +6 ) Ru+6 окислители: 2 K 2 Ru. O 4 + 12 HCl = 2 K 2 [Ru. Cl 6 ] + Cl 2 + 6 H 2 O K 2 Ru. O 4 + H 2 SO 4 = O 2 + Ru. O 2 + H 2 O + K 2 SO 4 Os +6 восстановители: K 2 [Os. O 2 (OH)4 ]+O 2 = Os. O 4 + KOH + H 2 O 2 H 2 Os. O 4 = Os. O 2 + 2 H 2 O + Os. O 4 K 2 Os. O 4 + H 2 SO 4 = Os. O 2 + H 2 O + Os. O 4 + K 2 SO 4 K 2 Os. O 4 + 3 H 2 = Os + 2 KOH + 2 H 2 O
 Ru , Os ( + 4) Ru. O 2 , Os. O 2 Кислотно-основные свойства: Э O 2 + 6 HCl = H 2 [ Э Cl 6 ] + 2 H 2 O Э F 4 + H 2 O = Э O 2 + H 2 [ Э F 6 ]+ 2 HF Окислительно-восстановительные свойства: 2 Ru. O 2 + 3 Na 2 O 2 = 2 Na 3 Ru. O 4 + O 2 Ru. O 2 + 2 H 2 = Ru + 2 H 2 O
Ru , Os ( + 4) Ru. O 2 , Os. O 2 Кислотно-основные свойства: Э O 2 + 6 HCl = H 2 [ Э Cl 6 ] + 2 H 2 O Э F 4 + H 2 O = Э O 2 + H 2 [ Э F 6 ]+ 2 HF Окислительно-восстановительные свойства: 2 Ru. O 2 + 3 Na 2 O 2 = 2 Na 3 Ru. O 4 + O 2 Ru. O 2 + 2 H 2 = Ru + 2 H 2 O
 Rh, Ir (+4) Получение: Ir + Na 2 CO 3 + 2 Na. NO 3 = Na 2 Ir. O 3 + 2 Na. NO 2 + CO 2 K 2 Ir. F 6 + 4 KOH = Ir(OH)4 + 6 KCl ( вод. раствор ) K 2 Ir. F 6 + 2 K 2 CO 3 = Ir. O 2 + 6 KCl + 2 CO
Rh, Ir (+4) Получение: Ir + Na 2 CO 3 + 2 Na. NO 3 = Na 2 Ir. O 3 + 2 Na. NO 2 + CO 2 K 2 Ir. F 6 + 4 KOH = Ir(OH)4 + 6 KCl ( вод. раствор ) K 2 Ir. F 6 + 2 K 2 CO 3 = Ir. O 2 + 6 KCl + 2 CO
 Rh, Ir (+ 4) Ir. O 2 Прочная кристал. решетка низкая хим. активность Rh. O 2 не устойчив Обменные реакции Характерны только для Ir +4. В аналогичных ситуациях Rh +4 проявит окислительные свойства ( NH 4 )2 Ir. Cl 6 + 4 KI = Ir. I 4 + 2 NH 4 Cl + 4 KCl
Rh, Ir (+ 4) Ir. O 2 Прочная кристал. решетка низкая хим. активность Rh. O 2 не устойчив Обменные реакции Характерны только для Ir +4. В аналогичных ситуациях Rh +4 проявит окислительные свойства ( NH 4 )2 Ir. Cl 6 + 4 KI = Ir. I 4 + 2 NH 4 Cl + 4 KCl
![Rh, Ir (+4) Rh+4 сильные окислители Cs 2 [Rh. Cl 6 ] Rh, Ir (+4) Rh+4 сильные окислители Cs 2 [Rh. Cl 6 ]](/docs//platinovye_metally_images/platinovye_metally_26.jpg) Rh, Ir (+4) Rh+4 сильные окислители Cs 2 [Rh. Cl 6 ] = Rh. Cl 3 + Cs. Cl + Cl 2 2 Rh. O 2 + 8 HCl = 2 Rh. Cl 3 + Cl 2 + 4 H 2 O 2 Rh. O 2 + 14 HCl = 2 H 2 [Rh. Cl 6 ] + Cl 2 + 4 H 2 O 4 Rh. O 2 = 2 Rh 2 O 3 + O 2 Ir +4 как окислитель слабее ( NH 4 )2 Ir. Cl 6 + 2 H 2 = Ir + 2 NH 3 + 6 HCl
Rh, Ir (+4) Rh+4 сильные окислители Cs 2 [Rh. Cl 6 ] = Rh. Cl 3 + Cs. Cl + Cl 2 2 Rh. O 2 + 8 HCl = 2 Rh. Cl 3 + Cl 2 + 4 H 2 O 2 Rh. O 2 + 14 HCl = 2 H 2 [Rh. Cl 6 ] + Cl 2 + 4 H 2 O 4 Rh. O 2 = 2 Rh 2 O 3 + O 2 Ir +4 как окислитель слабее ( NH 4 )2 Ir. Cl 6 + 2 H 2 = Ir + 2 NH 3 + 6 HCl
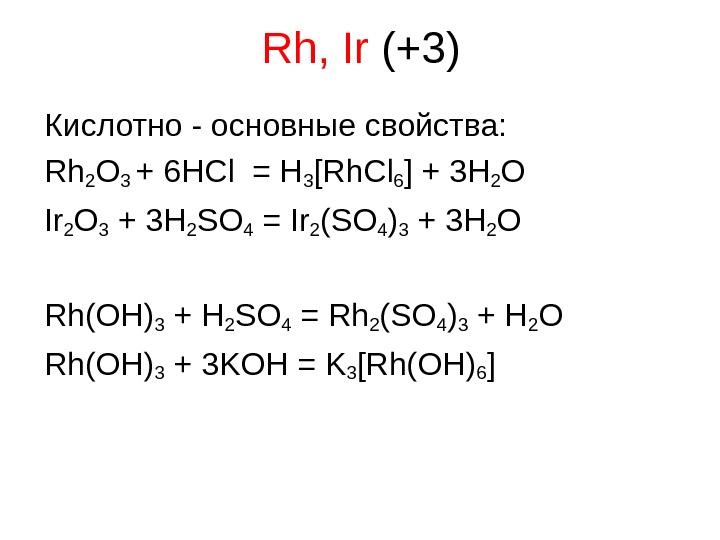
 Rh, Ir (+ 3 ) Кислотно — основные свойства: Rh 2 O 3 + 6 HCl = H 3 [Rh. Cl 6 ] + 3 H 2 O Ir 2 O 3 + 3 H 2 SO 4 = Ir 2 (SO 4 )3 + 3 H 2 O Rh(OH) 3 + H 2 SO 4 = Rh 2 (SO 4 )3 + H 2 O Rh(OH) 3 + 3 KOH = K 3 [Rh(OH)6 ]
Rh, Ir (+ 3 ) Кислотно — основные свойства: Rh 2 O 3 + 6 HCl = H 3 [Rh. Cl 6 ] + 3 H 2 O Ir 2 O 3 + 3 H 2 SO 4 = Ir 2 (SO 4 )3 + 3 H 2 O Rh(OH) 3 + H 2 SO 4 = Rh 2 (SO 4 )3 + H 2 O Rh(OH) 3 + 3 KOH = K 3 [Rh(OH)6 ]
 Rh, Ir ( + 3) Окислительно-восстановительные свойства: Ir+3 2 Ir. Cl 3 + 3 H 2 = 2 Ir + 6 HCl Ir 2 O 3 + 2 HNO 3 = 2 Ir. O 2 + 2 NO 2 + H 2 O Rh +3 Ru 2 O 3 + 4 Na. OH(конц. ) + 3 Na. Cl. O= 2 Na 2 Ru. O 4 + H 2 O + K 2 SO 4 Rh 2 O 3 + 3 H 2 = 2 Rh + 3 H 2 O
Rh, Ir ( + 3) Окислительно-восстановительные свойства: Ir+3 2 Ir. Cl 3 + 3 H 2 = 2 Ir + 6 HCl Ir 2 O 3 + 2 HNO 3 = 2 Ir. O 2 + 2 NO 2 + H 2 O Rh +3 Ru 2 O 3 + 4 Na. OH(конц. ) + 3 Na. Cl. O= 2 Na 2 Ru. O 4 + H 2 O + K 2 SO 4 Rh 2 O 3 + 3 H 2 = 2 Rh + 3 H 2 O
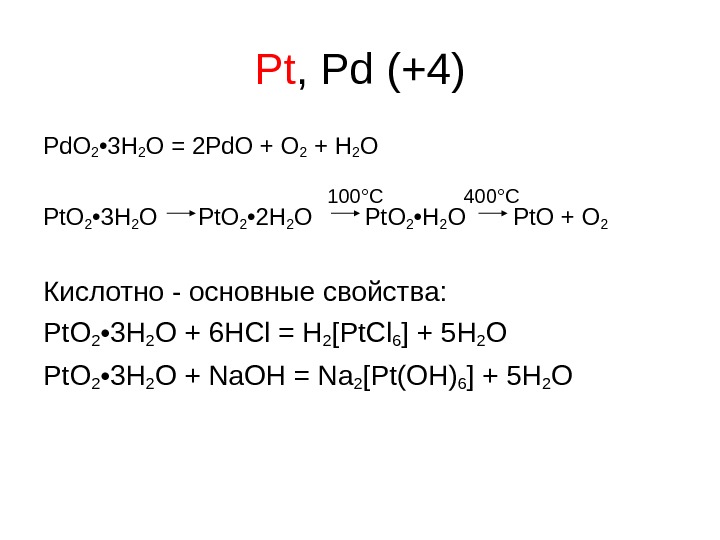
 Pt , Pd ( +4 ) Pd. O 2 • 3 H 2 O = 2 Pd. O + O 2 + H 2 O Pt. O 2 • 3 H 2 O Pt. O 2 • 2 H 2 O Pt. O 2 • H 2 O Pt. O + O 2 Кислотно — основные свойства: Pt. O 2 • 3 H 2 O + 6 HCl = H 2 [Pt. Cl 6 ] + 5 H 2 O Pt. O 2 • 3 H 2 O + Na. OH = Na 2 [Pt(OH)6 ] + 5 H 2 O 100 ° C 4 00°
Pt , Pd ( +4 ) Pd. O 2 • 3 H 2 O = 2 Pd. O + O 2 + H 2 O Pt. O 2 • 3 H 2 O Pt. O 2 • 2 H 2 O Pt. O 2 • H 2 O Pt. O + O 2 Кислотно — основные свойства: Pt. O 2 • 3 H 2 O + 6 HCl = H 2 [Pt. Cl 6 ] + 5 H 2 O Pt. O 2 • 3 H 2 O + Na. OH = Na 2 [Pt(OH)6 ] + 5 H 2 O 100 ° C 4 00°
![H 2 [Pt. Cl 6 ] Гексахлороплатинат( IV ) водорода Гексахлорплатиновая кислота Устойчивая, сильная H 2 [Pt. Cl 6 ] Гексахлороплатинат( IV ) водорода Гексахлорплатиновая кислота Устойчивая, сильная](/docs//platinovye_metally_images/platinovye_metally_30.jpg) H 2 [Pt. Cl 6 ] Гексахлороплатинат( IV ) водорода Гексахлорплатиновая кислота Устойчивая, сильная Получение: Pt ( OH ) 4 + HCl = H 2 [Pt. Cl 6 ] + H 2 O Pt. Cl 4 + HCl = H 2 [Pt. Cl 6 ] 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2 [Pt. Cl 6 ] + 4 NO + 8 H 2 O Соли щелочных металлов, NH 4 + H 2 [Pt. Cl 6 ] + 2 KCl = K 2 [Pt. Cl 6 ] + 2 HCl
H 2 [Pt. Cl 6 ] Гексахлороплатинат( IV ) водорода Гексахлорплатиновая кислота Устойчивая, сильная Получение: Pt ( OH ) 4 + HCl = H 2 [Pt. Cl 6 ] + H 2 O Pt. Cl 4 + HCl = H 2 [Pt. Cl 6 ] 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2 [Pt. Cl 6 ] + 4 NO + 8 H 2 O Соли щелочных металлов, NH 4 + H 2 [Pt. Cl 6 ] + 2 KCl = K 2 [Pt. Cl 6 ] + 2 HCl
![H 2 [Pt(OH) 6 ] Гексагидроксоплатинат ( IV ) водорода Гексагидроксоплатиновая кислота Слабая, H 2 [Pt(OH) 6 ] Гексагидроксоплатинат ( IV ) водорода Гексагидроксоплатиновая кислота Слабая,](/docs//platinovye_metally_images/platinovye_metally_31.jpg) H 2 [Pt(OH) 6 ] Гексагидроксоплатинат ( IV ) водорода Гексагидроксоплатиновая кислота Слабая, малорастворимая Получение: K 2 [Pt(OH)6 ] + HCl = H 2 [Pt(OH)6 ] + KCl [Pt(NH 2 OH)4 ](OH)2 + 3 H 2 O 2 = H 2 [Pt(OH)6 ] + 2 N 2 + H 2 O Pt. O 2 • 3 H 2 O + KOH = K 2 [Pt(OH)6 ] + 5 H 2 O
H 2 [Pt(OH) 6 ] Гексагидроксоплатинат ( IV ) водорода Гексагидроксоплатиновая кислота Слабая, малорастворимая Получение: K 2 [Pt(OH)6 ] + HCl = H 2 [Pt(OH)6 ] + KCl [Pt(NH 2 OH)4 ](OH)2 + 3 H 2 O 2 = H 2 [Pt(OH)6 ] + 2 N 2 + H 2 O Pt. O 2 • 3 H 2 O + KOH = K 2 [Pt(OH)6 ] + 5 H 2 O
 Pt, Pd (+4) Окислительно-восстановительные свойства Pd +4 сильный окислитель Pd(OH) 4 = Pd(OH) 2 + O 2 + 2 H 2 O Т комн. Pd(OH) 4 + H 2 O = Pt +4 окислитель только при сильном восстановителе H 2 [Pt. Cl 6 ] + Fe. SO 4 + KOH = Pt + Fe(OH) 3 + K 2 SO 4 + KCl + H 2 O H 2 [Pt. Cl 6 ] + Sn. Cl 2 = Sn(OH) 4 + Pt
Pt, Pd (+4) Окислительно-восстановительные свойства Pd +4 сильный окислитель Pd(OH) 4 = Pd(OH) 2 + O 2 + 2 H 2 O Т комн. Pd(OH) 4 + H 2 O = Pt +4 окислитель только при сильном восстановителе H 2 [Pt. Cl 6 ] + Fe. SO 4 + KOH = Pt + Fe(OH) 3 + K 2 SO 4 + KCl + H 2 O H 2 [Pt. Cl 6 ] + Sn. Cl 2 = Sn(OH) 4 + Pt
![Pt, Pd (+2) Pd+2 в воде [Pd(H 2 O)6 ] 2+ Pd(Cl. Pt, Pd (+2) Pd+2 в воде [Pd(H 2 O)6 ] 2+ Pd(Cl.](/docs//platinovye_metally_images/platinovye_metally_33.jpg) Pt, Pd (+2) Pd+2 в воде [Pd(H 2 O)6 ] 2+ Pd(Cl. O 4 ), Pd. SO 4 Кислотно-основные свойства: Pt. O амфотерен Pt. O + HCl = H 2 [Pt. Cl 4 ] + H 2 O Pt. O + 2 KOH + H 2 O= K 2 [Pt(OH)4 ]
Pt, Pd (+2) Pd+2 в воде [Pd(H 2 O)6 ] 2+ Pd(Cl. O 4 ), Pd. SO 4 Кислотно-основные свойства: Pt. O амфотерен Pt. O + HCl = H 2 [Pt. Cl 4 ] + H 2 O Pt. O + 2 KOH + H 2 O= K 2 [Pt(OH)4 ]
 Pd, Pt ( +2 ) Окислительно-восстановительные свойства Pt+2 Pt. Cl 2 + H 2 SO 4 = Pt + Pt(SO 4 )2 + HCl Pt. Cl 2 + H 2 = Pt + 2 HCl Pd +2 Pd. Cl 2 + CO = Pd + CO 2 + HCl Качественная реакция на СО
Pd, Pt ( +2 ) Окислительно-восстановительные свойства Pt+2 Pt. Cl 2 + H 2 SO 4 = Pt + Pt(SO 4 )2 + HCl Pt. Cl 2 + H 2 = Pt + 2 HCl Pd +2 Pd. Cl 2 + CO = Pd + CO 2 + HCl Качественная реакция на СО
 Применение Pd : Kat реакций гидрирования. Pt : Kat Посуда Термопары Электроды Ювелирное и зубопротезное Rh, Os Добавки в сплавы
Применение Pd : Kat реакций гидрирования. Pt : Kat Посуда Термопары Электроды Ювелирное и зубопротезное Rh, Os Добавки в сплавы
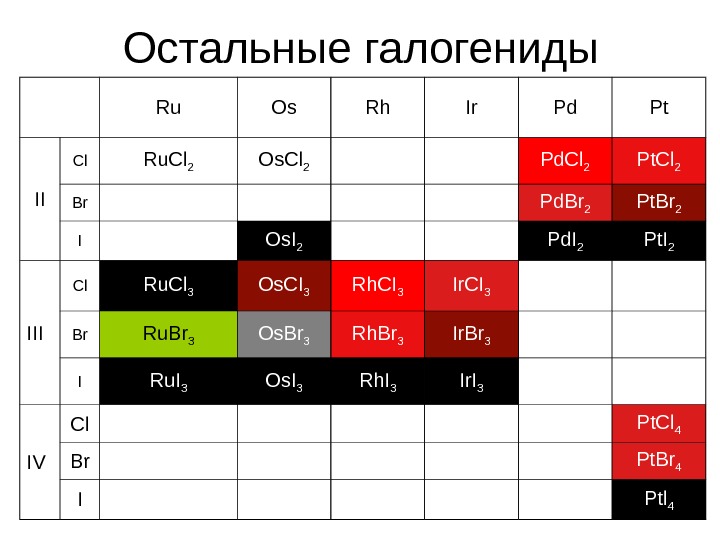
 Остальные галогениды Ru Os Rh Ir Pd Pt II Cl Ru. Cl 2 Os. Cl 2 Pd. Cl 2 Pt. Cl 2 Br Pd. Br 2 Pt. Br 2 I Os. I 2 Pd. I 2 Pt. I 2 III Cl Ru. Cl 3 Os. CI 3 Rh. CI 3 Ir. CI 3 Br Ru. Br 3 Os. Br 3 Rh. Br 3 Ir. Br 3 I Ru. I 3 Os. I 3 Rh. I 3 Ir. I 3 IV Cl Pt. Cl 4 Br Pt. Br 4 I Ptl
Остальные галогениды Ru Os Rh Ir Pd Pt II Cl Ru. Cl 2 Os. Cl 2 Pd. Cl 2 Pt. Cl 2 Br Pd. Br 2 Pt. Br 2 I Os. I 2 Pd. I 2 Pt. I 2 III Cl Ru. Cl 3 Os. CI 3 Rh. CI 3 Ir. CI 3 Br Ru. Br 3 Os. Br 3 Rh. Br 3 Ir. Br 3 I Ru. I 3 Os. I 3 Rh. I 3 Ir. I 3 IV Cl Pt. Cl 4 Br Pt. Br 4 I Ptl
 Сульфиды, фосфиды и т. д. Ru 2 P – Co 2 P Rh. P 3 – Co. P 3 Ru. P – Fe. P и Co. P Pd. P 3 – Ni. P 3 C ложные системы с S, Se, Te, P, As, Bi, Sn и Pb. Pd 4 S, Pd 14 S 4 , Pd 11 S 5 , Pd. S 2 H 2 S на раствор соли Ме: K 2 [Pt. Cl 6 ]+ 2 H 2 S = Pt. S 2 + 2 KCl +4 HCl K 2 [Pd. Cl 4 ]+ 2 H 2 S = Pd. S + 2 KCl +2 HCl Pd. S + S = Pd. S
Сульфиды, фосфиды и т. д. Ru 2 P – Co 2 P Rh. P 3 – Co. P 3 Ru. P – Fe. P и Co. P Pd. P 3 – Ni. P 3 C ложные системы с S, Se, Te, P, As, Bi, Sn и Pb. Pd 4 S, Pd 14 S 4 , Pd 11 S 5 , Pd. S 2 H 2 S на раствор соли Ме: K 2 [Pt. Cl 6 ]+ 2 H 2 S = Pt. S 2 + 2 KCl +4 HCl K 2 [Pd. Cl 4 ]+ 2 H 2 S = Pd. S + 2 KCl +2 HCl Pd. S + S = Pd. S
 Принципы разделения • Os и Ru не растворяются ни в одной из кислот вплоть до Ткип , тогда как Pd растворяется в азотной кислоте. • Os и Ru окисляются при щелочной окислительной плавке ( Na 2 O 2 , Na. OH + Na. Cl); плав растворяется в воде с образованием рутенатов, осматов. • Рутенаты восстанавливаются спиртом до Ru. O 2 ·n. H 2 O, а осматы в виде аммониевой соли. • +Fe. SO 4 осаждается золото. Rh, Ir и Pd до низших степеней. [Pt. Cl 6 ]2 — в виде аммониевой соли. • Rh и Ir + Cl. O 2 — (Br. O 3 — ) = гидратированные окислы. Na 3 [Rh. Cl 6 ] не растворяется в этаноле, а аналогичные комплексы Pd(IV), Ir(IV) растворяются.
Принципы разделения • Os и Ru не растворяются ни в одной из кислот вплоть до Ткип , тогда как Pd растворяется в азотной кислоте. • Os и Ru окисляются при щелочной окислительной плавке ( Na 2 O 2 , Na. OH + Na. Cl); плав растворяется в воде с образованием рутенатов, осматов. • Рутенаты восстанавливаются спиртом до Ru. O 2 ·n. H 2 O, а осматы в виде аммониевой соли. • +Fe. SO 4 осаждается золото. Rh, Ir и Pd до низших степеней. [Pt. Cl 6 ]2 — в виде аммониевой соли. • Rh и Ir + Cl. O 2 — (Br. O 3 — ) = гидратированные окислы. Na 3 [Rh. Cl 6 ] не растворяется в этаноле, а аналогичные комплексы Pd(IV), Ir(IV) растворяются.


