Платиновые элементы.pptx
- Количество слайдов: 25
 ПЛАТИНОВЫЕ ЭЛЕМЕНТЫ
ПЛАТИНОВЫЕ ЭЛЕМЕНТЫ
 Рутений Родий Палладий Осмий Иридий Платина
Рутений Родий Палладий Осмий Иридий Платина
 Платиновые элементы – блестящие серебристо-белые металлы (осмий – синевато-серый). Самый тугоплавкий осмий, у него самая высокая плотность – 22, 7 г/см 3. Обладают высокой пластичностью – больше у платины и палладия.
Платиновые элементы – блестящие серебристо-белые металлы (осмий – синевато-серый). Самый тугоплавкий осмий, у него самая высокая плотность – 22, 7 г/см 3. Обладают высокой пластичностью – больше у платины и палладия.
 Осмий Открыт в 1804 году английским химиком Смитсоном Теннантом. Назван от др. греч. ὀσμή (запах), по резко пахнущему летучему оксиду Os. O 4 (напоминает озон). Получение: Из соли — перосмата натрия, который восстанавливают водородом при 120 °C : Na 2[Os. O 2(OH)4] + 3 H 2 = 2 Na. OH + Os + 4 H 2 O Os. O 4+ 4 H 2= Os + 4 H 2 O
Осмий Открыт в 1804 году английским химиком Смитсоном Теннантом. Назван от др. греч. ὀσμή (запах), по резко пахнущему летучему оксиду Os. O 4 (напоминает озон). Получение: Из соли — перосмата натрия, который восстанавливают водородом при 120 °C : Na 2[Os. O 2(OH)4] + 3 H 2 = 2 Na. OH + Os + 4 H 2 O Os. O 4+ 4 H 2= Os + 4 H 2 O
 Родий Открыт в 1803 году английским химиком Уильямом Волластаном. Назван от др. греч. ῥόδον (роза), соединения родия (III) имеют глубокий тёмно-красный цвет. Получение: Из соли — перосмата натрия, который восстанавливают водородом при 120 °C : 2 Rh. Cl 3 + 3 H 2 = 2 Rh + 6 HCl
Родий Открыт в 1803 году английским химиком Уильямом Волластаном. Назван от др. греч. ῥόδον (роза), соединения родия (III) имеют глубокий тёмно-красный цвет. Получение: Из соли — перосмата натрия, который восстанавливают водородом при 120 °C : 2 Rh. Cl 3 + 3 H 2 = 2 Rh + 6 HCl
 Палладий Открыт в 1803 году английским химиком Уильямом Волластаном. Назван по имени астероида Паллада, открытого в 1802 году. Получение: Из соли — сульфида палладия: Pd. S + H 2 = Pd + H 2 S Pd(NO 3)2= Pd + 2 NO 2+ O 2
Палладий Открыт в 1803 году английским химиком Уильямом Волластаном. Назван по имени астероида Паллада, открытого в 1802 году. Получение: Из соли — сульфида палладия: Pd. S + H 2 = Pd + H 2 S Pd(NO 3)2= Pd + 2 NO 2+ O 2
 Рутений Открыт профессором Казанского университета Карлом Клаусом в 1844 году из уральской платиновой руды. Получение: Ru. O 2 + 2 H 2 = Ru + 2 H 2 O
Рутений Открыт профессором Казанского университета Карлом Клаусом в 1844 году из уральской платиновой руды. Получение: Ru. O 2 + 2 H 2 = Ru + 2 H 2 O
 Иридий был открыт в 1803 году английским химиком Смитсоном Теннантом одновременно с осмием. Получение: 3(NH 4)2[Ir. Cl 6] = 2 N 2 + 2 NH 3 + 18 HCl + 3 Ir (NH 4)2[Ir. Cl 6] + 2 Н 2 = 2 NH 3 + 6 HCl + Ir
Иридий был открыт в 1803 году английским химиком Смитсоном Теннантом одновременно с осмием. Получение: 3(NH 4)2[Ir. Cl 6] = 2 N 2 + 2 NH 3 + 18 HCl + 3 Ir (NH 4)2[Ir. Cl 6] + 2 Н 2 = 2 NH 3 + 6 HCl + Ir
 Платина Известна с давних времен в Южной Америке. В 1748 году испанский математик и мореплаватель А. де Ульоа первым привез на европейский континент образцы самородной платины. Впервые в чистом виде платина получена английским химиком У. Волластоном в 1803 г. Получение: 3(NH 4)2[Pt. Cl 6] = 2 N 2 + 2 NH 3 + 18 HCl + 3 Pt 200 o. C (NH 4)2[Pt. Cl 6] = 2 HCl + 2 NH 3 + 2 Cl 2 + Pt 600 o. C H 2[Pt. Cl 6] + 2 HCOOH + 3 Na 2 CO 3 = 6 Na. Cl + 5 CO 2 + 3 H 2 O + 3 Pt
Платина Известна с давних времен в Южной Америке. В 1748 году испанский математик и мореплаватель А. де Ульоа первым привез на европейский континент образцы самородной платины. Впервые в чистом виде платина получена английским химиком У. Волластоном в 1803 г. Получение: 3(NH 4)2[Pt. Cl 6] = 2 N 2 + 2 NH 3 + 18 HCl + 3 Pt 200 o. C (NH 4)2[Pt. Cl 6] = 2 HCl + 2 NH 3 + 2 Cl 2 + Pt 600 o. C H 2[Pt. Cl 6] + 2 HCOOH + 3 Na 2 CO 3 = 6 Na. Cl + 5 CO 2 + 3 H 2 O + 3 Pt
 Химические свойства металлов 1. Окисление кислородом Os + 2 O 2 = Os. O 4 (200 о. С) Ru+ O 2 = Ru. O 2 (400 o. C) 2 Rh+ 3 O 2 2 Rh 2 O 3 Ir + O 2 Ir. O 2 2 Pd + O 2 (1 атм) = 2 Pd. O Pt + O 2 ≠ 2. Окисление фтором Ru+ 3 F 2 = Ru. F 6 Os + 3 F 2= Os. F 6 Pt + 3 F 2= Pt. F 6 2 Rh + 5 F 2= 2 Rh. F 5 2 Ir + 5 F 2= 2 Ir. F 5 Pd + 2 F 2= Pd. F 4 3. При Т > 1000 o. C реагируют с S, Se, Te, P, Si, C, B (кроме азота) Pd + S = Pd. S Ir+ 3 P = Ir. P 3 Ru+ Si= Ru. Si 4. Растворяют Н 2, не реагируя.
Химические свойства металлов 1. Окисление кислородом Os + 2 O 2 = Os. O 4 (200 о. С) Ru+ O 2 = Ru. O 2 (400 o. C) 2 Rh+ 3 O 2 2 Rh 2 O 3 Ir + O 2 Ir. O 2 2 Pd + O 2 (1 атм) = 2 Pd. O Pt + O 2 ≠ 2. Окисление фтором Ru+ 3 F 2 = Ru. F 6 Os + 3 F 2= Os. F 6 Pt + 3 F 2= Pt. F 6 2 Rh + 5 F 2= 2 Rh. F 5 2 Ir + 5 F 2= 2 Ir. F 5 Pd + 2 F 2= Pd. F 4 3. При Т > 1000 o. C реагируют с S, Se, Te, P, Si, C, B (кроме азота) Pd + S = Pd. S Ir+ 3 P = Ir. P 3 Ru+ Si= Ru. Si 4. Растворяют Н 2, не реагируя.
 5. Не растворяются в кислотах и щелочах 6. Взаимодействие с кислотами-окислителями Pd + 4 HNO 3(конц) = Pd(NO 3)2 + 2 NO 2 + 2 H 2 O 3 Pt + 4 HNO 3+ 18 HCl = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O Ru, Rh, Os, Ir + HNO 3+ HCl ≠ Pt+ 2 HNO 3+ 4 HCl + Cl 2= H 2[Pt. Cl 6] + 2 NO 2+ 2 H 2 O Аналогично для Rh, Ir 7. Щелочное окисление Ru+ 3 Na. NO 3+ 2 Na. OH (ж) = Na 2 Ru. O 4+ 3 Na. NO 2+ H 2 O Аналогично для Os Ir+ 2 Na. NO 3+ 2 Na. OH (ж)= Na 2 Ir. O 3+ 2 Na. NO 2+ 2 H 2 O аналогично для Rh 2 Rh + 3 Ba. O 2 = Rh 2 O 3+ 3 Ba. O Аналогично для Ir
5. Не растворяются в кислотах и щелочах 6. Взаимодействие с кислотами-окислителями Pd + 4 HNO 3(конц) = Pd(NO 3)2 + 2 NO 2 + 2 H 2 O 3 Pt + 4 HNO 3+ 18 HCl = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O Ru, Rh, Os, Ir + HNO 3+ HCl ≠ Pt+ 2 HNO 3+ 4 HCl + Cl 2= H 2[Pt. Cl 6] + 2 NO 2+ 2 H 2 O Аналогично для Rh, Ir 7. Щелочное окисление Ru+ 3 Na. NO 3+ 2 Na. OH (ж) = Na 2 Ru. O 4+ 3 Na. NO 2+ H 2 O Аналогично для Os Ir+ 2 Na. NO 3+ 2 Na. OH (ж)= Na 2 Ir. O 3+ 2 Na. NO 2+ 2 H 2 O аналогично для Rh 2 Rh + 3 Ba. O 2 = Rh 2 O 3+ 3 Ba. O Аналогично для Ir
 Применение металлов 1. Pt, Rh, Ir - изготовлениехимическойпосуды, аппаратуры, термопар, электродов 2. Pt, Pd, Rh - производство катализаторов 3. Pd - глубокая очистка водорода 4. Pt – создание лекарственных препаратов 5. Ru, Ir – нанесение защитных покрытий 6. Pd - создание датчиков, сенсоров 7. Ir, Ru, Os – изготовление сверхтвердых, инертных и износостойких инструментов 8. Pt, Rh, Ir – изготовление ювелирных изделий
Применение металлов 1. Pt, Rh, Ir - изготовлениехимическойпосуды, аппаратуры, термопар, электродов 2. Pt, Pd, Rh - производство катализаторов 3. Pd - глубокая очистка водорода 4. Pt – создание лекарственных препаратов 5. Ru, Ir – нанесение защитных покрытий 6. Pd - создание датчиков, сенсоров 7. Ir, Ru, Os – изготовление сверхтвердых, инертных и износостойких инструментов 8. Pt, Rh, Ir – изготовление ювелирных изделий
 Высшие с. о. Ru, Os 1. Получение Os + 2 O 2 = Os. O 4 Na 2 Ru. O 4+ Cl 2 = Ru. O 4 + 2 Na. Cl 2. Соединения Os (VIII) Os. O 4 + 2 KOH = K 2[Os. O 4(OH)2] перосмат Os. O 4 + 2 Na. F = Na 2[Os. O 4 F 2] Os. O 4 + F 2= Os 2 O 3 F 2 + ½O 2 Os. O 4 + NH 3+ KOH = K[Os. O 3 N] 3. Окислительные свойства 2 Os. O 4+ C 2 H 5 OH + 5 KOH = 2 K 2[Os. O 2(OH)4] + CH 3 COOK 2 Ru. O 4+ 4 KOH = 2 K 2 Ru. O 4 + O 2 + 2 H 2 O сильный окислитель 3 K 2 Ru. O 4+ HNO 3= 2 KRu. O 4+ Ru. O 2+ 4 KNO 3+ 2 H 2 O Диспропорционирование: Ru 6+ → Ru 7+ + Ru 4+
Высшие с. о. Ru, Os 1. Получение Os + 2 O 2 = Os. O 4 Na 2 Ru. O 4+ Cl 2 = Ru. O 4 + 2 Na. Cl 2. Соединения Os (VIII) Os. O 4 + 2 KOH = K 2[Os. O 4(OH)2] перосмат Os. O 4 + 2 Na. F = Na 2[Os. O 4 F 2] Os. O 4 + F 2= Os 2 O 3 F 2 + ½O 2 Os. O 4 + NH 3+ KOH = K[Os. O 3 N] 3. Окислительные свойства 2 Os. O 4+ C 2 H 5 OH + 5 KOH = 2 K 2[Os. O 2(OH)4] + CH 3 COOK 2 Ru. O 4+ 4 KOH = 2 K 2 Ru. O 4 + O 2 + 2 H 2 O сильный окислитель 3 K 2 Ru. O 4+ HNO 3= 2 KRu. O 4+ Ru. O 2+ 4 KNO 3+ 2 H 2 O Диспропорционирование: Ru 6+ → Ru 7+ + Ru 4+
 Соединения Ru, Os(IV) 1. Галогениды: Известны Ru. F 4, Ru. Cl 4, Os. F 4, Os. Cl 4, Os. Br 4 Ru+ 2 Cl 2 + 2 KCl = K 2[Ru. Cl 6] (t) Os. Cl 4 + 2 KCl = K 2[Os. Cl 6] Ru. O 4+ 14 HCl + 4 KCl = K 4[Ru 2 OCl 10] + 7 H 2 O + 4 Cl 2 темно-красный 2. Оксиды Ru. O 2, Os. O 2 Ru. O 2: темно-синий, t. разл. = 1200 о. С Os. O 2: светло-коричневый, t. разл. = 600 о. С Ru+ O 2= Ru. O 2 (400 o. C) Os. O 4+ H 2= Os. O 2+ 2 H 2 O (25 o. C) 3. Кислородные соединения Ru. O 2+ Sr. CO 3= Sr. Ru. O 3 (700 o. C) 2 K 4[Ru 2 OCl 10] + 6 H 2 SO 4+ 16 H 2 O = [Ru 4 O 6(H 2 O)12](SO 4)2 + 4 K 2 SO 4+ 20 HCl
Соединения Ru, Os(IV) 1. Галогениды: Известны Ru. F 4, Ru. Cl 4, Os. F 4, Os. Cl 4, Os. Br 4 Ru+ 2 Cl 2 + 2 KCl = K 2[Ru. Cl 6] (t) Os. Cl 4 + 2 KCl = K 2[Os. Cl 6] Ru. O 4+ 14 HCl + 4 KCl = K 4[Ru 2 OCl 10] + 7 H 2 O + 4 Cl 2 темно-красный 2. Оксиды Ru. O 2, Os. O 2 Ru. O 2: темно-синий, t. разл. = 1200 о. С Os. O 2: светло-коричневый, t. разл. = 600 о. С Ru+ O 2= Ru. O 2 (400 o. C) Os. O 4+ H 2= Os. O 2+ 2 H 2 O (25 o. C) 3. Кислородные соединения Ru. O 2+ Sr. CO 3= Sr. Ru. O 3 (700 o. C) 2 K 4[Ru 2 OCl 10] + 6 H 2 SO 4+ 16 H 2 O = [Ru 4 O 6(H 2 O)12](SO 4)2 + 4 K 2 SO 4+ 20 HCl
![Ru. O 2 [Ru 2 OCl 10]4– Ru. O 2 [Ru 2 OCl 10]4–](https://present5.com/presentation/32530824_185376550/image-15.jpg) Ru. O 2 [Ru 2 OCl 10]4–
Ru. O 2 [Ru 2 OCl 10]4–
 Низшие с. о. Ru, Os 1. Галогениды: известны MX 3 (кроме Os. F 3), MX 2 (кроме MF 2) 2 Ru + Cl 2= 2 Ru. Cl 3 2 Ru. O 4+ 16 HI (aq) = 2 Ru. I 3+ 5 I 2+ 8 H 2 O 2 Ru. O 4 + 16 HCl (к) + 6 KCl = 2 K 3[Ru. Cl 6] + 5 Cl 2+ 8 H 2 2. Комплексы Ru, Os (III) все–октаэдры, низкоспиновые Ru. Cl 3· 3 H 2 O + 2 Na. Cl = Na 2[Ru. Cl 5(H 2 O)] + 2 H 2 O красный Ru. Cl 3· 3 H 2 O + 3 H 2 C 2 O 4 = H 3[Ru(C 2 O 4)3] + 3 HCl + 3 H 2 O темно-зеленый 2 K 2[Os. O 2(OH)4]+ 16 HCl(к) + 2 KCl = 2 K 3[Os. Cl 6] + 12 H 2 O + 3 Cl 2
Низшие с. о. Ru, Os 1. Галогениды: известны MX 3 (кроме Os. F 3), MX 2 (кроме MF 2) 2 Ru + Cl 2= 2 Ru. Cl 3 2 Ru. O 4+ 16 HI (aq) = 2 Ru. I 3+ 5 I 2+ 8 H 2 O 2 Ru. O 4 + 16 HCl (к) + 6 KCl = 2 K 3[Ru. Cl 6] + 5 Cl 2+ 8 H 2 2. Комплексы Ru, Os (III) все–октаэдры, низкоспиновые Ru. Cl 3· 3 H 2 O + 2 Na. Cl = Na 2[Ru. Cl 5(H 2 O)] + 2 H 2 O красный Ru. Cl 3· 3 H 2 O + 3 H 2 C 2 O 4 = H 3[Ru(C 2 O 4)3] + 3 HCl + 3 H 2 O темно-зеленый 2 K 2[Os. O 2(OH)4]+ 16 HCl(к) + 2 KCl = 2 K 3[Os. Cl 6] + 12 H 2 O + 3 Cl 2
![[Ru(C 2 O 4)3]3– [Ru(C 2 O 4)3]3–](https://present5.com/presentation/32530824_185376550/image-17.jpg) [Ru(C 2 O 4)3]3–
[Ru(C 2 O 4)3]3–
 Высшие с. о. Rh, Ir 1. Соединения Rh, Ir (VI, V) Известны Rh. F 6, Ir. F 6, Rh. F 5, Ir. F 5 Rh. F 6 = Rh. F 5 + ½F 2 (120 o. C) 5 Ir. F 6+ Ir = 6 Ir. F 5 (350 o. C) 2 Ir. F 6+ H 2 O = 2 Ir. O 2· 2 H 2 O + O 2+ 12 HF Rh. F 6 + 3 Cl 2= 2 Rh. F 6+ 6 Cl. F 2. Соединения Rh, Ir (IV) Известны Rh. F 4, Ir. O 2 (единственный оксид Ir) Ir. O 2+ 4 HCl + 2 KCl = K 2[Ir. Cl 6] + 2 H 2 O темно-красный (NH 4)2[Ir. Cl 6] + 2 H 2 = Ir+ 2 NH 3+ 6 HCl K 2[Ir. Cl 6] + 2 KI = K 3[Ir. Cl 6] + ½I 2 Rh (IV) очень сильный окислитель
Высшие с. о. Rh, Ir 1. Соединения Rh, Ir (VI, V) Известны Rh. F 6, Ir. F 6, Rh. F 5, Ir. F 5 Rh. F 6 = Rh. F 5 + ½F 2 (120 o. C) 5 Ir. F 6+ Ir = 6 Ir. F 5 (350 o. C) 2 Ir. F 6+ H 2 O = 2 Ir. O 2· 2 H 2 O + O 2+ 12 HF Rh. F 6 + 3 Cl 2= 2 Rh. F 6+ 6 Cl. F 2. Соединения Rh, Ir (IV) Известны Rh. F 4, Ir. O 2 (единственный оксид Ir) Ir. O 2+ 4 HCl + 2 KCl = K 2[Ir. Cl 6] + 2 H 2 O темно-красный (NH 4)2[Ir. Cl 6] + 2 H 2 = Ir+ 2 NH 3+ 6 HCl K 2[Ir. Cl 6] + 2 KI = K 3[Ir. Cl 6] + ½I 2 Rh (IV) очень сильный окислитель
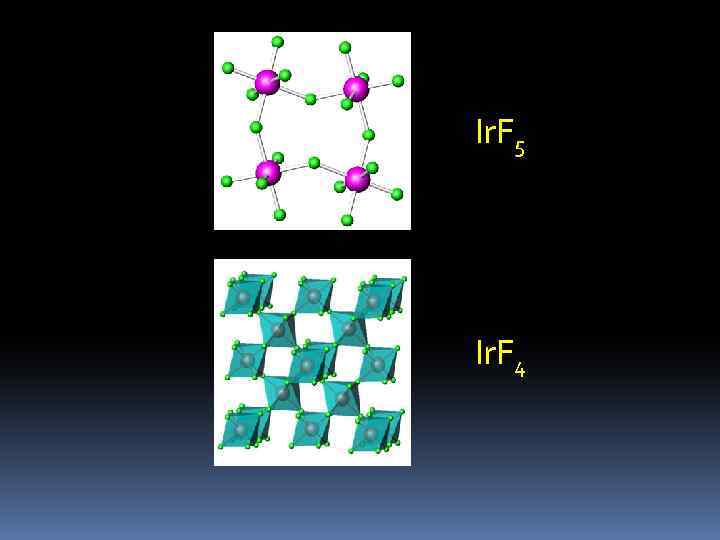 Ir. F 5 Ir. F 4
Ir. F 5 Ir. F 4
 Низшие с. о. Rh, Ir 1. Получение: 2 Rh. Cl 3· 3 H 2 O + 4 CH 3 COOH = [Rh 2(CH 3 COO)4]· 2 H 2 O + + 6 HCl + 3 H 2 O (метанол, t) Rh. Cl 3· 3 H 2 O + 2 PPh 3 = [Rh. Cl(PPh 3)2] + 3 H 2 O + Cl 2 (этанол, t) K 3[Ir. Cl 6] + CO + 2 PPh 3 = [Ir. Cl(CO)(PPh 3)2] + 3 KCl + Cl 2 2. Все комплексы Rh (II) имеют остов Rh 24+ 3. Все комплексы Rh (I), Ir (I) квадратные [Ir. Cl(CO)(PPh 3)2] + I 2= [Ir. Cl(I)2(CO)(PPh 3)2] 4. Карбонилы 2 Rh. Cl 3· 3 H 2 O + 6 CO = Rh 2(CO)4 Cl 2+ 2 COCl 2+ 6 H 2 O
Низшие с. о. Rh, Ir 1. Получение: 2 Rh. Cl 3· 3 H 2 O + 4 CH 3 COOH = [Rh 2(CH 3 COO)4]· 2 H 2 O + + 6 HCl + 3 H 2 O (метанол, t) Rh. Cl 3· 3 H 2 O + 2 PPh 3 = [Rh. Cl(PPh 3)2] + 3 H 2 O + Cl 2 (этанол, t) K 3[Ir. Cl 6] + CO + 2 PPh 3 = [Ir. Cl(CO)(PPh 3)2] + 3 KCl + Cl 2 2. Все комплексы Rh (II) имеют остов Rh 24+ 3. Все комплексы Rh (I), Ir (I) квадратные [Ir. Cl(CO)(PPh 3)2] + I 2= [Ir. Cl(I)2(CO)(PPh 3)2] 4. Карбонилы 2 Rh. Cl 3· 3 H 2 O + 6 CO = Rh 2(CO)4 Cl 2+ 2 COCl 2+ 6 H 2 O
 Соединения Pd, Pt(IV) 1. Основные с. о. Pd, Pt +2, +4. Известен Pt. F 6 - фторокислитель Pt. F 6+ O 2= O 2[Pt. F 6] Pt 5+ 2. Галогениды. Известны Pd. F 4, Pt. X 4 Pt + 2 Cl 2= Pt. Cl 4 (300 o. C) красно-коричневый Pt. Cl 4+ 5 H 2 O = [Pt. Cl 4(H 2 O)2]· 3 H 2 O 3. Оксиды Pd. O 2, Pt. O 2 Pt. Cl 4+ 4 KOH + (n– 2)H 2 O = Pt. O 2·n. H 2 O + 4 KCl оранжевый K 2[Pt. Cl 6] + 2 Na 2 CO 3= Pt. O 2+ 4 Na. Cl + 2 KCl + 2 CO 2 коричневый Pt. O 2· 2 H 2 O + 2 Na. OH = Na 2[Pt(OH)6] Pt. O 2· 2 H 2 O + 6 HCl (к) = H 2[Pt. Cl 6] + 4 H 2 O
Соединения Pd, Pt(IV) 1. Основные с. о. Pd, Pt +2, +4. Известен Pt. F 6 - фторокислитель Pt. F 6+ O 2= O 2[Pt. F 6] Pt 5+ 2. Галогениды. Известны Pd. F 4, Pt. X 4 Pt + 2 Cl 2= Pt. Cl 4 (300 o. C) красно-коричневый Pt. Cl 4+ 5 H 2 O = [Pt. Cl 4(H 2 O)2]· 3 H 2 O 3. Оксиды Pd. O 2, Pt. O 2 Pt. Cl 4+ 4 KOH + (n– 2)H 2 O = Pt. O 2·n. H 2 O + 4 KCl оранжевый K 2[Pt. Cl 6] + 2 Na 2 CO 3= Pt. O 2+ 4 Na. Cl + 2 KCl + 2 CO 2 коричневый Pt. O 2· 2 H 2 O + 2 Na. OH = Na 2[Pt(OH)6] Pt. O 2· 2 H 2 O + 6 HCl (к) = H 2[Pt. Cl 6] + 4 H 2 O
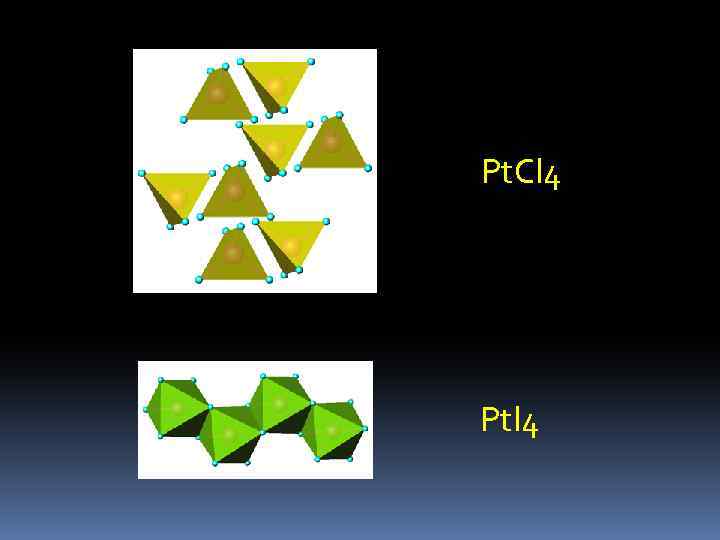 Pt. Cl 4 Ptl 4
Pt. Cl 4 Ptl 4
 Соединения Pd, Pt (II) 1. Галогениды. Известны все МХ 2, кроме. Pt. F 2 Pd + Cl 2 = Pd. Cl 2 (500 o. C) т. пл. = 680 o. C Pt. Cl 4 = Pt. Cl 2+ Cl 2 (400 o. C) т. пл. = 580 o. C Pd. Cl 2+ 2 HCl = H 2[Pd. Cl 4] H 2[Pt. Cl 6] + SO 2+ 2 H 2 O = H 2[Pt. Cl 4] + H 2 SO 4+ 2 HCl Pd. Cl 2+ CO + H 2 O = Pd + CO 2+ 2 HCl
Соединения Pd, Pt (II) 1. Галогениды. Известны все МХ 2, кроме. Pt. F 2 Pd + Cl 2 = Pd. Cl 2 (500 o. C) т. пл. = 680 o. C Pt. Cl 4 = Pt. Cl 2+ Cl 2 (400 o. C) т. пл. = 580 o. C Pd. Cl 2+ 2 HCl = H 2[Pd. Cl 4] H 2[Pt. Cl 6] + SO 2+ 2 H 2 O = H 2[Pt. Cl 4] + H 2 SO 4+ 2 HCl Pd. Cl 2+ CO + H 2 O = Pd + CO 2+ 2 HCl
 2. Оксиды Pd. O т. разл. = 900 о. С, Pt. O т. разл. = 350 о. С Pd. Cl 2 + 4 Na. NO 3 → Pd. O+ Na 2 O + 2 Na. Cl + 2 N 2+ 5 O 2 Pd. Cl 2+ 2 KOH = Pd(OH)2+ 2 KCl амфотерен Pd(OH)2+ 2 HCl. O 4+ 2 H 2 O = Pd(Cl. O 4)2· 4 H 2 O Pd(OH)2+ 2 KOH = 2[Pd(OH)4] квадратные комплексы H 2[Pt. Cl 4] + 4 KOH = Pt. O· 2 H 2 O + 4 KCl + H 2 O
2. Оксиды Pd. O т. разл. = 900 о. С, Pt. O т. разл. = 350 о. С Pd. Cl 2 + 4 Na. NO 3 → Pd. O+ Na 2 O + 2 Na. Cl + 2 N 2+ 5 O 2 Pd. Cl 2+ 2 KOH = Pd(OH)2+ 2 KCl амфотерен Pd(OH)2+ 2 HCl. O 4+ 2 H 2 O = Pd(Cl. O 4)2· 4 H 2 O Pd(OH)2+ 2 KOH = 2[Pd(OH)4] квадратные комплексы H 2[Pt. Cl 4] + 4 KOH = Pt. O· 2 H 2 O + 4 KCl + H 2 O
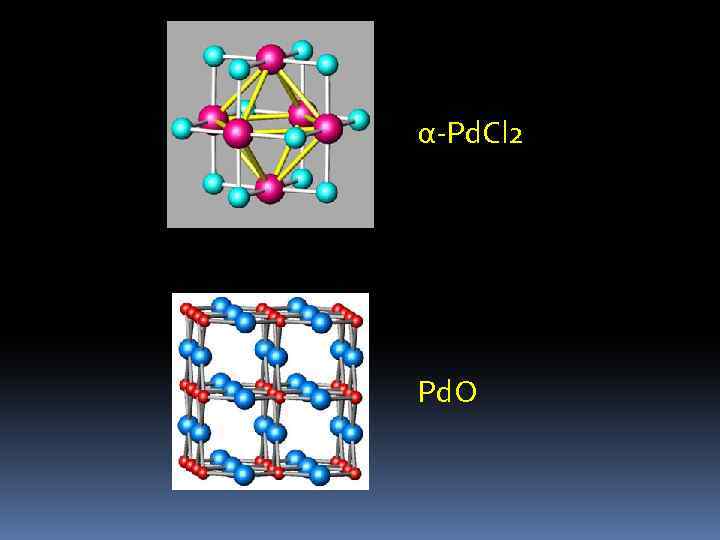 α-Pd. Cl 2 Pd. О
α-Pd. Cl 2 Pd. О


